微管是由α和β球蛋白构成的中空管状结构, 是细胞骨架的重要组成成分, 在维持细胞形态、细胞分裂、胞内运输及细胞运动等过程中发挥着重要作用[1, 2]。微管抑制剂能改变微管的聚合状态和动力学, 从而导致细胞周期阻滞, 并诱导细胞凋亡[3, 4]。根据对微管聚合量的影响, 微管抑制剂可分为微管解聚剂(如秋水仙碱、长春新碱)和微管稳定剂(如紫杉醇)。微管蛋白有3个常见的药物结合位点, 即紫杉醇位点、长春碱位点和秋水仙碱位点[4]。多种微管抑制剂已被用于肿瘤的一线治疗, 如紫杉醇用于治疗卵巢癌、乳腺癌及肺癌等, 长春新碱用于治疗急性白血病和恶性淋巴瘤等, 微管是肿瘤化疗中最成功的靶点之一[4]。近年来的研究显示微管抑制剂还可通过抑制肿瘤血管生成和破环肿瘤血管而发挥抗肿瘤活性[5]。尽管微管抑制剂广泛用于癌症的治疗, 但肿瘤非常普遍地存在耐药性[6, 7]。另外很多微管抑制剂是植物或微生物来源的次生代谢产物, 其自身产量极低, 且化合物结构复杂, 难于合成, 产量一直受到限制[8, 9]。临床常用微管抑制剂还存在其他缺陷, 例如具有神经毒性、水溶性差等[3, 9-11]。寻找新型微管蛋白抑制剂有望克服这些不足。
2-(4-吗啉基)-5-硝基苯甲酸4-甲硫基苄酯(IMB5046)是本课题组从化合物库中筛选得到的一种具有全新结构的微管蛋白聚合抑制剂[12]。之前的研究显示IMB5046结合于秋水仙碱位点上, 对秋水仙碱、长春新碱及紫杉醇耐受的细胞株表现出较强的杀伤活性[12]。本文报道了IMB5046的合成线路及其体外抗血管生成活性。根据IMB5046的结构特点, 本研究以2-(4-吗啉基)-5-硝基苯甲酸(化合物1)与4-甲硫基苄醇(化合物2)反应生成IMB5046。采用荧光法、MTT法、流式细胞术、划痕实验、Transwell实验及内皮小管生成实验等检测化合物对血管内皮细胞微管聚合、增殖、周期、运动及血管生成的影响。实验结果显示两种原料药均不具备微管聚合抑制活性及细胞增殖抑制活性。IMB5046将内皮细胞阻滞于G2/M期, 可显著抑制内皮细胞的增殖、运动及内皮小管的生成, 表明IMB5046有希望成为一种具有抗血管生成活性的靶向微管药物。
材料与方法仪器 质谱分析: Q-TOF串联质谱仪(美国AB Sciex公司, 型号QSTAR), APCI源, 分辨率调节为8 000, 溶剂:甲醇, NC为2, 温度300 ℃; 核磁共振分析: Bruker AV500-Ⅲ核磁共振仪(德国Bruker公司), 1H NMR核磁共振频率为500 MHz, TMS为内标, 溶剂CDCl3; 高效液相色谱分析: UltiMate 3000液相色谱系统(美国Thermo Fisher Scientific公司), 色谱柱采用资生堂CAPCELL PAK C18反相色谱柱(4.6 mm×150 mm, 5 μm), 流动相:乙腈-水(0.1% TFA)溶液, 将约1 mg IMB5046样品溶解于3 mL流动相中, 得到测试液, 柱温40 ℃, 进样量5 μL, 流速1 mL·min-1, 检测波长400 nm, 采用面积归一化法计算化合物纯度; 全波长扫描采用DU800型紫外/可见分光光度计(美国Beckman公司)。
制备2-(4-吗啉基)-5-硝基苯甲酰氯 将2-(4-吗啉基)-5-硝基苯甲酸溶于由甲苯与二甲基甲酰胺按照体积比1:0.1~1:0.2组成的混合溶剂中, 得到浓度为1.0%~2.5%的2-(4-吗啉基)-5-硝基苯甲酸溶液(以重量计), 然后在温度50~80 ℃的条件下搅拌0.8~1.2 h, 接着滴加浓度为50%~70%的亚硫酰氯甲苯溶液(以重量计), 其中2-(4-吗啉基)-5-硝基苯甲酸与亚硫酰氯的摩尔比为1:1~1:6, 在同样的温度下继续反应4~ 8 h, 得到的反应液进行减压蒸干, 得到一种蒸干物W1;按照蒸干物W1 (以克计)与乙醚的比为1:50~ 1:80 (以毫升计), 让蒸干物W1在乙醚中于室温条件下进行重结晶, 分离的结晶物在红外灯下于温度50~60 ℃的条件下进行干燥, 得到2-(4-吗啉基)-5-硝基苯甲酰氯。
制备2-(4-吗啉基)-5-硝基苯甲酸4-甲硫基苄酯 在温度0 ℃与搅拌的条件下, 将4-甲硫基苄醇完全溶于吡啶中得到浓度为3%~10%的溶液Ⅰ (以重量计), 同时将步骤“制备2-(4-吗啉基)-5-硝基苯甲酰氯”得到的2-(4-吗啉基)-5-硝基苯甲酰氯溶于二氯甲烷中得到浓度为10%~20%的溶液Ⅱ (以重量计); 然后, 按照4-甲硫基苄醇与2-(4-吗啉基)-5-硝基苯甲酰氯的摩尔比1:1.0~1:1.2把溶液Ⅱ滴加到溶液Ⅰ中, 在温度2~-2 ℃的条件下搅拌0.8~1.2 h, 接着在室温下反应一夜, 该反应液再减压蒸干, 得到一种蒸干物W2;按照蒸干物W2与硅胶的质量比1:1~1:3, 将蒸干物W2与硅胶混合, 然后按照蒸干物W2 (以克计)和硅胶混合物与二氯甲烷(以毫升计)的比为1:2.0~1:6.0, 将蒸干物W2和硅胶混合物加入二氯甲烷溶剂中, 然后在温度40~50 ℃的条件下蒸干得到蒸干物, 把这种蒸干物加到硅胶柱上层, 再使用苯与乙酸乙酯按照体积比3:0.4~3:0.6组成的混合溶剂在室温、减压的条件下进行洗脱, 收集的洗脱液进行减压蒸干, 得到一种蒸干物W3;按照蒸干物W3 (以克计)与乙醚(以毫升计)的比为1:20~1:30, 让蒸干物W3在乙醚和室温条件下进行重结晶, 分离的结晶物在红外灯下在温度50~60 ℃的条件下干燥, 得到化合物2-(4-吗啉基)-5-硝基苯甲酸4-甲硫基苄酯。
细胞培养 人微血管内皮细胞HMEC-1为本实验室保存, 用含10%胎牛血清的DMEM培养基(Hyclone公司)培养于37 ℃、5% CO2培养箱。人肝癌细胞HepG2及肺癌细胞NCI-H460为本实验室保存, 用含10%胎牛血清的RPMI-1640培养基(Hyclone公司)培养于37 ℃、5% CO2培养箱。
MTT检测 取对数生长期的细胞消化、计数, 按细胞数4 000个/孔接种于96孔板, 培养于37 ℃、5% CO2培养箱24 h后, 分别加入不同浓度的药物, 每个药物浓度设3个平行孔。继续培养48 h后, 每孔加入以磷酸盐缓冲液溶解的四唑盐(MTT, 5 mg·mL−1) 20 μL, 37 ℃继续培养4 h后, 吸弃上清液, 加入150 μL DMSO, 室温下摇床振摇10 min, 酶标仪上测定570 nm的光吸收度值(A)。每次实验均设无药对照孔和无细胞空白孔各3个。按公式[抑制率%=(A对照组−A给药组)/(A对照组−A空白组)×100%]计算药物对细胞的增殖抑制率。
荧光实验 HMEC-1细胞按1.5×104个/孔种4腔室35 mm玻底培养皿(Cellvis公司), 待细胞长至80%满, 加入终浓度100 nmol·L-1 SiR-tubulin (Cytoskeleton公司), 继续培养12 h后, 加入待测药物1 h, 荧光显微镜拍照(Olympus IX81), 观察微管骨架及细胞形态。
细胞周期检测 取对数生长期的HMEC-1细胞消化、计数, 按细胞数2×105个/孔接种于6孔板, 培养于37 ℃、5% CO2培养箱; 24 h后, 加入IMB5046, 继续培养24 h后, 消化、收集细胞, 用磷酸盐缓冲液洗2遍, 70%乙醇4 ℃固定过夜; 加入终浓度为50 μg·mL−1碘化丙啶(PI)及100 μg·mL−1 RNA酶A, 室温下避光放置30 min后, 流式细胞仪检测细胞周期(BD FACS Calibur Cytometer)。
划痕实验 HMEC-1细胞按5×105个/孔种6孔板, 待细胞长满孔板(约24 h)用200 μL移液器头划痕, 磷酸盐缓冲液洗3次, 去除划下的细胞; 加入含1%胎牛血清的DMEM培养基, 同时加入不同浓度的药物继续培养, 在加药时及加药后24 h分别拍照(Motic AE31显微镜)。Image J软件(version1.49, National Institutes of Health)分析细胞迁移的面积, 计算抑制率。
Transwell实验 取对数生长期的HMEC-1细胞, 胰酶消化并收集细胞, 用含1%胎牛血清的DMEM培养液洗涤细胞3次, 用无血清的DMEM培养液重悬细胞(每毫升细胞数1×106个)。取100 μL细胞悬液加入Transwell (Millipore公司)上室, 同时加入不同浓度的药物; 在Transwell的下室加入含5%胎牛血清的DMEM培养液600 μL, 37 ℃培养4 h。取出上室, 用棉签擦掉上层细胞, 加入甲醇固定3 min, 弃固定液, 加入0.1%结晶紫染液, 染色20 min, 双蒸水洗3遍, 显微镜下拍照(Motic AE31显微镜); 随机统计5个视野的跨膜细胞数, 计算跨膜抑制率。
内皮小管生成实验 基质胶(威格拉斯生物技术有限公司) 4 ℃溶解过夜, 按每孔150 μL加入预冷的48孔板, 37 ℃聚合4~6 h。HMEC-1细胞按4×104个/孔种板, 加入不同浓度的药物, 继续培养16 h后, 显微镜拍照(Motic AE31)。Image J软件(version 1.49, National Institutes of Health)分析小管长度及节点数目。
统计学方法 统计分析运用Excel软件进行(Microsoft Office Standard 2013), t检验用于分析组间的差异。P < 0.05被认为在统计学上有差异, P < 0.01为显著性差异。
结果 1 IMB5046的合成及鉴定IMB5046的合成过程见路线1。首先, 将2-(4-吗啉基)-5-硝基苯甲酸与亚硫酰氯反应转化成2-(4-吗啉基)-5-硝基苯甲酰氯; 接着与4-甲硫基苄醇反应制得2-(4-吗啉基)-5-硝基苯甲酸4-甲硫基苄酯。终产物结构经1H NMR、HR-MS确证, 1H NMR (CDCl3, 500 MHz) δ: 2.49 (s, 3H, S-Me), 3.15 (t, J = 4.5 Hz, 4H, 2N(CH2)), 3.75 (t, J = 4.5 Hz, 4H, 2O(CH2)), 5.31 (s, 2H, CH2Ar), 6.96 (d, J = 9.5 Hz, 1H, ArH), 7.27 (d, J = 8.0 Hz, 2H, ArH), 7.38 (d, J = 8.0 Hz, 2H, ArH), 8.22 (dd, J = 9.0, 2.5 Hz, 1H, ArH), 8.61 (d, J = 2.5 Hz, 1H, ArH)。质谱结果表明终产物的分子离子峰389.117 0 [M+H]+ (Calcd. for C19H21N2O5S 389.116 6)。由这些测定数据可以确定, 这个步骤所得到的终产物即是IMB5046。HPLC分析表明终产物的纯度为99.86%。
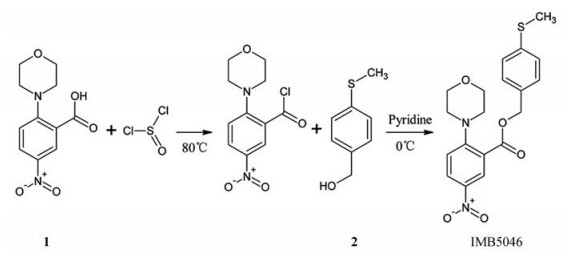
|
Scheme 1 Synthetic route of IMB5046 |
全波长扫描显示化合物1在393 nm处存在最大吸收峰, 化合物2在257 nm处存在最大吸收峰, IMB5046在269 nm及406 nm处均存在吸收峰(图 1)。
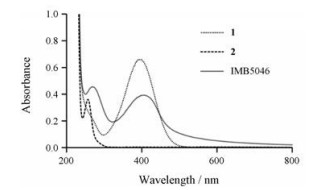
|
Figure 1 Full wavelength scan of compound 1, 2 and IMB5046 |
MTT法检测3种化合物对血管内皮细胞及肿瘤细胞增殖的影响。10 μmol·L-1化合物1、2处理细胞48 h后, 对人微血管内皮细胞HMEC-1、人肝癌细胞HepG2及人肺癌细胞NCI-H460的生长没有明显影响。10 μmol·L-1 IMB5046对HMEC-1细胞的增殖抑制率为45.9%。IMB5046对HepG2细胞及NCI-H460细胞的半数抑制浓度(IC50)为0.102±0.020及0.165±0.046 μmol·L-1 (表 1)。
| Table 1 Effect of three compounds on cell proliferation. n = 3, x±s > 10 indicates that 10 μmol·L-1 compound shows no obvious effect on cell proliferation. *Inhibitory rates of 10 μmol·L-1 IMB5046 |
微管抑制剂作用于细胞时, 会引起细胞形态的改变, 本研究比较了两种原料药及IMB5046对血管内皮细胞形态的影响。HMEC-1运用药物处理1 h后, 观察细胞形态。10 μmol·L-1化合物1、2对细胞形态没有明显影响。1 μmol·L-1 IMB5046处理后细胞收缩变圆, 且可观察到明显的细胞膜出泡现象(图 2A)。
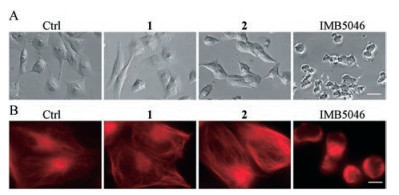
|
Figure 2 Effect of three compounds on morphology and microtubule structure in HMEC-1 cells. A: HMEC-1 cells were treated with 10 μmol·L-1 compound 1, 2 or 1 μmol·L-1 IMB5046, respectively, for 1 h, then visualized by phase contrast microscopy. White arrow indicates the membrane blebs. (bar = 30 μm); B: HMEC-1 cells were labeled with SiR-tubulin for 12 h, then treated with 10 μmol·L-1 compound 1, 2 or 1 μmol·L-1 IMB5046, respectively, for 1 h, and photographed under fluorescence microscopy (bar = 10 μm) |
荧光法检测3种化合物对血管内皮细胞微管骨架的影响。SiR-tubulin可在活细胞中标记微管, HMEC-1细胞与SiR-tubulin孵育12 h后, 加入不同浓度的药物处理细胞1 h, 荧光显微镜检测。结果显示10 μmol·L-1化合物1、2对微管骨架无明显影响, 1 μmol·L-1 IMB5046引起微管骨架的解聚(图 2B)。
4 IMB5046将内皮细胞阻滞于G2/M期微管抑制剂可诱导细胞周期的阻滞, 本研究探讨了IMB5046对HMEC-1细胞周期的影响。1 μmol·L-1 IMB5046作用24 h后, 流式细胞术检测细胞周期的变化。结果显示, G2/M期细胞的比例由9.24%上升至42.32%, G1期细胞的比例由61.58%下降至14.67%。说明IMB5046将细胞周期阻滞于G2/M期(图 3)。
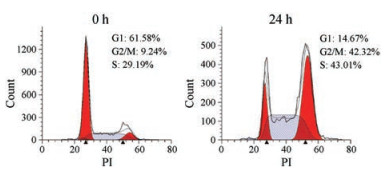
|
Figure 3 IMB5046 arrests HMEC-1 cells at G2/M phase. HMEC-1 cells were treated with 1 μmol·L-1 IMB5046 for 24 h, then stained with PI and analyzed by flow cytometry |
内皮细胞的增殖、运动及内皮小管的形成在新生血管的生成过程中发挥着重要[13], 划痕实验可检测药物对细胞运动能力的影响。HMEC-1细胞接种6孔板, 细胞贴壁24 h后, 划痕并加入不同浓度的IMB5046, 24 h后检测划痕愈合情况。结果显示, IMB5046可显著抑制划痕的愈合(图 4A), 且呈明显的浓度依赖性(图 4B)。按细胞迁移的面积计算50 nmol·L-1 IMB5046抑制率为72.3%。MTT结果显示, 50和100 nmol·L-1 IMB5046作用24 h后, 对HMEC-1细胞增殖抑制率为5.6%和10.6% (图 4C), 与对照组相比细胞存活率均无显著差异, 说明IMB5046能特异性地抑制HMEC-1细胞的运动能力。
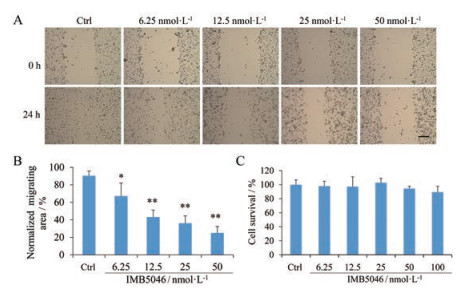
|
Figure 4 IMB5046 suppresses the migration of HMEC-1 cells evaluated by scratch assay. Representative results (A) and quantitative data (B) of scratch wound-healing migration in cells treated with IMB5046 were shown. n = 5, x±s*P < 0.05, **P < 0.01 vs control group (Ctrl). (bar = 200 μm). C: Effect of IMB5046 on the proliferation of HMEC-1 cells after 24-h treatment. n = 3, x±s |
本研究进一步运用Transwell实验检测了IMB5046对HMEC-1细胞跨膜运动能力的影响。将HMEC-1细胞接种于Transwell上室, 12.5和50 nmol·L-1 IMB5046作用4 h后, 跨膜细胞数分别减少了30%和47% (图 5A, B)。
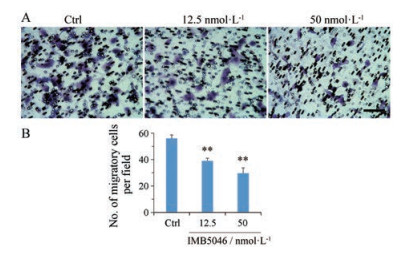
|
Figure 5 IMB5046 inhibits the migration of HMEC-1 cells evaluated by Transwell assay. A: Representative results; B: Statistical analysis of the number of migratory cells. Data are expressed as x±s from five random fields. **P < 0.01 vs Ctrl (bar = 100 μm) |
内皮小管形成实验可在体外检测药物对血管生成的影响。HMEC-1细胞接种于基质胶上, 同时加入不同浓度的IMB5046, 继续培养16 h后, 显微镜观察。结果如图 6所示, IMB5046破坏内皮小管的生成, 12.5和50 nmol·L-1 IMB5046分别使小管数减少了62%及77%, 节点数减少了25.4%及48%。由于12.5和50 nmol·L-1 IMB5046对HMEC-1细胞无明显细胞毒活性, 说明IMB5046可特异性抑制内皮小管的生成。
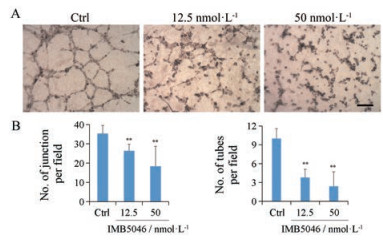
|
Figure 6 IMB5046 inhibits tube formation of endothelial cells. A: The effects of IMB5046 on tube formation of HMEC-1 cells on matrigel (bar = 200 μm); B: Statistical analysis of the number of junctions and tubes after treatment. Data are expressed as x±s from five random fields. **P < 0.01 vs Ctrl |
微管是除DNA外, 抗肿瘤药物最重要的靶点[3]。微管抑制剂广泛用于肿瘤的治疗, 但都不可避免地存在耐药性, 且这些化合物合成困难、水溶性差, 筛选新型微管抑制剂尤为必要。IMB5046是本课题组从约4万个化合物中筛选得到的具有全新结构的微管蛋白聚合抑制剂, 先前的研究显示IMB5046能显著抑制人异种移植瘤的生长[12], 且由于其较小的分子量, IMB5046是很有潜力的抗肿瘤药物。本研究以2-(4-吗啉基)-5-硝基苯甲酸与4-甲硫基苄醇通过两步反应生成IMB5046, 具有方法简单易于纯化的特点。本文对比研究了2种原料药与IMB5046的药理活性, 结果表明两种原料药均不具备微管抑制活性及细胞增殖抑制活性, 只有生成IMB5046后才具备活性, 说明IMB5046的两部分结构对其与微管蛋白结合并发挥聚合抑制活性缺一不可。
研究显示, 微管抑制剂可抑制肿瘤新生血管的生成, 且可破坏已形成的血管[5, 14]。本研究表明, IMB5046可抑制血管内皮细胞的增殖、运动及内皮小管的形成, 说明IMB5046体外具备血管生成抑制活性。由于IMB5046能强烈抑制肿瘤细胞的增殖并诱导细胞凋亡[12], 同时能抑制肿瘤血管的生成, IMB5046可通过直接杀伤肿瘤细胞和间接饿死肿瘤细胞而发挥双重抗肿瘤活性。肿瘤血管为肿瘤细胞的转移提供了通道, IMB5046可通过破坏肿瘤血管而抑制肿瘤细胞的转移。肿瘤血管内皮细胞通常为正常细胞, 基因组相对稳定, 不易产生耐药性; 且IMB5046不是P-gp糖蛋白底物, 对耐药肿瘤细胞具有较强的杀伤活性[12], IMB5046有望为耐药及复发的肿瘤患者提供新的治疗选择。
本文侧重于IMB5046的合成及体外抗血管生成活性研究, 其体内抗血管生成活性仍需进一步实验证实。课题组将在后续实验中运用鸡胚绒毛尿囊膜实验、动物模型等研究IMB5046的体内抗血管生成活性, 并对其在体内生物学效应、代谢动力学和毒副作用等进行研究。另外, 由于IMB5046具有较强的细胞毒活性, 导致其用药窗较窄, 且水溶性较差, 改进IMB5046的剂型如制备白蛋白结合型纳米粒、抗体药物偶联物及脂质体药物等有望进一步提高IMB5046的疗效, 为其临床应用提供基础。
本研究以2-(4-吗啉基)-5-硝基苯甲酸与4-甲硫基苄醇通过两步反应生成IMB5046, 具有方法简单易于纯化的特点。两种原料药均不具备微管抑制活性及细胞增殖抑制活性。IMB5046体外具备血管生成抑制活性, 有望在克服肿瘤耐药及抑制肿瘤转移领域发挥作用。
| [1] | Parker AL, Kavallaris M, McCarroll JA. Microtubules and their role in cellular stress in cancer[J]. Front Oncol, 2014, 4: 153. |
| [2] | Howard J, Hyman AA. Dynamics and mechanics of the microtubule plus end[J]. Nature, 2003, 422: 753–758. DOI:10.1038/nature01600 |
| [3] | Dumontet C, Jordan MA. Microtubule-binding agents:a dynamic field of cancer therapeutics[J]. Nat Rev Drug Discov, 2010, 9: 790–803. DOI:10.1038/nrd3253 |
| [4] | Jordan MA, Wilson L. Microtubules as a target for anticancer drugs[J]. Nat Rev Cancer, 2004, 4: 253–265. DOI:10.1038/nrc1317 |
| [5] | Kanthou C, Tozer GM. Microtubule depolymerizing vascular disrupting agents:novel therapeutic agents for oncology and other pathologies[J]. Int J Exp Pathol, 2009, 90: 284–294. DOI:10.1111/j.1365-2613.2009.00651.x |
| [6] | Kavallaris M. Microtubules and resistance to tubulin-binding agents[J]. Nat Rev Cancer, 2010, 10: 194–204. DOI:10.1038/nrc2803 |
| [7] | Dumontet C, Sikic BI. Mechanisms of action of and resistance to antitubulin agents:microtubule dynamics, drug transport, and cell death[J]. J Clin Oncol, 1999, 17: 1061–1070. DOI:10.1200/JCO.1999.17.3.1061 |
| [8] | Pabla N, Sparreboom A. CCR 20th anniversary commentary:BMS-247550-microtubule stabilization as successful targeted therapy[J]. Clin Cancer Res, 2015, 21: 1237–1239. DOI:10.1158/1078-0432.CCR-14-2551 |
| [9] | Arora S, Wang XI, Keenan SM, et al. Novel microtubule poly-merization inhibitor with potent antiproliferative and antitumor activity[J]. Cancer Res, 2009, 69: 1910–1915. DOI:10.1158/0008-5472.CAN-08-0877 |
| [10] | Cavaletti G, Cavalletti E, Oggioni N, et al. Distribution of paclitaxel within the nervous system of the rat after repeated intravenous administration[J]. Neurotoxicology, 2000, 21: 389–393. |
| [11] | Ohsumi K, Nakagawa R, Fukuda Y, et al. Novel combretastatin analogues effective against murine solid tumors:design and structure-activity relationships[J]. J Med Chem, 1998, 41: 3022–3032. DOI:10.1021/jm980101w |
| [12] | Zheng YB, Gong JH, Liu XJ, et al. A novel nitrobenzoate microtubule inhibitor that overcomes multidrug resistance exhibits antitumor activity[J]. Sci Rep, 2016, 6: 31472. DOI:10.1038/srep31472 |
| [13] | Su M, Huang J, Li J, et al. ZLM-7 exhibits anti-angiogenic effects via impaired endothelial cell function and blockade of VEGF/VEGFR-2 signaling[J]. Oncotarget, 2016, 7: 19018–19030. |
| [14] | Pasquier E, Honoré S, Braguer D. Microtubule-targeting agents in angiogenesis:where do we stand?[J]. Drug Resist Updat, 2006, 9: 74–86. DOI:10.1016/j.drup.2006.04.003 |
 2019, Vol. 54
2019, Vol. 54


