2. 西南大学动物科学学院, 重庆 402460
2. College of Animal Science, Southwestern University, Chongqing 402460, China
线粒体在几乎所有的真核细胞中均有非常重要的作用, 包括提供能量、维持细胞稳态、调节凋亡和自噬等。在最近的报道中, 线粒体可作为注射用药, 能够挽救受损的细胞并恢复细胞稳态[1-3]。临床研究已表明, 注射到心肌内的线粒体, 可改善心肌缺血儿童患者的心室功能并减轻缺血性损伤[4]。本课题组也证明了静脉注射的线粒体可通过提高细胞能量供应和细胞活力, 从而降低由安非他命和高脂饮食造成的肝脏损伤[5, 6]。尽管如此, 线粒体作为药物的功能还远未被完全揭示。已知线粒体在肿瘤始发时, 就改变了自身的功能和代谢途径, 促进肿瘤适应缺氧和酸性的微环境[7-9]。然而, 尚不清楚正常健康的线粒体对肿瘤发生发展的影响。
黑色素瘤是可致死的皮肤癌, 尤其近几年其发生率快速增长[10, 11]。本研究以小鼠皮下黑色素瘤为肿瘤模型, 研究从小鼠肝脏分离的线粒体对肿瘤生长的影响。同时, 还对比了青年和老年小鼠来源的线粒体的功能。本研究不仅对线粒体治疗肿瘤提出了新的思路, 而且还对了解线粒体和肿瘤的相互关系, 提供了新的证据。
材料和方法动物 雄性C57BL/6J小鼠, 购自重庆医科大学动物中心(生产许可号: SCXK [京2009-0015])。动物实验经西南大学实验动物伦理审查委员会批准。取1.5月龄的小鼠用于皮下肿瘤模型的制作。分别使用1.5月龄小鼠的肝脏(青年线粒体)和12月龄小鼠的肝脏(老年线粒体)提取线粒体。
细胞培养和皮下黑色素瘤小鼠模型的制备 黑色素瘤B16F10细胞株源自中国科学院上海生命科学院生物化学与细胞生物学研究所。常规培养于含有10%胎牛血清的RPMI 1640培养基中(含青、链霉素双抗, 100 u·mL-1)。在37 ℃、5% CO2培养箱中进行传代培养。取对数生长期的肿瘤细胞, 吸去培养液, 收集细胞, D-Hank液洗涤2次, 台盼蓝染色, 显微镜下计数存活的肿瘤细胞, 存活肿瘤细胞应大于95%。调整细胞数为每毫升1×107个。消毒小鼠右侧腋窝皮肤, 注射黑色瘤细胞悬液(每只0.2 mL)。
线粒体的分离 参考文献[12, 13]进行肝脏线粒体的分离。小鼠经颈椎脱臼快速处死, 迅速分离出肝脏。在冰冷的PBS溶液中洗涤并切碎匀浆, 匀浆液在低温匀浆机(0~4 ℃)中, 于800 ×g离心5 min。收集上清液, 重悬在分离液中, 于10 000 ×g离心10 min。沉淀中的线粒体用分离液洗涤2次, 然后置于4 ℃备用。计数时线粒体用詹纳斯绿B染色, 用细胞计数器在显微镜下计算线粒体数量。线粒体的分离和计数在60 min内完成。分离的线粒体在透射电镜(transmission electron microscope, TEM)下观测纯度和线粒体形貌。另外, 采用刃天青法检测线粒体的氧化还原能力[14]。每次实验前线粒体均临时提取, 立刻使用。
分组与给药 在接种肿瘤5天后, 将小鼠分为3组, 每组7只, 分别为老年线粒体组、青年线粒体组和模型对照组。其中线粒体组小鼠在分组后, 每隔1天静脉注射108个线粒体。对照组给予等量的PBS。观察记录肿瘤生长情况, 直至模型组的荷瘤小鼠因状态萎靡或肿瘤过大而被处死。另外, 当荷瘤小鼠第一次给予线粒体后4 h, 分离肿瘤组织, 戊二醛固定, TEM下观察肿瘤细胞中的线粒体数量。
抗肿瘤效果评估 肿瘤细胞移植到小鼠皮下后, 用游标卡尺测量肿瘤最长径(L)和肿瘤垂直方向最大横径(W), 依照公式计算肿瘤体积(V): V = LW2/2。生长速度以肿瘤逐日增长的体积百分率计算。在处死小鼠后, 分离小鼠肿瘤组织, 称重并进行HE染色。同时, 使用南京建成生物公司的试剂盒测定肿瘤组织匀浆液中的活性氧自由基(reactive oxygen species, ROS)、谷胱甘肽(glutathione, GSH)和腺苷三磷酸(adenosine-5-triphosphate, ATP)水平。此外, TEM下观察肿瘤细胞内的细胞器形态。
数据统计 数据表示为x±s。采用方差分析进行统计分析。P < 0.05为具有统计学意义。
结果 1 从青年和老年小鼠肝脏中分离的线粒体在TEM下, 青年线粒体膜完整, 并且内部嵴排列整齐、致密, 而老年线粒体的嵴之间出现大的空隙(图 1A); 氧化还原能力显示, 老年线粒体对刃天青的氧化还原能力明显减弱(图 1B), 提示老年线粒体的功能有所减弱。这与老年线粒体功能下降的报道一致[15, 16]。
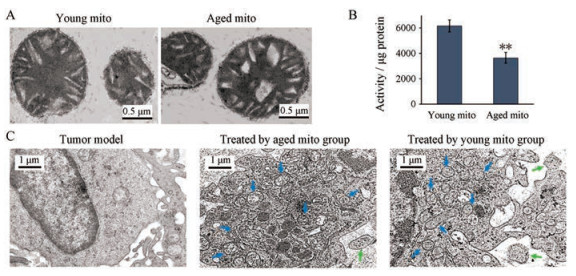
|
Figure 1 Hepatic mitochondrial (mito) from the young and aged mice entered tumor tissue of melanoma bearing mice. A: Young and aged mitochondria under transmission electron microscope; B: Determination of mitochondrial redox level; C: Mitochondria enter melanoma cells. The blue arrow represents the mitochondria in the cell, and the green arrow indicates the mitochondria that were entering the cell. n = 4, x±s. **P < 0.01 vs young mitochondrial group |
TEM观测是判断组织细胞内线粒体数量的一个准确且有效的方法。为确定静脉注射的线粒体是否在肿瘤组织内分布, 本研究采用了TEM观测的方法。图像显示, 未经过线粒体处理的小鼠, 其皮下瘤细胞中只有少量的线粒体; 但给予线粒体后, 肿瘤细胞内的线粒体数量明显增加; 并且老年线粒体组和青年线粒体组的线粒体数量没有显示出明显差别(图 1C)。该结果表明线粒体静脉注射后, 可通过血液循环到达肿瘤组织, 并进入肿瘤细胞内。
3 线粒体抑制肿瘤的生长表 1可见, 肿瘤细胞移植后, 模型组的皮下瘤组织块的体积不断增大, 在20天时被处死时, 其肿瘤体积可达(1.35 ± 0.15) cm3 (图 2A、B), 重量达到约0.63 g (图 2C)。而给予线粒体后, 肿瘤生长速度减慢。在青年线粒体静脉注射后的第8天(第4次给药), 肿瘤体积开始缩小, 生长速度呈负增长(图 2D), 至第20天后肿瘤体积缩小到(0.34 ± 0.21) cm3, 重量为约0.22 g。同时, 静脉注射老年线粒体12天后(第6次给药), 肿瘤体积出现负增长, 在第20天后肿瘤体积为(0.81 ± 0.12) cm3, 重量约为0.43 g。另外, 给予线粒体后, 尤其是青年线粒体给药后, 小鼠表现比较活跃, 摄食行为精神状态较好。
| Table 1 Statistical table of melanoma. n = 7, x±s. *P < 0.05, **P < 0.01 vs the melanoma bearing mice in the same column |
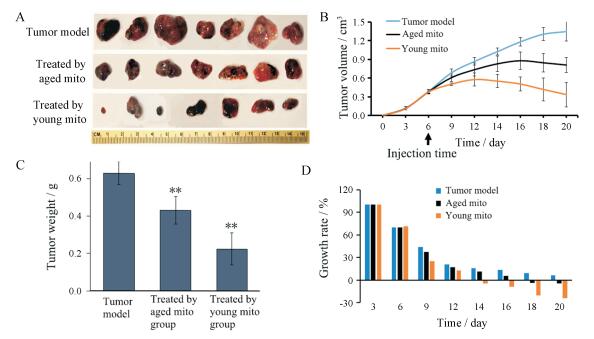
|
Figure 2 The anti-melanoma role of mitochondrial. A: Isolated melanoma; B: Growth curve of tumor volume in each group; C: 20 days after tumor cell transplantation, the weight of melanoma tissue in each group; D: Tumor growth rate in each group. n = 7, x±s. **P < 0.01 vs tumor model |
HE染色结果显示, 模型组的肿瘤呈实质性组织, 内部充盈大量的肿瘤细胞(图 3)。而给予老年线粒体后, 肿瘤内部出现液化; 使用苏木素染色后, 在肿瘤细胞和液化区之间, 出现清晰的细胞破碎的界面; 若给予青年线粒体, 肿瘤内部呈现大面积的液化区, 区域中含有大量的细胞碎片(图 3)。
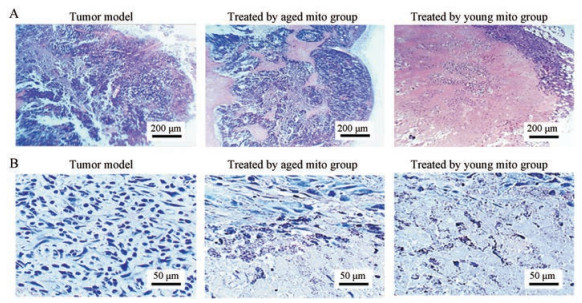
|
Figure 3 Staining of melanoma tissue. A: HE staining (×10); B: Hematoxylin staining (×40) |
生化指标测定结果表明, 给予线粒体后肿瘤组织内ROS明显升高(图 4A), 而细胞内的抗氧化物GSH则相应减少(图 4B)。另外, 小鼠静脉注射线粒体后, 肿瘤组织内的ATP含量明显降低(图 4C)。这与正常细胞接收线粒体后ATP含量明显增高相反。Islam等[17]报道线粒体注射后会导致健康动物的肺泡ATP浓度增加。
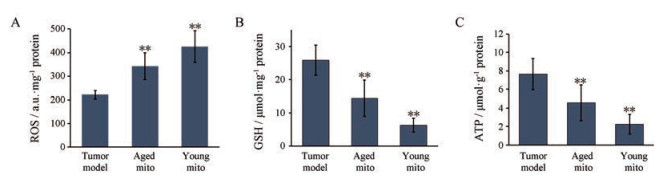
|
Figure 4 Determination of biochemical indices in tumor tissues. A: Reactive oxygen species (ROS); B: Glutathione (GSH); C: Adenosine-5-triphosphate (ATP). n = 4, x±s. **P < 0.01 vs tumor model |
在第20天时, 分离皮下肿瘤组织块进行TEM观察。此时模型组肿瘤细胞内的线粒体数量极少。而在老年线粒体处理组的小鼠肿瘤细胞中, 出现自噬体、细胞内线粒体变形、线粒体和内质网肿胀、核糖体从内质网脱落等现象(图 5)。在青年线粒体治疗组的小鼠肿瘤细胞内, 自噬体数量更多, 且线粒体和内质网肿胀等更为明显, 细胞内出现因缺氧、能量不足或应激引起的大量空泡结构(图 5)。
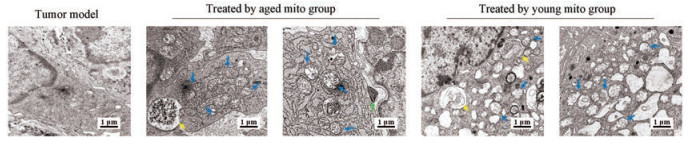
|
Figure 5 Mitochondria in melanoma cells under transmission electron microscope. Blue arrows indicated mitochondria, yellow arrows indicated autophagosome, and green arrows indicated mitochondria that were entering melanoma cells |
线粒体不仅是细胞的发电站, 对维持真核细胞的能量供应和存活不可或缺, 同时线粒体还是细胞的自杀性武器库, 调控着凋亡和自噬通路[18, 19]。外源的正常线粒体可为体细胞提供能量、提高细胞活力并促进细胞增殖[20, 21]。然而, 本研究的结果显示, 外源正常的线粒体可诱发肿瘤细胞自噬、坏死, 从而抑制肿瘤细胞增殖。线粒体对正常细胞和肿瘤细胞的相反作用, 可能在于这两类细胞中的线粒体所起的作用不同。
众所周知, 肿瘤细胞的线粒体和正常细胞的线粒体相比, 从结构、代谢途径到功能均已发生明显改变: ①肿瘤细胞内线粒体DNA以及编码三羧酸循环的多个酶基因均发生了突变[22, 23]; ②肿瘤细胞内线粒体的主要功能不再是消耗氧生成ATP, 而是利用一定的物质(如谷氨酰胺)作为碳源, 生成肿瘤生长所需的中间代谢物[24, 25]。线粒体呼吸功能的缺陷使肿瘤细胞的主要能量供应转变为糖酵解[26, 27]。从而继发性地引起核基因组对糖酵解相关代谢通路调节的重编程, 因此线粒体功能缺陷被认为是诱发肿瘤的起始步骤的“Warburg effect”。此外, 肿瘤细胞内的线粒体数量也发生改变[28]。恶性肿瘤中的线粒体数量明显减少[29], 从而降低氧的消耗以适应肿瘤因快速增殖而导致的缺氧微环境, 并使肿瘤避免因缺氧而激活的线粒体凋亡途径[30]。从药学角度来看, 肿瘤组织内普遍存在的线粒体数量和功能变化, 是防治肿瘤的特异性靶标[31-33]。
黑色素瘤与其他恶性肿瘤类似, 依赖明显增高的糖酵解来供给能量[34], 使肿瘤能够不依赖氧气生存, 适应外周缺氧和酸性的微环境并快速增殖[35, 36]。然而, 当在肿瘤细胞中补充依赖氧并对氧浓度非常敏感的正常线粒体后, 将可能竞争性消耗氧和代谢中间产物丙酮酸等, 导致快速的氧耗竭和营养物缺乏, 从而引发ROS升高等生化反应。同时线粒体在肿瘤细胞内数量的增加也激活了凋亡通路和线粒体自噬。因此, 外源的正常线粒体可抑制肿瘤细胞增殖。相反地, 当正常线粒体进入仍以线粒体为主要能量来源的体细胞时, 可为细胞补充能量, 从而提高细胞活力, 使细胞有足够的能量恢复原有的功能。这种对肿瘤细胞的选择性毒性, 将可能使正常线粒体成为抗肿瘤或其他器官疾病的有效候选药物[5, 6]。
本研究还证明了从青年小鼠中提取的线粒体比老年线粒体的抗肿瘤效能更高。这可能是由于衰老动物的线粒体DNA存在缺失突变, 其对氧气的依赖和ATP的产量比青年线粒体低[37]。因此在缺氧的肿瘤微环境中, 老年线粒体的抗肿瘤效果比青年线粒体低。尽管如此, 老年线粒体依然能够诱导自噬和细胞坏死, 从而抑制肿瘤的生长。
先前的研究表明分离的线粒体可经局部和静脉注射快速进入体内组织器官[38, 39], 包括肝脏、肺、心脏、肾脏和脑等[5, 6]。线粒体在肝脏分布较多, 而脑内分布较少, 研究表明将线粒体注射到正常大鼠体内后, 肺组织内的ATP含量明显升高[40]。但目前线粒体通透血管的机制尚不清楚。虽然静脉给予线粒体后, 线粒体可分布于多个组织, 但由于肿瘤组织的高通透性和滞留效应(enhanced permeability and retention effect; EPR效应)[41, 42], 可能使更多的线粒体滞留于肿瘤组织。这类似于静脉给予的载药微纳米颗粒, 能够被动靶向肿瘤组织并产生生物学效应。
一种理想的抗肿瘤药物不仅要效果明显, 而且这种药物对于正常细胞和组织无害或者有益。根据肿瘤细胞和正常细胞能量代谢方式不同, 增加细胞的线粒体水平, 不仅可显著抑制肿瘤细胞的生长, 而且还可促进正常细胞的生存。本研究不仅显示分离的正常线粒体具有抗肿瘤效果, 而且还证明了青年线粒体比老年线粒体在抗肿瘤方面有更高的效力。鉴于分离的线粒体已应用于临床治疗心肌缺血患者, 其抗恶性肿瘤的作用可能使线粒体在应用中有更广阔的前景。
| [1] | Mccully JD, Cowan DB, Emani SM, et al. Mitochondrial transplantation:from animal models to clinical use in humans[J]. Mitochondrion, 2017, 34: 127–134. DOI:10.1016/j.mito.2017.03.004 |
| [2] | Kitani T, Kami D, Kawasaki T, et al. Direct human mitochondrial transfer:a novel concept based on the endosymbiotic theory[J]. Transplant Proc, 2014, 46: 1233–1236. DOI:10.1016/j.transproceed.2013.11.133 |
| [3] | Cowan DB, Yao R, Akurathi V, et al. Intracoronary delivery of mitochondria to the ischemic heart for cardioprotection[J]. PLoS One, 2016, 11: e0160889. DOI:10.1371/journal.pone.0160889 |
| [4] | Emani SM, Piekarski BL, Ha Rrild D, et al. Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury[J]. J Thorac Cardiovasc Surg, 2017, 154: 286–289. DOI:10.1016/j.jtcvs.2017.02.018 |
| [5] | Fu A, Shi X, Zhang H, et al. Mitotherapy for fatty liver by intravenous administration of exogenous mitochondria in male mice[J]. Front Pharmacol, 2017, 8: 241. DOI:10.3389/fphar.2017.00241 |
| [6] | Shi XX, Bai HY, Zhao M, et al. Treatment of acetaminophen-induced liver injury with exogenous mitochondria in mice[J]. Transl Res, 2018, 196: 31–41. DOI:10.1016/j.trsl.2018.02.003 |
| [7] | Pan Y, Cao M, Liu J, et al. Metabolic regulation in mitochondria and drug resistance[J]. Adv Exp Med Biol, 2017, 1038: 149–171. DOI:10.1007/978-981-10-6674-0 |
| [8] | Lin CS, Liu LT, Ou LH, et al. Role of mitochondrial function in the invasiveness of human colon cancer cells[J]. Oncol Rep, 2018, 39: 316–330. |
| [9] | Stefano GB, Kream RM. Cancer:mitochondrial origins[J]. Med Sci Monit, 2015, 21: 3736–3739. DOI:10.12659/MSM.895990 |
| [10] | Køster B, Meyer M, Andersson T, et al. Development in sunburn 2007-2015 and skin cancer projections 2007-2040 of campaign results in the Danish population[J]. Medicine (Baltimore), 2018, 97: e12738. DOI:10.1097/MD.0000000000012738 |
| [11] | Huber R, Meier B, Otsuka A, et al. Tumour hypoxia promotes melanoma growth and metastasis via high mobility group box-1 and M2-like macrophages[J]. Sci Rep, 2016, 6: 29914. DOI:10.1038/srep29914 |
| [12] | Lu Y, Liu S, Wang Y, et al. Asiatic acid uncouples respiration in isolated mouse liver mitochondria and induces HepG2 cells death[J]. Eur J Pharmacol, 2016, 786: 212–223. DOI:10.1016/j.ejphar.2016.06.010 |
| [13] | Bustamante E, Pediaditakis P, He L, et al. Isolated mouse liver mitochondria are devoid of glucokinase[J]. Biochem Biophys Res Commun, 2005, 334: 907–910. DOI:10.1016/j.bbrc.2005.06.174 |
| [14] | Zhang HX, Du GH, Zhang JT, et al. Assay of mitochondrial functions by resazurin in vitro[J]. Acta Pharmacol Sin, 2004, 25: 385–389. |
| [15] | Dhillon RS, Denu JM. Using comparative biology to understand how aging affects mitochondrial metabolism[J]. Mol Cell Endocrinol, 2017, 455: 54–61. DOI:10.1016/j.mce.2016.12.020 |
| [16] | Del Campo AD, Jaimovich E, Tevy MF. Mitochondria in the aging muscles of flies and mice:new perspectives for old characters[J]. Oxid Med Cell Longev, 2016, 2016: 9057593. |
| [17] | Islam MN, Das SR, Emin MT, et al. Mitochondrial transfer from bone-marrow-derived stromal cells to pulmonary alveoli protects against acute lung injury[J]. Nat Med, 2012, 18: 759–765. DOI:10.1038/nm.2736 |
| [18] | Simone F, Lorenzo G, Guido K. Targeting mitochondria for cancer therapy[J]. Environ Mol Mutagen, 2010, 51: 476–489. DOI:10.1002/em.v51:5 |
| [19] | Wang Y, Liu SN, Shen ZF. Dynamic associations of mitochondria-endoplasmic reticulum in maintenance of pancreatic beta cell homeostasis[J]. Acta Pharm Sin (药学学报), 2017, 52: 667–672. |
| [20] | Gollihue JL, Patel SP, Eldahan KC, et al. Effects of mitochondrial transplantation on bioenergetics, cellular incorporation and functional recovery after spinal cord injury[J]. J Neurotrauma, 2018, 35: 1800–1818. DOI:10.1089/neu.2017.5605 |
| [21] | Robicsek O, Ene HM, Karry R, et al. Isolated mitochondria transfer improves neuronal differentiation of schizophrenia-derived induced pluripotent stem cells and rescues deficits in a rat model of the disorder[J]. Schizophr Bull, 2018, 44: 432–442. DOI:10.1093/schbul/sbx077 |
| [22] | Sajnani K, Islam F, Smith RA, et al. Genetic alterations in Krebs cycle and its impact on cancer pathogenesis[J]. Biochimie, 2017, 135: 164–172. DOI:10.1016/j.biochi.2017.02.008 |
| [23] | Kirches E. MtDNA as a cancer marker:a finally closed chapter?[J]. Curr Genomics, 2017, 18: 255–267. DOI:10.2174/1389202918666170105093635 |
| [24] | Scalise M, Pochini L, Galluccio M, et al. Glutamine transport and mitochondrial metabolism in cancer cell growth[J]. Front Oncol, 2017, 7: 306. DOI:10.3389/fonc.2017.00306 |
| [25] | Filipp FV, Boris R, Jessica DI, et al. Glutamine-fueled mitochondrial metabolism is decoupled from glycolysis in melanoma[J]. Pigment Cell Melanoma Res, 2012, 25: 732–739. DOI:10.1111/pcmr.2012.25.issue-6 |
| [26] | Seyfried TN, Sanderson TM, El-abbadi MM, et al. Role of glucose and ketone bodies in the metabolic control of experimental brain cancer[J]. Br. J Cancer, 2003, 89: 1375–1382. DOI:10.1038/sj.bjc.6601269 |
| [27] | Zhu Y, Dean AE, Horikoshi N, et al. Emerging evidence for targeting mitochondrial metabolic dysfunction in cancer therapy[J]. J Clin Invest, 2018, 128: 3682–3691. DOI:10.1172/JCI120844 |
| [28] | Onishi Y, Ueha T, Kawamoto T, et al. Regulation of mitochondrial proliferation by PGC-1α induces cellular apoptosis in musculoskeletal malignancies[J]. Sci Rep, 2013, 4: 3916. |
| [29] | Man Y, Yunli Z, Yurong S, et al. Reduced mitochondrial DNA copy number is correlated with tumor progression and prognosis in Chinese breast cancer patients[J]. IUBMB Life, 2010, 59: 450–457. |
| [30] | Bensaad K, Harris AL. Hypoxia and metabolism in cancer[J]. Adv Exp Med Biol, 2014, 772: 1–39. DOI:10.1007/978-1-4614-5915-6 |
| [31] | Barbosa IA, Machado NG, Skildum AJ, et al. Mitochondrial remodeling in cancer metabolism and survival:potential for new therapies[J]. Biochim Biophys Acta, 2012, 1826: 238–254. |
| [32] | Weinberg SE, Chandel NS. Targeting mitochondria metabolism for cancer therapy[J]. Nat Chem Biol, 2015, 11: 9–15. DOI:10.1038/nchembio.1712 |
| [33] | Zhu Q, Lin F. Molecular markers of autophagy[J]. Acta Pharm Sin (药学学报), 2016, 51: 33–38. |
| [34] | Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect:the metabolic requirements of cell proliferation[J]. Science, 2009, 324: 1029–1033. DOI:10.1126/science.1160809 |
| [35] | Lian L, Ren F, Chao Q, et al. Intermittent hypoxia promotes melanoma lung metastasis via oxidative stress and inflammation responses in a mouse model of obstructive sleep apnea[J]. Respir Res, 2018, 19: 19–28. DOI:10.1186/s12931-018-0724-0 |
| [36] | Han YH, Lai XH, Le ZW, et al. Anti-tumor effect and impact on tumor immune microenvironment of tumor-targeted Salmonella VNP20009[J]. Acta Pharm Sin (药学学报), 2016, 51: 1417–1422. |
| [37] | Jodi N, Anu S. Mitochondria:in sickness and in health[J]. Cell, 2012, 148: 1145–1159. DOI:10.1016/j.cell.2012.02.035 |
| [38] | Zhang Z, Ma Z, Yan C, et al. Muscle-derived autologous mitochondrial transplantation:a novel strategy for treating cerebral ischemic injury[J]. Behav Brain Res, 2019, 356: 322–331. DOI:10.1016/j.bbr.2018.09.005 |
| [39] | Shi XX, Zhao M, Fu C, et al. Intravenous administration of mitochondria for treating experimental Parkinson's disease[J]. Mitochondrion, 2017, 34: 91–100. DOI:10.1016/j.mito.2017.02.005 |
| [40] | Zhu L, Zhang J, Zhou J, et al. Mitochondrial transplantation attenuates hypoxic pulmonary hypertension[J]. Oncotarget, 2016, 7: 48925–48940. |
| [41] | Greish K. Enhanced permeability and retention (EPR) effect for anticancer nanomedicine drug targeting[J]. Methods Mol Biol, 2010, 624: 25–37. DOI:10.1007/978-1-60761-609-2 |
| [42] | Iyer AK, Khaled G, Fang J, et al. Exploiting the enhanced permeability and retention effect for tumor targeting[J]. Drug Discov Today, 2006, 11: 812–818. DOI:10.1016/j.drudis.2006.07.005 |
 2019, Vol. 54
2019, Vol. 54


