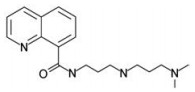
天然多胺(polyamine, PA), 包括腐胺(putrescine, Put)、精脒(spermidine, Spd)和精胺(spermine, Spm), 是一类普遍存在于真核细胞并带高密度正电荷的小分子脂肪族化合物[1]。细胞中的天然多胺能与DNA、RNA、蛋白质和磷脂等带负电荷的生物大分子相互作用, 具有维持染色质结构、调节基因表达、维持细胞膜稳定和清除自由基等重要生理功能[2, 3]。研究发现, 肿瘤细胞的快速生长高度依赖于细胞内的多胺含量, 耗竭肿瘤细胞中多胺可有效抑制肿瘤细胞的生长, 由此干扰多胺代谢和和拮抗多胺促细胞生长与分化的功能成为抗肿瘤药物设计的新靶标[4, 5]。精胺氧化酶(spermine oxidase, SMO)是参与多胺分解代谢的关键酶, 它直接以Spm为底物并将其氧化分解为Spd, 同时产生活性氧(H2O2)和氨基丙醛[6, 7]。研究发现, SMO表达异常导致的多胺代谢紊乱与包括肿瘤在内的多种疾病的病理进程密切相关[8, 9], SMO高表达是肺癌、前列腺癌、结肠癌及胃肠癌等恶性肿瘤发生与发展的重要诱发因素[10-13], 由此特异性靶向SMO的小分子抑制剂在相关疾病防治中的潜在应用价值也越来越受到关注[14, 15]。SI-4650 (SMO inhibitor-4650, 分子结构如图 1所示)是本实验室运用计算机辅助药物设计结合高通量虚拟筛选技术得到的一种SMO小分子抑制剂, 前期研究发现, SI-4650能高效抑制SMO酶活性, 并干扰人胶质瘤U87细胞内的正常多胺代谢、诱导U87细胞发生凋亡和自噬性死亡。为进一步评价SI-4650对不同肿瘤的杀伤效应及其抑瘤谱, 本研究以人骨肉瘤143B细胞作为实验对象, 探究SI-4650对143B细胞多胺代谢和增殖的影响以及可能的作用机制, 以为将SI-4650用于人骨肉瘤的临床治疗提供基础研究支撑。
|
Figure 1 Molecular structure of SI-4650 |
试剂、细胞 人骨肉瘤143B细胞购于中乔新舟生物制品有限公司, 由肿瘤微环境与免疫治疗湖北省重点实验室传代保存; SI-4650 (荷兰Specs生物特殊化合物公司); DMEM培养基(美国Gibco公司); 胎牛血清、青霉素/链霉素双抗(天津市灏洋生物制品科技有限公司); RIPA蛋白裂解液(武汉Servicebio公司); BCA蛋白定量试剂盒、ECL显影液(美国Thermo Scientific公司); LC3-Ⅰ/Ⅱ抗体、P62抗体、Beclin-1抗体、聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase, PARP)抗体(美国CST公司); Bax抗体、Bcl-2抗体、N-cadherin抗体、Vimentin抗体(美国Santa Cruz公司); Caspase 3抗体(美国Proteintech公司); E-cadherin抗体(英国BD Bioscience公司); β-actin抗体(北京科美博瑞有限公司); 辣根酶标记二抗(北京中杉金桥生物技术有限公司); pEGFP-LC3质粒(美国Add Gene公司); FITC-Annexin V凋亡检测试剂盒、活性氧检测试剂盒(上海碧云天生物技术有限公司); DIOC6(3) (3, 3'-dihexyloxacarbocyanine iodide)探针(美国Thermo Fisher公司); 3-MA抑制剂(美国Selleck公司); 二甲基亚砜(dimethyl sulfoxide, DMSO, 美国Sigma公司); 细胞培养皿、培养板、8 μm孔径Transwell小室(美国Corning公司); PVDF膜(美国GE公司)。
仪器设备 恒温CO2细胞培养箱、-80 ℃低温冷冻冰箱(日本SANYO公司); 超净工作台(上海新苗医疗器械制造有限公司); 4 ℃、-20 ℃冰箱(青岛海尔股份有限公司); 5424R台式高速冷冻离心机(德国Eppendorf公司); Western blot电泳系统、电转膜系统(美国Bio-Rad公司); 各式微量移液器(北京大龙兴创实验仪器有限公司、德国Eppendorf公司); Sirius化学发光检测仪(德国Berthold公司); Waters e2695高效液相色谱分析仪(美国Waters公司); TE2000-S荧光倒置显微镜(日本Nikon公司); FACSVerse流式细胞仪(美国BD公司); 全波长酶标仪(美国Thermo公司); ChemiScope mini化学发光成像显影仪(上海勤翔科学仪器有限公司)。
SI-4650配制 称取SI-4650干粉溶解于DMSO中, 配制成浓度为100 mmol·L-1药物储存液, 分装后于-20 ℃低温保存。使用前, 用DMEM完全培养基将药物储存液稀释至所需浓度。
MTT法检测细胞增殖 将对数生长期的143B细胞接种于96孔细胞培养板中(1.0×103个细胞/孔), 置37 ℃、5% CO2细胞培养箱中24 h, 换用含终浓度为0、10、20、40、80、160 μmol·L-1 SI-4650的DMEM培养基继续培养, 每个浓度设置4个复孔, 分别继续培养24、48、72 h; 或用3-MA预处理1 h后换终浓度为0、40、80 μmol·L-1 SI-4650的DMEM培养基继续培养48 h, 吸弃培养基, 每孔加入MTT试剂200 μL (终质量浓度0.2 g·L-1), 于37 ℃、5% CO2培养箱中孵育4 h, 吸去MTT试剂, 每孔再以150 μL DMSO充分溶解沉淀, 用酶标仪于490 nm波长处检测每孔吸光度值(A)。SI-4650对143B细胞的生长抑制率=[1-(A实验组-A空白组)/(A阴性对照组-A空白组)]×100%。
化学发光法分析细胞内SMO的酶活性 收集0、40、80 μmol·L-1 SI-4650处理48 h的143B细胞, 每样加入0.083 mol·L-1甘氨酸缓冲液(pH 8.0) 200 μL, 置于-80 ℃冰箱中低温冻融裂解细胞, 4 ℃、12 000 r·min-1离心10 min收集上清, BCA法测定总蛋白浓度。根据参考文献[16]配制酶反应体系, 化学发光法检测上清液中SMO的酶活性。
流式细胞术检测细胞内活性氧水平 收集0、40、80 μmol·L-1 SI-4650处理48 h的143B细胞, 用1 mL DCFH-DA探针工作液重悬后, 将细胞置37 ℃培养箱内孵育20 min, 每隔5 min颠倒混匀1次, 使探针与细胞充分接触。室温1 000 r·min-1离心5 min, 弃上清, 加1 mL无血清DMEM培养液洗涤细胞3次, 500 μL 1×PBS重悬混匀, 流式细胞仪检测DCF荧光强度。
DCFH-DA探针自身无荧光, 能自由穿过细胞膜, 进入细胞后它可被细胞内的酯酶水解生成不能透出细胞膜的DCFH, 后者可被胞内的活性氧氧化成为具有荧光的DCF, 其荧光强度可反映细胞内活性氧的积累水平[17]。
高效液相色谱法(high performance liquid chromatography, HPLC) 分析细胞内多胺含量收集0、40、80 μmol·L-1 SI-4650处理48 h的143B细胞, 加入800 μL细胞裂解液, 冰置30 min、12 000 r·min-1离心15 min, 取上清液转移至新EP管。BCA法测定上清中的蛋白浓度, 取总蛋白含量相同的细胞裂解液, ddH2O补足体积至800 μL。加入1 mmol·L-1内标分子DAH 20 μL、2 mol·L-1 NaOH 500 μL、苯甲酰氯10 μL, 涡旋振荡30 s, 40 ℃水浴20 min, 加入2 mL饱和NaCl溶液终止反应。反应液用2 mL乙醚颠倒混匀萃取, 静置分层, 留取上层乙醚液, 重复萃取3次, 合并上层萃取乙醚液, 通风橱中挥发至干。1 mL甲醇溶解沉淀, 经0.2 μm微孔滤膜过滤至样品瓶中, Waters-e2695高效液相色谱分析仪分析。分析条件: Luna C18色谱柱(150 mm×4.6 mm, 5 μm)为固定相, 乙腈-水(40:60)为流动相, 流速1 mL·min-1, 检测波长254 nm, 柱温30 ℃。
Transwell法分析细胞迁移能力 收集0、40、80 μmol·L-1 SI-4650处理48 h的143B细胞, 用含0.2% BSA的DMEM培养基重悬(每毫升2.5×105个细胞)。向24孔细胞培养板中加含20% FBS的DMEM (每孔800 μL), 将Transwell小室放入加有上述培养基的培养孔, 并分别向小室内加入143B细胞悬液200 μL, 置37 ℃、5% CO2培养箱中继续培养18 h, 取出Transwell小室, 轻轻吸弃小室内的细胞培养基, 1×PBS润洗小室3次后, 4%多聚甲醛固定30 min。1×PBS润洗小室3次, 结晶紫溶液染色15 min, 1×PBS润洗小室3次, 湿棉签拭去小室内侧面的细胞, 将小室放在滴有1×PBS的载玻片上, 倒置显微镜下观察。
流式细胞术检测细胞周期改变 收集0、40、80 μmol·L-1 SI-4650分别处理24、48 h的143B细胞, 用1.5 mL预冷75%乙醇(1×PBS配制)重悬细胞, 4 ℃固定过夜。室温1 000 r·min-1离心5 min后, 弃上清, 加1.5 mL 1×PBS洗涤细胞, 室温1 000 r·min-1离心5 min, 弃上清。以500 μL 1×Binding buffer (PBS配制, 含50 μg·mL-1 RNase和0.1% TritonX-100)重悬细胞, 加入0.5 g·L-1碘化丙啶(propidium iodide, PI) 20 μL, 避光条件下37 ℃水浴30 min, 流式细胞仪检测细胞周期。
流式细胞术检测细胞凋亡 收集0、40、80 μmol·L-1 SI-4650处理48 h的143B细胞, 用100 μL 1×Binding buffer重悬后, 加入5 μL FITC-Annexin V和5 μL PI混匀, 25 ℃避光孵育15 min, 再以400 μL 1×Binding buffer重悬混匀, 流式细胞仪检测细胞凋亡。
流式细胞术检测细胞线粒体膜电位改变 收集0、40、80 μmol·L-1 SI-4650处理48 h的143B细胞, 用无血清DMEM培养基洗涤细胞1次。用无血清DMEM培养液稀释的DIOC6(3)探针(1:2 000) 1 mL重悬细胞, 置37 ℃细胞培养箱内孵育20 min, 每隔5 min颠倒混匀1次。室温1 000 r·min-1离心5 min, 弃上清, 用1 mL无血清DMEM培养液洗涤细胞3次, 以500 μL 1×PBS重悬混匀, 流式细胞仪检测DIOC6(3)探针的绿色荧光。
DIOC6(3)是一种可以透过细胞膜的阳离子染料, 聚集在正常线粒体内的DIOC6(3)主要以聚合物的形式存在并发出红色荧光, 当线粒体膜电位下降或丧失时, DIOC6(3)主要以单体的形式游离存在于胞浆内并产生绿色荧光, 因此细胞内绿色荧光强弱的改变可显示细胞内线粒体膜电位的变化[18]。
倒置荧光显微镜观察细胞内自噬小体的形成 将143B细胞悬液按1.5×105个细胞/孔接种于六孔板, 继续培养至细胞融合度约80%时, 用Thermo TurboFect脂质体转染法将2 μg pEGFP-LC3质粒转染至143B细胞中。转染24 h后, 加入40、80 μmol·L-1 SI-4650继续培养48 h, 以不加SI-4650处理的转染细胞作为对照。倒置荧光显微镜下观察外源性重组绿色荧光蛋白GFP-LC3的亚细胞定位, 由此分析143B细胞中自噬小体的形成。
Western blot检测细胞凋亡、自噬、迁移相关蛋白表达水平 收集0、40、80 μmol·L-1 SI-4650单独处理48 h或3-MA预处理1 h后联合SI-4650处理48 h的143B细胞, 100 μL RIPA裂解液冰上裂解30 min, 4 ℃、12 000 r·min-1离心15 min, 取上清液转移至新的1.5 mL EP管中。BCA法测定上清中的总蛋白浓度, 取含60 μg总蛋白的上清液, 加1/4体积5×上样缓冲液, 100 ℃煮沸10 min。蛋白样品经SDS-PAGE分离, 电转至PVDF膜。膜用5%脱脂牛奶(TBST配制)室温封闭2 h, TBST洗膜10 min×3次; 加对应一抗于4 ℃孵育过夜, TBST洗膜10 min×3次; 加对应二抗室温孵育2 h, TBST洗膜10 min×3次, ECL化学发光法检测蛋白表达量。
统计学方法 采用SPSS 13.0统计软件。计量资料以x±s表示, 两组间比较采用独立样本t检验, 设置检验水准为α=0.05。
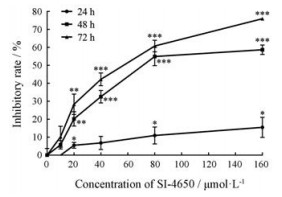
结果 1 SI-4650抑制143B细胞增殖MTT法检测结果显示, SI-4650能有效抑制143B细胞增殖, 且抑制率呈作用时间和药物浓度依赖性(图 2)。使用GraphPad Prism7软件分析, SI-4650处理143B细胞48 h的IC50值为(79.85±3.32) μmol·L-1。以此为依据, 后续实验中以终浓度为40、80 μmol·L-1 SI-4650处理48 h的143B细胞作为实验组, 以0 μmol·L-1处理48 h的143B细胞作为对照组。
|
Figure 2 SI-4650 inhibited proliferation of 143B cells. 143B cells were treated with SI-4650 (0, 10, 20, 40, 80, 160 μmol·L-1) for 24, 48 and 72 h, and then the inhibitory rate of cell proliferation was detected by MTT assay. x±s, n = 3. *P < 0.05, **P < 0.01, ***P < 0.001 vs control (0 μmol·L-1) |
流式细胞术分析结果显示, 与对照组细胞相比, SI-4650处理可使143B细胞周期发生浓度依赖性的显著性改变, S期细胞数量显著增多, 而G0/G1期和G2/M期细胞数量减少, 提示SI-4650可抑制143B细胞增殖(表 1)。
| Table 1 Effect of SI-4650 on cell cycle of 143B cells. x±s, n = 3. *P < 0.05, **P < 0.01, ***P < 0.001 vs control |
143B细胞经过0、40、80 μmol·L-1 SI-4650处理48 h后, 分别用化学发光法、流式细胞术和HPLC法检测细胞中SMO活性。与对照组细胞相比, SI-4650处理后的细胞中SMO酶活性明显下降(图 3A), 且具有浓度依赖性(P < 0.01);随SI-4650浓度的增加, 细胞中SMO底物Spm逐渐增多而产物Spd随之减少(图 3B), 同时H2O2的含量也呈下降趋势(图 3C), 细胞中总多胺含量也显著下降。提示SI-4650能有效抑制143B细胞中SMO酶活性, 阻滞Spm转化为Spd的酶促反应, 干扰多胺代谢, 减少肿瘤细胞中总多胺含量。

|
Figure 3 Effects of SI-4650 on SMO activity in 143B cells. After treating with SI-4650 (0, 40, 80 μmol·L-1) for 48 h, chemiluminescence assay was used to analyze the enzymatic activity of intracellular SMO (A); HPLC was used to analyze the changes of cellular polyamine contents (B); DCFH-DA probe staining/flow cytometry was used to analyze the accumulation of cellular reactive oxygen species (C). x±s, n = 3. **P < 0.01, ***P < 0.001 vs control |
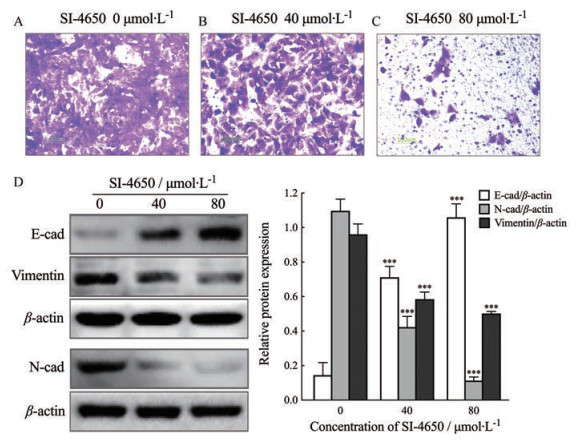
用Transwell技术分析了SI-4650对143B细胞迁移能力的影响, 结果发现与对照细胞相比, SI-4650处理后穿过膜孔的细胞数显著减少, 提示SI-4650高效抑制143B细胞迁移, 且抑制能力呈浓度依赖性(图 4A~C)。
|
Figure 4 Effect of SI-4650 on migration ability of 143B cells. 143B cells were treated with SI-4650 (A: 0 μmol·L-1, B: 40 μmol·L-1, C: 80 μmol·L-1) for 48 h and then the migration ability of 143B cells was detected by Transwell assay (200×); D: Expression level of migration-related protein determined by Western blot assay and quantized graph. x±s, n = 3. ***P < 0.01 vs control |
进一步用Western blot检测了迁移相关蛋白的表达水平, 随着SI-4650浓度的增加, 143B细胞中Ⅰ类经典钙黏蛋白E-cadherin的表达量逐渐升高, 而钙黏蛋白N-cadherin和波形蛋白Vimentin表达量减少(图 4D)。提示SI-4650抑制143B细胞迁移的机制可能与增加细胞间黏附, 降低细胞运动能力, 诱导肿瘤细胞向上皮表型细胞转化相关。
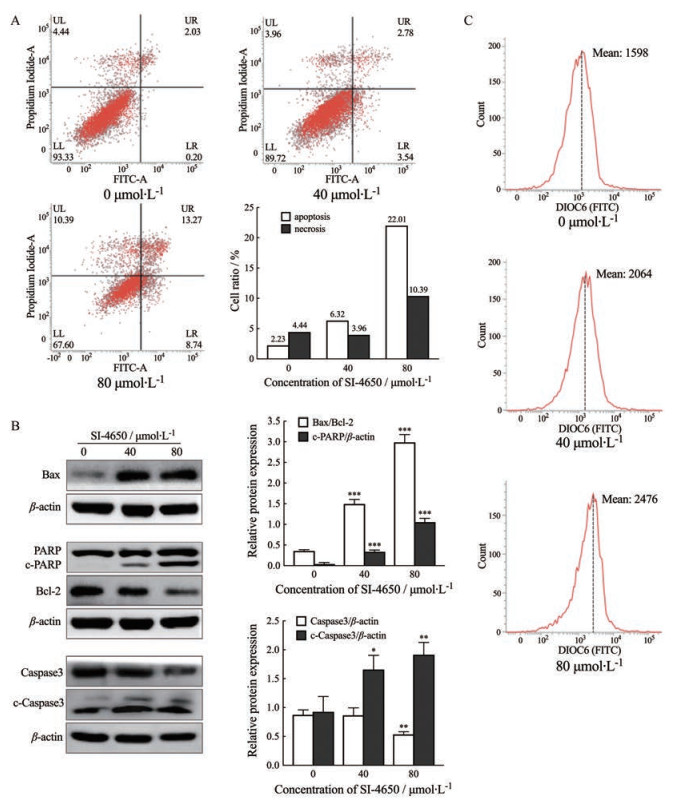
5 SI-4650诱导143B细胞凋亡PI/FITC-Annexin V双染流式细胞术检测显示(图 5A), 143B细胞经40、80 μmol·L-1 SI-4650处理48 h, FITC-Annexin V (+)/PI (-)和FITC-Annexin V (+)/PI (+)细胞数量均随SI-4650浓度增高而增加。提示SI-4650诱导143B细胞发生凋亡。
|
Figure 5 Effect of SI-4650 on apoptosis of 143B cells. A: FCM was used to determine effect of SI-4650 on apoptotic rate of 143B cells; B: Western blot assay was used to determine expression levels of apoptosis-related proteins and quantized graph; C: FCM assay combined with DIOC6(3) probe to detect the change of MMP. x±s, n = 3. *P < 0.05, **P < 0.01, ***P < 0.001 vs control |
Western blot检测143B细胞凋亡相关蛋白和流式细胞术分析细胞线粒体膜电位(图 5B和C), 结果可见SI-4650能引起143B细胞内标志性凋亡降解蛋白c-PARP表达水平明显增加; 上调促凋亡蛋白Bax、下调凋亡抑制蛋白Bcl-2的表达水平, Bax/Bcl-2比值显著升高; 全长的Caspase 3表达减少, 被切割后有活性的c-Caspase 3含量显著增加; 单体DIOC6(3)的绿色荧光峰值随着药物浓度的升高逐渐右偏, 表明线粒体膜电位随SI-4650浓度的升高而逐渐降低, 提示SI-4650通过活化线粒体依赖的细胞凋亡途径诱导143B细胞发生凋亡。
6 SI-4650诱导143B细胞自噬143B细胞用pEGFP-LC3真核表达质粒转染24 h后, 分别用0、40、80 μmol·L-1 SI-4650处理48 h, 倒置荧光显微镜下观察143B细胞中外源性表达的GFP-LC3融合蛋白的亚细胞定位。结果如图 6A所示, GFP-LC3荧光蛋白在对照组143B细胞中呈弥散性均匀分布, 而在SI-4650处理的细胞中, GFP-LC3荧光蛋白呈斑点状聚集, 这种聚集随SI-4650浓度的增加更加显著。上述研究结果提示, SI-4650能诱导细胞发生自噬, 使得GFP-LC3融合蛋白向自噬小体大量转移和聚集。
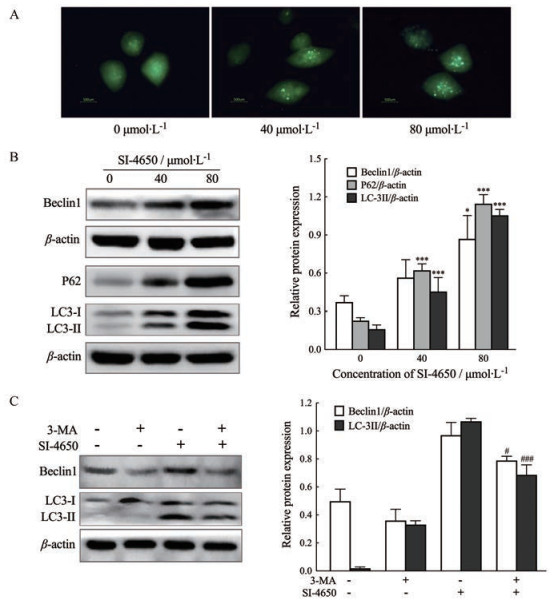
|
Figure 6 Effect of SI-4650 on autophagy of 143B cells. A: Fluorescence microscope was used to observe subcellular distribution of GFP-LC3 fusion protein in 143B cells (1 500×); B: Western blot assay was used to determine expression levels of autophagy-related proteins. C: Western blot assay was used to determine expression levels of autophagy-related proteins of 143B cells treated by 2.5 mmol·L-1 3-MA and 80 μmol·L-1 SI-4650. x±s, n = 3. *P < 0.05, ***P < 0.001 vs control; #P < 0.05, ###P < 0.001 vs SI-4650 (80 μmol·L-1) |
用Western blot分析自噬相关蛋白的表达, 结果发现(图 6B), 143B细胞中的自噬活化蛋白Beclin-1、标志性自噬微管蛋白LC3-Ⅱ以及自噬转运蛋白P62的表达水平均随SI-4650浓度的增高而显著增加, 以上结果提示SI-4650能诱导143B细胞发生自噬性死亡。
为分析143B细胞发生自噬是SI-4650抗人骨肉瘤143B细胞分子机制之一还是肿瘤细胞在药物压力下的自我保护作用, 进一步观察了自噬抑制剂3-MA阻滞肿瘤细胞自噬流进程后SI-4650对143B细胞的抑制作用。结果显示(图 6C、表 2), 与单独SI-4650处理48 h 143B细胞相比较, 2.5 mmol·L-1 3-MA预处理后再使用SI-4650作用48 h的143B细胞中Beclin-1和LC3-Ⅱ表达减少, 同时40、80 μmol·L-1 SI-4650对143B细胞的抑制率分别从22.86%和55.38%下降为8.26%和28.67%, 表明3-MA预处理能抑制SI-4650诱导143B细胞自噬, 同时减弱SI-4650对143B肿瘤细胞的生长抑制作用, 提示SI-4650诱导细胞自噬性死亡是其抗人骨肉瘤143B细胞分子机制之一。
| Table 2 Inhibition rate of 3-MA and SI-4650 on growth of 143B cells. x±s, n = 3. **P < 0.01, ***P < 0.001 vs SI-4650 (40/80 μmol·L-1) |
骨肉瘤是最常见的原发性恶性骨肿瘤, 它起源于间叶组织, 恶性程度高, 好发于长骨干骺端, 易经血液循环传播引起肺转移而导致死亡。目前该肿瘤的治疗以手术和放、化疗为主, 但疗效有限, 病死率高[19]。为探索SI-4650是否具有抗骨肉瘤临床应用潜能, 本实验探究了SI-4650对人骨肉瘤143B细胞增殖、迁移、凋亡和自噬的影响及其可能的分子机制, 以期为开发更有效的骨肉瘤临床治疗新药提供理论和实验依据。
SMO是参与多胺分解代谢的关键酶, 能将底物Spm转化为Spd, 同时生成3-氨基丙醛和H2O2[6, 7]。鉴于SI-4650是以SMO为靶点设计、筛选得到的小分子抑制剂, 本研究首先利用化学发光法、流式细胞技术、HPLC法验证SI-4650对143B细胞中SMO酶活性的影响。结果显示随着SI-4650浓度的增加, 143B细胞中SMO酶活性显著降低, 酶促反应产物Spd和H2O2的含量水平逐步下降, 而底物Spm浓度增加。同时发现SI-4650能高效抑制143B细胞的增殖(48 h, IC50为79.85±3.32 μmol·L-1), 且抑制效应与SI-4650作用时间和剂量呈正相关性。由此证实了SI-4650作为SMO的有效抑制剂, 能通过直接抑制SMO酶活性, 阻滞SMO参与的多胺代谢途径, 影响Spm的转化, 减少总多胺含量, 干扰143B肿瘤细胞正常的多胺代谢过程从而抑制人骨肉瘤143B细胞增殖。
随后SI-4650抗143B肿瘤机制分析发现, SI-4650还能通过诱导凋亡和自噬而显著地抑制肿瘤细胞分裂, 并将瘤细胞阻滞于S期。在SI-4650诱导143B细胞发生凋亡的过程中, 促凋亡蛋白Bax表达上调, 而凋亡抑制蛋白Bcl-2的表达则显著性下降, Bax高表达后形成的Bax-Bax同源二聚体将在线粒体膜上形成跨膜离子通道, 导致线粒体跨膜电位的下降、崩溃和细胞色素C等促凋亡因子大量释放进入胞浆, 它们进一步激活细胞内的Caspase相关级联反应, 导致包括Caspase-3在内的凋亡相关Caspase蛋白酶原被切割为具有活性的c-Caspase。后者进一步剪切凋亡降解底物PARP, 导致细胞内其降解产物c-PARP的水平大幅升高, 从而诱导细胞出现不可逆的细胞凋亡。与此相一致的是, SI-4650处理引起143B细胞内凋亡标志性蛋白c-PARP表达增加; FITC-Annexin V (+)/PI (-)早期凋亡细胞和FITC-Annexin V (+)/PI (+)晚期凋亡细胞数均明显增多。以上结果提示, SI-4650能通过线粒体途径诱导人骨肉瘤143B细胞发生凋亡。
细胞凋亡和细胞自噬之间存在相互影响和相互关联的机制。在特定的情况下, 二者之间有相互促进、相互拮抗和相互协调的关系特征, 两者之间的复杂关系, 形成促进肿瘤细胞死亡的“双保险”机制[20-22]。自噬激活相关蛋白Beclin-1是形成自噬体的关键分子之一, 它介导自噬相关蛋白定位于吞噬泡, 并与多种蛋白相互作用共同调控自噬体的形成与成熟。LC3一般以可溶性LC3-Ⅰ的形式存在, 自噬发生时LC3和自噬泡膜表面的磷脂酰乙醇胺结合, 转变为脂溶性的LC3-Ⅱ, LC3-Ⅱ的表达水平与自噬活性呈正比, 是公认的自噬活性标志分子[23]。P62在自噬早期作为一种转运载体蛋白, 招募并携带胞内待降解成分向自噬小体转运聚集, 并结合到LC3-Ⅱ上。在自噬晚期, 它又作为选择性的自噬底物在自噬溶酶体内被降解[24-26]。本研究发现, SI-4650引起143B细胞内外源性表达的GFP-LC3蛋白由弥散分布向斑点聚集状态转化, 同时143B细胞中自噬相关蛋白Beclin-1、LC3-Ⅱ和P62蛋白表达水平均显著增加, 说明SI-4650有效诱导人骨肉瘤143B细胞发生自噬。为验证143B细胞发生自噬是否为SI-4650抗人骨肉瘤143B细胞分子机制之一, 使用自噬抑制剂3-MA预处理肿瘤细胞后再将SI-4650作用143B细胞。结果发现, 3-MA预处理有效减少SI-4650引起的自噬活化蛋白Beclin-1和自噬标志蛋白LC3-Ⅱ的表达, 抑制SI-4650诱导的143B细胞自噬流进程; 与此同时, 40、80 μmol·L-1 SI-4650对143B细胞增殖抑制率分别从22.86%和55.38%下降为8.26%和28.67%, 说明干扰143B细胞自噬发生会减弱SI-4650对肿瘤细胞的抑制作用。以上结果提示SI-4650有效诱导人骨肉瘤143B细胞发生自噬性死亡, 此过程是SI-4650抗肿瘤药理活性分子机制之一。
上皮间质转化(epithelial to mesenchymal transition, EMT)是指在某些特定的生理及病理条件下, 上皮细胞失去极性, 细胞间以及细胞与基底膜的连接减弱, 细胞外基质重塑, 使上皮细胞转变为具有移行能力的间质细胞的过程[27]。研究表明, EMT与肿瘤细胞的侵袭和迁移能力密切相关[28-30]。作为EMT进程标志性蛋白, Ⅰ类经典钙黏蛋白E-cadherin是细胞表面的跨膜糖蛋白, 构成细胞间黏附性链接的重要组成部分, 抑制E-cadherin表达将促进细胞的迁移、侵袭及转移; N-cadherin是一种细胞黏附分子, 参与细胞间的黏附, 维持组织结构和形态的稳定, 其过度表达则引起细胞黏附功能降低, 导致肿瘤细胞转移发生; Vimentin是中间纤维蛋白家族的主要成员, 上皮间质转化的标志性蛋白之一。EMT演变过程中伴随着细胞黏附分子标志蛋白如E-cadherin的表达下调和Vimentin、N-cadherin等间质表型蛋白上调。本研究发现SI-4650引起143B细胞E-cadherin表达上调和Vimentin、N-cadherin表达下调, 同时高效抑制143B细胞的迁移能力。提示SI-4650抑制143B细胞迁移可能与诱导肿瘤细胞从间质表型细胞向上皮表型细胞转化, 增加细胞间黏附, 减弱细胞运动能力相关。
综上所述, 本研究证实, 作为一种新型SMO小分子抑制剂, SI-4650具有高效抑制人骨肉瘤143B细胞增殖和迁移能力的药理活性, 其机制可能与干扰多胺代谢、阻滞细胞周期, 诱导细胞凋亡, 引起自噬性死亡及促进间质上皮转化相关, 具有用于人骨肉瘤临床治疗的潜在价值。
| [1] | Amendola R, Cervelli M, Fratini E, et al. Spermine metabolism and anticancer therapy[J]. Curr Cancer Drug Targets, 2009, 9: 118–130. DOI:10.2174/156800909787580935 |
| [2] | Battaglia V, DeStefano Shields C, Murray-Stewart T, et al. Polyamine catabolism in carcinogenesis: potential targets for chemotherapy and chemoprevention[J]. Amino Acids, 2014, 46: 511–519. DOI:10.1007/s00726-013-1529-6 |
| [3] | Miller-Fleming L, Olin-Sandoval V, Campbell K, et al. Remaining mysteries of molecular biology: the role of polyamines in the cell[J]. J Mol Biol, 2015, 427: 3389–3406. DOI:10.1016/j.jmb.2015.06.020 |
| [4] | Zhou Y, Cao CY, Wang YL. Advances in targeting of anti-cancer drugs based on polyamine transport system[J]. Chem Life (生命的化学), 2018, 38: 543–550. |
| [5] | Casero RA Jr, Murray Stewart T, Pegg AE. Polyamine metabolism and cancer: treatments, challenges and opportunities[J]. Nat Rev Cancer, 2018, 18: 681–695. DOI:10.1038/s41568-018-0050-3 |
| [6] | Cervelli M, Salvi D, Polticelli F, et al. Structure-function relationships in the evolutionary framework of spermine oxidase[J]. J Mol Evol, 2013, 76: 365–370. DOI:10.1007/s00239-013-9570-3 |
| [7] | Wang Y, Devereux W, Woster PM, et al. Cloning and characterization of a human polyamine oxidase that is inducible by polyamine analogue exposure[J]. Cancer Res, 2001, 61: 5370–5373. |
| [8] | Nowotarski SL, Woster PM, Casero RA Jr. Polyamines and cancer: implications for chemotherapy and chemoprevention[J]. Expert Rev Mol Med, 2013, 15: e3. DOI:10.1017/erm.2013.3 |
| [9] | Cervelli M, Amendola R, Polticelli F, et al. Spermine oxidase: ten years after[J]. Amino Acids, 2012, 42: 441–450. DOI:10.1007/s00726-011-1014-z |
| [10] | Goodwin AC, Jadallah S, Toubaji A, et al. Increased spermine oxidase expression in human prostate cancer and prostatic intraepithelial neoplasia tissues[J]. Prostate, 2008, 68: 766–772. DOI:10.1002/(ISSN)1097-0045 |
| [11] | Murray-Stewart T, Sierra JC, Piazuelo MB, et al. Epigenetic silencing of miR-124 prevents spermine oxidase regulation: implications for Helicobacter pylori-induced gastric cancer[J]. Oncogene, 2016, 35: 5480–5488. DOI:10.1038/onc.2016.91 |
| [12] | Goodwin AC, Destefano Shields CE, Wu S, et al. Polyamine catabolism contributes to enterotoxigenic Bacteroides fragilis-induced colon tumorigenesis[J]. Proc Natl Acad Sci U S A, 2011, 108: 15354–15359. DOI:10.1073/pnas.1010203108 |
| [13] | Murray-Stewart TR, Woster PM, Casero RA Jr. Targeting polyamine metabolism for cancer therapy and prevention[J]. Biochem J, 2016, 473: 2937–2953. DOI:10.1042/BCJ20160383 |
| [14] | Moriya S, Iwasaki K, Samejima K, et al. A mass spectrometric method to determine activities of enzymes involved in polyamine catabolism[J]. Anal Chim Acta, 2012, 748: 45–52. DOI:10.1016/j.aca.2012.08.031 |
| [15] | Seiler N, Renault J, Gosse F, et al. Cytotoxicity of the polyamine oxidase inactivator MDL 72527 to cancer cells: comparison with a saturated structural analogue[J]. Int J Oncol, 2005, 27: 1669–1676. |
| [16] | Goodwin AC, Murray-Stewart TR, Casero RA Jr. A simple assay for mammalian spermine oxidase: a polyamine catabolic enzyme implicated in drug response and disease[J]. Methods Mol Biol, 2011, 720: 173–181. DOI:10.1007/978-1-61779-034-8 |
| [17] | Wu TT, Du R, Li LF, et al. Detection of reactive oxygen species of human dental pulp cells by flow cytometry[J]. Shanghai J Stomatol (上海口腔医学), 2012, 21: 617–621. |
| [18] | Danylovich GV, Danylovich Iu V, Gorchev VF. Comparative investigation by spectrofluorimetry and flow cytometry of plasma and inner mitochondrial membranes polarisation in smooth muscle cell using potential-sensitive probe DiOC6(3)[J]. Ukr Biokhim Zh, 2011, 83: 99–105. |
| [19] | Shaikh AB, Li F, Li M, et al. Present advances and future perspectives of molecular targeted therapy for osteosarcoma[J]. Int J Mol Sci, 2016, 17: 506. DOI:10.3390/ijms17040506 |
| [20] | Tang Q, Bu W, Wang D. Advance research on interaction between autophagy and apoptosis and its influence in development of tumors[J]. J Jilin Univ (Med Sci Ed)(吉林大学学报:医学版), 2015, 41: 1303–1306. |
| [21] | Choi AM, Ryter SW, Levine B. Autophagy in human health and disease[J]. N Engl J Med, 2013, 368: 1845–1846. DOI:10.1056/NEJMc1303158 |
| [22] | Jiang P, Mizushima N. Autophagy and human disease[J]. Cell Res, 2014, 24: 69–79. DOI:10.1038/cr.2013.161 |
| [23] | Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147: 728–741. DOI:10.1016/j.cell.2011.10.026 |
| [24] | Chen HY, Huang TC, Shieh TM, et al. Isoliquiritigenin induces autophagy and inhibits ovarian cancer cell growth[J]. Int J Mol Sci, 2017, 18: 2025. DOI:10.3390/ijms18102025 |
| [25] | Li CJ, Liao WT, Wu MY, et al. New insights into the role of autophagy in tumor immune microenvironment[J]. Int J Mol Sci, 2017, 18: 1566–1570. DOI:10.3390/ijms18071566 |
| [26] | Liu H, Shao RG. The regulatory role of autophagy in tumor process[J]. Acta Pharm Sin (药学学报), 2016, 51: 23–28. |
| [27] | Zhou J, Wang J, Zhang N, et al. Identification of biomechanical force as a novel inducer of epithelial-mesenchymal transition features in mechanical stretched skin[J]. Am J Transl Res, 2015, 7: 2187–2198. |
| [28] | Yang G, Yuan J, Li K. EMT transcription factors: implication in osteosarcoma[J]. Med Oncol, 2013, 30: 697–701. DOI:10.1007/s12032-013-0697-2 |
| [29] | Yan S, Holderness BM, Li Z, et al. Epithelial-mesenchymal expression phenotype of primary melanoma and matched metastases and relationship with overall survival[J]. Anticancer Res, 2016, 36: 6449–6456. DOI:10.21873/anticanres |
| [30] | Feng M, Feng J, Chen W, et al. Lipocalin2 suppresses metastasis of colorectal cancer by attenuating NF-kappaB-dependent activation of snail and epithelial mesenchymal transition[J]. Mol Cancer, 2016, 15: 77–80. DOI:10.1186/s12943-016-0564-9 |
 2019, Vol. 54
2019, Vol. 54


