2. 中国医学科学院、北京协和医学院药物研究所, 北京市药物靶标研究与药物筛选重点实验室, 北京 100050;
3. 包头医学院神经科学研究所, 内蒙古 包头 014040
2. Beijing Key Laboratory of Drug Targets Identification and Drug Screening, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
3. Institute of Neuroscience, Baotou Medical College, Baotou 014040, China
脑卒中是严重威胁人类健康的一类疾病, 致死率仅次于心梗和癌症, 是致残的首位原因[1]。脑卒中可分为缺血性卒中和出血性卒中, 其中缺血性脑卒中患者约占80%[2]。出血转化是急性脑梗死后发生的脑内出血, 显著增加脑卒中的死亡率和致残率, 是脑卒中的常见严重并发症。针对脑卒中的治疗, 恢复缺血区的血流供应仍是现在广泛应用的治疗手段。
组织纤溶酶原激活剂(t-PA)是被美国FDA批准的唯一用于临床溶栓治疗的药物, 但存在治疗时间窗窄、易引发出血转化(hemorrhagic transformation, HT)的缺点。研究表明, 使用t-PA溶栓能够使HT的发生率提高10倍, 死亡率高达60%[3]。t-PA的治疗时间窗已经从最初的3 h延长到4.5 h, 但仍满足不了临床需求。目前, 对于HT复杂的病理机制和治疗靶点尚不清楚, 临床还未有有效的防治药物。
匹诺塞林是中国医学科学院药物研究所从蜂胶中提取, 通过高通量筛选技术获得的一种天然黄酮类化合物, 是抗脑缺血Ⅰ类新药, 具有起效快、保护神经血管单元、改善脑血流等特点[4]。此外, 还有抗心律失常、抗过敏性气道炎症、抗纤维化、抗肿瘤等作用[5-8]。近期的研究发现, 匹诺塞林能够通过抑制炎症反应降低脑出血损伤[9], 而本课题组前期的结果也表明, 匹诺塞林和t-PA联合应用可延长t-PA治疗时间窗, 改善t-PA溶栓的安全性[4]。但匹诺塞林对t-PA溶栓后HT的发生尚缺乏进一步的研究。因此, 本文探讨了匹诺塞林和t-PA联合应用对t-PA溶栓治疗所致出血转化的作用, 为匹诺塞林增加新的临床适应症提供实验依据。
材料与方法药品和试剂 t-PA购自勃林格殷格翰(50 mg, 批号: 707896);注射用匹诺塞林, 中国医学科学院药物研究所提供(10 mg, 批号: 20061101); Evans blue (EB)、2, 3, 5-氯化三苯基四氮唑(TTC)、三氯乙酸, 购自Sigma公司; QuantiChrom Hemoglobin Assay Kit, 购自美国博世生物技术有限公司; 实验用水均为双蒸水。
仪器设备 小动物血栓生成仪(YLS-14B, 济南益延科技发展有限公司); ALC-HTP动物恒温系统(上海奥尔科特生物科技有限公司); WZS-50F6双道微量注射泵(浙江史密斯医学仪器有限公司); TX223L电子天平(日本岛津公司); BT100-2J LongerPump (保定兰格恒流泵有限公司); 连续光谱酶标测试仪(Molecular公司); DHX-9243B电热恒温鼓风干燥箱(上海福玛实验设备有限公司)。
动物 SD大鼠, SPF级, 雄性, 体重210~230 g, 购自北京维通利华实验动物技术有限公司, 许可证号SCXK (京)2016-0006。饲养在中国医学科学院药物研究所动物房, 明暗交替(12 h:12 h), 环境温度22~24℃, 相对湿度为40%~60%, 自由进食进水。动物实验遵循北京协和医学院动物伦理委员会规定。
大鼠大脑中动脉血栓栓塞(MCAO)模型制备 参考文献[10]模型制备方法, 并予以改进。具体操作如下: 10%水合氯醛腹腔麻醉大鼠, 之后将其仰卧位固定在放有保温垫的鼠板上。用酒精棉对大鼠颈部皮毛消毒, 颈前正中剪开皮肤约2~2.5 cm, 钝性分离皮下肌肉、薄膜等, 分离颈总、颈内及颈外动脉。之后用动脉夹夹闭颈外动脉, 将颈总动脉薄膜剥离干净, 埋一根线在颈总下面, 用棉签轻微擦拭颈总动脉后, 将颈总动脉放入血管电击夹的沟槽中, 高度和方向调整适宜后, 用1.00 mA直流电预先电凝1 min, 将血栓粉碎后再次电凝4 min, 用动脉夹夹闭颈总远心端, 将血栓粉碎后松开动脉夹, 使血栓进入中动脉, 立刻用动脉夹夹闭颈总近心端15 min, 然后松开所有动脉夹, 缝合皮肤, 放入笼中。
动物分组及给药 大鼠随机分为6组, 假手术组(sham)、模型组(model)、t-PA (10 mg·kg-1)组、t-PA+匹诺塞林(5、10、20 mg·kg-1)组, 每组21只。术后6 h, 尾静脉给予匹诺塞林3个剂量组5 min后, 尾静脉滴注t-PA 10 min。模型组尾静脉滴注生理盐水。
行为学评分 于术后24 h进行mNSS评分, 观察鼠的运动、感觉、反射功能。运动功能包括提尾实验、地板实验和平衡木实验。提尾实验包括:前肢屈曲(1分)、后肢屈曲(1分)、30 s内头上仰(1分); 地板实验包括:不能走直线(1分)、偏瘫(1分)、旋转(1分)。平衡木实验又分为:紧抓平衡木边缘(1分); 紧抓平衡木, 一肢体从平衡木垂落(2分); 紧抓平衡木, 二肢体从平衡木上垂落或在平衡木上旋转(> 60 s) (3分); 试图在平衡木上保持平衡但跌落(> 40 s) (4分); 试图在平衡木上保持平衡但跌落(> 20 s) (5分); 直接跌落, 未尝试在平衡木上平衡(< 20 s) (6分)。感触觉实验包括:视觉和触觉放置(1分)、本体觉放置(1分)。反射功能测试包括耳廓反射(1分)和角膜反射(1分)。
脑梗死体积测定 行为学评分完毕后, 10%水合氯醛麻醉, 打开胸腔, 使心脏充分暴露, 从心尖微偏左一点插入灌注针头到主动脉后, 用止血钳夹住针头, 剪开左心耳, 释放静脉血, 直至左心耳流出澄清液体, 断头取脑。将大脑冠状切成6片, 置于6孔板中, 避光加入1% TTC, 37 ℃恒温染色10 min后, 将脑片翻面, 再次染色10 min。4%多聚甲醛固定24 h后拍照, 用Image J计算每个脑切片的梗死面积并以百分率表示。计算公式如下:脑梗死体积=[梗死面积-(梗死侧面积-对侧面积)]/对侧面积×100%。
脑组织含水量检测 在断头取脑后, 去掉小脑和脑干, 称量脑湿重。脑梗死体积测定完, 将脑片置于烘箱烘干, 称脑干重。脑含水量计算公式如下:脑含水量%=(湿重-干重)/湿重×100%。
脑组织Evans blue含量测定 术后24 h, 尾静脉注射4% Evans blue (EB) 2 h后, 生理盐水灌流至左心耳流出澄清液体。断头取脑, 冠状切片、拍照。将两侧脑组织分别称重并记录后, 置于匀浆器中。以1:3比例加入50%三氯乙酸, 匀浆, 4 ℃、12 000 ×g, 离心5 min后, 吸取200 μL上清液于96孔板中, 在620 nm处测OD值。标准曲线用正常大鼠脑组织匀浆液制备。
脑组织血红蛋白含量检测 术后24 h, 灌流取脑, 冠状切片、拍照, 将两侧脑组织分别称重并记录后, 置于匀浆器中。以1:1比例加入0.01 mol·L-1 PBS, 匀浆, 4 ℃、12 000 ×g, 30 min离心, 吸取50 μL上清液于96孔板中, 加入200 μL Reagent后室温放置15 min后, 在400 nm处测OD值。
病理切片 术后24 h, PBS灌流至左心耳流出澄清液体, 4%多聚甲醛继续灌流, 大鼠四肢僵硬后停止灌流, 断头取脑, 固定在4%多聚甲醛中, 石蜡包埋、切片, 进行HE染色。
统计学处理 采用GraphPad Prism 7.05软件处理各组数据, 实验结果以x±s表示, 采用双因素方差分析(two-way ANOVA), 组间进行t检验, P < 0.05认为有显著性差异。
结果 1 匹诺塞林改善缺血大鼠神经功能术后24 h, 用mNSS对大鼠进行评分, 模型组大鼠表现出较明显的神经功能障碍。手术对侧前肢向内偏, 四肢协调能力下降, 感触功能下降(图 1)。单用t-PA组行为评分进一步增加, 表明神经功能受损加重; 而联合应用匹诺塞林3个剂量组均不同程度地降低行为学评分, 缓解神经功能损伤。其中, 10 mg·kg-1剂量组作用显著。
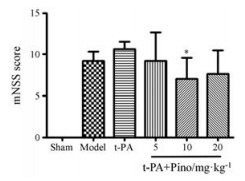
|
Figure 1 The effect of pinocembrin (Pino) on neurological function. Tissue plasminogen activator (t-PA) was administrated 6 h after ischemia and pinocembrin (5, 10 and 20 mg·kg-1) was given 5 min before t-PA administration. Neurologic score was evaluated at 24 h after ischemia. n = 6, x±s. *P < 0.05 vs t-PA group |
行为学评分后, 对大鼠脑组织进行TTC染色。如图 2所示, 缺血6 h后, 模型组大鼠脑组织出现显著的梗死; 单独给予t-PA后, 脑梗死体积增加, 达到39%, 而联合应用匹诺塞林治疗后, 脑梗死体积降低, 其中10 mg·kg-1作用显著。
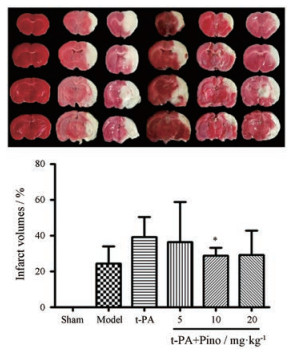
|
Figure 2 The effect of Pino on infarct volume. A: Representative TTC stained images; B: Bar graph of infarct volume. Infarct volume was evaluated at 24 h after ischemia. n = 6, x±s. *P < 0.05 vs t-PA group |
脑组织含水量直接反映大脑水肿情况。缺血6 h后, 脑含水量从79.8%增加到81.7%, 单用t-PA进一步加重脑损伤, 脑含水量增加至83.4% (图 3), 联合应用匹诺塞林各剂量组显著降低脑含水量, 其中, 10 mg·kg-1作用显著, 使含水量降至80.3%。

|
Figure 3 The effect of Pino on brain water content. Brain water content was measured at 24 h after ischemia. n = 6, x±s. ##P < 0.01 vs sham group; **P < 0.01 vs t-PA group |
EB渗漏实验反映了血脑屏障(blood-brain barrier, BBB)通透性。缺血6 h后, 血脑屏障通透性增加, 导致EB进入脑组织的含量增加, 而单用t-PA能够进一步损伤血脑屏障, 促进EB渗漏(图 4)。联合应用匹诺塞林3个剂量组可明显降低脑组织中EB含量, 提示匹诺塞林可以保护BBB。

|
Figure 4 The effect of Pino on Evans blue leakage. A: Representative images of EB leakage; B: Bar graph of EB content. EB content was measured at 24 h after ischemia. n = 6, x±s. ##P < 0.01 vs sham group; *P < 0.05 vs t-PA group |
脑组织中血红蛋白含量多少直接反映了出血转化的发生及严重程度。如图 5A、B所示, 缺血6 h后静滴t-PA能够诱导HT的发生, 脑组织中血红蛋白含量显著升高, 由32 mg·dL-1升高到44.9 mg·dL-1。与单用t-PA组相比, 联合应用匹诺塞林各剂量组均可明显降低脑组织内血红蛋白含量, 分别降低了26.2%、34.6%、27.5%。进一步的病理切片观察也可以看到(图 5C), 模型组有轻微出血, 单独给予t-PA出血严重, 联合应用匹诺塞林(10 mg·kg-1)能够显著减轻出血程度, 与血红蛋白检测实验结果一致。以上实验均表明, 匹诺塞林具有抗t-PA所致出血转化的作用。
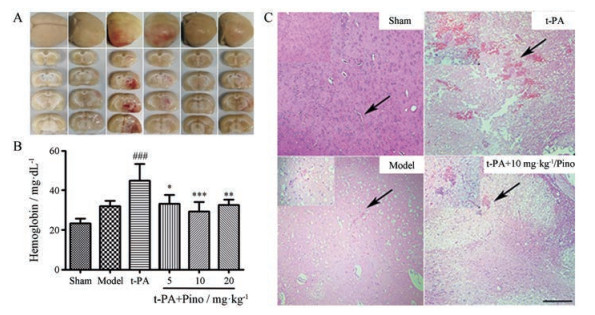
|
Figure 5 The effect of Pino on hemorrhagic transformation. A: Representative images of hemorrhagic transformation; B: Bar graph of hemoglobin; C: Representative images of HE staining. Hemoglobin was measured at 24 h after ischemia. n = 6, x±s. ###P < 0.001 vs sham group; *P < 0.05, **P < 0.01, ***P < 0.001 vs t-PA group. Bar=50 μm |
脑卒中作为一种严重威胁人类健康的疾病, 目前仍缺乏有效的治疗药物。t-PA作为唯一被FDA批准用于脑卒中的溶栓药物, 临床应用受限于较窄的治疗时间窗和高HT发生率。因此, 寻找新的HT防治药物对于扩大t-PA的临床应用, 改善溶栓患者的预后具有重要的意义。
目前, 对t-PA诱导HT的动物模型研究主要是通过线栓法和自体血栓法制备脑缺血模型, 缺血一定时间后静滴t-PA引起HT的发生[10, 11]。但是线栓法和自体血栓法均存在一定的缺陷。线栓法使用的是尼龙线堵塞大脑中动脉造成脑缺血, 而不是血栓, 不能反映t-PA的溶栓作用, 与临床脑缺血发生的病理机制相差较大。自体血栓法虽然采用血栓堵塞大脑中动脉, 与临床病理机制类似, 但是血栓是通过体外凝结后再注入血管的, 与体内血栓的形成过程存在差异。
另外, HT的发生与溶栓时间密切相关。研究表明, 随缺血时间的延长, t-PA溶栓导致HT的发生率显著升高[12]。而不同研究中的缺血时间不同, 目前尚无统一标准, 可能导致HT研究结果的差异。本研究采用直流电刺激颈动脉形成血栓制备脑缺血模型, 能够更好地模拟脑缺血的病理过程, 通过对第三代溶栓药物瑞替普酶的考察证明该模型适用于溶栓药物的评价[13]。同时, 通过对缺血时间的考察发现, 缺血6 h后静脉滴注t-PA能够诱导HT的发生。因此, 本实验采用了电凝法制备脑缺血模型, 缺血6 h后静滴t-PA能够更加准确地反映HT发生的病理过程及匹诺塞林的治疗作用。
目前的研究认为, HT发生的主要机制是血脑屏障完整性的丧失和神经血管稳态的破坏。t-PA可以使纤溶酶原转化为纤溶酶, 进而使纤维蛋白溶解发挥溶栓作用, 纤溶酶能进一步激活基质金属蛋白酶(matrix metalloproteinases, MMPs)导致BBB的破坏[14]。此外, t-PA所致HT的发生不仅是再灌注的结果, 还与多种分子机制相关, 如低密度脂蛋白受体相关蛋白、活化蛋白C、血小板衍生因子C和N-甲基-D-天冬氨酸受体等通路[15]。BBB破坏是脑卒中的主要病理特征, 也是HT发生的标志。损伤的BBB增加了溶栓过程中致死性HT的发生, 促进脑水肿和神经炎症, 限制了t-PA的使用[16]。因此, 抑制t-PA诱导的BBB破坏能够降低HT的发生。本实验采用EB渗漏实验检测了BBB的通透性, 结果发现匹诺塞林能够抑制EB的渗漏, 保护BBB。因此, 匹诺塞林抗HT的作用可能与BBB保护有关, 其具体的作用机制和相关通路尚需进一步的研究。
HT发生的病理机制复杂, 涉及氧化应激、炎症等多种病理过程和多个靶点。这些靶点之间可能独立或协同发挥作用, 调节一个靶点可能影响其他靶点, 而不同靶点之间也可能有直接作用[17]。因此, 多靶点药物可能是HT防治药物研究的新方向。大量研究表明, 天然产物具有多靶点的优势, 在脑卒中的治疗中发挥了重要作用[18]。一些天然产物已被证明对血脑屏障具有保护作用, 如丹参酮IIA、石衫碱甲、和厚朴酚、葛根素、甘草素等, 可以通过多条信号通路发挥血脑屏障保护作用[19], 具有潜在的抗HT作用。最近的研究发现黄芩苷与t-PA联合给药能够降低死亡率, 抑制t-PA介导的BBB破坏和HT的发生[20]。因此, 天然产物在HT防治药物的研究中具有明显的优势。前期的研究也表明, 匹诺塞林作为一种天然的黄酮类化合物, 能够通过多途径、多靶点保护神经血管单元, 这表明匹诺塞林具有抗HT的潜力。本研究也进一步证实匹诺塞林与t-PA联合使用能够降低HT的发生及程度。另外, 本研究选择了匹诺塞林3个剂量进行实验, 结果表明10 mg·kg-1综合作用最好, 这也与前期的实验结果一致, 其量效关系还需进一步的研究。
综上所述, 匹诺塞林与t-PA联用能够降低HT的发生及严重程度, 其机制可能与多靶点、多途径保护BBB有关。因此, 匹诺塞林可能是防治HT的潜在药物, 值得进一步的研究。
| [1] | Zhang R, Liu G, Pan Y, et al. World stroke trends overview[J]. Chin Stroke J (中国卒中杂志), 2014, 9: 768–773. |
| [2] | Roger VL. Heart disease and stroke statistics-2011 update: a report from the American Heart Association[J]. Circulation, 2011, 123: e18–e209. |
| [3] | Balami JS, Sutherland BA, Buchan AM. Complications associated with recombinant tissue plasminogen activator therapy for acute ischaemic stroke[J]. CNS Neurol Disord Drug Targets, 2013, 12: 155–169. DOI:10.2174/18715273112119990050 |
| [4] | Ma Y, Li L, Kong L, et al. Pinocembrin protects blood brain barrier function and expands the therapeutic time window for tissue type plasminogen activator treatment in a rat thromboembolic stroke model[J]. Biomed Res Int, 2018, 2018: 8943210. |
| [5] | Zhang P, Xu J, Hu W, et al. Effects of pinocembrin pretreatment on connexin 43 (Cx43) protein expression after rat myocardial ischemia reperfusion and cardiac arrhythmia[J]. Med Sci Monit, 2018, 24: 5008–5014. DOI:10.12659/MSM.909162 |
| [6] | Gu X, Zhang Q, Du Q, et al. Pinocembrin attenuates allergic airway inflammation via inhibition of NF-κB pathway in mice[J]. Int Immunopharmacol, 2017, 53: 90–95. DOI:10.1016/j.intimp.2017.10.005 |
| [7] | Said MM, Azab SS, Saeed NM, et al. Antifibrotic mechanism of pinocembrin: impact on oxidative stress, inflammation and TGF-β/Smad inhibition in rats[J]. Ann Hepatol, 2018, 17: 307–317. |
| [8] | Zheng Y, Wang K, Wu Y, et al. Pinocembrin induces ER stress mediated apoptosis and suppresses autophagy in melanoma cells[J]. Cancer Lett, 2018, 431: 31–42. DOI:10.1016/j.canlet.2018.05.026 |
| [9] | Lan X, Han X, Li Q, et al. Pinocembrin protects hemorrhagic brain primarily by inhibiting toll-like receptor 4 and reducing M1 phenotype microglia[J]. Brain Behav Immun, 2017, 61: 326–339. DOI:10.1016/j.bbi.2016.12.012 |
| [10] | Ma Y, Du G. Preparation and evaluation of intravascular thrombotic cerebral infarction model[J]. Chin Pharma Bull (中国药理学通报), 2015, 31: 1620–1622. |
| [11] | Wang W, Li M, Chen Q, et al. Hemorrhagic transformation after tissue plasminogen activator reperfusion therapy for ischemic stroke: mechanisms, models, and biomarkers[J]. Mol Neurobiol, 2015, 52: 1572–1579. DOI:10.1007/s12035-014-8952-x |
| [12] | Lees KR, Bluhmki E, Kummer RV, et al. Time to treatment with intravenous alteplase and outcome in stroke: an updated pooled analysis of ECASS, ATLANTIS, NINDS, and EPITHET trials[J]. Lancet, 2010, 375: 1695–1703. DOI:10.1016/S0140-6736(10)60491-6 |
| [13] | Ma Y, Li L, Niu Z, et al. Effect of recombinant plasminogen activator timing on thrombolysis in a novel rat embolic stroke model[J]. Pharmacol Res, 2016, 107: 291–299. DOI:10.1016/j.phrs.2016.03.030 |
| [14] | Turner RJ, Sharp FR. Implications of MMP9 for blood brain barrier disruption and hemorrhagic transformation following ischemic stroke[J]. Front Cell Neurosci, 2016, 10: 56. |
| [15] | Kanazawa M, Takahashi T, Nishizawa M, et al. Therapeutic strategies to attenuate therapeutic strategies to attenuate hemorrhagic transformation after tissue plasminogen activator treatment for acuteischemic stroke[J]. J Atheroscler Thromb, 2017, 24: 240–253. DOI:10.5551/jat.RV16006 |
| [16] | Kong L, Ma Y, Chen Y, et al. Advances in the study of mechanism of thrombolysis-induced hemorrhagic transformation and therapeutic drugs[J]. Acta Pharm Sin (药学学报), 2018, 53: 1467–1476. |
| [17] | Yepes M, Roussel BD, Ali C, et al. Tissue-type plasminogen activator in the ischemic brain: more than a thrombolytic[J]. Trends Neurosci, 2009, 32: 48–55. DOI:10.1016/j.tins.2008.09.006 |
| [18] | Ghosh N, Ghosh R, Bhat ZA, et al. Advances in herbal medicine for treatment of ischemic brain injury[J]. Nat Prod Commun, 2014, 9: 1045–1055. |
| [19] | Chen HS, Qi SH, Shen JG. One-compound-multi-target: combination prospect of natural compounds with thrombolytic therapy in acute ischemic stroke[J]. Curr Neuropharmacol, 2017, 15: 134–156. |
| [20] | Chen H, Guan B, Chen X, et al. Baicalin attenuates blood-brain barrier disruption and hemorrhagic transformation and improves neurological outcome in ischemic stroke rats with delayed t-PA treatment: involvement of ONOO-MMP-9 pathway[J]. Transl Stroke Res, 2018, 9: 515–529. DOI:10.1007/s12975-017-0598-3 |
 2019, Vol. 54
2019, Vol. 54


