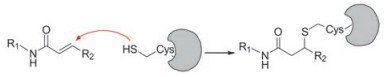
酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)可抑制肿瘤细胞增殖, 在抗肿瘤治疗中发挥着重要作用[1]。第1代可逆的表皮细胞生长因子受体(EGFR)抑制剂, 如吉非替尼和厄洛替尼, 对发生EGFR敏感突变(L858R和19号外显子删除)的非小细胞肺癌(NSCLC)患者, 具有显著的疗效。然而, 用药11~14个月后, 患者会产生耐药, 其主要原因是由于EGFR发生T790M二次突变, 增加了靶标与ATP的亲和力[2]。为了克服这种耐药性, 共价TKIs, 通过共价修饰EGFR的ATP结合口袋中的Cys-797残基, 从而克服T790M突变[3]。共价TKIs的主要药效团特征是通过药物结构的杂环骨架连接疏水基团和亲电性弹头(Michael受体)。亲电性弹头一般采用丙烯酰胺, 能够与靶蛋白中保守的, 溶剂可及的半胱氨酸残基发生共价相互作用[4]。图 1是共价TKIs与EGFR中的半胱氨酸残基发生共价结合的示意图。
|
Figure 1 Schematic representation of the covalent bond formation between EGFR and an covalent TKI |
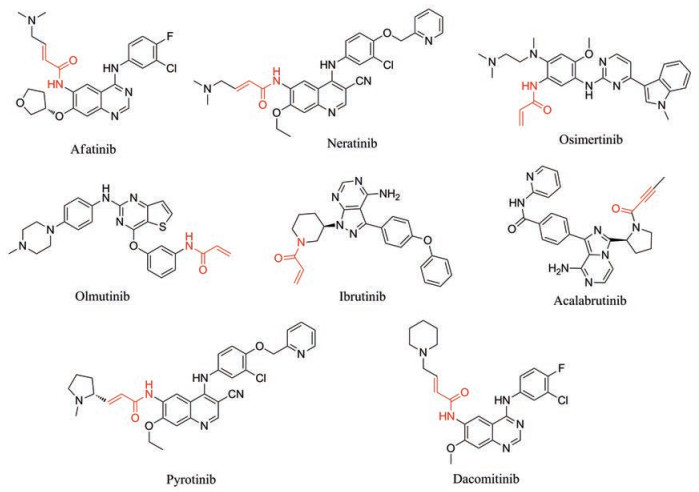
与非共价TKIs相比, 共价TKIs具有明显的药理学优势, 如较高的生化效能、选择性高、降低给药剂量和给药频率、药效学和药动学分离, 即使药物清除率高也能维持效力、能够预防耐药性的产生[5]。目前, 美国FDA已批准上市的共价TKIs有6个, 包括第2代EGFR抑制剂阿法替尼(afatinib)、来那替尼(neratinib)和达克替尼(dacomitinib), 第3代EGFR抑制剂奥希替尼(osimertinib)、布鲁顿酪氨酸酶(BTK)抑制剂依鲁替尼(ibrutinib)和阿可替尼(acalabrutinib)。韩国已批准第3代EGFR抑制剂奥莫替尼(olmutinib)上市, 我国自主研发的第2代EGFR抑制剂吡咯替尼(pyrotinib)最近获批上市。此外, 还有许多共价TKIs处于临床研发阶段。图 2展示了8个已上市的共价TKIs的结构式。
|
Figure 2 Chemical structures of the 8 covalent tyrosine kinase inhibitors |
本文概述了共价TKIs的作用机制、药物代谢与药动学、与血浆蛋白共价结合的特点, 并对共价TKIs的药动学研究方法提出展望。
1 共价TKIs的作用机制共价TKIs与靶蛋白的结合可分为两步, 第1步是药物与靶蛋白特定结合口袋发生非共价结合, 形成非共价复合物。第2步是非共价复合物中, 共价TKIs的弹头与靶蛋白中的亲核性氨基酸残基自发形成共价键, 产生不可逆的共价结合, 从而阻断靶蛋白与ATP的结合[6]。因为共价TKIs与靶蛋白的共价结合是不可逆的, 且酪氨酸激酶的合成时间较长, 所以降低了药物的给药剂量和给药频率, 从而进一步降低了药物的脱靶效应和药物-药物相互作用的可能性[7]。
虽然共价TKIs结构中含有Michael受体, 但其与反应性代谢物有着本质区别。它们的区别在于后者的反应性很强, 无选择性地与大量亲核性物质反应。而共价TKIs通过精心设计后, 调控其Michael受体的反应性, 选择性地结合到特定的靶蛋白。
表 1[3, 8-14]总结了7个共价TKIs的研发企业、上市时间、给药途径、适应证、临床给药方案和靶点的信息。除了靶点信息外, 其他信息均来源于药品说明书。奥希替尼是不可逆的EGFR抑制剂, 吡咯替尼是不可逆的EGFR/HER-2抑制剂, 阿法替尼、达克替尼和来那替尼是不可逆的EGFR/HER-2/HER-4抑制剂, 依鲁替尼和阿可替尼是不可逆的布鲁顿激酶抑制剂。
| Table 1 A list of 7 marketed covalent tyrosine kinase inhibitors, the corresponding corporations that marketed them, approved time, their route of administration, therapeutic indications, clinical dosing regimen, and therapeutic target |
对于非共价TKIs而言, 需要将血药浓度维持在一定水平来维持药效。而共价TKIs与靶蛋白共价结合后, 持续占据靶标活性位点, 使其失活, 靶标活性的恢复周期取决于新靶标合成所需的时间[7]。EGFR和布鲁顿激酶的合成半衰期都是16~24 h[15]。对于共价TKIs而言, 靶标占有率-药效动力学相关性取代了传统的药代动力学-药效动力学(PK/PD)相关性。
2 共价TKIs的代谢和药动学表 2[16-25]总结了7个共价TKIs的人体清除途径。吡咯替尼和奥希替尼分别是第2代和第3代EGFR抑制剂, 两者与血浆蛋白结合的可逆性不同。本文以奥希替尼和吡咯替尼为代表性药物, 详细介绍了这两个药物的代谢和药动学, 并对共价TKIs的药物相互作用研究进行汇总。
| Table 2 Clearance pathway of the covalent tyrosine kinase inhibitors. NR: Not reported |
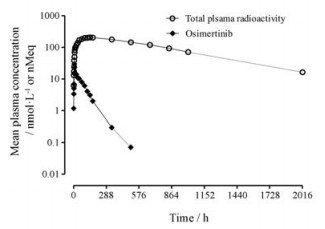
奥希替尼(osimertinib)是第3代EGFR抑制剂, 在一项健康志愿者单次口服20 mg (0.037 MBq) [14C]-奥希替尼的临床试验中, 给药84天后, 放射性总回收率占给药剂量的82%, 粪和尿的回收率分别是67.8%和14.2%[23]。图 3展示了物质平衡试验中, 奥希替尼和血浆总放射性的药时曲线图。
|
Figure 3 Arithmetic mean concentration-time profiles of osimertinib and total plasma radioactivity in healthy male volunteers after a single oral dose of 20 mg (0.037 MBq) [14C]-osimertinib (semilogarithmic scale)[23]. n = 8 |
奥希替尼在人体中吸收良好(至少88%), 血浆奥希替尼达峰时间(tmax)为6 h, 血浆总放射性的tmax是144 h[23]。奥希替尼的稳态血浆分布容积(Vss)是986 L, 说明奥希替尼分布广泛。奥希替尼的血浆蛋白结合率(预测值)是99%, 其口服清除率(CL/F)是14.2 L。奥希替尼每天1次, 在15天后可达稳态。稳态时, 奥希替尼的AUC蓄积比是3~4[26]。
奥希替尼的主要代谢途径是氧化代谢。在稳态条件下, 血浆中丰度最高的两种代谢物是AZ5104和AZ7550, 约占检测到的血浆总相关物质暴露量的8%和6%。奥希替尼、AZ5104和AZ7550主要由CYP3A4/5催化代谢(分别为54.0%、95.1%和99.9%)[23]。
奥希替尼、AZ5104和AZ7550平均消除半衰期分别为61.2、55.2和82.0 h, 而血浆总放射性半衰期是474 h。体外研究表明, 奥希替尼与人肝细胞、人血浆和人血清白蛋白(HSA)都能发生共价结合。血浆总放射性的消除延迟可能是因为奥希替尼与人血浆蛋白发生共价结合。结合血浆总放射性半衰期与HSA半衰期(19~20天)一致的现象, 表明给药后血浆中的大多数放射性是不可逆地结合到血浆蛋白, 且主要是与HSA结合[27]。在人体物质平衡试验中, 奥希替尼、AZ5104和AZ7550仅占血浆总放射性的0.8%、0.08%和0.07%, 说明与血浆蛋白共价结合的药物相关物质是血浆中的主要成分[23]。
与人肝细胞孵育时, 奥希替尼生成谷胱甘肽(GSH)及半胱氨酸-甘氨酸结合物。而在人体研究中, GSH结合物仅占所鉴定的代谢物的小部分, 表明奥希替尼对蛋白特定亲核基团的反应性高于GSH。在人体ADME研究中, 人血浆的放射性提取率(8%)远低于粪便(70%), 表明与奥希替尼共价结合的血浆蛋白远多于被排泄的蛋白质。约有30%的剂量与蛋白质类物质结合, 被排泄到粪中, 是奥希替尼主要的消除途径[23]。
在人体物质平衡试验中, 奥希替尼在粪和尿的7天累积排泄量分别为给药剂量的1.2%和0.71%, 表明大部分奥希替尼是通过代谢(酶促或共价结合蛋白质)消除[23]。
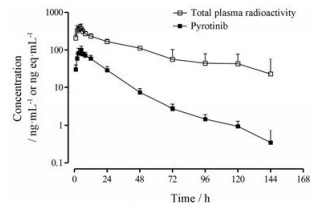
2.2 吡咯替尼吡咯替尼(pyrotinib)是第2代EGFR/HER-2抑制剂。健康志愿者单次口服402 mg (5.55 MBq) [14C]-吡咯替尼后, 放射性总回收率是给药剂量的92.6%, 粪和尿的回收率分别是90.9%和1.72%。吡咯替尼是粪便中的主要成分, 约占粪总放射性的22.4%。图 4是吡咯替尼和血浆总放射性的药时曲线图, 二者的tmax分别为5.0和3.5 h, 说明药物吸收较为缓慢。单次给药后, 吡咯替尼的分布容积(Vz/F)是8 570 L, 说明药物分布广泛[20]。吡咯替尼的血浆蛋白结合率是99.25%, 其口服清除率(CL/F)是207 L。稳态时, 吡咯替尼的AUC的蓄积比是1.22~1.57[10]。
|
Figure 4 Arithmetic mean concentration-time profiles of pyrotinib and total plasma radioactivity in healthy male volunteers after a single oral dose of 402 mg (5.55 MBq) [14C]-pyrptinib (semilogarithmic scale). n = 6, x±s |
吡咯替尼有两条代谢途径, 分别是O-去烷基和吡咯环单氧化并脱氢, 主要代谢酶是CYP3A4[21]。人血浆中的主要成分是吡咯替尼、SHR150980 (O-去皮考林)、SHR151468 (O-去皮考林并四氢吡咯环氧化为内酰胺)、SHR151136 (四氢吡咯环氧化为内酰胺)。根据AUC0-∞比值, 它们分别占血浆总放射性的10.9%, 1.9%、1.0%和3.0%。血浆中大约有58.3%的放射性与血浆蛋白共价结合, 是血浆中的主要成分[20]。吡咯替尼、SHR151136、SHR150980、SHR151468和血浆总放射性的半衰期分别是29.3、9.75、32.2、10.4和47.9 h。给药后2 h, 药物相关物质与血浆蛋白共价结合部分占血浆总放射性的29.3%, 到48 h后, 该比例增加至65.2%。将吡咯替尼与人空白血浆在37 ℃孵育2、5、8和24 h后, 样品的提取回收率分别降为97.4%、91.8%、69.6%和46.7%。将吡咯替尼与HSA和α1-酸性糖蛋白(APG)在37 ℃下孵育, 也可以观察到提取回收率降低, 且吡咯替尼主要与HSA结合[20]。
将[14C]-吡咯替尼与血浆孵育24 h后, 用盐酸(90 ℃, 2 h)水解, 经放射性色谱和高分辨质谱检测, 鉴定了一系列吡咯替尼与氨基酸加合物的结构, 结果表明吡咯替尼可以共价结合到HSA的第190位赖氨酸。进一步实验显示, 吡咯替尼与血浆蛋白的共价结合是可逆的[20]。
2.3 其他药物其他药物包括EGFR/HER-2/HER-4抑制剂阿法替尼、来那替尼和达克替尼, 布鲁顿激酶抑制剂依鲁替尼和阿可替尼。阿法替尼、来那替尼和达克替尼人体给药后, 吸收较为缓慢(tmax分别为6、7和12 h), 而布鲁顿激酶抑制剂依鲁替尼和阿可替尼则吸收较为迅速(tmax分别为0.52和0.75 h)。除了阿可替尼外, 其余4个药物都具有较高的组织分布。5个药物的血浆蛋白结合率都很高(≥95%), 且体外实验证明阿法替尼和依鲁替尼都可以与HSA共价结合[16, 22, 25, 28]。
在物质平衡试验中, 血浆中有大量的放射性组分不能被有机溶剂提取。说明与血浆蛋白共价结合的组分占血浆总放射性的比例较大。在阿法替尼物质平衡试验中, 与血浆蛋白共价结合的放射性占血浆总放射性的比例随着采样时间的增加而增加, 从给药后1~2 h的7%, 增加到72 h的48%[16]。对于依鲁替尼而言, 与血浆蛋白共价结合的放射性分别占血浆总放射性AUC0-24 h和AUC0-72 h的38%和51%[24]。
阿法替尼每天1次, 在8天后可达稳态。稳态时, 阿法替尼的Cmax和AUC的蓄积比分别是2.0~2.7和2.5~3.4[29]。连续给药6个月后, 阿法替尼的半衰期可达344 h[29]。来那替尼多次给药后, 稳态时来那替尼的AUC的蓄积比是1.14[30]。稳态时, 达克替尼的AUC蓄积比是6.32~7.37[31]。依鲁替尼每天1次, 连续给药后, 其AUC蓄积比为1~1.6, 未表现出蓄积[32, 33]。阿可替尼一天两次, 连续给药后未表现出蓄积[34]。
阿法替尼几乎不经CYP酶代谢, 来那替尼、依鲁替尼和阿可替尼则主要由CYP3A代谢。达克替尼主要由CYP2D6代谢, 主要代谢途径为氧化代谢和结合代谢。对于不可逆TKIs而言, 药物主要经由粪排泄, 尿排泄占的比例较小。依鲁替尼以原形排泄的量很少, 肠和肝代谢生成大量的氧化物, 且在粪中未检测到还原产物, 表明依鲁替尼的胃肠道吸收完全, 且在体内经历广泛代谢[24]。
依鲁替尼和阿可替尼的血浆半衰期都很短, 但是其药效持续时间长。依鲁替尼的血浆消除半衰期是3.14 h, 口服依鲁替尼420 mg后24 h的靶标占据率仍大于95%[35]。慢性淋巴细胞白血病患者口服阿可替尼100 mg后, 给药4 h后, 布鲁顿激酶的占据率可达99%~100%[36]。下次给药前, 布鲁顿激酶的占据率仍可维持在95%~97%[34]。
2.4 药物相互作用由于大多数共价TKIs是CYP3A的底物, 因此CYP3A的诱导剂和抑制剂会影响此类药物的暴露量。药物相互作用研究中常用的诱导剂是利福平, 临床试验早期使用的抑制剂为酮康唑, 现多为伊曲康唑。由于酮康唑或伊曲康唑抑制药物的代谢, 所以导致药物的暴露量增加。然而, 共价TKIs暴露量增加的幅度差别很大。如伊曲康唑使得奥希替尼的血浆暴露量增加7%, 而使阿可替尼的暴露量增加到5.1倍。当药物只经单一途径代谢时, 其发生药物相互作用的可能性会显著增加[37]。奥希替尼在血浆中主要与血浆蛋白共价结合, 从而降低了CYP酶对其代谢的影响。与利福平联用时, 共价TKIs的暴露量降低。在这几个药物中, 依鲁替尼血浆暴露量增加或降低的幅度最大, 这是因为依鲁替尼的首过代谢很强。伊曲康唑和利福平不仅影响了依鲁替尼的代谢, 还显著影响了它的生物利用度。由于CYP3A的强诱导剂或强抑制剂会导致共价TKIs的暴露量发生改变, 一般不推荐或避免将这些药物与共价TKIs联合使用。如果必须联用时, 需进行剂量调整并考虑进行血药浓度监测。
阿法替尼几乎不经CYP酶代谢, 但其是转运体P-gp的底物, 因此其暴露量受P-gp诱导剂和抑制剂的影响。来那替尼是P-gp的抑制剂, 与P-gp底物地高辛合用时, 影响后者的血浆暴露量。由于来那替尼、达克替尼和阿可替尼的溶解度随pH的增加而降低, 所以抗酸药会影响它们的血浆暴露量。表 3[38-43]汇总了已知的共价TKIs的药物-药物相互作用研究, 部分数据来源于药品说明书。
| Table 3 The summary of drug-drug interaction of covalent TKIs. *Data from PharmaPendium (https://www.pharmapendium.com) |
共价TKIs结构中的丙烯酰胺反应性低, 但其对GSH中的半胱氨酸残基仍具有一定的亲电性作用。在体外实验中, 阿法替尼和来那替尼容易生成GSH加合物[44]。但在人体中, 阿法替尼在血浆中的主要成分是原形、阿法替尼与血浆蛋白的加合物[16]。来那替尼主要是经CYP3A4介导的氧化途径清除[39]。同样, 对于奥希替尼与吡咯替尼而言, 在人体中生成的GSH、半胱氨酸或N-乙酰半胱氨酸结合物占已鉴定的代谢物的比例很小, 血浆中主要成分是药物相关物质与血浆蛋白的加合物[10, 20, 23]。说明在人体内, 共价TKIs对蛋白特定亲核性基团的反应性高于对GSH的反应性。
3.2 共价TKIs与血浆蛋白的共价结合是非酶催化的过程, 具有时间依赖性和种属特异性在阿法替尼、依鲁替尼和吡咯替尼人体物质平衡研究中, 随着采样时间的增加, 放射性与血浆蛋白的加合物占样品总放射性的比例增加[16, 20, 24]。将奥希替尼和来那替尼与不同种属的血浆孵育后, 人血浆提取回收率显著低于其他种属血浆。研究表明, 来那替尼、阿法替尼、奥希替尼、依鲁替尼和吡咯替尼都可以与HSA发生共价结合。HSA由单一肽链组成, 含有585个氨基酸, 共有35个半胱氨酸残基, 形成17对二硫键, 只有Cys-34含有游离巯基[45]。共价TKIs与血浆蛋白共价结合具有种属特异性, 推测是因为不同种属的血清白蛋白氨基酸序列不同, 影响了结合口袋的环境, 改变了底物结合的方向, 最终改变底物和血清白蛋白结合的性质。
3.3 共价TKIs与血浆蛋白结合的可逆性共价TKIs通过Michael加成共价结合到人血浆蛋白上。有文献报道, 某些类型的共价结合, 如Michael加成是可逆的[46]。体外实验证明, 吡咯替尼和来那替尼与血浆蛋白的共价结合是可逆的, 阿法替尼与HSA的共价结合也是可逆的[20, 28, 47]。推测达克替尼、依鲁替尼与血浆蛋白的结合是可逆的, 因为它们的血浆总放射性的消除半衰期远小于HSA的半衰期。奥希替尼单次给药后, 血浆总放射性半衰期与HSA的半衰期一致, 提示奥希替尼与HSA的共价结合是不可逆的。药物与血浆蛋白的共价结合若是可逆的, 那么血浆蛋白就可以作为储备药物的载体。相反, 与血浆蛋白结合的部分药物则未能发挥药效作用。共价TKIs与血浆蛋白共价结合的可逆性受哪些因素影响尚未知, 还需进一步研究。
4 结语共价TKIs结构中的丙烯酰胺弹头能与血浆蛋白(如人血清白蛋白)发生共价结合, 从而影响药物的吸收、分布、代谢和排泄。共价TKIs主要经粪排泄, 尿排泄很少。对于这类药物而言, 肝外代谢(如与血浆蛋白结合)十分重要, 因此需采用放射性同位素标记的药物来研究其与血浆蛋白的共价结合。这类药物大都由CYP酶催化代谢, 当其与主要代谢酶的抑制剂或诱导剂联用时, 需要及时进行剂量调整。
共价TKIs与血浆蛋白的共价结合表现出种属特异性, 因此在早期研究中应采用合适的动物模型。传统的ADME和药代动力学(PK)筛选对这类化合物并不适用, 研究者更需要关注的是靶标的占有率及其药物的靶组织分布。在研发过程中应筛选共价TKIs是否会产生反应性代谢产物, 以防共价TKIs设计的选择性烷化性质受损。目前, 对共价TKIs与脱靶大分子反应可逆性的生物学后果了解尚少。相信随着对这类药物的深入研究, 对这些问题的理解将逐渐加深。
| [1] | Ferguson FM, Gray NS. Kinase inhibitors: the road ahead[J]. Nat Rev Drug Discov, 2018, 17: 353–377. DOI:10.1038/nrd.2018.21 |
| [2] | Cheng H, Nair SK, Murray BW. Recent progress on third generation covalent EGFR inhibitors[J]. Bioorg Med Chem Lett, 2016, 26: 1861–1868. DOI:10.1016/j.bmcl.2016.02.067 |
| [3] | Yun CH, Mengwasser KE, Toms AV, et al. The T790M mutation in EGFR kinase causes drug resistance by increasing the affinity for ATP[J]. Proc Natl Acad Sci U S A, 2008, 105: 2070–2075. DOI:10.1073/pnas.0709662105 |
| [4] | Hossam M, Lasheen DS, Abouzid KA. Covalent EGFR inhibitors: binding mechanisms, synthetic approaches, and clinical profiles[J]. Arch der Pharmazie, 2016, 349: 573–593. DOI:10.1002/ardp.v349.8 |
| [5] | Zhang DF, Jiao Y, Liu Y, et al. Progress of small molecule anti-tumor covalent drugs[J]. J Chin Pharm Univ (中国药科大学学报), 2017, 48: 1–7. |
| [6] | Singh J, Petter RC, Baillie TA, et al. The resurgence of covalent drugs[J]. Nat Rev Drug Discov, 2011, 10: 307–317. DOI:10.1038/nrd3410 |
| [7] | Baillie TA. Targeted covalent inhibitors for drug design[J]. Angew Chem Int Ed, 2016, 55: 13408–13421. DOI:10.1002/anie.201601091 |
| [8] | Solca F, Dahl G, Zoephel A, et al. Target binding properties and cellular activity of afatinib (BIBW 2992), an irreversible ErbB family blocker[J]. J Pharmacol Exp Ther, 2012, 343: 342–350. DOI:10.1124/jpet.112.197756 |
| [9] | Wissner A, Mansour TS. The development of HKI-272 and related compounds for the treatment of cancer[J]. Arch Pharm Chem Life Sci, 2008, 341: 465–477. DOI:10.1002/ardp.v341:8 |
| [10] | Li X, Yang C, Wan H, et al. Discovery and development of pyrotinib: a novel irreversible EGFR/HER2 dual tyrosine kinase inhibitor with favorable safety profiles for the treatment of breast cancer[J]. Eur J Pharm Sci, 2017, 110: 51–61. DOI:10.1016/j.ejps.2017.01.021 |
| [11] | Gajiwala KS, Feng J, Ferre R, et al. Insights into the aberrant activity of mutant EGFR kinase domain and drug recognition[J]. Structure, 2013, 21: 209–219. DOI:10.1016/j.str.2012.11.014 |
| [12] | Cross DA, Ashton SE, Ghiorghiu S, et al. AZD9291, an irreversible EGFR TKI, overcomes T790M-mediated resistance to EGFR inhibitors in lung cancer[J]. Cancer Discov, 2014, 4: 1046–1061. DOI:10.1158/2159-8290.CD-14-0337 |
| [13] | Honigberg LA, Smith AM, Sirisawad M, et al. The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy[J]. Proc Natl Acad Sci U S A, 2010, 107: 13075–13080. DOI:10.1073/pnas.1004594107 |
| [14] | Barf T, Covey T, Izumi R, et al. Acalabrutinib (ACP-196): a covalent Bruton tyrosine kinase inhibitor with a differentiated selectivity and in vivo potency profile[J]. J Pharmacol Exp Ther, 2017, 363: 240–252. DOI:10.1124/jpet.117.242909 |
| [15] | Moghaddam MF, Tang Y, O'Brien Z, et al. A proposed screening paradigm for discovery of covalent inhibitor drugs[J]. Drug Metab Lett, 2014, 8: 19–30. DOI:10.2174/1872312808666140317151735 |
| [16] | Stopfer P, Marzin K, Narjes H, et al. Afatinib pharmacokinetics and metabolism after oral administration to healthy male volunteers[J]. Cancer Chemother Pharmacol, 2012, 69: 1051–1061. DOI:10.1007/s00280-011-1803-9 |
| [17] | European Medicines Agency, Committee for Medicinal Products for Human Use. CHMP assessment report[EB/OL]. Accessed July 28, 2018. https://www.ema.europa.eu/medicines/human/EPAR/giotrif. |
| [18] | Food and Drug Administration, Department of Health and Human Services. Center for drug evaluation and research application number: 208051Orig1s000[EB/OL]. Accessed July 28, 2018. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2017/208051orig1s000multidiscipliner.pdf. |
| [19] | Wang J, Li-Chan XX, Atherton J, et al. Characterization of HKI-272 covalent binding to human serum albumin[J]. Drug Metab Dispos, 2010, 38: 1083–1093. DOI:10.1124/dmd.110.032292 |
| [20] | Meng J, Liu XY, Ma S, et al. Metabolism and disposition of pyrotinib in healthy male volunteers: covalent binding with human plasma protein[J]. Acta Pharmacol Sin, 2018. DOI:10.1038/S41401-018-0176-6 |
| [21] | Zhu YT, Li L, Zhang G, et al. Metabolic characterization of pyrotinib in humans by ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. J Chromatogr B, 2016, 1033-1034: 117–127. DOI:10.1016/j.jchromb.2016.08.009 |
| [22] | Bello CL, Smith E, Ruiz-Garcia A, et al. A phase Ⅰ, open-label, mass balance study of[14C] dacomitinib (PF-00299804) in healthy male volunteers[J]. Cancer Chemother Pharmacol, 2013, 72: 379–385. DOI:10.1007/s00280-013-2207-9 |
| [23] | Dickinson PA, Cantarini MV, Collier J, et al. Metabolic disposition of osimertinib in rats, dogs, and humans: insights into a drug eesigned to bind covalently to a cysteine residue of epidermal growth factor receptor[J]. Drug Metab Dispos, 2016, 44: 1201–1212. DOI:10.1124/dmd.115.069203 |
| [24] | Scheers E, Leclercq L, de Jong J, et al. Absorption, metabolism and excretion of oral 14C radiolabeled ibrutinib: an open-label, phase Ⅰ, single-dose study in healthy men[J]. Drug Metab Dispos, 2014, 43: 289–297. DOI:10.1124/dmd.114.060061 |
| [25] | Food and Drug Administration, Department of Health and Human Services. Center for drug evaluation and research application number: 210259Orig1s000[EB/OL]. Accessed7 August, 2018. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2017/210259orig1s000approv.pdf. |
| [26] | Planchard D, Brown KH, Kim DW, et al. Osimertinib Western and Asian clinical pharmacokinetics in patients and healthy volunteers: implications for formulation, dose, and dosing frequency in pivotal clinical studies[J]. Cancer Chemother Pharmacol, 2016, 77: 767–776. DOI:10.1007/s00280-016-2992-z |
| [27] | Tabish Rehman M, Khan AU. Understanding the interaction between human serum albumin and anti-bacterial/anti-cancer compounds[J]. Curr Pharm Design, 2015, 21: 1785–1799. DOI:10.2174/1381612821666150304161201 |
| [28] | European Medicines Agency, Committee for Medicinal Products for Human Use. CHMP assessment report Giotrif [EB/OL]. Accessed7 August, 2018. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002280/WC500152394.pdf. |
| [29] | Wind S, Schnell D, Ebner T, et al. Clinical pharmacokinetics and pharmacodynamics of afatinib[J]. Clin Pharmacokinet, 2017, 56: 235–250. DOI:10.1007/s40262-016-0440-1 |
| [30] | Wong KK, Fracasso PM, Bukowski RM, et al. A phase Ⅰ study with neratinib (HKI-272), an irreversible pan ErbB receptor tyrosine kinase inhibitor, in patients with solid tumors[J]. Clin Cancer Res, 2009, 15: 2552–2558. DOI:10.1158/1078-0432.CCR-08-1978 |
| [31] | Takahashi T, Boku N, Murakami H, et al. Phase Ⅰ and pharmacokinetic study of dacomitinib (PF-00299804), an oral irreversible, small molecule inhibitor of human epidermal growth factor receptor-1, -2, and -4 tyrosine kinases, in Japanese patients with advanced solid tumors[J]. Invest New Drugs, 2012, 30: 2352–2363. DOI:10.1007/s10637-011-9789-z |
| [32] | Marostica E, Sukbuntherng J, Loury D, et al. Population pharmacokinetic model of ibrutinib, a Bruton tyrosine kinase inhibitor, in patients with B cell malignancies[J]. Cancer Chemother Pharmacol, 2015, 75: 111–121. DOI:10.1007/s00280-014-2617-3 |
| [33] | Advani RH, Buggy JJ, Sharman JP, et al. Bruton tyrosine kinase inhibitor ibrutinib (PCI-32765) has significant activity in patients with relapsed/refractory B-cell malignancies[J]. J Clin Oncol, 2013, 31: 88–94. |
| [34] | Byrd JC, Harrington B, O'Brien S, et al. Acalabrutinib (ACP-196) in relapsed chronic lymphocytic leukemia[J]. N Engl J Med, 2016, 374: 323–332. DOI:10.1056/NEJMoa1509981 |
| [35] | Parmar S, Patel K, Pinilla-Ibarz J. Ibrutinib (imbruvica): a novel targeted therapy for chronic lymphocytic leukemia[J]. Pharm Ther, 2014, 39: 483–487. |
| [36] | Markham A, Dhillon S. Acalabrutinib: first global approval[J]. Drugs, 2018, 78: 139–145. DOI:10.1007/s40265-017-0852-8 |
| [37] | Scripture CD, Figg WD. Drug interactions in cancer therapy[J]. Nat Rev Cancer, 2006, 6: 546–558. DOI:10.1038/nrc1887 |
| [38] | Wind S, Giessmann T, Jungnik A, et al. Pharmacokinetic drug interactions of afatinib with rifampicin and ritonavir[J]. Clin Drug Investig, 2014, 34: 173–182. DOI:10.1007/s40261-013-0161-2 |
| [39] | Abbas R, Hug BA, Leister C, et al. Pharmacokinetics of oral neratinib during co-administration of ketoconazole in healthy subjects[J]. Br J Clin Pharmacol, 2011, 71: 522–527. DOI:10.1111/bcp.2011.71.issue-4 |
| [40] | Keyvanjah K, DiPrimeo D, Li A, et al. Pharmacokinetics of neratinib during coadministration with lansoprazole in healthy subjects[J]. Br J Clin Pharmacol, 2017, 83: 554–561. DOI:10.1111/bcp.13132 |
| [41] | Ruiz-Garcia A, Giri N, LaBadie RR, et al. A phase Ⅰ open-label study to investigate the potential drug-drug interaction between single-dose dacomitinib and steady-state paroxetine in healthy volunteers[J]. J Clin Pharmacol, 2014, 54: 555–562. DOI:10.1002/jcph.v54.5 |
| [42] | Bello CL, LaBadie RR, Ni G, et al. The effect of dacomitinib (PF-00299804) on CYP2D6 activity in healthy volunteers who are extensive or intermediate metabolizers[J]. Cancer Chemother Pharmacol, 2012, 69: 991–997. DOI:10.1007/s00280-011-1793-7 |
| [43] | Vishwanathan K, Dickinson PA, So K, et al. The effect of itraconazole and rifampicin on the pharmacokinetics of osimertinib[J]. Br J Clin Pharmacol, 2018, 84: 1156–1169. DOI:10.1111/bcp.13534 |
| [44] | Shibata Y, Chiba M. The role of extrahepatic metabolism in the pharmacokinetics of the targeted covalent inhibitors afatinib, ibrutinib, and neratinib[J]. Drug Metab Dispos, 2015, 43: 375–384. DOI:10.1124/dmd.114.061424 |
| [45] | Hirose M, Tachibana A, Tanabe T. Recombinant human serum albumin hydrogel as a novel drug delivery vehicle[J]. Mat Sci Eng C, 2010, 30: 664–669. DOI:10.1016/j.msec.2010.02.020 |
| [46] | Lin D, Saleh S, Liebler DC. Reversibility of covalent electrophile-protein adducts and chemical toxicity[J]. Chem Res Toxicol, 2008, 21: 2361–2369. DOI:10.1021/tx800248x |
| [47] | Chandrasekaran A, Shen L, Lockhead S, et al. Reversible covalent binding of neratinib to human serum albumin in vitro[J]. Drug Metab Lett, 2010, 4: 220–227. DOI:10.2174/187231210792928206 |
 2019, Vol. 54
2019, Vol. 54


