2. 温州大学生命科学研究院, 浙江 温州 325000
2. Life Sciences College, Wenzhou University, Wenzhou 325000, China
X连锁低磷酸盐血症(X-linked hypophosphatemia, XLH)是常见的低磷血症类疾病, 该疾病的全球患病率是1:20 000[1], 该病的特点是患者血清磷酸盐水平低下并导致骨骼矿化水平低下。XLH患者在儿童时期的鉴别和诊断特征是患者髌骨内翻并表现X形腿, 因为儿童软骨矿化水平低下且承受能力不足。该疾病的其他表现形式还包括生长迟缓、骨骼变形和骨骼易碎等[2]。近几年, 临床研究发现XLH患者血清中含有较高水平的成纤维细胞生长因子23 (fibroblast growth factor-23, FGF23)。FGF23通过近曲小管上皮细胞刷状缘膜上的钠-磷协同转运蛋白NPT2a和NPT2c的内移和降解增加尿磷的排泄, 减少肾脏无机磷重吸收从而调节磷的排泄[3]。大量的研究也证实肾近曲小管中过高的FGF23是导致磷酸盐代谢紊乱和相关后遗症的关键原因[4]。
FGF23是成纤维细胞生长因子家族(FGFs)的成员, 是一种重要的内分泌磷稳态调节因子。FGF23通过与受体细胞的FGFR1c/α-klotho受体复合物结合[5], 其中FGF23的C端的73个氨基酸(FGF23C-tail)是与受体复合物结合的结合位点, FGF23的N端(N-tail)是受体复合物的激活位点, 将信号进一步传导到胞内。Goetz等[6]研究发现, 保留C端73个氨基酸的FGF23C-tail可以与FGF23竞争性结合FGFR1c/α-klotho受体复合物, 且FGF23C-tail不会激活受体复合物。在健康和磷代谢紊乱的动物模型中发现, 体外注射FGF23C-tail可以有效抑制FGF23的功能, 提高肾脏对血磷的重吸收。因此, FGF23C-tail作为拮抗剂抑制FGF23, 可以有效地降低FGF23对患者血磷的调节功能, 对于XLH和其他低磷血症疾病的治疗具有重要的研究价值和应用前景。
但在药物开发应用过程中, 73个氨基酸的FGF23C-tail与很多其他重组功能蛋白一样存在稳定性差、体内半衰期短的缺陷。研究表明FGF23C-tail体内的半衰期仅为11.5 min, 这就意味着临床需要频繁给药才能维持该药物的体内有效性, 这将会进一步加重病人的痛苦及其家庭经济负担[7]。目前, FGF23C-tail的药物长效性改造还处于研究初期阶段, 国内尚未见FGF23C-tail的长效改造的文献报道, 国外只有辉瑞公司对FGF23C-tail与Fc抗体片段融合进行长效改造, 改造后FGF23C-tail-Fc可以有效地抑制FGF23的生物学活性[8]。人血清白蛋白(human serum albumin, HSA)是人体血清中的主要蛋白, 因其与人体的相容性好、免疫原性低、半衰期长而得到广泛的应用[9]。白蛋白融合研究从上世纪90年代开始至今已得到广泛的研究, 截止目前为止, HSA融合蛋白共有11种处于临床前的研究[10]。针对FGF23C-tail的长效改造, 尚未见有与HSA融合的报道。本文首次将FGF23C-tail与载体蛋白(HSA)通过基因工程的手段构建融合蛋白FGF23C-tail-HSA, 并在毕赤酵母菌株中进行表达。制备高纯度的FGF23C-tail-HSA融合蛋白并检测蛋白的生物学活性, 为融合蛋白的进一步开发和应用奠定基础。
材料与方法质粒与菌株 毕赤酵母(Pichia pastoris)菌株GS115、大肠杆菌DH5α来自本实验室保存, 表达质粒pPIC9K由江南大学金坚实验室馈赠。
试剂 FGF23C-tail基因、引物委托上海生工生物工程有限公司合成。FGF23、FGF23C-tail由分子生物学教研室馈赠。分子构建所使用的试剂EcoR I和Not I、DNA marker、protein marker、T4 ligase等购自Thermo Scientific公司。PCR产物纯化试剂盒、质粒小量抽提试剂盒、酵母基因组DNA抽提试剂盒、DNA胶回收试剂盒、遗传霉素(G418)、蛋白胨、酵母粉等试剂购买于上海生工生物工程有限公司。尿微量白蛋白检测试剂盒购买于上海名典生物试剂有限公司。实验所用抗体购自Abcam公司。其余的化学试剂来源于上海国药化学试剂有限公司。
重组基因和重组质粒的构建 委托上海生工生物有限公司全基因合成FGF23C-tail片段序列, HSA基因为本实验室保存的pPIC9K/HSA。融合PCR构建FGF23C-tail-HSA重组基因序列, 引物序列见表 1, 使用pfu DNA聚合酶扩增基因片段。按照表 2的反应过程进行扩增。DNA回收试剂盒回收1st、2nd的基因片段, 调整摩尔数比为1:1, 不添加引物, 融合具有互补片段的两个基因。获得的融合基因经EcoR I、Not I双酶切后回收酶切片段, 然后与经相同酶切位点剪切后的pPIC9K质粒连接。连接好的质粒转化到DH5α菌株中, 并在LB固体培养基(0.5%酵母粉、1%蛋白胨、0.5% NaCl加50 μg·mL-1 Amp)中培养16 h。挑选单菌落, 筛选获得的阳性质粒经PCR验证和测序验证正确后用于下一步的实验。
| Table 1 List of primers for amplification target gene |
| Table 2 Conditions and primer sets for fusion PCR |
重组毕赤酵母菌株的构建 提取重组质粒。验证正确的质粒经Sal I线性化酶切后, 与GS115感受态细胞混合电击(1.5 kV, 40 μF, 180 Ω)转化。毕赤酵母GS115的感受态细胞经标准方法制备获得[11]。在MD平板(20 g·L-1葡萄糖、10 g·L-1硫酸铵、3.4 g·L-1的YNB、15 g·L-1琼脂粉)培养4天。待重组菌株形成菌落后挑选30株阳性克隆株至含2 mg·mL-1 G418抗性的YPD平板中继续培养两天。挑选10株菌落明显的阳性克隆株至BMGY液体培养基培养2天, 第3天离心换为BMMY培养基并隔天补加2%的甲醇连续培养3天[12]。收集上清液用尿微量白蛋白检测试剂盒检测上清液中FGF23C-tail-HSA的蛋白含量, 并挑选高表达的克隆菌株。具体的步骤可参考Invitrogen公司的pPIC9K表达手册。
菌株的验证 酵母基因组抽提试剂盒抽提重组菌株的基因组DNA。以基因组为模板, 用F5p\H3p为引物检测目标基因。制备好12%的SDS-PAGE胶[13], 离心收集发酵上清液, 150 V、80 min蛋白胶中分离, 并转化到硝酸纤维素膜上。制备两份, 并分别用鼠源FGF23多抗和HSA多抗杂交, 用羊抗鼠的二抗孵育, 用ECL显色液显色。
菌株的发酵罐制备表达 发酵罐选用上海保兴的5 L发酵罐, 初始装液量为3 L。初始培养基[20 g·L-1蛋白胨、10 g·L-1酵母粉、100 g·L-1硫酸铵、3.4 g·L-1无氨基酵母氮源、100 mmol·L-1 (pH 6.0)磷酸钾缓冲液、20 mL·L-1甘油]。在30 ℃、pH 6.0、400 r·min-1发酵培养。通过35%的磷酸和2 mol·L-1的氢氧化钾自动控制pH。培养基中的甘油消耗完全后, 溶氧值会升高, 当反弹至30%时, 降低发酵温度至25 ℃并将转速提高至600 r·min-1。补加甲醇, 甲醇补加速度与溶氧(30%)呈负反馈相关, 以12 mL·h-1补加防降解培养基(100 g·L-1蛋白胨、50 g·L-1酵母粉)。每4 h取样检测菌体干重浓度(g·L-1)和甲醇消耗量, 并用尿微量白蛋白检测试剂盒检测发酵液中FGF23C-tail-HSA的蛋白含量。
重组蛋白的纯化 发酵液经8 000 r·min-1离心12 min后收集上清, 用0.45 μm的滤膜过滤, 再经超滤仪浓缩10倍。浓缩液稀释5倍后, 再次浓缩至原体积。Blue柱先经Ⅰ液(20 mmol·L-1磷酸钠缓冲液, pH 7.0, 0.1 mol·L-1 NaCl)平衡后将浓缩的样品上样, 淋洗平衡后以45% Ⅱ液(20 mmol·L-1磷酸钠缓冲液, pH 7.0, 2 mol·L-1 NaCl)和100% Ⅱ液梯度洗脱。收集100% Ⅱ液上样于Phenyl柱, 经淋洗平衡后以100%的Ⅲ液(20 mmol·L-1磷酸钠缓冲液, 50 mmol·L-1 NaCl, pH 7.0)洗脱。收集Phenyl柱的洗脱液上样于Q柱, 淋洗平衡后用40%的Ⅳ液(1 mol·L-1 NaCl pH 7.0)和100%的Ⅳ液洗脱。收集40%的Ⅳ液即为目标蛋白的纯化液。
重组蛋白的活性检测 购自上海斯莱克实验动物有限公司的Sprague-Dawley大鼠作为实验动物, 参照动物实验管理和宜春学院伦理委员会的要求开展实验。每组5只, 设置对照组、FGF23全长蛋白组(给药剂量为0.2 μg·kg-1)、FGF23C-tail (给药剂量为0.2 μg·kg-1)和FGF23C-tail-HSA融合蛋白组(给药剂量为0.2 μg·kg-1)。静脉注射给药, 对照组注射同体积的生理盐水。在给药前和给药3 h后采取尾尖取血法收集血液约1 mL, 血液凝固后收集血清, 血清中血磷含量采用血磷浓度检测试剂盒(Solarbio, BC1655)检测。
结果 1 重组基因和重组质粒的构建FGF23C-tail基因片段委托上海生工合成, HSA基因片段为本实验室保存。利用表 1的引物设计, 按照表 2的反应进行第一次和第二次PCR, 此时各自基因片段多扩增出一部分互补的基因序列。胶回收后调整PCR产物的摩尔数比, 进行第三次的融合PCR, 再扩增获得融合基因(FGF23C-tail-HSA)序列(流程图见图 1A)。融合基因经双酶切后连接到pPIC9K质粒上, 连接产物转化到DH5α中。获得的重组质粒经PCR鉴定和基因测序鉴定与预期重组质粒(图 1B)一致。

|
Figure 1 Construction of the recombinant plasmid. A: Fusion gene FGF23C-tail-HSA constructed by fusion of PCR. B: Schematic of the recombinant plasmid |
GS115是毕赤酵母(Pichia pastoris)菌株的一种。参照说明书制作GS115感受态细胞, 重组质粒经Sal I线性化后, 与感受态细胞混合并电击转化。将转化后的GS115均匀涂布到MD平板中, 经4天培养后形成大约120个单菌落。随机挑选30个菌落继续在YPD抗性平板(含2 mg·mL-1的G418)中继续培养两天。抗性压力下生长出11个克隆株, 并将其全部接种到摇瓶中, 并进行连续3天的诱导表达。尿微量白蛋白试剂盒是医院用于检验人体尿液白蛋白含量的试剂盒, 检测范围为20~200 mg·L-1。融合蛋白FGF23C-tail-HSA有白蛋白的抗原性, 检测发酵液白蛋白的含量来指示融合蛋白的含量[12]。产量的结果显示, 有4株菌株的表达量低于30 mg·L-1, 6号菌株的表达量最高, 为43.7 mg·L-1 (图 2B)。

|
Figure 2 Construction and screening of recombinant P. pastoris strains |
利用5 L发酵罐研究重组菌株的发酵表达。发酵到28 h时, 菌体干重浓度达到50.6 g·L-1, 此后菌体干重增加不大, 结果显示28 h已进入细菌培养的平台期(图 3)。且28 h时, 发酵罐的溶氧水平已触底反弹至43%, 与溶氧(30%)负关联的方式开始补加甲醇(诱导培养基)。28~44 h甲醇消耗速度较低, 重组蛋白的积累量也不大, 此后甲醇消耗速度明显增加, 且重组蛋白的产量显著增加, 这与理论相符。培养至76 h, 重组蛋白的浓度最大至265.6 mg·L-1。随后甲醇消耗速度明显下降, 且重组蛋白浓度也下降, 这可能与菌体的活率下降而导致重组蛋白的降解相关。因此, 根据发酵参数分析, 重组菌株的最佳的发酵时间为76 h, 此时重组蛋白的表达量最高。
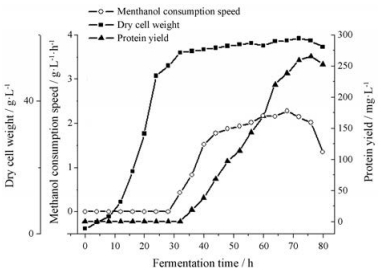
|
Figure 3 The process in 5 L-fermentation. Cell density, protein concentration, and rate of glucose consumption were measured every 4 h |
发酵罐在76 h停止发酵, 离心收集上清并过滤除菌, 超滤浓缩仪获得浓缩上清液。浓缩上清液经Blue Sepharose柱纯化, 50%的Ⅱ液洗脱除杂, 100%的Ⅱ液洗脱收集。收集的Blue洗脱液再经Phenyl Sepharose柱纯化, 淋洗平衡去除大部分色素和部分杂蛋白, 100%的Ⅲ液直接洗脱。Phenyl Sepharose柱的洗脱液为低盐溶液, 可直接上样于Q Sepharose柱进行纯化, 分别用40%和100%的Ⅳ液进行洗脱。40%的Ⅳ液洗脱液为纯化的最终溶液。发酵罐的发酵上清液、每步纯化收集的样品电泳图(图 4)显示, 样品经三步纯化后, 纯度得到明显的提升。空载的质粒未见目标蛋白的表达(图 4)。最终收集的纯化样品浓度为0.92 g·L-1, 总回收率为24.5%, 批次纯化的参数详见表 3。纯化后的样品经SEC-HPLC检测和SDS-PAGE检测纯度为95.3% (图 5), 可用于后续的生物活性检测。
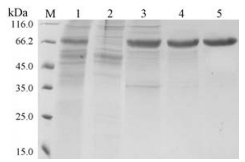
|
Figure 4 Protein purity assessed by SDS-PAGE. M: Protein molecular weight marker; Lanes 1: Supernatant after fermentation by P. pastoris/pPIC9K-FGF23C-tail-HSA; Line 2: Supernatant after fermentation by P. pastoris/pPIC9K (empty plasmid); Lanes 3: Samples after blue sepharose purification; Lanes 4: Samples after phenyl sepharose purification; Lanes 5: Samples after Q sepharose purification |
| Table 3 Purification process for the fusion protein FGF23C-tail-HSA produced by P. pastoris |
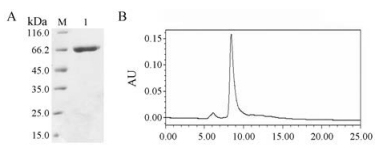
|
Figure 5 Protein purity assessed by HPLC and 12% SDS-PAGE. A: SDS-PAGE of final purified protein; M: Protein molecular weight marker; Lanes 1: Samples of final purified protein. B: HPLC of final purified protein. The purity was 95.3% |
为检测FGF23C-tail-HSA的生物学活性, 以Sprague-Dawley大鼠作为实验动物。设置对照组、FGF23全长蛋白组、FGF23C-tail组和FGF23C-tail-HSA融合蛋白组, 每组5只静脉给药。分别在给药前和给药后3 h取样检测血清中血磷的浓度。结果显示, 给药3 h后, FGF23实验组的血磷浓度从0.644 mg·L-1降低到0.518 mg·L-1, FGF23可以显著地降低血磷的水平。FGF23C-tail-HSA实验组的血磷浓度从0.632 mg·L-1上升到0.764 mg·L-1, 血磷浓度显著地升高, 且与阳性对照组(FGF23C-tail)的趋势一致。空白对照组的大鼠注射同体积生理盐水, 血磷含量几乎没有变化(图 6)。FGF23C-tail作为FGF23的抑制剂, 具有抑制FGF23的功能而提高血磷的作用[6], 本研究设计的新颖融合蛋白FGF23C-tail-HSA也具有抑制FGF23而提高血磷的良好生物活性。
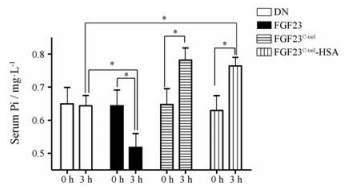
|
Figure 6 Bioactivity of fusion protein in rat. FGF23 or FGF23C-tail-HSA were injected i.v. into Sprague-Dawley rats. Serum parameters were measured and calculated before and 3 h after injection |
磷元素是人体遗传物质核酸的重要组分, 在能量代谢、信号传导、细胞结构组成、离子转运等基本生命过程中都发挥着重要的作用[14]。低磷可引起细胞能量代谢的广泛紊乱、骨骼矿质化不足、肌肉收缩和心肌功能衰退的症状[15, 16]。FGF23作为体内血磷调节激素, 以FGF23作为药物靶点开发血磷调节药物成为越来越多的学者研究的方向[17]。
美国科学院院报的研究报道表明[6], 保留FGF23的C端的73个氨基酸的片段的FGF23C-tail作为拮抗剂抑制FGF23的生物学功能, 从而降低FGF23对患者的血磷调节功能, 对于低磷血症疾病的治疗具有重要的研究价值和应用前景。FGF23C-tail的药物开发, 特别是长效性药物的开发还处于研究初期阶段。目前, 国内尚未见FGF23C-tail长效改造的文献报道, 国外也只有辉瑞公司对FGF23C-tail与Fc抗体片段融合进行长效改造, 改造后FGF23C-tail-Fc可以有效的抑制FGF23的信号传导[8]。本文将FGF23C-tail与HSA融合, 并尝试在毕赤酵母表达系统制备表达, 结果表明FGF23C-tail-HSA具有很好的生物活性, 为FGF23C-tail的长效化改造和应用提供基础。
融合PCR将FGF23C-tail与HSA基因链接为融合基因FGF23C-tail-HSA, 进一步构建表达质粒pPIC9K/FGF23C-tail-HSA。表达质粒电转至毕赤酵母中, 经克隆株的抗性筛选和表达量筛选, 获得一株高产的毕赤酵母表达菌株。在快速检测FGF23C-tail-HSA的产量时, 利用融合蛋白的人血清白蛋白的免疫原性[18], 利用HSA检测试剂盒测定发酵液中HSA的含量来反映融合蛋白的FGF23C-tail-HSA含量, 检测的结果特异性高、可靠性强。毕赤酵母的表达, 需要利用甲醇作为诱导剂诱导外源蛋白的表达。但甲醇作为次级碳源, 需要在初始的甘油消耗完全后加入酵母才会被利用。因此在5 L发酵罐中, 前28 h利用甘油作为C源, 之后利用甲醇作为C源融合蛋白表达。甲醇的添加速度与融氧负反馈相关, 可以降低因甲醇浓度过高导致的对酵母的毒副作用。发酵到76 h时, 融合蛋白的表达量最高, 能达到265.6 mg·L-1。纯化获得高纯度FGF23C-tail-HSA的体内实验显示, FGF23C-tail-HSA具有FGF23抑制剂的功能, FGF23C-tail-HSA实验组的血磷从0.632 mg·L-1上升到0.764 mg·L-1, 能显著地提高大鼠的血磷水平。本文将FGF23C-tail与HSA融合并在毕赤酵母中进行高效表达, 且FGF23C-tail-HSA可以显著地提高大鼠的血磷水平, 这将为FGF23C-tail-HSA生理学活性的深入研究和FGF23抑制剂的药物开发提供基础。
| [1] | Carpenter TO, Imel EA, Holm IA, et al. A clinician's guide to X-linked hypophosphatemia[J]. J Bone Miner Res, 2011, 26: 1381–1388. DOI:10.1002/jbmr.340 |
| [2] | Goldsweig BK, Carpenter TO. Hypophosphatemic rickets:lessons from disrupted FGF23 control of phosphorus homeostasis[J]. Curr Osteoporos Rep, 2015, 13: 88–97. DOI:10.1007/s11914-015-0259-y |
| [3] | Bergwitz C, Juppner H. Regulation of phosphate homeostasis by PTH, vitamin D, and FGF23[J]. Annu Rev Med, 2010, 61: 91–104. DOI:10.1146/annurev.med.051308.111339 |
| [4] | Fajol A, Honisch S, Zhang BB, et al. Fibroblast growth factor (Fgf) 23 gene transcription depends on actin cytoskeleton reorganization[J]. FEBS Lett, 2016, 590: 705–715. |
| [5] | Lindberg I, Pang HW, Stains JP, et al. FGF23 is endogenously phosphorylated in bone cells[J]. J Bone Miner Res, 2015, 30: 431–436. |
| [6] | Goetz R, Nakada Y, Hu MC, et al. Isolated C-terminal tail of FGF23 alleviates hypophosphatemia by inhibiting FGF23-FGFR-Klotho complex formation[J]. Proc Natl Acad Sci U S A, 2010, 107: 407–412. |
| [7] | Zhang X, Guo K, Xia F, et al. FGF23(C-tail) improves diabetic nephropathy by attenuating renal fibrosis and inflammation[J]. BMC Biotechnol, 2018, 18: 33. DOI:10.1186/s12896-018-0449-7 |
| [8] | Johnson K, Levine K, Sergi J, et al. Therapeutic effects of FGF23 C-tail Fc in a murine preclinical model of X-linked hypophosphatemia via the selective modulation of phosphate reabsorption[J]. J Bone Miner Res, 2017, 32: 2062–2073. DOI:10.1002/jbmr.3197 |
| [9] | Ruan C, Liu L, Lu Y, et al. Substance P-modified human serum albumin nanoparticles loaded with paclitaxel for targeted therapy of glioma[J]. Acta Pharm Sin B, 2018, 8: 85–96. DOI:10.1016/j.apsb.2017.09.008 |
| [10] | Tanaka R, Watanabe H, Kodama A, et al. Long-acting human serum albumin-thioredoxin fusion protein suppresses bleomycin-induced pulmonary fibrosis progression[J]. J Pharm Exp Ther, 2013, 345: 271–283. DOI:10.1124/jpet.112.201814 |
| [11] | Wang JH, Hung WP, Tsai SH. High efficiency transformation by electroporation of Yarrowia lipolytica[J]. J Microbiol, 2011, 49: 469–472. DOI:10.1007/s12275-011-0433-6 |
| [12] | Qian K, Lei JS, Guan B, et al. Expression and quality control of the recombinant human serum albumin and interferon-alpha2b fusion protein in Pichia pastoris[J]. J Food Sci Biotechnol (食品与生物技术学报), 2012, 31: 1269–1274. |
| [13] | Laemmli UK, Zhao K, Hart C, et al. Chromosomal structural loops and functional domains-sars and boundary elements[J]. J Cell Biochem, 1995: 121–121. |
| [14] | Masuda Y, Ohta H, Morita Y, et al. Expression of FGF23 in activated dendritic cells and macrophages in response to immunological stimuli in mice[J]. Biol Pharm Bull, 2015, 38: 687–693. DOI:10.1248/bpb.b14-00276 |
| [15] | Dounousi E, Torino C, Pizzini P, et al. Intact FGF23 and -klotho during acute inflammation/sepsis in CKD patients[J]. Eur J Clin Invest, 2016, 46: 234–241. |
| [16] | Zhu PJ, Hou XB, Fang H. Progress of lymphoid-specific tyrosine phosphatase inhibitors[J]. Acta Pharm Sin (药学学报), 2017, 52: 699–705. |
| [17] | Spichtig D, Zhang H, Mohebbi N, et al. Renal expression of FGF23 and peripheral resistance to elevated FGF23 in rodent models of polycystic kidney disease[J]. Kidney Int, 2014, 85: 1340–1350. DOI:10.1038/ki.2013.526 |
| [18] | Qian K, Gong XH, Guan B, et al. Efficient expression of glucagon-like peptide-1 analogue with human serum albumin fusion protein in Pichia pastoris using the glyceraldehyde-3-phosphate dehydrogenase promoter[J]. Biotechnol Bioproc E, 2015, 20: 694–700. DOI:10.1007/s12257-014-0818-6 |
 2019, Vol. 54
2019, Vol. 54


