甘草(Glycyrrhiza uralensis)属于豆科甘草属多年生草本植物, 是最常用大宗药材, 具有补脾益气、清热解毒、祛痰止咳的功效[1], 主要道地产区分布在宁夏、甘肃、内蒙古, 新疆等地[2]。而不同产地甘草药材的品质有差异, 外部环境因子如产地气候、土壤等可能是造成产地差异性的因素[3]。近年来, 关于甘草内生真菌的研究逐渐引起了人们的重视。内生真菌(endophytic fungi)是指那些在其生活史中的某段时期生活在植物组织内, 对植物组织没有引起病害症状的真菌[4]。相关研究表明, 从甘草内生真菌发酵提取物中检测到与宿主相同的有效成分, 如甘草酸、甘草苷、异甘草苷、甘草次酸、甘草素[5-9]。可见, 从甘草中分离内生真菌, 筛选具有活性的内生真菌及其天然产物作为药用植物替代资源的研究对于解决我国甘草野生资源匮乏具有重要的意义。由于同一种植物生长在不同的环境, 其内生菌的多样性及生物活性都有所不同[10]。此外, 前人对甘草内生真菌的研究多集中于内生真菌的抑菌作用[11, 12]、抗氧化性[13, 14]、次生代谢产物方面[15, 16]。而对其内生真菌的多样性研究较少, 且分离内生真菌所用的甘草只来源于一个产地, 分离出来的菌株大部分只鉴定到属, 缺乏不同产地甘草内生真菌多样性的研究[17, 18]。鉴于此, 本研究将首次展开对不同产地甘草内生真菌进行多样性研究。
在植物内生真菌分离过程中, 表面灭菌条件是内生真菌分离关键因素, 表面灭菌条件掌握不当, 会造成表生真菌混入或部分内生真菌被杀死, 且未发现前人对于甘草表面灭菌方法进行过重点优化。因此, 本实验将在研究不同产地甘草内生真菌过程中, 同时对其内生真菌分离方法进行重点研究, 旨在为正确分离研究植物内生真菌提供依据。
材料与方法植物样本 分别采集甘肃(临夏县榆林乡、武威市民勤县、兰州榆中县、白银市景泰县)、宁夏(吴忠市盐池县)、内蒙古(赤峰市、鄂尔多斯)、新疆(库尔勒市、图木舒克市)、北京(望京药园、良乡药园)等几个产地的新鲜健康乌拉尔甘草(无病斑伤口或腐烂), 取甘草根部于自封袋中, 4 ℃冰箱保藏。分离实验在采集后48 h以内完成。经北京中医药大学刘春生教授鉴定为乌拉尔甘草。
甘草内生真菌表面灭菌条件优化 取3年生甘草的根(取材于甘肃省白银市景泰县), 自来水冲洗干净晾干置超净台, 用75%的酒精浸泡1 min, 无菌水冲洗3次, 0.5%、2%、5%等3个浓度次氯酸钠溶液分别浸泡0.5、3、5和10 min, 以无菌水冲洗3次为对照。用无菌刀切成0.5 cm×0.5 cm的小块, 分别置于PDA培养基表面, 28 ℃恒温培养7天。实验共12组, 每组设3个平行, 各组灭菌条件见表 1。检验表面灭菌效果[18]采用漂洗液检测和组织印迹法检测, 记录不同表面灭菌条件下的甘草根的内生真菌分离效果。
| Table 1 Different test group numbers |
不同产地内生真菌分离、纯化 采集甘肃、宁夏、内蒙、新疆、北京等5个省市不同产地的甘草, 分离纯化培养同上优化的最佳条件。
内生真菌的形态显微鉴定 根据菌落在PDA培养基上不同阶段生长的菌落形态、颜色、菌体延伸及生长状况等特征, 依据《真菌鉴定手册》[19]和《中国真菌志》[20]并结合分子生物学鉴定结果最终确定真菌类群。
内生真菌的分子鉴定 菌种的分子鉴定采用ITS通用引物[21], 用MEGA 4构建分子进化树, 采用Neighbor Joining法的CompleteDeletion模式建树, Bootstrap进行检验, 并重复1 000次。ITS1 (5'-AGAA GTCGTAACAAGGTTTC-3'), ITS4 (5'-TCCTCCGCT TATTGATATGC-3') (由上海生工生物工程有限公司合成)。PCR反应条件: 94 ℃预变性5 min; 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 30个循环; 72 ℃后延伸5 min。PCR扩增产物经1%的琼脂糖胶电泳检测后送至生工生物工程(上海)股份有限公司进行测序。
数据分析 为了评价甘草样品中优势类内生真菌组成、内生真菌的丰富程度和每个样品受多重侵染的发生频率。分别统计内生真菌的分离率(isolation rate, IR)、定殖率(colonization rate, CR)、相对分离频率(IF)、相对频率(relative frequency, RF)、Shannon-Wiener指数(H ')和相似性系数(Cs)。
分离率(IR) 是指从样本组织块中得到的菌株数与全部样本组织块数的比值。分离率(%) = (组织块中得到的菌株数/实验供试的总组织块数)×100%。用于衡量植物组织中内生真菌的丰富程度。
定殖率(CR) 指样本中受内生真菌侵染的组织块数占全部样本组织块数的百分数。定殖率(%) = (有内生真菌侵染的组织块数/实验供试的总组织块数)×100%。
相对频率(RF) 是指样本中分离到的某种内生真菌的菌株数占分离到总菌株数的百分数。相对分离频率(%) = (样本中分到的某种内生真菌的菌株数/分到的总菌株数)×100%, 用于比较和判断优势菌群。
Shannon-Wiener指数(H') 用于比较不同组间内生真菌群落的多样性分析, 不能单独说明某个群落生物多样性的高低。公式H' = -∑(Pi)(lnPi), Pi是指某种内生真菌的菌株数占全部内生真菌菌株数的百分数。计算公式表明指数数值越大, 表示多样性越高, 群落的复杂程度越高。
Sorenson相似性系数(Cs) 比较不同采样地之间内生真菌群落组成的相似程度。计算公式为: Cs = 2j/(a+b)。其中, 公式中的j为两组共有的内生真菌种类数, a表示为一组中分离到的内生真菌种类数, b表示为另一个采样地中分离到的内生真菌种类数[22]。
以上数值的计算, 利用Microsoft Office Excel 2010编程实现。
结果与分析 1 甘草内生真菌表面灭菌条件优化通过对不同浓度次氯酸钠(3个梯度浓度)及其不同浸泡时间(4个时间梯度)来考察甘草根表面灭菌效果(分组见表 1), 实验结果是漂洗液检测法和组织印迹检测法的培养基中皆未出现杂菌污染的只有M3、M4、H3、H4实验组(表 2)。
| Table 2 The sterilizing effect of different surface sterilization conditions. A: Method represents the rinse solution test; B: Method represents the tissue imprinting test; -: Means no foreign bacteria; +: Means the presence of foreign bacteria |
由于次氯酸钠的杀菌消毒能力有渗透性, 对植物内部的微生物亦有减低活性甚至杀灭的作用, 有效氯含量越高, 浸泡时间越长, 次氯酸钠溶液容易损伤内生真菌的活性, 使内生真菌的分离和体外培养更加困难[23]。因此同时考察次氯酸钠消毒剂的浓度及时间对甘草根的内生真菌分离效果的影响。在记录和分析PDA培养基上内生真菌菌株的数目时, 表面灭菌不彻底的实验组无法区分污染菌和内生真菌, 不列入统计范围。因此, 只对M3、M4、H3、H4实验组统计菌株数目。结果是H3实验组7天后内生真菌数量最多(8株), 培养基上出现菌丝时间最早(第3天) (图 1)。
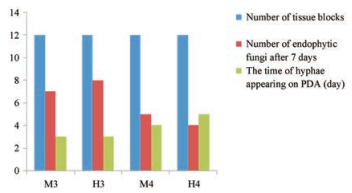
|
Figure 1 The growth of endophytic fungi |
综上, H3实验组即次氯酸钠溶液浓度为5%、灭菌时间5 min为最优表面灭菌条件, 即甘草内生真菌最佳分离方法为在75%乙醇中浸泡1 min, 无菌水冲洗3次; 5%次氯酸钠溶液浸泡5 min, 再用无菌水冲洗3次; 用75%乙醇漂洗30 s, 无菌水冲洗3次, 最后, 用无菌滤纸吸干表面水分, 备用。
2 不同产地内生真菌分离、纯化 2.1 不同产区的内生真菌的分离率和定殖率本研究从甘肃、宁夏、内蒙、新疆、北京5个地区的129株乌拉尔甘草中共分离得到438株内生真菌, 分别分离到内生真菌96株、141株、76株、76株、49株。不同产地甘草内生真菌的分离率和定殖率存在差异, 分离率依次为宁夏(85.5%) > 甘肃(63.2%) > 新疆(62.8%) > 内蒙(55.5%) > 北京(37.4%); 定殖率依次为宁夏(80.0%) > 甘肃(61.2%) > 新疆(56.2%) > 内蒙(53.3%) > 北京(36.6%)。研究结果显示不同产地甘草内生真菌的分离率和定殖率走势一致且具有差异性, 宁夏的分离率和定殖率都最高, 北京的分离率和定殖率都最低(图 2)。
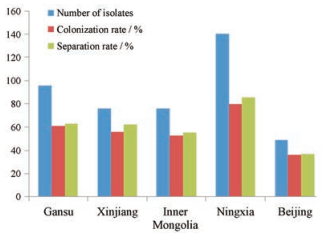
|
Figure 2 The isolation rate and colonization rate of endophytic fungi from different producing areas |
组织分离法分离、纯化得到438株甘草的内生真菌, 经分子生物学和形态显微学鉴定最终可归为5目7属10种, 一株内生真菌(Clonostachys rosea粉红粘帚菌)形态显微图如图 3。其中Clonostachys rosea粉红粘帚菌、Neocosmospora新赤壳属、Glomerales球囊霉目、Naganishia albida等4个分类单元首次在中国地区的甘草中被分离出来。鉴定到种的有11种: Clonostachys rosea粉红粘帚菌、Aspergillus niger黑曲霉、Aspergillus fumigatus烟曲霉、Aspergillus nidulans构巢曲霉、Aspergillus awamori泡盛曲霉、Aspergillus tubingensis塔宾曲霉、Penicillium polonicum波兰青霉、Fusarium solani腐皮镰刀菌、Fusarium oxysporum尖孢镰刀菌、Fusarium subglutinans顶腐病菌、Alternaria alternata链格孢菌, 分别为Aspergillus曲霉属、Penicillium青霉属、Fusarium镰孢菌属及Alternaria链格孢属。其中镰孢菌属、曲霉属分离的相对频率分别为25.80%、16.89%, 为优势菌属(图 4)。

|
Figure 3 A: Front view of the PDA of Clonostachys rosea; B: Rear view of PDA of Clonostachys rosea; C-E: Micrograph of Clonostachys rosea |
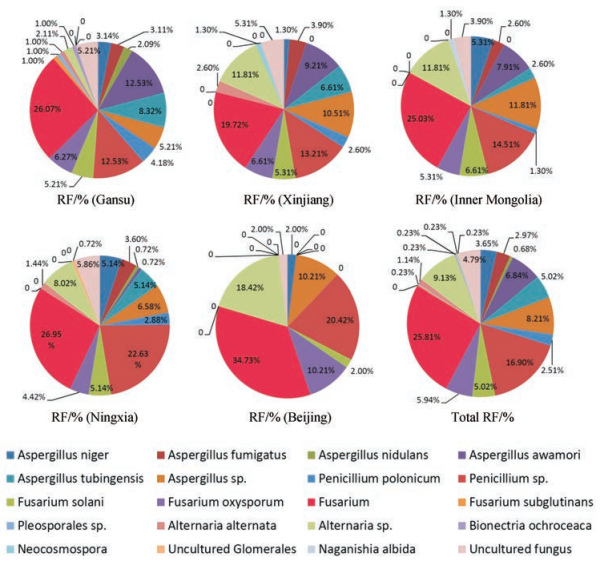
|
Figure 4 Relative frequency of different strains in different producing areas. -: Indicating no; The total relative separation frequency refers to the percentage of the total number of bacteria and the total number of bacteria in 5 producing areas |
不同产地甘草内生真菌群落组成也各不相同。甘肃产地的96株甘草内生真菌归属于17个种属, 其中以镰孢属和曲霉属为优势菌属, 分别占菌株总数的38.55%和34.40%;新疆产地的76株内生真菌隶属于14个种属, 其中以镰孢属和曲霉属为优势类群, 分别占菌株总数的31.64%和31.53%;内蒙产地的76株内生真菌隶属于13个种属, 其中以镰孢属和曲霉属为优势类群, 分别占菌株总数的36.95%和30.23%;宁夏产地的141株内生真菌隶属于15个种属, 以镰孢属为优势菌, 占菌株总数的36.51%;北京产地的49株内生真菌隶属于8个种属, 优势菌为镰孢属真菌, 占菌株总数的46.94%。
综上, 镰孢属、曲霉属为优势菌属, 但各产地之间优势属真菌并不完全相同。甘肃、新疆和内蒙古都以镰孢属和曲霉属为优势菌属, 而宁夏和北京是以镰孢属为优势菌属(图 4)。
3 不同产区甘草内生真菌的多样性和相似性系数Shannon-Wiener多样性指数(H')和Sorenson相似性系数分析结果见表 3所示, 5个产区甘草内生真菌的多样性指数较高, 分布在1.7~4.81之间, 大小顺序为甘肃(4.81) > 新疆(2.40) > 宁夏(2.19) > 内蒙(2.10) > 北京(1.70), 即甘肃的甘草内生真菌多样性指数最高(4.81), 北京的内生真菌多样性指数最低(1.7)。不同产区的甘草内生真菌的相似性系数见表 3, 其中宁夏与新疆的相似性系数最高(0.83), 甘肃与北京的相似性系数最低(0.56)。综上说明不同产地甘草内生真菌的种群结构差异较大, 多样性不一。
| Table 3 The Shannon-Wiener and similarity coefficient of endophytic fungi in Glycyrrhiza uralensis in different producing areas |
本研究目的是考察不同产地甘草内生真菌多样性, 在借鉴前人对甘草内生真菌分离方法的基础上, 根据甘草材料的组织致密度并结合表面消毒有效性确立了分离甘草内生真菌的最佳操作方法。结果显示次氯酸钠溶液浓度为5%、灭菌时间5 min为最优表面灭菌条件, 甘草表面灭菌效果最好。而Li等[24]分离乌拉尔甘草表面灭菌条件是次氯酸钠溶液浓度为2.5%、灭菌时间5 min, 分离出26株内生真菌。Bai等[25]用2% NaClO漂洗15 min分离甘草内生真菌46株。Wu等[16]用2%次氯酸钠浸泡甘草3 min分离出83株内生真菌。Chen等[26]考察3种不同浓度NaClO消毒处理方法对水稻内生真菌分离影响, 结果发现有效氯为1%的NaClO处理组中真菌分离数量偏少, 有效氯为2.5%的NaClO处理组中真菌种类较多, 而有效氯为5%的NaClO处理组中几乎没有真菌生长。由此可见, 植物组织表面消毒方法不同, 分离菌株数量差异性较大, 分离植物体内生真菌有必要先优化其表面灭菌条件。此外本实验对甘草内生真菌分离条件的研究主要是优化甘草表面灭菌的条件, 未对分离的内生真菌的培养条件进行优化。有研究报道, 对于一种植物而言, 仅可分离培养的内生真菌和/或细菌就可以多达数十种甚至数百种, 90%左右的内生菌至今还不可培养[27]。因此, 对于甘草内生真菌分离培养条件的优化有待进一步研究。
本研究从甘肃、宁夏、内蒙、新疆、北京5个地区的129株乌拉尔甘草中共分离得到438株内生真菌, 经分子生物学和形态显微学鉴定最终可归为5目7属11种(见2.2)。Yang等[28]从乌拉尔甘草中分离出2株曲霉属内生真菌。Wang等[29]从甘肃乌拉尔甘草中共分离出16株内生真菌, 归8个属, 分别为毛霉属、镰刀菌属、曲霉属、长蠕孢霉属、头孢霉属、青霉属、束梗孢属、木霉属。Wu等[30]从黑龙江乌拉尔甘草中分离出46株内生真菌, 分属于4个目、5个科、13个属, 分别为曲霉属、青霉属、粉孢属、丝梗孢属、头孢属、轮枝孢属、木霉属、葡萄孢属、长蠕孢属、链格孢属、棒束孢属、镰孢属、毛霉属。Wang等[18]从内蒙古乌拉尔甘草中分离出37株内生真菌, 分属于2目、3科、6属, 分别属于镰孢霉属、青霉属、拟青霉属、曲霉属、链格孢属、木霉属。Liu等[31]从宁夏乌拉尔甘草中分离出136株内生真菌, 分类为2纲4科6属, 黑葱花霉属、根霉、镰孢霉属、链格孢属、曲霉属和青霉属。Bai等[25]从黑龙江甘草植株中分离到了46株内生真菌, 除四株因不产孢未鉴定外, 分别属于4目、5科、13属, 分别为青霉属、曲霉属、镰孢属、轮枝孢属、棒束孢属、长蠕孢属、头孢属、丛梗孢属、葡萄孢属、木霉属。
综上, 前人所研究的乌拉尔甘草内生真菌皆来源于一个产地的甘草, 且大部分只鉴定到属。与前人所分离的乌拉尔甘草内生真菌进行比较, 本研究新分出Clonostachys rosea粉红粘帚菌、Neocosmospora新赤壳属、Glomerales球囊霉目、Naganishia albida等4个分类单元。其中Clonostachys rosea粉红粘帚菌特点是:无光照条件下白色, 分生孢子梗呈帚状分支, 分生孢子长椭圆形, 与《云南森林高等微真菌》[32]描述相符(图 3)。
本研究对甘肃、新疆、内蒙、宁夏及北京5个产地的甘草内生真菌进行分离研究。研究结果显示5个产区分离率、定殖率、分离频率、多样性指数具有差异性, 但道地产区甘草内生真菌的分离率、定殖率、多样性指数分别都比非道地产区北京高。此外5个道地产区之间的相似性系数(Cs)都比道地和非道地产区之间Cs高。综上, 笔者推测甘草内生真菌与甘草道地性有密切联系。Guo等[33]认为内生真菌是道地药材在特定区域分布的重要原因之一, 是道地药材与非道地药材品质差异的一个重要原因。Yu等[34]对不同产地仙鹤草中内生真菌的种类和分布进行比较, 发现以浙江产的仙鹤草内生真菌的种类最丰富, 而浙江产仙鹤草为道地药材, 药用品质最佳。道地产区川芎的内生真菌多样性较非道地产区更丰富, 且菌群结构更加稳定[35]。Ning等[22]认为植物内生真菌能够影响中药材的道地性, 能够提高药用植物对某些次级代谢产物的累积。对于中药的道地性, 人们在探索其形成机制方面做了大量的工作, 传统观点认为道地药材是植物基因型和环境相互作用的产物。但多集中于特定的地理因素或气候因素等植物外环境的作用, 很少从药用植物内环境方面进行考虑, 而内生菌则是植物内环境的重要组成部分[16, 36]。因此, 研究甘草的道地性, 甘草内生真菌方面值得进一步研究。
| [1] | State Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (Part 1) (中华人民共和国药典(一部))[M]. Beijing: China Medical Science Press, 2015. |
| [2] | Zhang XD, Zhou W, Yin YC, et al. Correlation analysis between glycosides CHS gene polymorphism and glycyrrhizin content[J]. Acta Pharm Sin (药学学报), 2018, 53: 646–658. |
| [3] | Yang H, Jia GL, Liu ZY, et al. Study on correlation between the main active ingredient of different habitats of licorice and environmental factors[J]. J Qingdao Agric Univ (Nat Sci) (青岛农业大学学报(自然科学版)), 2013, 30: 289–294. |
| [4] | Zulehumar W, Zhu J, Li XJ, et al. Research on relation between different cropping systems and soil microecology of licorice[J]. Mod Chin Med (中国现代中药), 2016, 18: 1474–1478. |
| [5] | Li YB, Zhang Q. Optimization of fermentation technology for flavonoids-producing endophytic fungus YF-A of licorice[J]. Food Sci Technol (食品科技), 2016, 41: 25–30. |
| [6] | Xu HC, Sun TY, Zhai LX, et al. Identification of glycyrrhetinic acid-producing endophytic fungus RE7 from Glycyrrhiza uralensis and its antibacterial activity[J]. Chin J New Drugs (中国新药杂志), 2016, 25: 102–105. |
| [7] | Wang HX, Li YL. Isolation of an glycyrrhizic acid-producing andophytic fungus from licorice and analysis of metabolites[J]. Hubei Agric Sci (湖北农业科学), 2011, 50: 2841–2843. |
| [8] | Li W, Bai CS, Zheng X, et al. Study on identification of liquiritin-producing endophytic fungus HGE5 from Glycyrrhiza uralensis and its antibacterial activity[J]. J Anhui Agric Sci (安徽农业科学), 2017, 45: 100–102. |
| [9] | Li WJ, Zheng SH, Mao PH, et al. Isolation of endophyte from Glycyrrhiza inflata Batalin of Xinjiang Uygur Autonomous region and screening of glycyrrhizic acid -producing strain[J]. Biotechnology (生物技术), 2008, 18: 28–31. |
| [10] | Southcott KA, Johnson JA. Isolation of endophytes from two species of palm, from Bermuda[J]. Can J Microbiol, 1997, 43: 789–792. DOI:10.1139/m97-113 |
| [11] | Bi JT, Wang XX, Chen WM, et al. Isolation of endophytic fungi from medicinal plant Glycyrrhiza uralensis and its microbial inhibition activity[J]. Pratacult Sci (草业科学), 2013, 30: 357–364. |
| [12] | Zhao N. Comparative Study on Antimicrobial Activity Between the Gansu Wild and Cultivated Licoce Endophyte Fermentation Product and the Host Plant and Its Medicinal Ingredient (甘肃野生与栽培甘草内生菌有效菌株发酵物与宿主及药效成分抑菌活性对比研究)[D]. Lanzhou: Gansu University of Chinese Medicine, 2016. |
| [13] | Yu HN, Yao Z, Gao Y, et al. Screening and identification of antioxidative endophytic strains in Glycyrrhiza uralensis[J]. J Zhejiang Univ Technol (浙江工业大学学报), 2014, 42: 63–66. |
| [14] | Gao XJ, Wu XL, Wu YL, et al. Separation of licorice flavonoids-producing salt-resistant endophytic fungi from wild Glycyrrhiza uralensis Fisch living in Ningxia district[J]. Nat Prod Res Devel (天然产物研究与开发), 2016, 28: 1549–1556. |
| [15] | Deng Y, Wang Y, Ding RW, et al. Preliminary study on antimicrobial activity of secondary metabolites of endophytic fungi from Gansu Glycyrrhiza uralensis[J]. J Chin Med Mater (中药材), 2013, 36: 181–184. |
| [16] | Wu YL. Studies of Salt-tolerance Endophytic Fungi on Its Isolation from Glycyrrhiza uralensis Fisch, Its Anti-oxidation Activitity and the Secondary Metabolites (甘草耐盐内生真菌分离、抗氧化活性及次生代谢物研究)[D]. Yinchuan: Ningxia Medical University, 2014. |
| [17] | Deng Y, Wang Y, Ding RW, et al. Identification and separation of endophytes in wild and cultivated Glycyrrhiza uralensis from Gansu Province[J]. West J Tradit Chin Med (西部中医药), 2012, 25: 8–11. |
| [18] | Wang HX. Separation and Fermentation Cultivation of Endophytic Fungi Producing Glycyrrhizic Acid from Ordos Plateau Licorice (鄂尔多斯高原甘草中产甘草酸内生真菌的分离与发酵培养)[D]. Huhhot: Inner Mongolia University of Science and Technology, 2011. |
| [19] | Wei JC. Fungal Identification Manual (真菌鉴定手册)[M]. Shanghai: Shanghai science and Technology Press, 1979. |
| [20] | Qi ZT. Consilio Florarum Cryptogamarum Sinicarum Academiae Sinicae Edita. Flora Fungorum Sinicorum Vol. 5 Aspergillus et Teleomorphi Cognati (中国真菌志第五卷曲霉属及其相关有性型)[M]. Beijing: Science Press, 1997. |
| [21] | Wu YZ, Li R, Qiu BL, et al. Chemical constituents from Fusarium redolens, the endophytic fungus from Edgeworthia chrysantha[J]. Acta Pharm Sin (药学学报), 2017, 52: 598–602. |
| [22] | Ning Y, Li YL, Li Y, et al. Diversity of endophytic fungi from the stem and leaf of Sinopodophyllum hexandrum (Royle) Ying[J]. Acta Ecol Sin (生态学报), 2017, 37: 5157–5166. |
| [23] | Cao DD, Lu H, Zhao BY, et al. The species distribution characteristics of endophyte in Astragalus variabilis[J]. Acta Vet Zoot Sin (畜牧兽医学报), 2014, 45: 2057–2066. |
| [24] | Li YB, Zhang Q. Isolation of Licorice endophytic fungi and screening of flavones-producing strains[J]. Tianjin Agric Sci (天津农业科学), 2012, 18: 15–18. |
| [25] | Bai CS. Endophytic Fungi and Their Active Metabolites in Glycyrrhiza uralensis (甘草内生真菌及其活性代谢物研究)[D]. Harbin: Heilongjiang University, 2010. |
| [26] | Chen YH. Isolation and Identification of Endophytic Fungi within Allelopathic Rice and Its Biological Characteristics Testing (化感水稻内生真菌的分离鉴定及生物学特性研究)[D]. Hefei: Anhui Agricultural University, 2016. |
| [27] | Chen QQ, Liu B, Guan X, et al. Analysis of anoectochilus roxburghii root microbial diversity by metagenomic technology[J]. J Agric Biotechnol (农业生物技术学报), 2014, 22: 1441–1446. |
| [28] | Yang ZJ, Deng Y, Yang XJ, et al. Identification and determination of total flavonoids and total saponins contens in Endophytes from Glycyrrhiza Uralensis[J]. Pharm J Chin PLA (解放军药学学报), 2018, 34: 337–340. |
| [29] | Wang L. Isolation and Bioactivity of Endophytic Fungi from Glycyrrhiza Uralensis and Angelica sinensis (甘草、当归内生真菌分离及其生物活性的研究)[D]. Lanzhou: Lanzhou University of Technology, 2018. |
| [30] | Wu T, Bai CS, Tan JY, et al. Study on isolation of endophytic fungi from Glycyrrhiza uralensis Fisch. and their antimicrobial activity[J]. J Chin Inst Food Sci Technol (中国食品学报), 2014, 14: 154–160. |
| [31] | Liu JL, Cao JM, Ma WP. Identification of endophytes from Glycyrrhiza uralensis in Ningxia and screening of antagonism against pathogens of post-harvest muskmelon[J]. Agric Res Arid Areas (干旱地区农业究), 2011, 29: 252–256. |
| [32] | Zhao GC, Zhao RL. The Higher Microfungi from Forests of Yunnan Province (云南森林高等微真菌)[M]. Kunming: Yunnan Science and Technology Press, 2012. |
| [33] | Li B, Li Q, Guo SX, et al. Effect of endophytic fungi on modernization of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 14–19. |
| [34] | Yu HN, Yao Z, Shen SL, et al. Distribution of endophytic fungi in Agrimonia pilosa Ledeb from different areas and screening of active strains[J]. J Zhejiang Univ Technol (浙江工业大学学报), 2013, 41: 260–264. |
| [35] | Wang H, Yan ZY, He DM, et al. Analysis of endophytic fungi community of Ligusticum chuanxiong using PCR-DGGE[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 1893–1897. |
| [36] | Cui JL, Guo SX, Xiao PG. Interaction between endophytes and host plant and the role of endophytes in genuineness analysis of medicinal plant[J]. Acta Pharm Sin (药学学报), 2017, 52: 214–221. |
 2019, Vol. 54
2019, Vol. 54


