2. 江西中医药大学现代中药制剂教育部重点实验室, 江西 南昌 330028;
3. 中药固体制剂制造技术国家工程研究中心, 江西 南昌 330004
2. Key Laboratory of Modern Preparation of TCM, Ministry of Education, Jiangxi University of Traditional Chinese Medicine, Nanchang 330028, China;
3. National Pharmaceutical Engineering Center for Solid Preparation in Chinese Herbal Medicine, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
银纳米粒(AgNPs)已经广泛被人们使用, 如感光材料[1]、装饰材料、催化材料、抗菌材料[2-4]及医用材料等。目前其制备方法很多, 形态多样如球状、管状和棒状等[5-7]。随着AgNPs在杀菌方面的优势日益突出, 不少研究小组开始研究其在抗肿瘤细胞方面的可能。
石墨烯量子点(GQDs)是由石墨烯延伸而来的一种新型材料。利用GQDs的光致发光性质, 改变GQDs的粒径, 会使它导带和价带之间的能级间隙改变, 这一特性直接影响GQDs的发射波长随粒径的改变而变化[8], 如果能够准确将GQDs运送到肿瘤部位, 利用其光致发光这一重要特性, 在外界光源作用下, 使其在肿瘤部位发光, 能够指示病灶组织, 引导手术成功进行[9-11]。靶向制剂是指在制剂表面修饰靶向配体或抗体, 根据肿瘤表面一些特异性受体, 使其能够较为精确地将药物或杀灭肿瘤细胞材料运送到肿瘤组织内部。
cRGD是一种含有精氨酸-甘氨酸-天冬氨酸(RGD)序列的环肽, 首先RGD特异性作用在肿瘤细胞表面或肿瘤血管内皮细胞表面的αvβ3整合素受体表面, 然后细胞表面的特异性蛋白水解酶将cRGD断开, 形成了激活的CendR特异性识别并激活细胞表面neuropilin-1受体, 在该受体的作用下实现靶向穿膜[12], 将聚乙二醇(PEG)作为一种长循环运输包衣, 在PEG外部修饰cRGD, 利用二硬脂酰基磷脂酰乙醇胺-聚乙二醇-环肽(DSPE-PEG2000-cRGD)耦联功能性纳米材料, 使其不仅能够在体内保持长循环特性, 而且在这过程中最大程度地将纳米材料运送到肿瘤部位[13, 14]。为实现药物在肿瘤部位的深部输送, Cabral等[15]研究了粒径与肿瘤组织渗透性之间的关系, 结果显示, 小于50 nm的载体对于贫供血肿瘤有较好的组织渗透性, 所有聚合物胶束(粒径30、50、70和100 nm)均可穿透小鼠的高度可渗透性肿瘤组织, 但只有30 nm胶束可以渗透胰腺肿瘤以达到抗肿瘤作用。在本文中, 构建了一个以无机纳米银材料作为内部核心, 利用GQDs的荧光定位功能, 加以外部修饰磷脂1, 2-二油烯氧基-3-三甲氨基丙烷(DOTAP)和DSPE-PEG2000-cRGD两种磷脂材料的、粒径小于50 nm的既能够靶向到肿瘤组织, 又能在体内实现长循环的一种新型纳米制剂, 以期实现“诊疗一体化”。
材料与方法材料和仪器 SH-DNA (5'-SHGGAGTTGGGGA GGAGG-3')巯基连接的ssDNA (上海生工生物工程有限公司); 氨基化GQDs (南京先锋纳米有限公司); 三(2-羧乙基)膦(TCEP, Sigma公司)。DOTAP、DSPE-PEG2000-cRGD (上海艾维特医药科技有限公司); 人宫颈癌细胞系HeLa获自中国科学院细胞库; 硝酸银、柠檬酸钠(国药集团化学试剂有限公司); 硼氢化钠(广东光华化学厂有限公司); 浓盐酸(西陇科学股份有限公司); 磷酸盐缓冲液(PBS, 索莱宝生物科技有限公司); 胎牛血清(美国Gibco公司); 含双抗的高糖培养基(DMEM)、胰蛋白酶-EDTA消化液(0.25%, 北京索莱宝科技有限公司); L-多聚赖氨酸包被细胞爬片(大连靓宜生物科技有限公司); 细胞膜红色荧光探针(DiI, 上海碧云天生物技术有限公司); 4%多聚甲醛固定液(阿拉丁生化科技股份有限公司); 再生纤维素透析袋(截留分子质量10 000 Da, 上海源叶生物有限公司); 去离子水(Milli-Q Integral 5超纯水机); 50 nm过滤器(德国赛多利斯集团); 其他试剂均购自国药集团化学试剂有限公司。
透射电子显微镜TEM (JEM2100, 日本电子株式会社); HC-3018R高速冷冻离心机(安徽中科中佳科学仪器有限公司); CO2细胞培养箱(美国Thermo Scientific公司); SpectraMax®i3酶标仪(美谷分子仪器上海有限公司); PB-21pH计(赛多利斯科学仪器北京有限公司); Eclipse Ni-U正置荧光显微镜(日本尼康公司); Zetasizer Nano ZS ZEN3690 (英国Malvern公司), UV-2550紫外/可见分光光度计(日本岛津公司); DF-101S集热式恒温加热磁力搅拌器(河南巩义予华仪器有限责任公司); FLS 980稳态瞬态荧光光谱仪(爱丁堡仪器有限公司)。
ADG-DDPC的制备 本文根据文献[16]报道的方法, 采用化学还原法, 利用硼氢化钠将银原子还原得到单质态的银纳米粒水溶液来获得实验所需的银纳米粒。经过预实验, 首先取3.3 mmol·L-1柠檬酸钠水溶液30 mL和6.6 mmol·L-1硼氢化钠水溶液90 mL, 冰浴条件下混合均匀。再取3.3 mmol·L-1硝酸银滴加到上述混合液中, 滴加过程保持冰浴及用力搅拌。反应结束后, 移至暗处过夜, 存放在4 ℃冰箱中保存备用。为构建AgNP-DNA-GQDs (ADG), 首先将序列为5'-SHGGAGTTGGGGAGGAGG-3'的ssDNA进行巯基的活化。取10 mmol·L-1 TCEP和100 μmol·L-1 ssDNA各20 μL, 在pH 6的BR缓冲液中孵育1 h。ssDNA加入到6 mL制备好的AgNPs中孵育5 min。再加入一定体积的pH 3柠檬酸三钠-盐酸缓冲液继续孵育5 min (每1 μL缓冲液加AgNP 100 μL), 并再次加入等体积pH 3柠檬酸三钠-盐酸缓冲液孵育20 min, 加入3倍体积量的BR缓冲液, 12 000 r·min-1离心20 min, 再用4~5倍BR缓冲液洗, 去除多余DNA, 然后AgNP-DNA重新分散在5 mL BR缓冲液中备用。取5 mL AgNP-DNA加入1 mg·mL-1 GQDs 1 mL中, 室温孵育2 h, 用截留分子质量为10 000Da的透析袋透析6 h, 将未吸附的GQDs除去, 备用。精密称取DOTAP 9.6 mg、DSPE-PEG2000-cRGD 2.4 mg于2 mL甲醇中溶解, 取不对称磷脂200 μL, 缓慢注入到上述制备好的ADG中, 在40 ℃水浴中孵育约30 min, 在此期间进行缓慢地摇晃, 待磷脂吸附于ADG内核表面后, 取2 mL于透析管中透析8 h以上, 保证有机相甲醇被完全透析出去。将制备好的磷脂复合物在50 nm过滤装置下过滤, 确保得到的磷脂复合物粒径在50 nm以下, 制得ADG-DDPC纳米制剂。制备过程示意图如图 1所示。
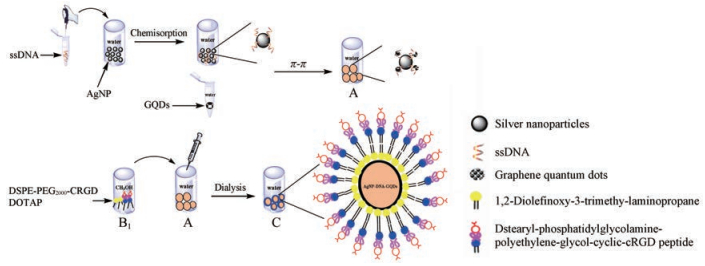
|
Figure 1 Schematic illustration of silver nanoparticles (AgNPs), graphene quantum dots (GQDs). AgNP-DNA-GQDs were the core of the nanoparticles (ADG) (A); 1, 2-dioleoyl-3-trimethy-lammonium-propane (DOTAP) and dstearyl-phosphatidylglycolamine-polyethylene-glycol-cyclic-cRGD peptide (DSPE-PEG2000-cRGD) were dissolved in methanol (B); synthesis of phospholipid-coated silver-graphene quantum dot multifunctional nanoparticles (ADG-DDPC) (C) |
AgNPs、AgNP-DNA及ADG-DDPC的紫外表征 取AgNPs和AgNP-DNA各2 mL于两面透光的比色皿中, 用紫外/可见分光光度计下测其在300~800 nm之间的吸光度。将ADG-DDPC用超纯水稀释至20.43、10.22、5.11和2.56 μg·mL-1, 分别测其吸光度。
ADG、ADG-DDPC的粒径及其稳定性的研究 取ADG-DDPC 1 mL于四面透光的比色皿中, 采用马尔文激光粒度测定仪测定纳米制剂的粒径。经预实验, 将内核ADG、ADG-DDPC放置于避光的4 ℃冰箱, 并取其在各个时间点的粒径大小。
AgNPs、GQDs、AgNP/GQDs、ADG及ADG-DDPC的透射电镜表征 将AgNPs与GQDs按照ADG-DDPC制剂比例进行物理混合后, 制得AgNP/GQDs; 取少量上述各溶液, 滴于覆有碳膜的铜网上, 自然干燥后, 于透射电镜下观察其形貌特征。
ADG-DDPC中的GQDs的释放 取GQDs 2 mL于四面透光比色皿中, 确定其激发波长与发射波长, 根据测得的GQDs最大的激发波长与发射波长, 检测ADG-DDPC在0.2~400 μmol·L-1 H2O2中、于37 ℃避光孵育50 min (模拟肿瘤细胞内较高浓度的H2O2)的荧光光谱。
定量AgNPs、ADG-DDPC中的银 量取试样原液1 mL, 加入硝酸5 mL, 于电热板上180 ℃消解6 h, 待消解完全后转移至50 mL量瓶中, 用2%稀硝酸定制刻度, 摇匀待测。根据加入硝酸银的量完全反应时生成的粒子浓度计算, 用电感耦合等离子体光谱仪(ICP-MS)[17, 18]测定溶液中银的浓度, 仪器条件如下:射频功率1 550 W, 冷却气14 L·min-1, 辅助气0.776 3 L·min-1, 雾化气1.074 9 L·min-1, 雾化室温度2.5 ℃, 蠕动泵速率40 r·min-1。
细胞毒性实验 利用CCK-8试剂盒检测AgNPs、GQDs和ADG-DDPC对HeLa细胞的细胞毒性。取处于对数生长期的HeLa细胞每孔5×103个接种于96孔板中, 并在37 ℃、5% CO2中孵育24 h (建立无细胞的空白对照组), 吸弃培养基, 向每个孔中加入含40、80、120、160、200、280、320、360和400 ng·mL-1的AgNPs、GQDs或ADG-DDPC的新鲜培养基。孵育24 h后, 加入10 μL CCK-8检测探针, 孵育1 h。最后使用酶标仪在450 nm下检测吸光度值(A)。按照下列公式计算细胞存活率(cell viability, CL), 并利用SPSS软件计算IC50值。以DMEM溶液的孔作为空白(A空白), 分别以加入AgNPs、GQDs和ADG-DDPC作为对照组(A对照), 计算每孔的细胞存活率: CL = (A实验−A空白)/(A对照−A空白)×100%。
细胞摄取实验 取两块24孔板, 每孔底部加入1片L-多聚赖氨酸包被的细胞专用爬片, 每孔用PBS 400 μL洗3遍, 每遍浸泡3 min, 吸弃; 每孔再加入DMEM 400 μL洗3遍, 每遍浸泡3 min。取对数生长期的HeLa细胞, 用培养液稀释至8×104个/mL, 以每孔400 μL加入24孔板, 置于恒温培养箱培养24 h。吸弃孔中培养液, 将24 ng·mL-1 ADG-DDPC、GQDs加入HeLa细胞中, 分别孵育6、12和16 h, 吸弃药液, 每孔加入PBS 400 μL洗3遍, 吸弃。每孔加4%多聚甲醛400 μL固定15 min, 吸弃。再每孔加PBS 400 μL洗3遍, 每遍浸泡5 min。每孔加入预先配好的1×10-5 mol·L-1 DiI (细胞膜红色荧光探针) 400 μL, 37 ℃孵育15 min后吸弃, 再次每孔加PBS 400 μL洗3遍, 每遍浸泡3 min。取出爬片, 置于预先滴有抗荧光猝灭剂的相应载玻片上, 于正置荧光显微镜下观察ADG-DDPC进入细胞后的荧光强度。
统计学方法 使用SPSS软件对所有数据进行统计学分析, 实验所有数据以均数±标准差(x ± s)表示。统计方法采用双侧t检验, P < 0.05为显著性差异。如果数据不符合正态分布, 则采用F检验。
结果 1 紫外表征AgNPs在400 nm处有很强的特征吸收峰, 峰形较狭窄且对称(图 2A), 说明该方法合成的AgNPs粒子较为均一; 当表面吸附DNA后, 复合物的特征吸收峰红移5 nm, 且吸光度有所下降, 且峰形较AgNPs更不对称, 这是由于DNA分子质量(5 303.6 Da)远大于柠檬酸根的分子质量(185 Da)。当DNA修饰吸附在AgNPs表面后会使AgNPs周围介质的折光指数增大, 粒径大小范围较AgNP的分布较广。所以, DNA分子在AgNPs表面的吸附修饰会引起AgNPs的特征吸收峰红移; 而吸光度的下降则可能是因为在吸附过程中, 一些AgNPs损失造成的。紫外特征峰的改变证明, DNA确实吸附在AgNPs表面。图 2B中不同质量浓度ADG-DDPC (20.43、10.22、5.11和2.56 μg·mL-1)紫外最大吸收峰位置不变, 证明合成的材料内部粒子大小均一, 在确定材料的浓度时具有非常大的意义。

|
Figure 2 UV absorption spectra of AgNPs, AgNP-DNA, ADG-DDPC UV-Vis absorption spectroscopy. A: AgNPs and AgNP-DNA; B: ADG-DDPC |
所制备的ADG-DDPC表征结果显示, 纳米粒的粒径为(25.18 ± 1.40) nm, PDI为0.035, 粒径分布均一, 粒径分布图见图 3。从表 1中可以看出, 随着时间的延长, 在相同的存储条件下无磷脂包裹的纳米内核ADG于48 h内团聚较严重, 不能满足纳米注射给药; 而有磷脂包覆的ADG-DDPC在48 h内粒径有些增大, 但仍小于50 nm, 满足纳米制剂的静脉注射给药需求。
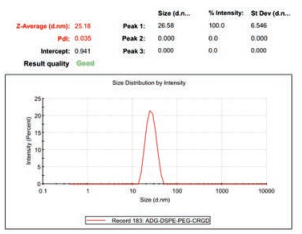
|
Figure 3 Particle size distribution of ADG-DDPC |
| Table 1 Particle size of ADG and ADG-DDPC within 48 hours in the absence of light at 4 ℃. PDI: Polydispersity index |
合成AgNPs的TEM图见图 4A, 大小在10 nm左右, 粒子大小均一, 晶格明显。NH2-GQDs从透射电镜(图 4B)可见呈规则的球状, 大小在1~2 nm之间, 分布均匀。图 4C为物理混合的AgNPs与GQDs, 在没有“桥梁”DNA作用下, AgNPs与GQDs随机分布在视野中, 两者之间的距离不规则, 且杂乱无章。图 4D为含单链DNA的ADG的TEM图, 从图中可见, 在AgNPs周围吸附了粒径较小的GQDs, 两者分布比图 4C中有了明显规律性, 不再杂乱无章。图 4E为合成的磷脂材料图, 从图中可见, 原先分布在视野中的小粒子消失, 只有粒径(25~30 nm)均一的光滑粒子, 比图 4A、C、D中粒子数目变少, 粒径则更大。

|
Figure 4 TEM topographical maps of AgNPs (A), GQDs (B), physical mixing of AgNPs and GQDs(C), ADG (D) and ADG-DDPC (E) |
从320~440 nm激发波长下的荧光光谱图(图 5A)可见, GQDs在350 nm处最大发射波长为425 nm。将GQDs最大激发与发射波长用于检测ADG-DDPC, 由图 5B可见, ADG-DDPC纳米材料的荧光随着H2O2含量的增大而增强。表明在高H2O2的环境中, ADG-DDPC中的GQDs被释放较多, 且能恢复荧光。从图 5C可以更直观地看出, AgNP被溶蚀而聚集, GQDs被释放出来。

|
Figure 5 Emission spectra of GQDs at different excitation wavelengths (A); fluorescence spectra of ADG-DDPC as functions of different concentrations of H2O2 (B); TEM of the ADG-DDPC after treating with 200 μmol·L-1 H2O2 (C). The GQDs are indicated by the arrows |
根据ICP-MS测定结果, AgNPs、ADG-DDPC中银的质量浓度分别为3.75和20.43 μg·mL-1, 说明ADG-DDPC包覆了内核后银浓度较AgNPs组显著增大。
6 细胞毒性实验用不同浓度的AgNPs和GQDs分散液加入到人宫颈癌(HeLa)细胞中孵育, AgNPs在HeLa细胞中显示了较强的毒性, 结果见图 6。SPSS软件计算得AgNPs的IC50值为(347.78 ± 0.06) ng·mL-1, ADG-DDPC对肿瘤细胞的IC50值为(209.68 ± 0.09) ng·mL-1, 而GQDs在100 μg·mL-1以下基本不显示细胞毒性。值得一提的是, AgNPs和ADG-DDPC在一定浓度范围内都具有杀灭HeLa细胞的作用, 并且杀伤作用与剂量呈依赖关系。

|
Figure 6 HeLa cell survival rate after incubation in different concentrations of AgNP (A), GQDs (B) and ADG-DDPC (C) after 24 h. n = 6, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs blank group |
将ADG-DDPC、GQDs与HeLa细胞进行孵育, 所得的荧光图见图 7。ADG-DDPC在孵育6 h后, 荧光强度较小, 而在孵育12 h后荧光强度明显增强; GQDs在孵育12 h内几乎不能被细胞摄取而发荧光, 延长GQDs的孵育时间至16 h后细胞内发出荧光, 较ADG-DDPC所需时间更长, 表明ADG-DDPC较GQDs的细胞摄取更高效。在安全剂量范围内, 通过染色红细胞膜, 细胞的形态仍然良好, 合成的磷脂材料可以在低剂量下发出强荧光, 证明发光效率较高。
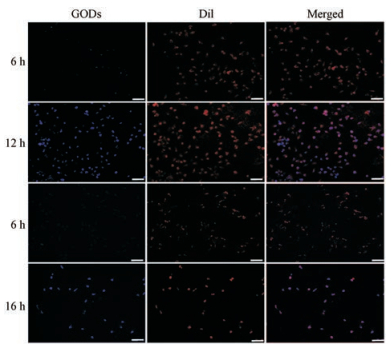
|
Figure 7 Fluorescence micrograph of HeLa cells incubated with ADG-DDPC for 6 and 12 h, GQDs incubation of HeLa cells for 6 and 16 h. From the left side are phospholipid materials (blue light), DiI (cell membrane, red stain) and fused images. Scale bar = 50 μm |
本文提出了一种既能够抑制肿瘤细胞生长, 又能在肿瘤细胞内发光的新型纳米制剂ADG-DDPC。首先利用还原反应制备得稳定的AgNPs, 透射电镜及紫外分光光度计均证明了该结论。利用电荷吸引, 以单链DNA为桥梁连接GQDs与AgNPs形成ADG内核, GQDs的荧光被AgNPs显著淬灭[19]。当H2O2存在的情况下, 与AgNPs发生类芬顿反应, AgNPs溶解的同时并产生羟基自由基[20]。从荧光分光光谱与透射电镜中可以看出AgNPs发生了溶蚀, 并且减弱了GQDs与AgNPs之间的能量转移, 使得GQDs的荧光强度恢复。透射电镜及马尔文粒径仪结果表明ADG-DDPC较ADG粒径有所增大, 可能的原因是靶向长循环磷脂包覆于纳米粒表面使表观粒径增大[21]。从细胞毒性实验与细胞荧光成像中可以看出, 含有穿膜肽cRGD的纳米制剂, 在相同银当量且孵育时间时, 较AgNPs对HeLa细胞的毒性更大。ADG-DDPC在低毒性剂量时, 随着孵育时间延长, 细胞内发出较明亮的蓝色光, 这可能是由于cRGD增加了纳米粒的跨细胞膜作用, 同时肿瘤细胞中存在较高浓度的H2O2[22, 23], 制剂中AgNPs被“侵蚀”, 释放荧光猝灭的GQDs并恢复其荧光; 细胞摄取实验结果表明, ADG-DDPC组较GQDs组在细胞内能更快发出荧光, 再次证明cRGD可成功介导本制剂细胞内化作用。肿瘤的可视化治疗是一项重要但具有挑战性的工作, 本研究为肿瘤可视化治疗提供了一种新的思路, 对寻找新的抗肿瘤纳米制剂提供一定的借鉴。
| [1] | Simpson MJ, Poblete H, Griffith M, et al. Impact of dye-protein interaction and silver nanoparticles on rose bengal photophysical behavior and protein photocross linking[J]. Photochem Photobiol, 2013, 89: 1433–1441. DOI:10.1111/php.2013.89.issue-6 |
| [2] | Zhao XX, Liu HR, Hu YB, et al. A novel gelatin-AgNPs coating preparing method for fabrication of antibacterial and no inflammation inducible coatings on PHBV[J]. React Funct Polym, 2016, 107: 54–59. DOI:10.1016/j.reactfunctpolym.2016.07.014 |
| [3] | Huang WD, Fang XL, Wang HD, et al. Biosynthesis of AgNPs by B. maydis and its antifungal effect against Exserohilum turcicum[J]. I ET Nanobiotechnol, 2018, 12: 585–590. |
| [4] | Ernest V, Gajalakshmi S, Mukherjee A, et al. Enhanced activity of lysozyme-AgNP conjugate with synergic antibacterial effect without damaging the catalytic site of lysozyme[J]. Artif Cells Nanomed Biotechnol, 2014, 42: 336–343. DOI:10.3109/21691401.2013.818010 |
| [5] | Li BK, Wang CL, Chen P, et al. The synthesis and characterization of silver nanoparticle-loaded mesoporous silica material and its antibacterial performance[J]. Acta Sci Nat Uni Nakai (南开大学学报(自然科学版)), 2018, 51: 31–38. |
| [6] | Lu L, Zheng LP, Zhao PF, et al. Preparation and antifungal activity of Ag-SiO2 core-shell nanoparticles[J]. Chin J Bio Eng (生物加工过程), 2014, 12: 51–55. |
| [7] | Subbiah RP, Lee H, Veerapandian M, et al. Structural and biological evaluation of a multifunctional SWCNT-AgNPs-DNA/PVA bio-nanofilm[J]. Anal Bioanal Chem, 2011, 400: 547–560. DOI:10.1007/s00216-011-4757-1 |
| [8] | Ritter KA, Lyding JW. The influence of edge structure on the electronic properties of graphene quantum dots and nanoribbons[J]. Nat Mater, 2009, 8: 235–242. DOI:10.1038/nmat2378 |
| [9] | Wang H, Wang XM. In vitro nucleus nanoprobe with ultra-small polyethylenimine functionalized graphene quantum dots[J]. RSC Adv, 2015, 5: 75380–75385. DOI:10.1039/C5RA13509E |
| [10] | Wang X, Sun X, He H, et al. A two-component active targeting theranostic agent based on graphene quantum dots[J]. J Mater Chem B, 2015, 3: 3583–3590. DOI:10.1039/C5TB00211G |
| [11] | Su XQ, Chan CY, Shi JY, et al. A graphene quantum dot@Fe3O4@SiO2 based nanoprobe for drug delivery sensing and dual-modal fluorescence and MRI imaging in cancer cells[J]. Biosens Bioelectron, 2017, 92: 489–495. DOI:10.1016/j.bios.2016.10.076 |
| [12] | Qin J, Zhang RX, Li JL, et al. CRGD mediated liposomes enhanced antidepressant-like effects of edaravone in rats[J]. Eur J Pharm Sci, 2014, 58: 63–71. DOI:10.1016/j.ejps.2014.03.006 |
| [13] | Liu PF, Qin LB, Wang Q, et al. CRGD-functionalized mPEG-PLGA-PLL nanoparticles for imaging and therapy of breast cancer[J]. Biomaterials, 2012, 33: 6739–6747. DOI:10.1016/j.biomaterials.2012.06.008 |
| [14] | Li JZ, Yuang ZQ, Yan M, et al. pH-sensitive micelles loaded paclitaxel using carboxymethyl chitosan-palmitic acid mediated by cRGD[J]. Acta Pharm Sin (药学学报), 2016, 51: 642–649. |
| [15] | Cabral H, Matsumoto Y, Mizuno K, et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size[J]. Nat Nanotechnol, 2011, 6: 815–823. DOI:10.1038/nnano.2011.166 |
| [16] | Sukirtha R, Priyanka KM, Antony JJ, et al. Cytotoxic effect of green synthesized silver nanoparticles using Melia azedarach against in vitro HeLa cell lines and lymphoma mice model[J]. Proc Biochem, 2012, 47: 273–279. DOI:10.1016/j.procbio.2011.11.003 |
| [17] | Yang Y, Luo L, Li HP, et al. Separation and determination of silver nanoparticle in environmental water and the UV-induced photochemical transformations study of AgNPs by cloud point extraction combined ICP-MS[J]. Talanta, 2016, 161: 342–349. DOI:10.1016/j.talanta.2016.08.052 |
| [18] | Roman M, Rigo C, Castillo-Michel H, et al. Hydrodynamic chromatography coupled to single-particle ICP-MS for the simultaneous characterization of AgNPs and determination of dissolved Ag in plasma and blood of burn patients[J]. Anal Bioanal Chem, 2016, 408: 5109–5124. DOI:10.1007/s00216-015-9014-6 |
| [19] | Mei Q, Zhang Z. Photoluminescent graphene oxide ink to print sensors onto microporous membranes for versatile visualization bioassays[J]. Angew Chem Int Ed, 2012, 51: 5602–5606. DOI:10.1002/anie.201201389 |
| [20] | Wang LL, Zheng J, Li YH, et al. AgNP-DNA@GQDs Hybrid:a new approach for sensitive detection of H2O2 and glucose via simultaneous AgNP etching and DNA cleavage[J]. Anal Chem, 2014, 86: 12348–12354. DOI:10.1021/ac503653c |
| [21] | Li FF, Zhang XX, Guo SY, et al. Preliminary study on pH sensitive lipid bilayer-coated mesoporous silica nanoparticles as a novel drug carrier for antitumor drug[J]. Acta Pharm Sin (药学学报), 2013, 48: 291–297. |
| [22] | Weinstain R, Savariar EN, Felsen CN, et al. In vivo targeting of hydrogen peroxide by activatable cell penetrating peptides[J]. J Am Chem Soc, 2014, 136: 874–877. DOI:10.1021/ja411547j |
| [23] | Tu LX, Xu YH, Tang CY, et al. In vivo imaging in tumor-bearing animals and pharmacokinetics of PEGylated liposomes modified with RGD cyclopeptide[J]. Acta Pharm Sin (药学学报), 2012, 47: 646–651. |
 2019, Vol. 54
2019, Vol. 54


