2. 天津科技大学食品工程与生物技术学院, 天津 300457
2. College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China
红曲(red yeast rice, RYR)是中华民族开发利用微生物的一项伟大发明, 已有上千年的使用历史, 是将红曲霉(Monascus)接种于浸泡蒸熟的大米上经发酵形成, 《本草纲目》对其制法进行了详细描述, 并称赞“此乃人窥造化之巧者也”, “盖奇药也”。红曲的传统功效为“健脾消食, 活血化瘀。用于饮食积滞, 脘腹胀满, 赤白下痢, 产后恶露不尽, 跌打损伤”。上世纪80年代, 红曲中洛伐他汀等系列他汀化合物的发现[1-4], 使红曲又成为降血脂类药物(血脂康、脂必妥等)、保健品(批准文号多达156个)的常用原料, 动物实验和全球不同国家的临床实验均验证了其在降低血液胆固醇尤其低密度脂蛋白-胆固醇(low density lipoprotein cholesterol, LDL-C)浓度方面的疗效[5-10]:作用机制是洛伐他汀能竞争性抑制胆固醇合成步骤中的关键限速酶—3-HMG-CoA还原酶(3-hydroxymethyl glutaryl coenzyme A reductase)的活性; 而且, 他汀类不耐受患者使用红曲时发生肌肉疼痛等不良反应的几率低[7-11], 在防治动脉硬化、冠心病等方面应用前景广阔。美国NMCD数据库(Natural Medicines Comprehensive Database)收载的含红曲或Monascus purpureus的膳食补充剂产品多达120种, 2008年该类产品的销售额已高达2 000万美元[12]。除了药用外, 红曲还能用作食品着色剂(色曲)、酿造黄酒(酿造红曲)等。
虽然红曲中洛伐他汀等次生代谢物的降血脂疗效在美国在内的许多国家得到认可, 但由于红曲发酵工艺未执行动态药品生产管理规范(current good manufacturing practices, CGMP), 流通市场上该类产品中洛伐他汀含量波动范围大, 其疗效、安全性和质量稳定性难以得到保障, 美国FDA建议消费者慎用[11, 12]。国内红曲药材的质量现状也非常令人担忧:本课题组从药材市场随机购买的5个红曲样品指纹图谱一致性很差, 有疑似色曲的样品, 显微鉴别难以发现红曲发酵菌Monascus purpureus的典型特征, 均未检出洛伐他汀; 更严峻的是, 红曲传统药用功效的研究基础非常薄弱, 未见相关文献报道, 是否含洛伐他汀的争议很大。目前红曲药材无统一的国家标准, 药典中仅收载了用于血脂康片/胶囊的红曲原料标准; 各地方药材标准以显微鉴别和水分控制为主, 难以区分药用红曲与其他用途的红曲。
为此, 本研究在全面调研全国红曲生产工艺基础上, 实地收集了包括道地产区(福建古田)在内的来源已知、用途不同的58批红曲, 以洛伐他汀(酸型和内酯型)等活性次生代谢物为红曲质量的重要探针, 首次探索建立了适用于不同用途红曲、与质谱兼容的超高效液相色谱法(ultra-performance liquid chromatographic, UPLC), 并采用主成分分析(principal component analysis, PCA)统计方法对它们进行了成功分类。
材料与方法药材和试剂 洛伐他汀对照品(内酯型, 批号: 100600-201504)由中国食品药品检定研究院提供。红曲样品共有58批, 均为本课题组经过充分调研后, 实地采集获取, 见表 1。样品来自10个生产企业, 包括道地产区福建古田的3家企业(A、B、C), 涉及色曲、酿造红曲、降血脂用红曲等不同用途[13]。乙腈、甲酸为色谱纯(Fisher); 水为Milli-Q超纯水, 其他试剂为分析纯。
| Table 1 Sample information. *Based on investigation information: 1 = RYR for food coloring, which corresponds to food supplements red yeast rice in GB1886.19-2015, with color values as its key quality parameter. 2 = RYR for brewing, which is rich in digestive enzymes, e.g. glycase, esterase. Lovatatin (acid form + lactone form) is the key quality parameter of functional RYR (3) and RYR raw materials of Zhibituo (4-1) and Xuezhikang (4-2)[13]. However, due to lack of definition for medicinal RYR, those used to produce traditional Chinese medicine (TCM) (4-3) or for traditional medicinal use (4-4) were not classified at the beginning of the study |
仪器设备 Waters Acquity UPLC色谱系统, 配备PDA检测器和ELSD检测器, 气源采用GA-10B低噪音空气泵(北京中兴汇利科技发展有限公司), 数据采集采用Empower软件。考察的色谱柱有Capcell Core AQ (100 mm×4.6 mm, 2.7 μm)、Capcell Core C18 (100 mm×3.0 mm, 2.7 μm)、Acquity UPLC HSS C18 (100 mm×2.1 mm, 1.8 μm)、Luna C18(2) (150 mm×4.6 mm, 3 μm)。PL303万分之一天平(Mettler-Toledo公司), KQ-300DA型超声波清洗器(昆山市超声仪器有限公司)。数据统计采用ChemPattern软件(Chemmind公司)。
色谱条件 采用Capcell Core AQ柱, 100 mm×4.6 mm, 2.7 μm; 采用PDA (设置: 200~650 nm, 提取: 237 nm)和ELSD (漂移管温度: 50 ℃, 载气压力: 40 psi, 增益系数: 50)串联检测; 流动相为0.1%甲酸(A)-乙腈(含0.1%甲酸) (B)系统, 梯度洗脱: 0~15 min, 50% B→85% B; 15~16 min, 85% B→50% B并维持至21 min, 流速: 0.5 mL∙min-1。进样体积: 1~5 μL (根据样品中目标化合物浓度适当调整)。
溶液的制备样品溶液 将本品粉末约3 g, 精密称定, 置具塞锥形瓶中, 精密加入乙腈10 mL, 密塞, 称定质量, 超声处理(功率250 W, 频率40 kHz) 30 min, 放冷, 再称定质量, 用乙腈补足减失的质量, 摇匀, 用0.45 μm滤膜过滤, 取续滤液, 即得。
内酯型洛伐他汀对照品溶液 取洛伐他汀对照品(内酯型)适量, 精密称定, 用乙腈制成1.5 mg∙mL-1的溶液, 即得。
酸型洛伐他汀对照品溶液 取洛伐他汀对照品(内酯型)约10 mg, 精密称定, 置于10 mL量瓶中, 加入含0.1 mol∙L-1 NaOH的75%甲醇溶液约8 mL使其溶解, 50 ℃水浴加热转化1 h, 放冷, 用上述乙醇溶液补足至刻度, 摇匀, 即得。
加样回收率溶液 精密称取含量已知的同一样品(E12, 酸型和内酯型洛伐他汀的含量分别为0.30%和0.33%) 12份, 每份约1.5 g, 平分为2组, 其中一组加入与该样品本身所含内酯型洛伐他汀含量相当的内酯型洛伐他汀对照品(对照品溶液浓度为0.506 mg∙mL-1, 精密加入1 mL), 再精密加入乙腈9 mL, 按照“样品溶液”项下方法超声制备, 计算内酯型洛伐他汀的加样回收率; 另一组精密加入与样品本身所含酸型和内酯型洛伐他汀总量相当的酸型洛伐他汀对照品(采用含0.1 mol∙L-1 NaOH的75%甲醇溶液配制, 浓度为0.948 mg∙mL-1, 精密加入10 mL), 50 ℃水浴加热转化1 h, 再超声提取30 min, 按照间接法计算酸型洛伐他汀的加样回收率。
结果 1 方法学考察 1.1 专属性本文所建的UPLC色谱系统能够使红曲的常见活性次生代谢物(包括他汀和色素类)有适宜的保留, 而且彼此之间能基线分离, 适宜于它们的定性、定量分析以及区分不同用途的红曲, 见图 1。
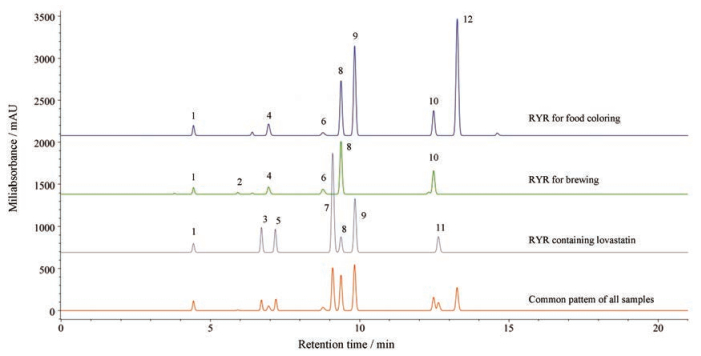
|
Figure 1 Typical fingerprints of red yeast rice (RYR) with various applications (ChemPattern software, with 25% (lower quartile) of frequency filter). 3: Lovastatin acid form; 7: Lovastatin lactone form |
取同一份红曲样品(E1), 重复进样(n = 6), 酸型和内酯型洛伐他汀峰保留时间和峰面积的RSD分别小于0.02%和1.2%;平行配制的6份样品溶液(E1), 酸型和内酯型洛伐他汀的“峰面积/称样量”的RSD小于1.8%。
1.3 线性、定量限和检出限酸型和内酯型洛伐他汀在0.04~1.98 mg∙mL-1和0.25~1.65 mg∙mL-1内的峰面积(y)~浓度(x)线性关系良好, 校正曲线的相关系数(r)分别为0.999 9和0.999 7。采用系列稀释法测得的酸型/内酯型洛伐他汀在本系统下的最低检出限(LOD)和定量限(LOQ)分别为10.2/1.25 ng和33.8/4.17 ng。
1.4 加样回收率酯型和酸型洛伐他汀的加样回收率平均值分别为100.18%和100.43%, RSD分别为1.48%和2.46% (n = 6), 揭示方法的准确性符合要求。
1.5 溶液的稳定性采用乙腈配制的供试品溶液, 在4 ℃条件下放置7天后, 各色谱峰面积的RSD小于1.5%, 表明所考察的红曲次生代谢物在乙腈中1周之内稳定。
2 样品测定 2.1 不同样品的次生代谢物指纹图谱比较采用所建的上述方法对课题组实地采集、来源准确的58批红曲样品进行了次生代谢物的指纹图谱考察, 发现:
① 采用不同用途、不同来源的样品作为代表性样品, 用ChemPatternTM软件合成的红曲指纹图谱共有模型(common pattern of all samples, 图 1)中, 3、7和11号峰为他汀类化合物, UVmax为231、238和247 nm; 其他可能为色素类代谢物, 其中1号和4号峰的UV光谱相似, UVmax为253、303、416和529 nm, 5号、8号和10号峰的UV光谱相似, UVmax为232、291和390 nm, 9号和12号的UV光谱相似, UVmax为246、285和473 nm, 而2号峰的UVmax为301、425和523 nm。
② 红曲次生代谢物的指纹图谱与其用途之间呈现较好的规律性:来源不同、但用途相同的红曲含许多共性成分, 指纹图谱之间的相似性较好(色曲、酿造红曲的相似度均高于0.90);不同用途的红曲, 即使来源于同一生产企业, 在次生代谢物的种类、含量方面也会有明显差异, 用PCA统计方法能够明确区分, 见图 2。其中, 色曲(RYR for food coloring)的常见共性成分为图 1中的1、4、6、8、9、10、12号峰, 酿造红曲(RYR for brewing)的常见共性成分为1、2、4、6、8、10号峰, 含洛伐他汀的红曲(RYR containing lovastatin)的特征共性成分为3、7号峰(即酸型和内酯型洛伐他汀)及1、5、8、11号峰。各用途红曲的共有峰为1号和8号峰。
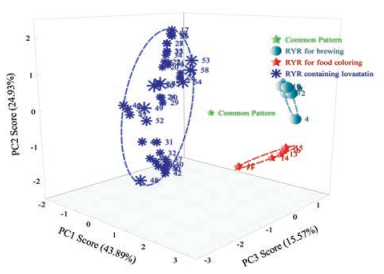
|
Figure 2 Classification of RYR for various uses by PCA |
③ H、I企业供中药饮片用红曲中含酸型和内酯型洛伐他汀, 其中I企业的红曲与F企业的降血脂用红曲(脂必妥用)的指纹图谱相似, 洛伐他汀的含量及比例情况也相似; H企业的红曲与E企业的功能性红曲的次生代谢物种类相似, 但整体含量偏低于后者。鉴于含洛伐他汀的红曲既有供降血脂药品用原料(例如G、F企业的红曲分别供血脂康和脂必妥用), 又有供保健品用红曲(例如E企业的功能性红曲), 还包括供中药饮片用的红曲(H、I企业), 而且它们的指纹图谱有时会有明显差异, 洛伐他汀含量波动范围也很宽(表 2), 会直接影响该类红曲的临床疗效、挑战其质量可控性。后续工作中, 会结合工艺调研、次生代谢物研究及其活性评价结果, 重点探索影响该类红曲质量的关键指标及影响因素, 为其质量规范提供科学依据。
| Table 2 Content of lovastatin in red yeast rice samples. aⅠ = RYR for food coloring, Ⅱ = RYR for brewing, Ⅲ = RYR containing lovastatin; bClassified based on their secondary metabolite fingerprints |
④ 传统“健脾消食、活血化瘀”用红曲(J1), 与福建古田、浙江金华的酿造红曲(A2, C1~C3, D1)的指纹图谱之间的相似度大于0.97。在390 nm、530 nm和ELSD检测条件下比较, 结论也一致(n = 2)。在调研中, 红曲道地产区的C企业也反映:他们的部分酿造红曲也供药用, 例如厦门某厂的新癀片的红曲原料即采用酿造红曲。后续工作中, 会通过收集更多来源的该类样品并结合活性评价结果进行验证。
⑤ 麦角甾醇在本系统中不出峰, 但采用纯甲醇系统, 能考察红曲中的麦角甾醇: E、J等企业的红曲中均能检出麦角甾醇。
2.2 红曲中洛伐他汀的含量测定采用外标法, 对收集到的58批红曲样品进行了酸型和内酯型洛伐他汀的含量测定, 结果见表 2, 考察结果表明: ①色曲(A1, B1, E17~E20)和酿造红曲(A2, C1~C3, D1, E21~E24)中均未检出洛伐他汀(酸型和内酯型洛伐他汀的最低检出限分别为10.2和1.25 ng), 传统“健脾消食、活血化瘀”用红曲(J1)中也未检出洛伐他汀。②含洛伐他汀的红曲中, 酸型和内酯型洛伐他汀的含量分别介于0.02%~0.55 %和0.01%~0.52%, 差异高达23倍和52倍; 总量介于0.03%~1.07%, 差异高达36倍, 亟待开展相关研究, 对洛伐他汀含量的适宜范围、其他代谢物的种类及含量范围等方面予以规范。
讨论本文首次探索建立了一个能与质谱兼容的UPLC方法, 运行时间从65 min缩短为21 min, 利于红曲次生代谢物的快速分析和定性鉴别。
红曲属于发酵产品, 其发酵菌株、发酵方式(固态/液态)、培养基质、pH、发酵温度、时间等因素均会影响红曲次生代谢产物的种类和含量[14-18]。不同用途的红曲发酵工艺有差异:例如, 与偏重于糖化力/酯化力的酿造红曲相比, 色曲需要更多次补水, 需要的“米+曲种+醋”总量多1倍(以相同的红曲产率计); 从发酵时间看, 含洛伐他汀的红曲所需时间最长, 通常为12~35 d, 其次为色曲, 通常为13~16 d, 酿造红曲需要的时间最短, 通常为8~10 d, 但该类红曲的酶活性最强[13]。针对目前药用红曲研究基础非常薄弱、流通市场上红曲药材质量一致性差的现状, 本文在充分调研、实际采集样品的基础上, 首次采用次生代谢物指纹图谱方式对不同用途的红曲进行了成功分类, 揭示了采用次生代谢物作为红曲质量探针的可行性, 弥补了各地方标准中性状和显微鉴别专属性差的缺陷, 为红曲药材质量的科学规范奠定了坚实基础。后续工作中, 会结合不同用途红曲的各类活性(例如降血脂、健脾消食、抑菌等)比较结果, 阐明其不同功效对应的红曲类型及相应的关键质量指标, 从而为红曲药材质量的科学评价奠定基础。
方法建立时发现: ①色谱柱的选择对于分离效果的影响最大, 在考察的4根色谱柱(CAPCELL CORE AQ、CAPCELL CORE C18、Acquity UPLC HSS C18和Luna C18(2))中, CAPCELL CORE AQ的分离效果最佳, 优于血脂康片/胶囊项下的红曲原料指纹图谱方法。②用乙腈与甲醇作提取溶剂时, 红曲中次生代谢物的种类和含量类似, 优于75%乙醇和水; 但内酯型洛伐他汀在乙腈中的稳定性优于甲醇, 与文献报道[19]一致, 故采用了乙腈作为提取溶剂; 超声30 min时, 红曲中他汀和色素类等代谢物的提取已完全。③本研究采用PDA和ELSD串联的方式:在237 nm下, 他汀类化合物的响应值最高, 色素类在该波长下也有较好的响应, 故洛伐他汀含量测定和指纹图谱分析采用237 nm。色素类也可采用390 nm或530 nm。ELSD检测时, 在15分钟后还能发现许多无特征紫外吸收的代谢物(例如tR = 15.09, 15.30, 16.56 min色谱峰), 但它们并非麦角甾醇、γ-氨基丁酸, 后续质谱分析中还会关注这些代谢物。
| [1] | Endo A. Monacolin K, a new hypocholesterolemic agent produced by a Monascus species[J]. J Antibiot, 1979, 32: 852–854. DOI:10.7164/antibiotics.32.852 |
| [2] | Endo A, Husumi K, Nakamura T, et al. Dihydromonacolin L and monacolin X, new metabolites that inhibit cholesterol biosynthesis[J]. J Antibiot, 1985, 38: 321–327. DOI:10.7164/antibiotics.38.321 |
| [3] | Endo A, Husumi K, Negishi S. Monacolin J and L, new inhibitors of cholesterol biosynthesis produced by Monoscus ruber[J]. J Antibiot, 1985, 38: 420–422. DOI:10.7164/antibiotics.38.420 |
| [4] | Endo A, Komagata D, Shimada H. Monacolin M, a new inhibitor of cholesterol biosynthesis[J]. J Antibiot, 1986, 39: 1670–1673. DOI:10.7164/antibiotics.39.1670 |
| [5] | Endo A. Monacolin K, a new hypocholesterolemic agent that specifically inhibits 3-hydroxy-3-methylglutaryl coenzyme A reductase[J]. J Antibiot, 1980, 33: 334–336. DOI:10.7164/antibiotics.33.334 |
| [6] | Endo A. Chemistry, biochemistry and pharmacology of HMG-CoA reductase inhibitors[J]. Klin Wochenschr, 1988, 66: 421–427. DOI:10.1007/BF01745510 |
| [7] | Huang CF, Li TC, Lin CC, et al. Efficacy of Monascus purpureus Went rice on lowering lipid ratios in hypercholesterolemic patients[J]. Eur J Cardiovasc Prev Rehabil, 2007, 14: 438–440. DOI:10.1097/HJR.0b013e32801da137 |
| [8] | Lin CC, Li TC, Lai MM. Efficacy and safety of Monascus purpureus Went rice in subjects with hyperlipidemia[J]. Eur J Endocrinol, 2005, 153: 679–686. DOI:10.1530/eje.1.02012 |
| [9] | Gheith O, Sheashaa H, Abdelsalam M, et al. Efficacy and safety of Monascus purpureus Went rice in children and young adults with secondary hyperlipidemia:a preliminary report[J]. Eur J Internal Med, 2009, 20: e57–e61. DOI:10.1016/j.ejim.2008.08.012 |
| [10] | Lu Z, Kou W, Du B, et al. Effect of Xuezhikang, an extract from red yeast Chinese rice, on coronary events in a Chinese population with previous myocardial infarction[J]. Am J Cardiol, 2008, 101: 1689–1693. DOI:10.1016/j.amjcard.2008.02.056 |
| [11] | Dujovne CA. Red yeast rice preparations:are they suitable substitutions for statins?[J]. Am J Med, 2017. DOI:10.1016/j.amjmed.2017.05.013 |
| [12] | Lindsey C, Andrea G, Atanaz Z, et al. Review of red yeast rice content and current food and drug administration oversight[J]. J Clin Lipidol, 2013, 7: 117–122. DOI:10.1016/j.jacl.2012.09.003 |
| [13] | Fu JQ, Zhang HS, Yao JC. Chinese Red Yeast Rice and Related Practical Techniques (中国红曲及其实用技术)[M]. Wuhan: Wuhan University of Technology Press, 2017: 169-77. |
| [14] | Tsukahara M, Shinzato N, Tamaki Y, et al. Red yeast rice fermentation by selected Monascus sp. with deep-red color, lovastatin production but no citrinin, and effect of temperature-shift cultivation on lovastatin production[J]. Appl Biochem Biotechnol, 2009, 158: 476–482. DOI:10.1007/s12010-009-8553-8 |
| [15] | Miyake T, Uchitomi K, Zhang MY, et al. Effects of the principal nutrients on lovastatin production by Manascus pilosus[J]. Biosci Biotechnol Biochem, 2006, 70: 1154–1159. DOI:10.1271/bbb.70.1154 |
| [16] | Huang J, Liao NQ, Li HM. Linoleic acid enhance the production of moncolin K and red pigments in Monascus ruber by activating mokH and mokA, and by accelerating cAMP-PkA pathway[J]. Int J Biol Macromol, 2018, 109: 950–954. DOI:10.1016/j.ijbiomac.2017.11.074 |
| [17] | Said MF, Brooks J, Chisti Y. Optimal C:N ratio for the production of red pigments by Monascus ruber[J]. World J Microbiol Biotechnol, 2014, 30: 2471–2479. DOI:10.1007/s11274-014-1672-6 |
| [18] | Chen MH, Ji DW, Ma RJ, et al. Effects of different substrates on the important metabolites of Monascus fermented products[J]. China Brewing (中国酿造), 2013, 32: 22–24. |
| [19] | Yang Y, Zheng RJ, Hua YY, et al. High-performance liquid chromatographic analysis of lovastatin (lactone) and lovastatin acid in red yeast rice[J]. Chin J Health Lab Technol (中国卫生检验杂志), 2014, 24: 1714–1717. |
 2019, Vol. 54
2019, Vol. 54


