2. 江苏大学药学院, 江苏 镇江 212013
2. School of Pharmacy, Jiangsu University, Zhenjiang 212013, China
骨质疏松症是一种以骨组织微结构恶化和骨量减少为特征的疾病, 会导致骨脆度增加, 从而增加骨折的风险[1]。全球约有1亿人患骨质疏松症, 而在中国就有6 940万人[2, 3]。骨质疏松可分为原发性和继发性, 其中摄入糖皮质激素是导致继发性骨质疏松最常见的原因[4, 5]。糖皮质激素在治疗炎症和免疫抑制方面疗效显著。然而, 临床研究表明, 患者持续使用糖皮质激素6个月以上, 有50%的几率患骨质疏松[6, 7]。此外, 这些患者使用糖皮质激素经过5年治疗后, 骨折的发生率约为30%[8]。因此, 骨质疏松是限制糖皮质激素使用的主要因素, 即使患者同时服用双膦酸盐来抵抗[9]。体内研究表明, 治疗量的糖皮质激素通过抑制小鼠成骨细胞形成, 导致小鼠骨量减少[10, 11]。在斑马鱼骨组织的生长、稳态和再生过程中, 糖皮质激素对其成骨细胞的数量、活性和分化有抑制作用[12]。据相关研究报道, 糖皮质激素能恶化绝经后或老年人的骨质疏松状态并加重骨骼代谢障碍[3], 从而提高了骨质疏松症的发病率和增加发生骨质疏松性骨折的风险。
桃红四物汤(THSWD)由桃仁、红花、熟地黄、当归、川芎和白芍六味中药组成, 是遵循“活血祛瘀”的原则所组成的基本复方, 其中, 桃仁、红花为君药, 活血化瘀; 熟地、当归为臣药, 滋阴补肝、养血调经; 芍药为佐药, 养血和营、补血; 川芎为使药, 活血行气、调畅气血。桃红四物汤在各种血栓性疾病的治疗, 如血管性头痛、冠心病和血栓性静脉炎等方面, 都取得了满意的疗效。先前的研究表明, 桃红四物汤中有9种有效成分, 包括没食子酸、绿原酸、咖啡酸、羟基红花黄色素A、香豆酸、阿魏酸、苯甲酸、洋川芎内酯I和洋川芎内酯H[13]。研究表明, THSWD能抑制激素诱导的骨髓间充质干细胞的甘油三酯、PPARγ mRNA和aP2 mRNA的表达, 这一作用与抑制激素诱导的骨髓间充质干细胞的成脂肪分化有关[14]。THSWD通过调节成骨细胞与破骨细胞偶联的OPG (osteoprotegerin)-RANKL (nuclearfactor-k beta receptor activator ligand)-RANK信号通路, 增加OPG和RANKL蛋白和基因在成骨细胞中的表达, 并抑制破骨细胞中RANK蛋白和基因的表达, 从而促进骨组织的生长[15]。因此, THSWD可能是一种有效的抗骨质疏松的中药处方。
近年来, 已经成功地用许多动物建立了不同发病时间的糖皮质激素性骨质疏松的模型, 包括大鼠[16]、家兔[17, 18]、绵羊[19]、比格犬[20]、母羊[21]和猪[22]。在过去的几十年里, 斑马鱼被确认为研究骨骼发育最有力的动物模型[23-25]。斑马鱼的骨骼发育与人的骨骼发育有很高的相似性, 因此, 斑马鱼动物模型得到了广泛的应用。研究表明, 用泼尼松龙处理斑马鱼幼鱼得到糖皮质激素性骨质疏松模型, 可以发现其早期骨矿化有着明显的延迟。
本研究中, 按照THSWD的经典配方进行提取, 并对其中有效成分进行含量测定; 使用泼尼松龙处理斑马鱼幼鱼来建立糖皮质激素性骨质疏松模型, 再通过骨骼染色、骨形成相关基因表达和骨矿含量的测定, 评价THSWD对糖皮质激素性骨质疏松的治疗作用。
材料与方法实验动物 斑马鱼为野生型AB系斑马鱼, 由南京一树梨花生物科技有限公司提供。
药材与试剂 桃仁、红花、熟地黄、当归、川芎和白芍由江苏大学附属医院中药房提供, 来源于安徽亳州药材市场。经赵蓉副主任药师鉴定, 桃仁为蔷薇科植物桃Prunus persica (L.) Batsch的干燥成熟种子; 红花为菊科植物红花Carthamus tinctorius L.的干燥花; 熟地黄为玄参科植物地黄Rehmannia glutinosa Libosch.的炮制加工品; 当归为伞形科植物当归Angelica sinensis (Oliv.) Diels的干燥根; 川芎为伞形科植物川芎Ligusticum chuanxiong Hort.的干燥根茎; 白芍为毛茛科植物芍药Paeonia lactiflora Pall.的干燥根。
没食子酸(批号: 110831-201605)、绿原酸(批号: 110753-201716)、羟基红花黄色素A (批号: 111637-201609)、阿魏酸(批号: 110773-201614)、咖啡酸(批号: 110885-201703)、苯甲酸(批号: 100419-201703)、依替膦酸二钠(中国食品药品检定研究院); 香豆酸(批号: S24556)、洋川芎内酯H (批号: B21462)和洋川芎内酯I (批号: B21463) (上海源叶生物科技有限公司); 泼尼松龙(纯度≥98%)、3-氨基苯甲酸乙酯甲磺酸盐(MS222, 纯度≥98%) (Adamas-reagent公司); 多聚甲醛(纯度≥95%, 上海泰坦科技股份有限公司); Trizol RNA提取剂(Ambion公司); 茜素红S (上海泰坦科技股份有限公司); HNO3 (日本Tama Chemicals公司); 其余皆为分析纯。
仪器 Agilent 1200 HPLC系统(美国Agilent公司); 倒置荧光显微镜(奥林巴斯Ⅸ 71/Ⅸ 81, 日本奥林巴斯公司); Image J图像分析软件(美国国立卫生研究院); 生化培养箱SPX-80 (宁波海曙赛福实验仪器厂); 电感耦合等离子体质谱仪(ICP/MS, Agilent Technologies公司); SPSS16.0软件。
标准品和样品的制备 用甲醇配制包含9种成分的标准品储备液, 在4 ℃冰箱中保存。再用适量的甲醇稀释储备液, 得到一系列浓度的标准液。取桃仁、红花、熟地黄、当归、川芎和白芍饮片适量, 粉碎, 过60目筛, 按9:6:12:9:9:6的比例混合均匀, 用10倍量的水浸泡2 h, 回流提取0.5 h (提取3次), 合并滤液, 冷冻干燥成粉末状, 备用。称取样品0.1 g, 用50%甲醇50 mL超声提取(200 W, 40 kHz) 40 min。离心取上清液, 过0.45 μm微孔注射器, 取20 μL注入HPLC进行分析。
色谱条件 色谱柱为Zorbax C18 (250 mm×4.6 mm, 5 μm); DAD检测器; 流速1 mL·min-1; 柱温30 ℃; 流动相为乙腈-水(0.1% H3PO3); 梯度洗脱; 检测波长为280 nm。
斑马鱼的胚胎培养 将自然交配得到的斑马鱼胚胎放置在含有空白E3培养基(5 mmol·L-1 NaCl、0.17 mmol·L-1 KCl、0.33 mmol·L-1 CaCl2和0.33 mmol·L-1 MgSO4)的6孔板中培养, 胚胎和幼鱼置于14 h/10 h光/暗循环的环境中, 水温为(28.5±0.5) ℃[24]。
药物的配制 精密称取泼尼松龙适量, 加入少量DMSO使溶解定容, 配成250 μmol·L-1储备液, 再量取适量储备液用培养基稀释成25 μmol·L-1的0.5% DMSO溶液; 精密称取依替膦酸二钠适量, 用超纯水溶解定容, 配制成150 μg·mL-1储备液。取适量储备液加入适量DMSO并用培养基稀释配制成含0.5% DMSO的15 μg·mL-1依替膦酸二钠溶液; 精密称取桃红四物汤提取的粉末适量, 用超纯水配成100 μg·mL-1储备液, 再量取适量储备液稀释成0.1、1和10 μg·mL-1 THSWD溶液。
斑马鱼分组与处理 在2 DPF (days post fertilization), 将刚孵化的斑马鱼幼鱼放入装3 mL空白培养基的6孔板中(每孔15只)。在3 DPF, 将幼鱼分为不同的组, 包括对照组(空白E3培养基), 泼尼松龙组(25 μmol·L-1 PNSL), 依替膦酸二钠(DE)组(15 μmol·L-1 DE和25 μmol·L-1 PNSL), THSWD组(0.1、1.0或10.0 μg·mL-1 THSWD和25 μmol·L-1 PNSL)。在6 DPF到10 DPF, 幼鱼每天喂食草履虫1 h。每次喂食后, 将剩下的草履虫洗净, 更换培养基。
斑马鱼的骨骼和基质染色 在10 DPF, 将斑马鱼置于3-氨基苯甲酸乙酯甲磺酸盐(MS-222, 100 mg·L-1)中, 麻醉处死。除去MS-222溶液, 将斑马鱼幼鱼固定在4%多聚甲醛溶液(pH 7.4)中, 用茜素红S (ARS, 0.5% KOH)染色。染色12 h后, 除去并洗净染色溶液, 加入1.5% H2O2和1% KOH现配的漂白剂。漂白1 h后, 用甘油脱色, 在显微镜下观察斑马鱼骨骼的染色情况。
斑马鱼的骨矿化分析 用先前使用的方法[26, 27]对斑马鱼的骨矿化面积(AMB)和累积光密度(COD)进行定量分析。幼鱼头骨腹侧图像(ARS染色)用倒置荧光显微镜获取。每组均使用相同的显微和摄像设置, 斑马鱼的ARS染色面积和COD值用ImageJ软件计算(n = 5)。
斑马鱼的RNA分离和实时定量PCR分析 用Trizol试剂提取斑马鱼幼鱼总RNA, 并通过反转录法获得cDNA。用实时PCR定量检测碱性磷酸酶(AKP)、Ⅰ型胶原(type Ⅰ)、人类相关转录因子2 (RUNX-2)、血清骨保护素(OPG)、抗酒石酸酸性磷酸酶5b(TRACP)和骨钙素(OCN)基因的表达。在ABI StepOnePlus TM实时PCR系统上进行RT-PCR (95 ℃变性1 min, 94 ℃退火10 s, 40个循环, 最后59 ℃延伸30 s), 然后进行熔解曲线分析, 采用2-ΔΔCT计算相对表达。PCR的引物列于表 1。
| Table 1 Primer sequences for quantitative real-time PCR. AKP: Alkaline phosphatase; Type Ⅰ:Type Ⅰ collagen; RUNX-2: Runt-related transcription factor 2; TRACP: Tartrate-resistant acid phosphatase 5b; OPG: Osteoprotegerin; OCN: Osteocalcin |
斑马鱼的矿物质含量检测 采用ICP-MS测定斑马鱼幼鱼中的矿物质含量[28]。幼鱼从3 DPF培养至10 DPF, 并在10 DPF收集(n = 15, 重复3次)。收集的幼鱼用双蒸水冲洗5次, 再转移到离心管(10 mL)中。然后, 用70% HNO3将样品在微波炉中处理4 h。用配备了G3160B I-AS集成自动采样器的7500cx ICP/MS系统测定其中Ca、P、K、Mg、Zn和Fe的含量。
统计学分析 所有数据以x± s表示, 采用单因素方差分析差异。用SPSS 16.0软件分析数据, P < 0.05表示有显著性差异。
结果 1 THSWD的成分分析在实验中, 用9种成分的标准储备液稀释成6个不同的浓度, 建立了标准曲线(表 2)。所有成分达到了基线分离(图 1), 并在较宽的浓度范围内线性良好, 且回收率稳定在95.4%~101.2%内。其中, 没食子酸、绿原酸、咖啡酸、羟基红花黄色素A、香豆酸、阿魏酸、苯甲酸、洋川芎内酯I和洋川芎内酯H的含量分别为0.58、0.15、0.03、0.27、0.02、0.04、0.01、0.03和0.05 g·kg-1。在THSWD水提液中, 9种成分的浓度顺序为:没食子酸 > 羟基红花黄色素A > 绿原酸 > 洋川芎内酯H > 阿魏酸 > 咖啡酸、洋川芎内酯Ⅰ > 香豆酸 > 苯甲酸。因此, 没食子酸、绿原酸和羟基红花黄色素A是THSWD提取物的主要成分。

|
Figure 1 Typical HPLC-DAD chromatograms of the Tao Hong Si Wu decoction (THSWD) extract. Compounds 1-9 is the same as Table 2 |
| Table 2 Linear regression, correlation coefficient, linear range and recovery of 9 compounds. 1: Gallic acid; 2: Chlorogenic acid; 3: Caffeic acid; 4: Hydroxysafflor yellow A; 5: Coumaric acid; 6: Ferulic acid; 7: Benzoic acid; 8: Senkyunolide Ⅰ; 9: Senkyunolide H |
ARS被广泛用于检测和定量骨矿化面积, 因为它能与钙盐结合(图 2A)。在前期研究中, 用受精后3~9天的斑马鱼幼鱼研究了糖皮质激素(泼尼松龙和地塞米松)抑制骨形成的最佳浓度(1.0、2.5、10.0和25 μmol·L-1)。结果表明, 与对照组相比, 用25 μmol·L-1泼尼松龙处理斑马鱼可显著降低其骨矿化面积和累积光密度(图 2B)。
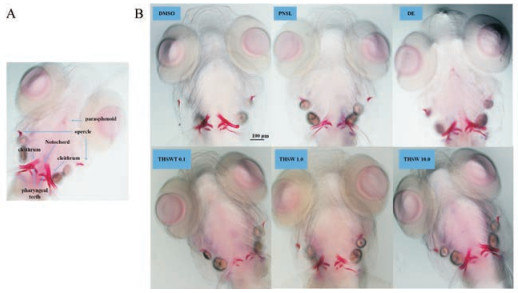
|
Figure 2 Ventral view of ARS-stained zebrafish skull at 10 DPF with exposure to prednisolone (PNSL, 25 μmol·L-1) and the therapeutic effect of THSWD (0.1, 1.0, 10.0 μg·mL-1). Areas of calcified matrix in craniofacial skeleton are stained red (×100) (A). The structure of zebrafish head bones after staining (B). CON: Blank E3 medium; DMSO: 0.5% DMSO; DE: 15 μmol·L-1 disodium ethydronate and 25 μmol·L-1 PNSL |
本研究中用水提法提取THSWD, 因此提取物有较好的水溶性。为了研究THSWD是否能减轻泼尼松龙诱导的骨形成抑制, 用3种质量浓度(0.1、1.0和10.0 μg·mL-1) THSWD从3 DPF到10 DPF处理在25 μmol·L-1泼尼松龙影响下的斑马鱼幼鱼。结果表明, THSWD对斑马鱼骨形成抑制具有一定的恢复作用。与PNSL组相比, THSWD干预后斑马鱼的骨矿化面积(图 3A)和累积光密度(图 3B)值有显著性升高(P < 0.01), 并在0.1~10.0 μg·mL-1内显示出剂量依赖性。THSWD不仅表现出减轻PNSL的骨生长抑制作用, 而且与空白对照组相比具有显著地促进骨形成作用。

|
Figure 3 The effect of THSWD (0.1, 1.0, 10.0 μg·mL-1) on mineralization in osteoporosis zebrafish larvae induced by PNSL (n = 15, x± s). A: Calculation of mineralized area of skull; B: Calculation of cumulative optical density of skull. ##P < 0.01 vs CON; **P < 0.01 vs PNSL |
骨组织中胶原的重量占17%~20%[29]。AKP由成骨细胞分泌, 促进骨矿化。OCN是骨基质中的主要非胶原蛋白酶。OPG是RANKL的诱导受体, 可以抑制RANKL激活破骨细胞, 从而减少骨吸收。RUNX-2可以刺激骨髓间充质干细胞分化成成骨细胞。因此, 检测了这些与骨形成相关基因的表达。结果表明, 8天内(3~10 DPF) PNSL组AKP、type Ⅰ、RUNX-2、OPG、OCN基因的表达有显著性降低(P < 0.01, 图 4)。经THSWD处理后, 这些基因的表达有明显的增加(P < 0.01, 图 4)。
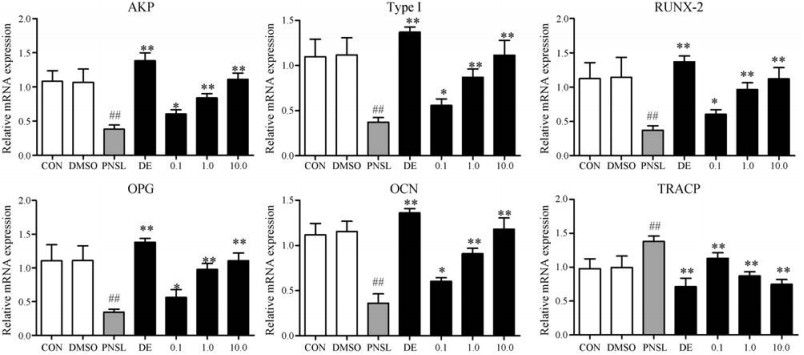
|
Figure 4 Effect of THSWD (0.1, 1.0, 10.0 μg·mL-1) on the expression of osteoblast marker genes in osteoporosis zebrafish larvae induced by PNSL (n = 15, x± s). mRNA levels of the AKP, type Ⅰ, RUNX-2, OPG, OCN, TRACP genes were determined by quantitative real-time PCR.TRACP:Tartrate-resistant acid phosphatase 5b. ##P < 0.01 vs CON; *P < 0.05, **P < 0.01 vs PNSL |
骨组织中磷酸钙等组分的重量占69%~80%[29]。为证明THSWD对骨形成的促进作用, 用ICP-MS法测定斑马鱼幼鱼体内Ca、P、K、Mg、Zn、Fe的含量。与对照相比, PNSL可使斑马鱼Ca、P、K、Mg、Zn、Fe水平分别降低了2.8、2.4、13.8、6.6、8.0和8.8倍(P < 0.05)。用THSWD处理后, 斑马鱼Ca、P、K、Mg、Zn、Fe水平均显著高于PNSL组(P < 0.05, 图 5)。随着THSWD浓度从0.1 μg·mL-1增加到10.0 μg·mL-1, 斑马鱼中这些元素的含量也呈上升趋势, 呈明显剂量依赖性。
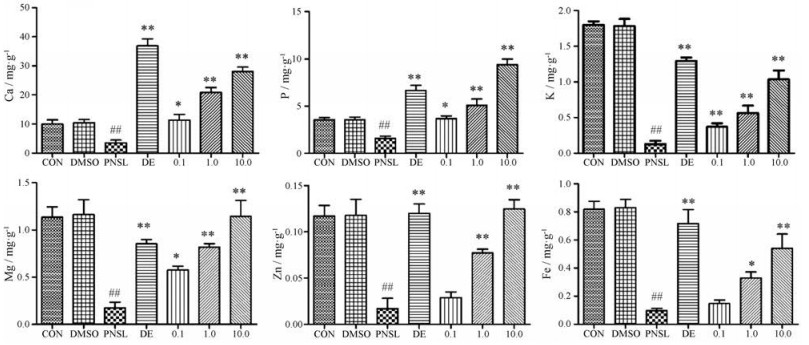
|
Figure 5 Effect of THSWD (0.1, 1.0, 10.0 μg·mL-1) on the mineral contents in osteoporosis zebrafish larvae induced by PNSL (n = 15, x± s). ##P < 0.01 vs CON; *P < 0.05, **P < 0.01 vs PNSL |
在人体内, 骨由磷酸钙、胶原和其他成分(水、矿物质、蛋白质等)组成。骨胶原蛋白能提高骨组织的韧性(抗能量冲击), 减轻矿物(Ca2+、Mg2+、K+和Zn2+等)脆性, 并增强骨强度[30]。此外, AKP、OPG和OCN是成骨细胞活性的重要指标。RUNX-2的表达反映了骨髓间充质干细胞分化成成骨细胞的能力。因此, 本研究中选定的指标完全可以作为成骨细胞的活性和骨形成时的骨矿化程度的标志。
本研究中使用的所有斑马鱼鱼龄均小于10 DPF。研究表明, 只有在20 DPF后, 才能检测出破骨细胞。Chen等[31]研究发现在10 DPF的斑马鱼幼鱼切片上观察不到抗酒石酸酸性磷酸酶5b (TRACP)阳性破骨细胞。因此, 在10 DPF以内, 幼鱼中不存在破骨细胞, 也没有相关的骨吸收过程。结果表明, 无论是PNSL还是THSWD对幼鱼的影响只与成骨细胞骨形成有关, 而与破骨细胞骨吸收无关。
斑马鱼模型是一种快速和高通量的糖皮质激素性骨质疏松动物模型。然而, 该模型并不适用于各种天然化合物的抗骨质疏松活性筛选。原因是斑马鱼通过皮肤或胃肠道从鱼水中吸收药物, 所选择的天然化合物需要有较好的水溶性或易溶于水。斑马鱼耐受二甲亚砜, 但在培养基中二甲亚砜含量不能超过0.5%。THSWD在水中具有很高的溶解性, 在25 ℃溶解度约为0.28 mg·mL-1 [32]。因此, 不需要使用二甲亚砜来增溶。
桃红四物汤源自清·吴谦的《医宗金鉴》, 具有活血化瘀、养血补血的双重功效。红花是组成THSWD的重要中药之一, 是一种有效治疗疼痛性骨质疏松症的中药, 含有黄酮醇、查尔酮、生物碱和其他化学成分[33]。羟基红花黄色素A是红花的主要活性成分, 在THSWD提取液中含量较高(0.27 g·kg-1)。羟基红花黄色素A可抑制原代骨髓间充质干细胞分化成脂肪细胞[34]。作者前期对羟基红花黄色素A进行了研究[35], 发现它能够促进骨矿化, 提高成骨细胞活性, 说明红花作为君药在桃红四物汤抗糖皮质激素性骨质疏松中发挥重要作用。
结论THSWD能够增强成骨细胞活力, 促进骨胶原表达和骨矿化, 从而增加骨量, 因此其具有潜在的抗糖皮质激素性骨质疏松作用。说明THSWD是一种具有良好抗骨质疏松活性和良好发展前景的中药复方。
| [1] | Kamycheva E, Goto T, Camargo CA. Celiac disease is associated with reduced bone mineral density and increased FRAX scores in the US National Health and Nutrition Examination Survey[J]. Osteoporo Int, 2017, 28: 781–790. DOI:10.1007/s00198-016-3791-4 |
| [2] | Li GF, Pan YZ, Sirois P, et al. Iron homeostasis in osteoporosis and its clinical implications[J]. Osteoporo Int, 2012, 23: 2403–2408. DOI:10.1007/s00198-012-1982-1 |
| [3] | Rinne PP, Laitinen MK, Huttunen T, et al. The incidence and trauma mechanisms of acetabular fractures:a nationwide study in Finland between 1997 and 2014[J]. Injury, 2017, 48: 2157–2161. DOI:10.1016/j.injury.2017.08.003 |
| [4] | Langdahl BL. Osteoporosis in premenopausal women[J]. Curr Opin Rheumatol, 2017, 29: 410–415. DOI:10.1097/BOR.0000000000000400 |
| [5] | Buckley L, Guyatt G, Fink HA, et al. 2017 American College of Rheumatology Guideline for the prevention and treatment of glucocorticoid-induced osteoporosis[J]. Arthritis Care Res, 2017, 69: 1521–1537. |
| [6] | Fujiwara S. Glucocorticoid and bone. Fracture risk of steroid-induced osteoporosis[J]. Clin Calcium, 2014, 24: 1295–1300. |
| [7] | Adinoff AD, Hollister JR. Steroid-induced fractures and bone loss in patients with asthma[J]. N Engl J Med, 1983, 309: 265–268. DOI:10.1056/NEJM198308043090502 |
| [8] | Chee C, Sellahewa L, Pappachan JM. Inhaled corticosteroids and bone health[J]. Open Respir Med J, 2014, 8: 85–92. |
| [9] | Weinstein RS, Chen JR, Powers CC, et al. Promotion of osteoclast survival and antagonism of bisphosphonate-induced osteoclast apoptosis by glucocorticoids[J]. J Clin Invest, 2002, 109: 1041–1048. DOI:10.1172/JCI0214538 |
| [10] | Kang H, Chen H, Huang P, et al. Glucocorticoids impair bone formation of bone marrow stromal stem cells by reciprocally regulating microRNA-34a-5p[J]. Osteoporos Int, 2016, 27: 1493–1505. DOI:10.1007/s00198-015-3381-x |
| [11] | Frenkel B, White W, Tuckermann J. Glucocorticoid-induced osteoporosis[M]//Wang JC, Harris C. Glucocorticoid Signaling. New York: Springer, 2015: 179-215. |
| [12] | Geurtzen K, Vernet A, Freidin A, et al. Immune suppressive and bone inhibitory effects of prednisolone in growing and regenerating zebrafish tissues[J]. J Bone Mineral Res, 2017, 32: 2476–2488. DOI:10.1002/jbmr.v32.12 |
| [13] | Li SS, Li S, Yang JM, et al. Determination of nine kinds of water -soluble active ingredients from Tao Hong Siwu Decoction by RP-HPLC[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2017, 28: 364–367. |
| [14] | Li SQ, Yu T, Qi ZX. Intervention of Taohong Siwu Decoction on adipogenic differentiation of steroid-induced bone marrow mesenchymal stem cells[J]. J Clin Rehabilit Tissue Eng Res (中国组织工程研究与临床康复), 2010, 14: 3539–3543. |
| [15] | Zeng ZP, Wang HB, Huang F, et al. Effect of Taohong Siwu Decoction on protein in "osteoclasts-osteoblastic collective system"[J]. J Chin Med Mater (中药材), 2012, 35: 456–461. |
| [16] | Liu K, Jing Y, Zhang W, et al. Silencing miR-106b accelerates osteogenesis of mesenchymal stem cells and rescues against glucocorticoid-induced osteoporosis by targeting BMP2[J]. Bone, 2017, 97: 130–138. DOI:10.1016/j.bone.2017.01.014 |
| [17] | Zhang Y, Wang K, Zheng J, et al. Glucocorticoids activate the local rennin-angiotensin system in bone:possible mechanism for glucocorticoid-induced osteoporosis[J]. Endocrine, 2014, 47: 598–608. DOI:10.1007/s12020-014-0196-z |
| [18] | Zhou F, Rong C, Wang K, et al. Investigation on the role on perindopril for prevention and treatment of glucocorticoid-induced osteoporosis in rabbits[J]. China J Orthop Traumatol (中国骨伤), 2016, 29: 52–57. |
| [19] | Kalpakcioglu BB, Engelke K, Genant HK. Advanced imaging assessment of bone fragility in glucocorticoid-induced osteoporosis[J]. Bone, 2011, 48: 1221–1231. DOI:10.1016/j.bone.2011.02.005 |
| [20] | Quarles LD. Prednisone-induced osteopenia in beagles:variable effects mediated by differential suppression of bone formation[J]. Am J Physiol, 1992, 263: E136–E141. |
| [21] | Chavassieux P, Buffet A, Vergnaud P, et al. Short-term effects of corticosteroids on trabecular bone remodeling in old ewes[J]. Bone, 1997, 20: 451–455. DOI:10.1016/S8756-3282(97)00016-1 |
| [22] | Scholz-Ahrens KE, Delling G, Stampa B, et al. Glucocorticosteroid-induced osteoporosis in adult primiparous G ttingen miniature pigs:effects on bone mineral and mineral metabolism[J]. Am J Physiol Endocrinol Metabol, 2007, 293: E385–E395. DOI:10.1152/ajpendo.00627.2006 |
| [23] | Pasqualetti S, Congiu T, Banfi G, et al. Alendronate rescued osteoporotic phenotype in a model of glucocorticoid-induced osteoporosis in adult zebrafish scale[J]. Int J Exp Pathol, 2015, 96: 11–20. DOI:10.1111/iep.12106 |
| [24] | Barrett R, Chappell C, Quick M, et al. A rapid, high content, in vivo model of glucocorticoid-induced osteoporosis[J]. Biotechnol J, 2006, 1: 651–655. DOI:10.1002/(ISSN)1860-7314 |
| [25] | Yu X, Tong Y, Han XQ, et al. Anti-angiogenic activity of Herba Epimedii on zebrafish embryos in vivo and HUVECs in vitro[J]. Phytother Res, 2013, 27: 1368–1375. DOI:10.1002/ptr.v27.9 |
| [26] | Wei YJ, Wang CM, Cai XT, et al. Establishment of zebrafish osteopenia model induced by dexamethasone[J]. Acta Pharm Sin (药学学报), 2013, 48: 255–260. |
| [27] | Zhan Y, Wei YJ, Sun E, et al. Two-dimensional zebrafish model combined with hyphenated chromatographic techniques for evaluation anti-osteoporosis activity of epimendin A and its metabolite baohuoside Ⅰ[J]. Acta Pharm Sin (药学学报), 2014, 49: 932–937. |
| [28] | Jiang J, Feng L, Li J, et al. Multielemental composition of suet oil based on quantification by ultrawave/ICP-MS coupled with chemometric analysis[J]. Molecules, 2014, 19: 4452–4465. DOI:10.3390/molecules19044452 |
| [29] | Ferreira AM, Gentile P, Chiono V, et al. Collagen for bone tissue regeneration[J]. Acta Biomater, 2012, 8: 3191–3200. DOI:10.1016/j.actbio.2012.06.014 |
| [30] | Wynnyckyj C, Omelon S, Savage K, et al. A new tool to assess the mechanical properties of bone due to collagen degradation[J]. Bone, 2009, 44: 840–848. DOI:10.1016/j.bone.2008.12.014 |
| [31] | Chen B, Yan YL, Liu C, et al. Therapeutic effect of deferoxamine on iron overload-induced inhibition of osteogenesis in a zebrafish model[J]. Calcif Tissue Int, 2014, 94: 353–360. DOI:10.1007/s00223-013-9817-4 |
| [32] | Wang S, Sun M, Ping Q. Enhancing effect of labrafac lipophile WL 1349 on oral bioavailability of hydroxysafflor yellow A in rats[J]. Int J Pharm, 2008, 358: 198–204. DOI:10.1016/j.ijpharm.2008.03.006 |
| [33] | Asgarpanah J, Kazemivash N. Phytochemistry, pharmacology and medicinal properties of Carthamus tinctorius L[J]. Chin J Integr Med, 2013, 19: 153–159. DOI:10.1007/s11655-013-1354-5 |
| [34] | Zhu HJ, Wang LJ, Wang XQ, et al. Hydroxysafflor yellow A (HYSA) inhibited the proliferation and differentiation of 3T3-L1 preadipocytes[J]. Cytotechnology, 2015, 67: 885–892. DOI:10.1007/s10616-014-9783-3 |
| [35] | Liu L, Tao W, Pan W, et al. Hydroxysafflor yellow A promoted bone mineralization and inhibited bone resorption which reversed glucocorticoids-induced osteoporosis[J]. Biomed Res Int, 2018. DOI:10.1155/2018/6762146 |
 2019, Vol. 54
2019, Vol. 54


