2. 河南中医药大学呼吸疾病诊疗与新药研发河南省协同创新中心, 河南 郑州 450046
2. Collaborative Innovation Center for Respiratory Disease Diagnosis and Treatment and Chinese Medicine Development of Henan Province, Henan University of Chinese Medicine, Zhengzhou 450046, China
雌激素为甾体类化合物, 具有广泛的生物活性, 不仅在女性生殖器官的发育、第二性征的维持中起着重要的作用, 而且对骨质代谢、脂类代谢、心血管和神经系统等也有重要作用[1]。妇女绝经后卵巢功能衰竭, 体内雌激素水平下降, 产生一系列相关的症状和并发症, 如潮热、骨质疏松、心血管疾病等, 而长期的雌激素替代治疗可能会增加乳腺癌、子宫内膜癌的危险性, 植物雌激素因其不良反应小而引起广泛关注。植物雌激素是指存在于植物中, 分子结构和药理作用与雌激素相似的化合物。植物雌激素的雌激素样作用是双重的:在体内雌激素水平低于正常水平时发挥类雌激素作用, 在绝经期症状的防治、癌症的治疗、心血管系统的保护、骨质疏松的缓解与治疗等方面发挥重要作用; 当体内雌激素水平较高时, 可产生雌激素拮抗作用, 抑制乳腺增生、子宫肌瘤等病症的恶化[2]。因此, 人们又把植物雌激素的这种作用称为“选择性雌激素受体调节剂” (selective estrogen receptor modulators, SERMs), 其临床价值受到众多学者的关注, 找寻疗效显著的植物雌激素也成为研究的热点。
许多中药中的植物药被广泛应用于妇女保健和妇科病症的治疗, 如淫羊藿、丹参和黄芪[3-5]等, 其中所含的植物雌激素发挥的药效不容忽视。地黄为中国传统草药, 归肝肾经, 始载于《神农本草经》, 列为上品。目前有关地黄的化学成分及药理活性的研究已广泛且深入, 地黄主要的化学成分为环烯醚萜及其苷类、紫罗兰酮类、糖类、氨基酸类、挥发油类和无机盐类等[6]; 现代药理活性研究表明, 地黄具有止血、提高机体免疫功能、改善中枢神经系统、保护肾脏器官、降血糖、抗衰老、抗炎、抗骨质疏松等作用[7]。研究报道, 六味地黄丸具有雌激素样活性, 并能在一定程度上改善卵巢功能[8]。本课题组前期对生地黄雌激素样活性进行筛选发现其能增加性未成熟小鼠子宫指数, 具有雌激素样活性[9]。同时, 从生地黄中分离出了较多的地黄苦苷元, 目前尚未有关地黄苦苷元雌激素样活性的报道。本研究以地黄苦苷元为研究对象, 通过观察地黄苦苷元对性未成熟小鼠子宫及对MCF-7细胞增殖作用的影响, 以期探讨地黄苦苷元是否为生地黄发挥雌激素样作用的物质基础, 并研究其雌激素样活性及作用机制, 为开发利用植物雌激素的新药源奠定理论基础。
材料与方法药物与试剂 地黄苦苷元由本实验室自制。生地黄购自河南省温县, 经河南中医药大学董诚明教授鉴定为玄参科植物地黄(Rehmannia glutinosa Libosch.)的干燥块根; 经提取和分离得到地黄苦苷元[10], 纯度为95%, 分子量为184.11;戊酸雌二醇片(拜耳医药, Ev, 动物实验阳性药); 17-β雌二醇(17-βE2, 细胞实验阳性药)、特异性雌激素受体拮抗剂(faslodex, ICI182, 780)、雌激素受体α阻断剂(methylpiperidino-pyrazole, MPP)、雌激素受体β阻断剂(Delta (9)-tetrahydrocannabinol, THC)、特异性雌激素受体拮抗剂(G15) (Sigma公司); DMEM高糖培养基(Gibco公司); 胎牛血清(浙江天杭生物科技股份有限公司); 无酚红DMEM、葡聚糖-活性炭去激素胎牛血清(Hyclone公司); 雌二醇(estradiol, E2)、黄体生成素(luteinizing hormone, LH)、卵泡刺激素(follicle stimulating hormone, FSH) ELISA试剂盒(苏州卡尔文生物科技有限公司); estrogen receptor alpha (ERα)抗体、estrogen receptor beta (ERβ)抗体、G-protein coupled receptor 30 (GPR30)抗体(Abcam公司); β-Actin抗体(武汉爱博泰克生物科技有限公司)。
仪器 iMarkTM型酶标仪、半干转膜仪、电泳仪(BIO-RAD公司); 超净工作台(江苏苏净集团); 化学发光仪(Beckman Coulter公司); 高速低温冷冻离心机(Thermo Fisher Scientific公司); 二氧化碳培养箱(STIK公司); 倒置显微镜(NIKON ECLIPSE TS100)。
小鼠子宫增重实验 本研究按照中华人民共和国国家科学技术委员会颁布的“实验动物管理条例”进行, 所有操作符合动物饲养管理和使用指南。选用昆明种小鼠30只, 刚断乳(21天), 清洁级, 雌性, 体重9~12 g, 购自北京维通利华实验动物技术有限公司[许可证号: SCXK (京) 2016-0011], 饲养于河南中医药大学动物研究中心。保持平均室温在(22±2) ℃, 自由进食饮水, 动物房明暗交替12 h:12 h, 动物适应环境3天后进行实验。随机分为正常组灌胃蒸馏水(0.02 mL·kg-1), 阳性药组灌胃戊酸雌二醇(0.33 mg·kg-1), 地黄苦苷元组灌胃地黄苦苷元混悬液(50 mg·kg-1), 每组10只, 给药7天, 取血后颈椎脱臼处死动物, 解剖并摘取子宫称重, 计算子宫指数, 子宫指数=子宫湿重/体重×100%。
MCF-7细胞增殖实验 MCF-7细胞购自中国医学科学院基础医学研究所细胞资源中心。MCF-7细胞经含5%去雌激素血清的无酚红DMEM培养1周, 除去内源性雌激素的干扰, 取对数生长期细胞, 以每毫升2×104个细胞接种于96孔板, 每孔200 μL, 待细胞贴壁后, 换为含药培养基继续培养24 h, MTT法检测药物对细胞活力的影响, 结果以吸光度(A)和增殖率(PR%)表示, PR%=A实验组/A对照组×100%。实验独立平行重复3次。
MCF-7细胞增殖拮抗实验 实验方法同“MCF-7细胞增殖实验”, 其中给药培养时, 拮抗剂组在给药前2 h加ICI182, 780 (0.01 μmol·L-1), 给药前0.5 h加MPP (0.01 μmol·L-1)、THC (0.01 μmol·L-1)、G15 (0.01 μmol·L-1)。同“MCF-7细胞增殖实验”检测细胞活力。
ELISA法检测血清E2、FSH、LH 小鼠颈椎脱臼处死前摘眼球取血, 血液室温静置1 h后, 3 000 r·min-1离心10 min, 取上清。按照ELISA试剂盒说明书操作检测E2、FSH、LH水平。
Western blots法检测小鼠子宫ERα、ERβ、GPR30蛋白表达 将小鼠子宫组织按照总蛋白提取试剂盒提取各组子宫总蛋白, 用BCA蛋白定量试剂盒测定总蛋白的浓度。以每孔上样量相同为前提, 经聚丙烯凝胶酰胺电泳后, 电转膜至PVDF膜上, 室温下5%脱脂奶粉封闭1.5 h, 加入一抗ERα (1:1 000)、ERβ (1:1 000)、GPR30 (1:1 000), 4 ℃孵育过夜, 用PBST洗膜5次, 每次5 min, 避光孵育二抗(1:20 000) 1 h, PBST洗膜3次, 每次5 min, 最后用PBS洗5 min, 待膜干后用近红外荧光显影。
统计学处理 实验结果以x±s表示, 采用SPSS 17.0软件中的相应程序处理数据, 各组数据采用单因素方差分析(one-way ANOVA)后, 组间比较应用t检验。P < 0.05为统计学差异有显著性, P < 0.01为统计学差异有极显著性。
结果 1 地黄苦苷元对性未成熟小鼠子宫指数的影响与正常组(0.053 62 ± 0.012 61)相比, 0.33 mg·kg-1阳性药戊酸雌二醇极显著增加性未成熟小鼠的子宫指数(0.152 6 ± 0.025 94, P < 0.01), 地黄苦苷元在剂量为50 mg·kg-1时能显著诱导子宫指数增加(0.078 85 ± 0.015 56, P < 0.05), 说明地黄苦苷元在体内具有雌激素样活性。
2 地黄苦苷元对血清E2、FSH、LH的影响与正常组相比, 50 mg·kg-1地黄苦苷元能极显著降低FSH、LH的水平(P < 0.01), 但对E2没有显著影响; 阳性药戊酸雌二醇能显著增加E2的水平, 显著降低FSH及LH的水平(P < 0.05或P < 0.01)。见表 1。
| Table 1 Effect on estradiol (E2), follicle stimulating hormone (FSH) and luteinizing hormone (LH) after 7 days oral administration on rehmapicrogenin. n = 10, x± s.**P < 0.01 vs control. Ev: Estradiol valerate, the positive group |
Western blot结果显示, 50 mg·kg-1地黄苦苷元能极显著促进ERα和GPR30的表达(P < 0.01), 但对ERβ表达影响较小; 阳性药戊酸雌二醇能显著促进ERα、ERβ和GPR30的表达(P < 0.01)。如图 1。
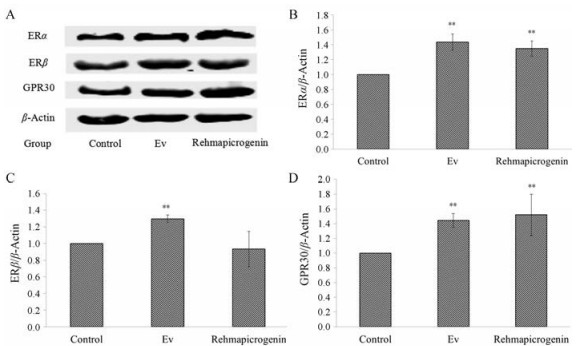
|
Figure 1 Effect on the expression of estrogen receptor alpha (ERα), estrogen receptor beta (ERβ) and G-protein coupled receptor 30 (GPR30) in uterus after 7 days oral administration with rehmapicrogenin (50 mg·kg-1). A: Protein expression levels of ERα, ERβ and GPR30 as determined using Western blot; B-D: Histogram analysis of the protein expression levels of ERα (B), ERβ (C), GPR30 (D). n = 3, x± s. **P < 0.01 vs control |
与正常组相比, 地黄苦苷元在浓度为6和8 μmol·L-1给药24 h时能极显著促进MCF-7细胞增殖(P < 0.01), 说明地黄苦苷元在体外具有雌激素样活性; 阳性对照组17β-E2能极显著地促进MCF-7细胞增殖(P < 0.01)。见表 2。
| Table 2 Effect on MCF-7 cell proliferation culturing with rehmapicrogenin for 24 h. n = 4, x ± s.**P < 0.01vs control. 17β-E2: 17β-Estradiol |
与正常组相比, 6和8 μmol·L-1地黄苦苷元能显著促进细胞增殖, ICI182, 780 (0.01 μmol·L-1)、MPP (0.01 μmol·L-1)及G15 (0.01 μmol·L-1)能拮抗地黄苦苷元促MCF-7细胞增殖的作用, 但THC (0.01 μmol·L-1)不能拮抗地黄苦苷元对MCF-7细胞的促增殖作用; 阳性对照组17β-E2对MCF-7细胞的促增殖作用能被ICI182, 780、MPP、THC及G15拮抗。ICI182, 780、MPP、THC、G15对10 μmol·L-1地黄苦苷元作用于MCF-7细胞增殖无影响。如图 2。
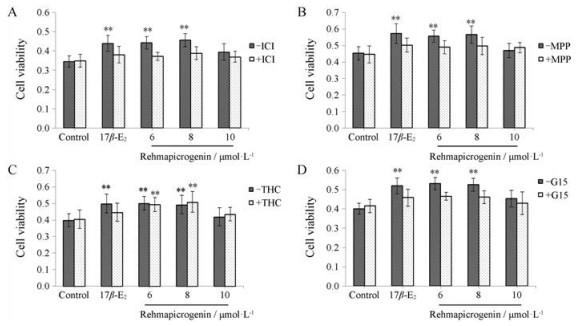
|
Figure 2 Effect of ICI182, 780 (ICI, A), methylpiperidino-pyrazole (MPP, B), delta (9)-tetrahydrocannabinol (THC, C) and G15 (D) on MCF-7 cell proliferation. n = 4, x± s. **P < 0.01 vs control |
雌激素在游离状态才具有生物学效应, 游离雌激素通过被动扩散或特异性主动转运进入靶细胞, 与雌激素受体结合发挥生物学效应。雌激素受体主要包括ERα、ERβ[11, 12]及GPR30[13]。植物雌激素在结构和功能上与雌激素类似, 因其与雌激素相比不良反应小, 近年来成为研究的热点。地黄是中医临床最常用的中药之一, 在妇科用于调经、改善绝经前后诸症等。课题组前期研究表明生地黄具有雌激素样活性[9], 为进一步探讨其发挥雌激素样作用的物质基础, 本研究对生地黄主要成分之一地黄苦苷元进行研究。
采用小鼠子宫增重实验[14]对地黄苦苷元进行雌激素样活性筛选, 其原理是雌激素或雌激素样物质与子宫组织雌激素受体结合, 使子宫组织的诱导蛋白(induced protein, IP)含量增加, 子宫组织增生变厚而使子宫增重[15]; 地黄苦苷元(50 mg·kg-1)与戊酸雌二醇均能显著增加小鼠子宫指数, 但戊酸雌二醇组小鼠出现子宫水肿现象, 表明地黄苦苷元与戊酸雌二醇产生的雌激素效应仍有较大差异, 认为地黄苦苷元在性未成熟小鼠体内发挥弱雌激素样作用。实验结果显示, 地黄苦苷元能激活雌激素受体ERα和GPR30, 但对ERβ无影响, 提示其雌激素样作用通过ERα和GPR30介导, 这与Hall等[16]报道的ERβ要在完全激动剂作用下才能被激活, 而ERα可以被激动剂和部分激动剂(如SERMs)激活相符; 地黄苦苷元能调节体内性激素的水平, 显著降低FSH、LH, 可能是通过与下丘脑雌激素受体结合, 调节下丘脑-垂体-卵巢轴而抑制FSH和LH的水平, 但其对E2无影响, 推测可能与给药时间有关。
人乳腺癌细胞系(MCF-7细胞)是雌激素受体阳性的细胞系, 富含雌激素受体, 对雌激素或雌激素类活性物质非常敏感, 雌激素或雌激素类活性物质能显著诱导该细胞的增殖, 因此MCF-7细胞已被广泛用于筛选和评价植物雌激素的活性[17]。6和8 μmol·L-1地黄苦苷元对MCF-7细胞有促增殖作用并能被特异性雌激素受体拮抗剂ICI182, 780[18]和膜受体GPR30阻断剂G15[19]拮抗, 提示地黄苦苷元在体外具有激素样活性, 且是通过经典ER和GPR30共同介导的; 为进一步探究其机制, 采用雌激素受体α阻断剂MPP[20]和雌激素受体β阻断剂THC[21]进行MCF-7细胞增殖拮抗实验, MPP明显抑制地黄苦苷元的促增殖作用, THC对其无影响, 提示地黄苦苷元促MCF-7细胞增殖由ERα和GPR30共同介导, 这与动物实验结果相符。李建民等[22]研究表明高浓度植物雌激素可以抑制MCF-7细胞增殖, 本实验结果显示10 μmol·L-1地黄苦苷元对MCF-7细胞有促增殖的趋势, 但无显著性差异, 这可能与植物雌激素的双向调节作用有关。
本研究结果表明, 地黄苦苷元具有雌激素样活性, 可归为植物雌激素, 为生地黄发挥雌激素样作用的物质基础之一。这一结果为指导临床用药及围绝经期妇女保健用药提供了理论依据。
| [1] | Zhu Y, Huang XP. Pharmacology and clinical application of estrogen[J]. Chin J New Drugs Clin Rem (中国新药与临床杂志), 2018, 37: S3–S8. |
| [2] | Chen Q, Li WL, Ding ZD, et al. Study on two-way adjustment mechanism of traditional Chinese medicine phytoestrogens[J]. J Harbin Univ Commerce (哈尔滨商业大学学报(自然科学版)), 2014, 30: 138–141. |
| [3] | Ma Q, Wang DM. Application of epimedium in gynecological diseases[J]. Jilin J Tradit Chin Med (吉林中医药), 2017, 37: 78–81. |
| [4] | Su YF, Tian ZT, Ge SS, et al. Salvia application status and formulations in the treatment of gynecological diseases in the country[J]. Pract Pharm Clin Remed (实用医学志), 2014, 31: 453–455. |
| [5] | Guo ZK, Li LL, Wei J. Discussion on the compatibility of Astragalus and Rhizoma in the treatment of gynecological tumors[J]. Liaoning J Tradit Chin Med (辽宁中志), 2014, 41: 1376–1377. |
| [6] | Li HW, Meng XL. Research progress on chemical constituents and pharmacological activities of Rehmannia glutinosa[J]. Drug Eva Res (药物评价研究), 2015, 38: 218–228. |
| [7] | LI HF. Summary on pharmacological action and clinical usage of Rehmanniae radix[J]. J Pharm Res (药学研究), 2014, 36: 345–347. |
| [8] | Luo YX, Li XR, Yang JL, et al. Effect of Liuwei Dihuang Pills on ovarian function in natural aging SD rats[J]. J Ningxia Med Univ (宁夏医科大学学报), 2018, 40: 512–516. |
| [9] | Zheng XK, Liu ZY, Jiang Y, et al. Evaluation of the estrogenic effects of Rehmannia glutinosa Libosch[J]. Chin Pharm J (中国药学杂志), 2013, 48: 1813–1836. |
| [10] | Feng WS, Li M, Zheng XK, et al. Study on chemical of immunosuppressive parts from the roots of Rehmannia glutinasa[J]. Acta Pharm Sin (药学学报), 2014, 49: 1496–1502. |
| [11] | Evans RM. The steroid and thyroid hormone superfamily[J]. Science, 1988, 240: 889–895. DOI:10.1126/science.3283939 |
| [12] | Beato M, Herrlich P, Schutz G. Steroid hormone receptors:many actors in search of a plot[J]. Cell, 1995, 83: 851–857. DOI:10.1016/0092-8674(95)90201-5 |
| [13] | Maggiolini M, Picard D. The unfolding stories of GPR30, a new membrane-bound estrogen receptor[J]. J Endocrinol, 2010, 2014: 105–114. |
| [14] | Andersen HR, Andersen AM, Aronold SF, et al. Comparison of short-term estrogenicity tests for identification of hormone-disrupting chemicals[J]. Environ Health Perspect, 1999, 107: 89–108. DOI:10.1289/ehp.99107s189 |
| [15] | Thigpen JE, Haseman JK, Saunders H, et al. Dietary factors affecting uterine weights of immature CD-1 mice used in uterotrophic bioassays[J]. Cancer Detect Prev, 2002, 26: 381–393. DOI:10.1016/S0361-090X(02)00122-8 |
| [16] | Hall JM, McDonnell DP. The estrogen receptor beta-isoform (ER beta) of the human estrogen receptor modulates ER alpha transcriptional activity and is a key regulator of the cellular response to estrogens and antiestrogens[J]. Endocrinology, 1999, 140: 5566–5578. DOI:10.1210/endo.140.12.7179 |
| [17] | Soto AM, Sonnenschein C, Chung KL, et al. The E-screen assay as a tool to identify estrogens:an update on estrogenic environmental pollutants[J]. Environ Health Perspect, 1995, 103: 113–122. |
| [18] | Sawada M, Alkayed NJ, Goto S, et al. Estrogen receptor antagonist ICI182, 780 exacerbates ischemic injury in female mouse[J]. J Cereb Blood Flow Metab, 2000, 20: 112–118. DOI:10.1097/00004647-200001000-00015 |
| [19] | Chen Y, Hong DY, Wang J, et al. Baicalein, unlike 4-hydroxytamoxifen but similar to G15, suppresses 17β-estradiol-induced cell invasion, and matrix metalloproteinase-9 expressionand activation in MCF-7 human breast cancer cells[J]. Oncol Lett, 2017, 14: 1823–1830. DOI:10.3892/ol.2017.6298 |
| [20] | David S, Jean T. Estrogen regulation and ion dependence of taurine uptake by MCF-7 human breast cancer cells[J]. Cell Mol Biol Lett, 2007, 12: 2177–2183. |
| [21] | Watanabe K, Motoya E, Matsuzawa N. Marijuana extracts possess the effects like the endocrine disrupting chemicals[J]. Toxicology, 2004, 206: 471–478. |
| [22] | Li JM, Yang L, Wang YQ, et al. Study on the estrogen-like effects of glycyrrhetinic acid and glycyrrhizin[J]. Chin Prev Med (中国预防医学杂志), 2017, 18: 168–172. |
 2019, Vol. 54
2019, Vol. 54


