2. 广东药科大学, 广东 广州 510006;
3. 包头医学院, 内蒙古 包头 014040;
4. 沈阳药科大学, 辽宁 沈阳 110016
2. Guangdong Pharmaceutical University, Guangzhou 510006, China;
3. Baotou Medical College, Baotou 014040, China;
4. Shenyang Pharmaceutical University, Shengyang 110016, China
血栓性疾病是由于血管阻塞导致血液不能流入组织而引起机体损伤的一类疾病, 主要由血栓引起。血栓的形成过程较为复杂, 主要与血小板过度活化有关。血小板是从骨髓成熟的巨核细胞胞浆脱落下来的不规则小块胞质, 直径约为2~3 µm。在正常情况下, 每天产生的血小板数约1×1011个, 其寿命约7~10天[1]。生理条件下, 血小板参与机体正常的止血过程, 防止损伤后出血, 发挥保护机体作用。但是, 血小板的过度活化是血栓性疾病如缺血性脑卒中、急性心肌梗死、急性肺栓塞等疾病形成的重要原因[2]。
丹酚酸A是从中药丹参中分离得到的主要水溶性有效成分之一[3]。研究表明, 丹酚酸A具有多种药理活性, 如抗炎、抗氧化以及神经保护作用等[4, 5]。目前越来越多的研究发现, 丹酚酸A具有抑制血小板聚集的作用。进一步研究发现丹酚酸A不仅通过磷酸肌醇-3-激酶通路抑制血小板激活[6], 还可以通过升高环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)发挥抗血小板聚集作用[7], 但多数是仅从体内或体外、正常或疾病等某一方面进行探究的, 且丹酚酸A与现有的抗血小板药物相比在抗血小板及抗血栓方面有哪些作用特点, 鲜有报道。
阿司匹林作为目前最常用的抗血栓药物, 具有抑制血小板聚集和预防血栓形成的作用, 广泛用于心脑血管疾病的防治。其抗血小板的作用主要通过不可逆乙酰化环氧合酶1 (cyclooxygenase, COX1)的Ser529, 使得COX1的催化位点不能与花生四烯酸接触, 抑制前列腺素H2及血栓烷A2的生成, 从而达到抑制血小板聚集作用[8], 但在临床应用过程中存在胃肠道出血等不良反应。同时阿司匹林使用存在着一定的风险, 且在脑卒中预防中的作用仍存有争议[9]。
本文结合体内、体外抗血小板作用, 同时进一步对正常和疾病状态下的作用进行研究, 能够更加系统全面地展示丹酚酸A在血栓性疾病中的作用, 并通过体外、体内研究比较丹酚酸A与阿司匹林在正常大鼠和脑缺血大鼠中抗血小板及抗血栓作用。通过比较研究, 初步明确丹酚酸A与阿司匹林作用的异同点, 为血栓性疾病的治疗药物研究提供实验依据。
材料与方法药品和试剂 丹酚酸A (HPLC > 94%)由中国医学科学院药物研究所自制; 阿司匹林、花生四烯酸(arachidonic acid, AA)、二磷酸腺苷(adenosine diphosphate, ADP)、凝血酶(thrombin, THR)均购自美国Sigma公司; 凝血四项试剂盒购自泰州中勤世帝生物技术有限公司; 牛血清白蛋白(bovine serum albumin, BSA)购自VWR公司。
实验动物 雄性SD大鼠(210~230 g), 由北京维通利华实验动物技术有限公司提供[许可证号: SCXK (京) 2016-0006], 动物福利和实验过程均遵循中国医学科学院动物伦理委员会的规定。
实验仪器 YLS-14B小动物血栓生成仪(济南益延科技发展有限公司); LG-PABER-Ⅰ半自动凝血分析仪(北京世帝科学仪器公司); ALC-HTP小动物恒温系统(上海奥尔科特生物科技有限公司)。
体外抗血小板聚集实验 具体方法参照文献[10]的基础上改进。雄性SD大鼠水合氯醛麻醉, 仰卧位固定于鼠板上, 腹主动脉取血, 加入3.8%枸橼酸钠溶液1:9 (抗凝剂:血液)用于抗凝, 1 200 r·min-1, 室温(23 ℃)离心10 min, 待离心结束后, 用移液枪小心吸取上层, 避免吸入血细胞, 所得上层即为富血小板血浆(platelet-rich plasma, PRP), 将剩余下层再次离心, 3 000 r·min-1, 室温(23 ℃)离心10 min, 用移液器小心吸取上层, 即为贫血小板血浆(platelet-poor plasma, PPP)。取PRP, 1 800 r·min-1, 室温(23 ℃)离心10 min, 弃上清, 得到血小板沉淀, 加入血小板重悬液(7.78 g·L-1 NaCl、0.048 g·L-1 Na2HPO4、0.22 g·L-1 KCl、1.0 g·L-1 NaHCO3、0.90 g·L-1葡萄糖、0.095 g·L-1 MgCl2、4.77 g·L-1 HEPES和0.35% BSA), 即为洗涤血小板。通过LG-PABER-Ⅰ半自动凝血分析仪采用比浊法在37 ℃条件下测定血小板聚集率, 用PPP调零, 将PRP与药物孵育5 min, 加入诱导剂, 测定5 min, 用于测定丹酚酸A对ADP和AA诱导的血小板聚集的抑制作用。用0.35% BSA调零, 将洗涤血小板与药物孵育5 min, 加入诱导剂, 测定5 min, 用于测定丹酚酸A对THR诱导的血小板聚集的抑制作用。诱导剂的终浓度如下, ADP: 5×10-6 mol·L-1; AA: 5×10-3 mol·L-1; THR: 750 U·L-1。最大抑制率(%)= (MAR空白组-MAR给药组)/MAR空白组×100%, MAR:血小板最大聚集率。
正常大鼠体内抗血小板聚集实验 雄性SD大鼠随机分为6组, 每组5只, 分组情况如下, 空白对照组: 0.5%羧甲基纤维素钠(CMC-Na), 早晚各1次; 阿司匹林组: 100 mg·kg-1, 早晚各1次; 丹酚酸低剂量组: 1 mg·kg-1, 早晚各1次; 丹酚酸中剂量组: 3 mg·kg-1, 早晚各1次; 丹酚酸高剂量组: 10 mg·kg-1, 早晚各1次; 连续灌胃给药5天后, 在第6天测定血小板聚集。按上述实验方法制备PRP、PPP、洗涤血小板, 通过LG-PABER-Ⅰ半自动凝血分析仪采用比浊法在37 ℃条件下测定血小板聚集率, 用PPP调零, PRP孵育5 min, 加入诱导剂, 测定5 min, 用于测定丹酚酸A对ADP和AA诱导的血小板聚集的抑制作用。用0.35% BSA调零, 洗涤血小板孵育5 min, 加入诱导剂, 测定5 min, 用于测定丹酚酸A对THR诱导的血小板聚集的抑制作用。诱导剂的终浓度与上述“体外抗血小板聚集实验”浓度相同。
凝血功能的检测 动物分组及给药方法同上, 连续给药5天后, 大鼠用水合氯醛麻醉, 腹主动脉取血, 加入3.8%枸橼酸钠溶液1:9 (抗凝剂:血液)用于抗凝, 3 000 r·min-1, 室温(23 ℃)离心10 min, 待离心结束后, 用移液枪小心吸取上层用于凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplatin time, APTT)、凝血酶时间(thrombin time, TT)、纤维蛋白原(fibrinogen, FIB)的检测。
电凝法脑缺血模型的制备 雄性SD大鼠随机分为4组, 每组5只, 分组如下。空白对照组: 0.5% CMC-Na, 早晚各1次; 模型组: 0.5% CMC-Na, 早晚各1次; 阿司匹林组: 100 mg·kg-1, 早晚各1次; 丹酚酸A组: 10 mg·kg-1 (上述体内实验确定的最佳给药剂量), 具体方法在参照文献[11]的基础上改进, 大鼠用水合氯醛麻醉, 取仰卧位固定。剪开颈部皮肤, 钝性分离颈外静脉、颈总动脉与颈外动脉, 用动脉夹夹闭颈外动脉。剥离颈总静脉, 将其放入血管电击夹的沟槽内, 调整好高度和方向, 使用1.00 mA电流强度, 预刺激1 min, 再持续电刺激4 min。电刺激结束后, 取下电击夹, 使用动脉夹夹闭颈总动脉的远心端, 使用长度为1 cm的软质镊子夹动血栓, 使其变为小块血栓, 并见动脉恢复搏动并冲击碎栓, 放开动脉夹, 见到血栓进入颈内动脉后立即夹闭颈总动脉近心端15 min, 然后打开所有动脉夹, 缝合大鼠颈部皮肤。假手术组只分离不电凝, 其余步骤同手术组。
脑缺血模型的药效学评价
动物行为学评分 手术造模结束, 动物清醒后记为0 h, 立即进行mNSS评分, 在手术24 h后, 再次进行mNSS评分。
血小板聚集实验 行为学评分结束后, 腹主动脉取血, 按上述方法测定血小板聚集。
脑梗死面积和脑含水量检测 上述各组大鼠取血后, 处死大鼠, 小心剥取全脑, 称取全脑湿重, 称量结束后, 迅速于-40 ℃冷冻并切片。每片厚度2 mm。脑组织切片后, 使用0.5% TTC溶液于37 ℃孵育15 min, 更换4%多聚甲醛孵育20 min。然后按顺序摆放切片并拍摄照片。在进行数据处理时, 应用图像分析软件Image J处理并计算每张脑片的梗死面积, 乘以每片脑片的厚度2 mm, 每只动物所有脑片梗塞面积乘以厚度相加, 即为脑梗塞体积。梗塞体积以所占大脑半球的百分率来表示, 按下述公式计算梗死面积。脑梗塞体积(%)=[梗死面积-(同侧脑半球体积-对侧脑半球体积)]/对侧脑半球体积×100%, 以消除脑水肿的影响。待拍照结束后, 取每只大鼠的所有脑片于烘箱55 ℃烘烤48 h, 然后称量烘干后的全脑干重, 然后按照下述公式计算大鼠全脑含水量。大鼠全脑含水量(%) = (全脑湿重-全脑干重)/全脑湿重×100%。
统计学方法 实验结果以mean±SEM表示, 应用SPSS 19.0统计软件对各组数据进行处理, 采用单因素方差分析(one-way ANOVA), 各组间差异采用Tukey's post hoctest计算, P < 0.05视为具有统计学意义。
结果 1 体外抗血小板聚集作用的比较本研究首先检测了丹酚酸A和阿司匹林在体外的抗血小板聚集作用。丹酚酸A对ADP、AA和THR诱导的血小板聚集均有显著的抑制作用, 最大抑制率分别为32.32%、35.47%和96.83%, 且具有较好的量效关系。而阿司匹林对ADP和THR诱导的血小板聚集的抑制率分别为28.09%、15.6%, 对AA诱导的血小板聚集无抑制作用(图 1)。
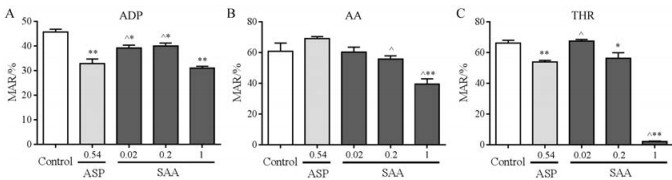
|
Figure 1 The antiplatelet effect of salvianolic acid A (SAA: 0.02, 0.2 and 1 μmol·L-1) and aspirin (ASP: 0.54 μmol·L-1) in vitro. Platelet aggregation was induced by adenosine diphosphate (ADP: 5×10-6 mol·L-1, A), arachidonic acid (AA: 5×10-3 mol·L-1, B) and thrombin (THR: 750 U·L-1, C), respectively. n = 3, mean ± SEM. *P < 0.05, **P < 0.01 vs control group; ^P < 0.05 vs ASP group. MAR: Maximum platelet aggregation rate |
为进一步比较丹酚酸A和阿司匹林抗血栓的作用, 连续给药5天后检测丹酚酸A和阿司匹林对正常大鼠血小板聚集的作用。实验结果表明, 丹酚酸A不同剂量组(1、3和10 mg·kg-1)和阿司匹林(100 mg·kg-1)均能显著抑制由ADP、AA、THR诱导的血小板聚集。丹酚酸A具有较好的量效关系, 对ADP、AA、THR诱导的血小板聚集的最大抑制率分别为32.70%、54.17%、8.19%, 阿司匹林的最大抑制率分别为28.74%、94.29%、10.93% (图 2)。
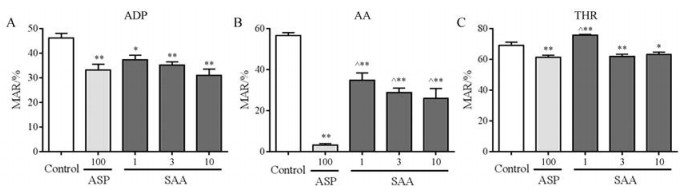
|
Figure 2 The antiplatelet effect of SAA (1, 3, 10 mg·kg-1) and ASP (100 mg·kg-1) in vivo. Platelet aggregation was induced by ADP (5×10-6 mol·L-1, A), AA (5×10-3 mol·L-1, B) and THR (750 U·L-1, C), respectively. n = 5, mean ± SEM. *P < 0.05, **P < 0.01 vs control group; ^P < 0.05 vs ASP group |
凝血四项(包括APTT、TT、PT和FIB)主要用于凝血功能的检查, 通过检测凝血四项可以评价药物对凝血系统的影响。如图 3所示, 丹酚酸A各剂量组对APTT、TT无明显作用, 但能显著降低FIB, 提高PT; 阿司匹林(100 mg·kg-1)作用类似, 对APTT、TT无明显作用, 显著升高PT, 降低FIB。

|
Figure 3 The effects of SAA (1, 3, 10 mg·kg-1) and ASP (100 mg·kg-1) on blood coagulation. A: Activated partial thromboplatin time (APTT); B: Thrombin time (TT); C: Prothrombin time (PT); D: Fibrinogen (FIB). n = 4, mean ± SEM. **P < 0.01 vs control group; ^P < 0.05 vs ASP group |
手术0和24 h后, 分别对动物进行mNSS评分。由图 4A可知, 丹酚酸A和阿司匹林均能显著降低手术0 h后的mNSS评分, 而手术24 h之后, 丹酚酸A仍能够降低mNSS评分, 但没有显著性差异, 而阿司匹林有增加mNSS评分的趋势, 表明随时间延长, 阿司匹林可能会加重神经功能损伤。
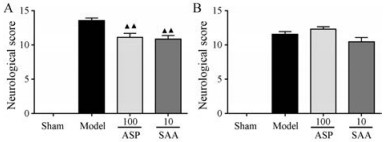
|
Figure 4 SAA (10 mg·kg-1) and ASP (100 mg·kg-1) treatment in thromboembolic stroke model. A: The mNSS score of animals after operation; B: The mNSS score of animals after 24 hours of operation. n = 4, mean ± SEM. ▲▲P < 0.01 vs model group |
进一步比较丹酚酸A和阿司匹林在模型动物中的抗血小板聚集作用。实验结果表明, 模型引起ADP诱导的血小板聚集率明显升高, 但对AA和THR诱导的血小板聚集无明显影响。丹酚酸A (10 mg·kg-1)和阿司匹林(100 mg·kg-1)均能显著抑制由ADP、AA诱导的血小板聚集。相比于模型组, 丹酚酸A对ADP、AA诱导的血小板聚集的抑制率分别为37.31%、33.86%, 阿司匹林的抑制率分别为28.55%、84.72% (图 5)。
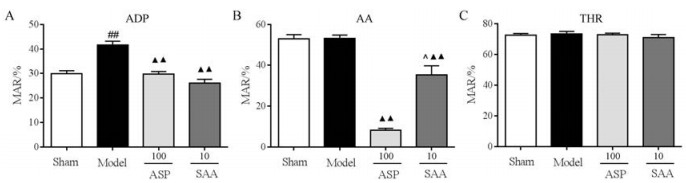
|
Figure 5 The antiplatelet effect of SAA (10 mg·kg-1) and ASP (100 mg·kg-1) in thromboembolic stroke model. Platelet aggregation induced by ADP (5×10-6 mol·L-1, A), AA (5×10-3 mol·L-1, B) and THR (750 U·L-1, C), respectively. n = 4, mean ± SEM. ▲▲P < 0.01 vs model group, ##P < 0.01 vs sham group, ^P < 0.05 vs ASP group |
如图 6A和B所示, TTC染色显示模型组大鼠缺血侧严重梗死,丹酚酸A可以显著降低脑梗死体积, 阿司匹林组对脑梗死体积具有降低的趋势, 但无显著性差异。对脑含水量的结果表明(图 6C), 缺血后大鼠的脑含水量明显增加, 丹酚酸A可以显著降低脑含水量, 阿司匹林对脑含水量无明显作用。
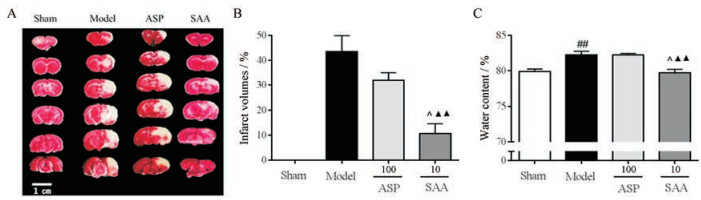
|
Figure 6 The neuroprotective effects of SAA (10 mg·kg-1) and ASP (100 mg·kg-1) in thromboembolic stroke model. A: The brain lesion was measured by TTC-staining; B: The effects of SAA (10 mg·kg-1) and ASP (100 mg·kg-1) on infarct volumes; C: The effects of SAA (10 mg·kg-1) and ASP (100 mg·kg-1) on the water content of brain. n = 4, mean ± SEM. ▲▲P < 0.01 vs model group; ##P < 0.01 vs sham group; ^P < 0.05 vs ASP group |
血栓性疾病是导致中老年人死亡的主要原因, 随着人口老龄化逐年增长, 对人类生命健康和生活质量产生严重威胁[12, 13]。过度活化的血小板与众多血栓性疾病直接相关, 因此, 抗血小板治疗成为血栓性疾病治疗的重要方向之一。阿司匹林是临床上常用的抗血小板药物, 长期服用具有抑制血小板聚集, 预防血栓形成的作用, 减少缺血事件的发生[14]。但是在临床应用过程中发现有的患者会对阿司匹林产生“抵抗效应”[15], 且在单独使用阿司匹林时, 会增加出血风险[16]。丹酚酸A作为一种天然产物, 其效应温和, 作用全面, 具有多种药理学活性。本研究通过比较丹酚酸A和阿司匹林抗血小板和抗血栓的作用差异, 初步明确了其作用特点, 为血栓性疾病的治疗提供实验依据。
体外抗血小板聚集的实验结果显示, 丹酚酸A(0.02、0.2和1 μmol·L-1)均可以抑制由AA、ADP、THR诱导的血小板聚集, 浓度为1 μmol·L-1时作用最强, 抑制率明显高于阿司匹林(0.54 μmol·L-1)。而在同等剂量下(0.54 μmol·L-1), 丹酚酸A与阿司匹林作用相当, 但作用机制明显不同。丹酚酸A对THR诱导的血小板聚集有显著抑制作用, 而阿司匹林作用并不明显。体内实验显示, 丹酚酸A和阿司匹林灌胃给药均能显著抑制由ADP、AA、THR诱导的血小板聚集。阿司匹林对AA诱导的血小板聚集抑制作用最强, 抑制率达到了94%, 这与阿司匹林抗血小板作用机制一致。而丹酚酸A对3种诱导剂的作用均有抑制作用, 最大抑制率在30%~55%, 且具有较好的量效关系。同时, 丹酚酸A与阿司匹林的给药剂量相差较大, 阿司匹林的给药剂量为丹酚酸A最大剂量的10倍, 而在ADP和THR诱导的血小板聚集中, 阿司匹林(100 mg·kg-1)与丹酚酸A (10 mg·kg-1)作用相当, 说明一定剂量范围内, 丹酚酸A的效价更高, 而不良反应的发生率可能会更低。此外, 体内和体外实验结果并不完全一致, 这可能与体内代谢过程有关。阿司匹林和丹酚酸A进入体内需要经过代谢吸收的过程, 而体外实验是直接作用于血小板, 因此会产生药效上的差异。凝血四项的检测结果显示, 阿司匹林和丹酚酸A对APTT和TT均无明显作用, 但对FIB和PT有一定作用, 这种作用的意义有待进一步研究。
血小板过度活化是导致血栓性疾病的重要原因。因此, 本研究不仅比较了阿司匹林和丹酚酸A在正常大鼠体内外抗血小板的作用, 还比较了两者在脑缺血模型大鼠中的作用。给药5天后, 电凝法制备大鼠脑缺血模型, 观察药物的抗血栓及抗血小板聚集作用。行为学结果显示, 丹酚酸A显著降低手术0 h后大鼠的行为学评分, 对24 h后的评分也有一定降低作用。而阿司匹林仅能降低0 h后大鼠的行为学评分, 对24 h后的评分甚至有增加趋势。这可能与缺血初期的损伤和血栓相关, 而阿司匹林和丹酚酸A均具有抗血栓作用, 所以对脑卒中初期具有保护作用。但是随着时间的推移, 损伤逐渐加重, 丹酚酸A不仅具有抗血栓作用, 还具有血管内皮[17]和神经保护[18, 19]作用, 从而对脑组织发挥更好的保护作用。血小板聚集实验结果表明, 模型可以显著引起ADP诱导的血小板聚集率升高, 表明模型可以引起血小板的过度活化。相比于模型组, 丹酚酸A和阿司匹林均能显著抑制ADP和AA诱导的血小板聚集, 丹酚酸A对血小板的抑制作用温和, 其抑制率为25%~40%;但阿司匹林作用较强, 其中对AA诱导的血小板聚集的抑制率高达84%, 这可能与阿司匹林单独服用时会增加出血事件的发生有关。此外, TTC染色和脑含水量结果表明, 丹酚酸A可以显著降低脑梗死面积和脑水肿, 而阿司匹林无明显作用。这些结果表明, 在血栓引起的脑损伤中, 丹酚酸A的作用要优于阿司匹林。结合前面抗血小板聚集的实验结果, 本研究认为丹酚酸A抗脑缺血的作用可能与其对血小板的抑制活性有关, 同时结合其他药理活性, 如抗氧化、抗炎、神经保护等作用, 共同介导了脑缺血的保护作用[20]。
本研究同时证明阿司匹林也具有较强的抗血小板作用, 尤其是对AA诱导的血小板聚集具有强大的抑制作用, 而这可能也是其容易引起出血的一个主要原因。在脑缺血模型中的结果表明, 阿司匹林对缺血后引起的病理过程无明显的改善作用。此外, 为进一步比较丹酚酸A和阿司匹林的作用特点, 下一步还需要在多种不同血栓性疾病中进行研究。
综上所述, 与阿司匹林相比, 丹酚酸A具有相似的抗血小板作用, 但作用机制不同, 丹酚酸A不仅对多种原因引起的血小板活化过程具有抑制作用, 抑制血栓的形成, 而且在血栓形成后, 可以通过其广泛的药理活性延缓血栓引起的疾病进展, 具有良好的应用前景。
| [1] | George JN. Platelets[J]. Lancet, 2000, 355: 1531–1539. DOI:10.1016/S0140-6736(00)02175-9 |
| [2] | Lordkipanidzé M. Platelet turnover in atherothrombotic disease[J]. Curr Pharm Des, 2012, 18: 5328–5343. DOI:10.2174/138161212803251952 |
| [3] | Li NL, Tan R, Wei M, et al. Salvianolic acid A, a new depside from roots of Salvia miltiorrhiza[J]. Planta Med, 1984, 50: 227–228. DOI:10.1055/s-2007-969684 |
| [4] | Zhang L, Zhang WK, Zhao Y, et al. Research progress of salvianolic acid A[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 2603–2609. |
| [5] | Li YJ, Duan CL, Liu JX. Salvianolic acid A promotes the acceleration of neovascularization in the ischemic rat myocardium and the functions of endothelial progenitor cells[J]. J Ethnopharmacol, 2014, 151: 218–227. DOI:10.1016/j.jep.2013.10.019 |
| [6] | Huang ZS, Zeng CL, Zhu LJ, et al. Salvianolic acid A inhibits platelet activation and arterial thrombosis via inhibition of phosphoinositide 3-kinase[J]. J Thromb Haemost, 2010, 8: 1383–1393. DOI:10.1111/j.1538-7836.2010.03859.x |
| [7] | Fan HY, Fu FH, Yang MY, et al. Antiplatelet and antithrombotic activities of salvianolic acid A[J]. Thromb Res, 2010, 126: e17–e22. DOI:10.1016/j.thromres.2010.04.006 |
| [8] | Guo ZR. Enduring aspirin[J]. Acta Pharm Sin (药学学报), 2015, 50: 506–508. |
| [9] | Yang Z, Liu JR. Application of aspirin in the primary prevention of stroke[J]. Chin J Contemp Neurol Neurosurg (中国现代神经疾病杂志), 2015, 15: 103–107. |
| [10] | Olga K, Karen G, Matthew TH, et al. PKCα regulates platelet granule secretion and thrombus formation in mice[J]. J Clin Invest, 2009, 119: 399–407. |
| [11] | Ma YZ, Du GH. Establishment and evaluation of intravascular thrombosis used for cerebral embolism model[J]. Chin Pharmacol Bull (中国药理学通报), 2015, 31: 1620–1623. |
| [12] | Vallon M, Chang JL, Zhang HJ, et al. Developmental and pathological angiogenesis in the central nervous system[J]. Cell Mol Life Sci, 2014, 71: 3489–3506. DOI:10.1007/s00018-014-1625-0 |
| [13] | El Haouari M, Rosado JA. Platelet signalling abnormalities in patients with type 2 diabetes mellitus:a review[J]. Blood Cells Mol Dis, 2008, 41: 119–123. DOI:10.1016/j.bcmd.2008.02.010 |
| [14] | Rauzi F, Kirkby NS, Edin ML, et al. Aspirin inhibits the production of proangiogenic 15S-HETE by platelet cyclooxygenase-1[J]. FASEB J, 2016, 30: 4256–4266. DOI:10.1096/fj.201600530R |
| [15] | Alemanno L, Massimi I, Klaus V, et al. Impact of multidrug resistance protein-4 inhibitors on modulating platelet function and high on-aspirin treatment platelet reactivity[J]. Thromb Haemost, 2018, 118: 490–501. DOI:10.1055/s-0038-1629920 |
| [16] | Johnston SC, Easton JD, Farrant M, et al. Clopidogrel and aspirin in acute ischemic stroke and high-risk TIA[J]. N Engl J Med, 2018, 379: 215–225. DOI:10.1056/NEJMoa1800410 |
| [17] | Zhang Z, Qi D, Wang X, et al. Protective effect of salvianolic acid A on ischaemia-reperfusion acute kidney injury in rats through protecting against peritubular capillary endothelium damages[J]. Phytother Res, 2018, 32: 103–114. DOI:10.1002/ptr.v32.1 |
| [18] | Chien MY, Chuang CH, Chern CM, et al. Salvianolic acid A alleviates ischemic brain injury through the inhibition of inflammation and apoptosis and the promotion of neurogenesis in mice[J]. Free Radic Biol Med, 2016, 99: 508–519. DOI:10.1016/j.freeradbiomed.2016.09.006 |
| [19] | Zhang W, Song JK, Du GH, et al. Salvianolic acid A alleviate the brain damage in rats after cerebral ischemia-reperfusion through Nrf2/HO-1 pathway[J]. Acta Pharm Sin (药学学报), 2016, 51: 1717–1723. |
| [20] | Du GH, Sun L, Zhao R, et al. Polyphenols:potential source of drugs for the treatment of ischaemic heart disease[J]. Pharmacol Ther, 2016, 162: 23–34. DOI:10.1016/j.pharmthera.2016.04.008 |
 2019, Vol. 54
2019, Vol. 54


