2. 哈尔滨商业大学生命科学与环境科学研究中心, 黑龙江 哈尔滨 150076
2. Research Center on Life Sciences and Environmental Sciences, Harbin University of Commerce, Harbin 150076, China
近年来, 我国糖尿病的发病率逐年增高, 继发于糖尿病的心血管并发症已成为糖尿病患者死亡的主要原因。其中, 糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病患者的主要并发症之一, 发病率高, 危害性大, 与糖尿病患者心血管疾病的高发生率和高病死率密切相关[1]。
灯盏细辛, 是菊科植物短葶飞蓬Erigeron breviscapus (Vant.) Hand-Mazz的干燥全草, 分布于我国西南地区。其主要用于治疗冠心病、心绞痛、脑卒中等症, 在糖尿病、肾病、颈性眩晕、老年性疾病的治疗上也有较好的疗效[2, 3]。灯盏乙素(scutellarin, Scu)是灯盏细辛的主要活性成分。研究发现灯盏乙素可以调节心脑血管功能, 对心绞痛、心肌梗死、脑卒中、脑血栓以及与血管内皮细胞相关的功能性障碍等疾病有保护效应[4]。尽管灯盏乙素对心血管系统具有明显的保护作用, 但其在糖尿病心肌病保护的药效学及机制方面研究基础薄弱, 分子机制不清。本研究通过高脂喂养及链脲佐菌素(streptozotocin, STZ)诱导的2型糖尿病小鼠模型(T2DM), 观察灯盏乙素对DCM的影响, 并探讨其减轻DCM的分子机制。
材料与方法实验动物 SPF级C57BL/6J雄性小鼠100只, 体质量18~22 g, 购于北京维通利华实验动物技术有限责任公司, 合格证号: SCXK (京) 2014-0001。自由进食进水, 室温保持在(24±1) ℃, 每天照明12 h (8:00~20:00), 实验过程均符合北京协和医学院动物保护委员会的相关规定。
试剂 灯盏乙素购于上海融禾医药科技发展有限公司, 纯度 > 98%;普通饲料及高脂饲料购于北京华阜康公司; 罗氏活力型血糖仪及试纸条购自美国罗氏公司; 链脲佐菌素(STZ)购于美国Sigma-Aldrich公司; 乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)、总超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-PX)、考马斯亮蓝试剂盒购自南京建成生物工程研究所; collagen Ⅰ、collagen Ⅲ、IFNγ、IL-1β、MCP-1、TNFα ELISA试剂盒购于北京海泰通达科技有限公司; Nrf2、NFкB、AKT、p-AKT、β-actin、Lamin B等抗体购自美国Abcam公司; BCA试剂盒试剂盒、电泳液、转膜液购于碧云天生物技术公司。
仪器 石蜡切片机(德国Leica公司); 倒置显微镜、荧光显微镜(日本Olympus公司); 电泳仪(美国Bio-Rad公司); 酶标仪(瑞士Tecan公司); 离心机(中国Anke公司)。
动物模型的建立及分组 100只C57BL/6J小鼠适应性饲养1周后, 按体重随机取20只作为正常对照组, 实验过程始终给予普通饲料喂养。T2DM造模组80只, 采用高脂饲料喂养4周后, 禁食不禁水12 h, 一次性腹腔注射50 mg∙kg-1 STZ (以柠檬酸-柠檬酸钠缓冲液稀释, pH 4.5, 4 ℃配制, 随配随用), 继续高脂饲养, 正常组注射等体积的柠檬酸缓冲液。造模组注射STZ后第3天和第5天禁食不禁水4 h, 尾静脉采血检测血糖, 血糖值连续2次大于14 mmol∙L-1, 视为T2DM造模成功。如血糖不合格则再次注射STZ。将存活并成模的T2DM小鼠随机分为4组:模型组DM (20只)、DM+Scu (7.5 mg∙kg-1)组(17只)、DM+Scu (17 mg∙kg-1) (18只)、DM+Scu (30 mg∙kg-1) (18只)。各给药组分别腹腔注射给药8周, 对照组及DM组使用生理盐水注射8周。
血糖测定 给药8周后, 禁食不禁水4 h, 经尾静脉测空腹血糖。
心肌收缩功能检测 M型超声心动图用VEVO 770TM高分辨率成像系统(加拿大VisualSonics Inc公司)进行检测[5]。腹腔注射1.2% 2, 2, 2-三溴乙醇进行麻醉(0.02 mL∙g-1体重)。然后将小鼠的胸部剃毛, 置于卧位, 测定并计算左心室收缩期内径(LVDs)及左心室舒张期内径(LVDd)、左心室缩短分数(FS)、射血分数(EF)。
取材及生化指标检测 称取小鼠体重, 眼球取血, 仰卧位固定, 打开胸腔, 将针头插入左心室, 生理盐水灌注至肝脏颜色发白, 取下心脏称重, 计算心脏重量(mg)与体重(g)的比例。每组8只小鼠心脏用多聚甲醛固定, 其他心脏冻于-80 ℃冰箱。血液静置30 min后3 500 r∙min-1离心10 min, 取血清4 ℃保存用于生化指标检测。按照试剂盒说明书分别测定LDH、CK-MB、SOD、CAT、MDA、GSH-PX水平, ELISA法测定炎性因子IFNγ、IL-1β、MCP-1、TNFα水平。心肌组织按质量体积比1:9加生理盐水, 匀浆后3 000 r∙min-1离心10 min, 取上清按试剂盒说明书测定collagen Ⅰ和collagen Ⅲ水平。
心肌组织Masson染色 取左心室心肌组织, 用4%多聚甲醛固定, 常规石蜡包埋, 制作切片, 脱蜡后行Masson染色, 光镜下观察心肌细胞呈红色, 胶原纤维呈蓝色, 每张切片在200倍光学显微镜下观察并随机选取5个视野拍照。
Western blot检测心肌组织蛋白表达 心肌组织按质量体积比1:9加生理盐水, 匀浆后3 000 r∙min-1离心10 min。弃去上清, 沉淀加入组织裂解液重悬, 于4 ℃裂解1 h, 12 000 r∙min-1离心15 min, 收集上清液即为总蛋白, 细胞核蛋白提取按核蛋白抽提试剂盒操作说明进行。BCA法测定蛋白浓度, 每组取20 g总蛋白, 12% SDS-PAGE分离蛋白, 用电转移法将蛋白质转移至PVDF膜, 5%脱脂奶粉室温封闭3 h, 分别加入Nrf2、NFкB、AKT、p-AKT、β-actin、Lamin B一抗, 4 ℃过夜; TBST溶液洗涤3次(每次5 min), 加入辣根素过氧化酶标记的二抗, 室温孵育4 h, TBST溶液洗膜3次(每次5 min), 化学发光法显影。
统计学分析 所有实验均重复3次, 采用SPSS 18.0软件对数据进行分析, 计量资料用均数±标准差表示, 各组间比较用单因素方差分析法, 以P < 0.05为差异有统计学意义。
结果 1 灯盏乙素对糖尿病小鼠血糖、心重、体重和心体比的影响如图 1所示, DM小鼠出现高血糖, 体重较对照组小鼠降低, 心体比升高(P < 0.01)。与DM小鼠比较, 灯盏乙素各剂量组均可降低心体比(P < 0.01), 但对小鼠血糖和体重没有显著影响。结果提示, 灯盏乙素可能对DM模型小鼠的心脏具有一定的保护作用。
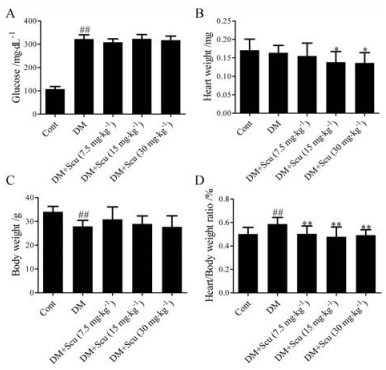
|
Figure 1 Effects of scutellarin (Scu) on glucose (A), heart weight (B), body weight (C), and heart/body weight ratio (D) in diabetic mice. n = 15-20, x± s. ##P < 0.01 vs control (Cont) group; *P < 0.05, **P < 0.01 vs diabetic model (DM) group |
图 2A为小鼠超声心动图, 统计结果如图 2B所示, 与对照组小鼠比较, 模型小鼠LVDd、LVDs、EF、FS显著下降(P < 0.01)。灯盏乙素给药8周后, 与模型组小鼠比较, 15和30 mg∙kg-1剂量可显著增加LVDd、LVDs、EF、FS水平(P < 0.05或P < 0.01), 超声心动结果显示, 灯盏乙素能有效地防止糖尿病小鼠心肌功能的衰退, 且其作用存在剂量依赖性。
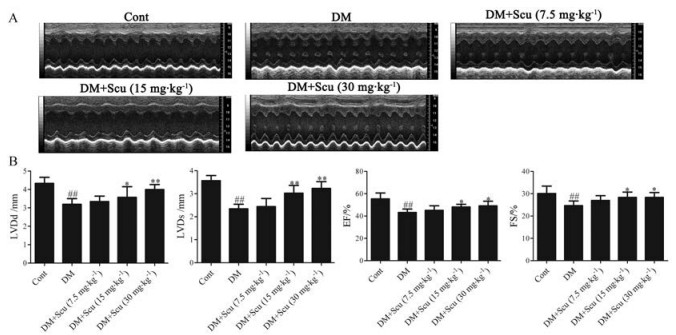
|
Figure 2 Effects of Scu on left ventricular functions in diabetic mice. A: Representative images of M-mode echocardiogram; B: Effects of Scu on left ventricular functions in diabetic mice. EF: Ejection fraction; FS: Fractional shortening; LVDd: Left ventricular internal diameter at diastolic phase; LVDs: Left ventricular internal diameter at systolic phase. n = 12, x± s. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs DM group |
如图 3所示, 各组小鼠心肌组织Masson染色显示, 对照组小鼠左心室心肌间血管和心肌间质可见少许胶原纤维沉积; 模型组小鼠的胶原纤维沉积显著增加, 心肌纤维排列明显紊乱, 心肌细胞间隙增宽, 间质可见纤维化; 统计结果显示, 与模型组相比, 15和30 mg∙kg-1灯盏乙素可以明显减少心肌间质胶原纤维的沉积(P < 0.01), 提示灯盏乙素可以减轻糖尿病小鼠心肌组织纤维化。
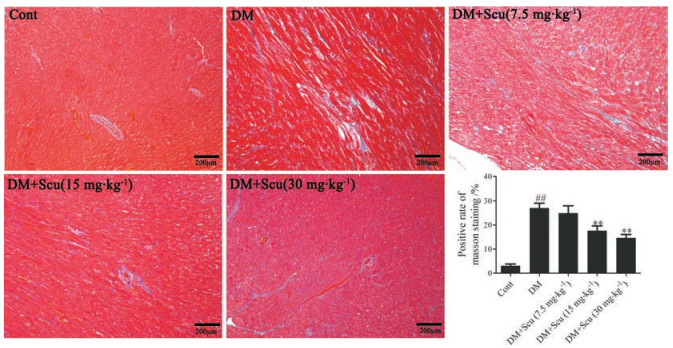
|
Figure 3 Effects of Scu on myocardial fibrosis in diabetic mice. n = 8, x± s. ##P < 0.01 vs control group; **P < 0.01 vs DM group |
如图 4所示, 进一步通过ELISA法检测心肌组织collagen Ⅰ和collagen Ⅲ的水平, 与对照组相比, 模型组小鼠心肌组织collagen Ⅰ和collagen Ⅲ表达水平明显升高(P < 0.01);与模型组相比较, 灯盏乙素可以显著降低糖尿病小鼠心肌组织collagen Ⅰ和collagen Ⅲ的表达(P < 0.05或P < 0.01)。
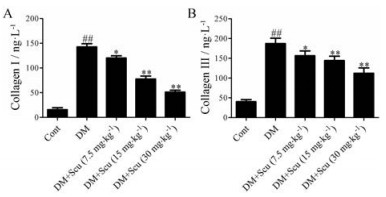
|
Figure 4 Effects of Scu on collagen Ⅰ (A) and Ⅲ (B) levels in cardiac tissues of diabetic mice. n = 8, x± s. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs DM group |
为了研究灯盏乙素对糖尿病小鼠心肌组织损伤及抗氧化能力的影响, 本研究检测了小鼠血清中LDH、CK-MB、MDA、SOD、CAT和GSH-Px的变化。LDH和CK-MB能一定程度反映心肌损伤情况, 结果表明(图 5)与对照组相比, 模型组小鼠LDH和CK-MB水平显著升高(P < 0.01), 灯盏乙素可以剂量依赖性地降低LDH和CK-MB水平, 其中15和30 mg∙kg-1组具有统计学差异(P < 0.05或P < 0.01), 提示灯盏乙素可以减轻糖尿病小鼠心肌组织损伤。MDA是细胞内的脂质过氧化物, 其含量反映细胞氧化损伤的程度, SOD、CAT与GSH-Px是细胞内的抗氧化酶, 对细胞的氧化损伤起着重要的保护作用。如图 5所示, 模型组的MDA含量较正常组明显升高(P < 0.01), 灯盏乙素可剂量依赖性降低MDA水平(P < 0.05或P < 0.01)。另一方面, 与对照组相比, 模型组的抗氧化酶SOD、CAT与GSH-Px活力都明显下降(P < 0.01)。而灯盏乙素治疗组的抗氧化酶水平较模型组均显著增加(P < 0.05或P < 0.01)。提示灯盏乙素可以增加糖尿病小鼠心肌组织抗氧化能力, 减轻心肌组织氧化损伤。
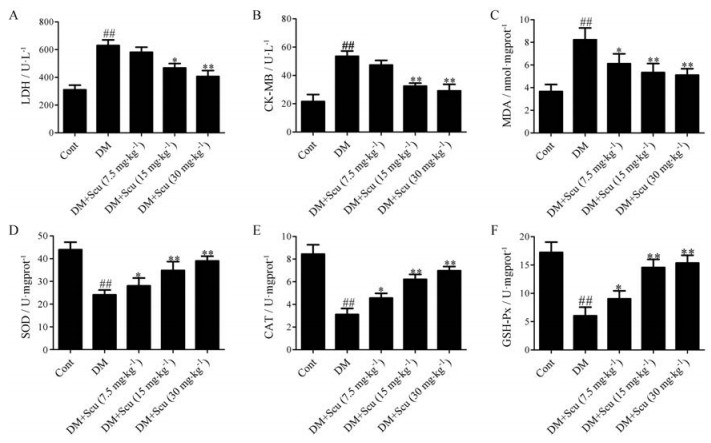
|
Figure 5 Effects of Scu on LDH (A), CK-MB (B), MDA (C), SOD (D), CAT (E), GSH-Px (F) levels in serum of diabetic mice. n = 15, x± s. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs DM group |
为了研究灯盏乙素对糖尿病小鼠心肌组织炎性损伤的影响, 本研究通过ELISA检测了小鼠血清中IFNγ、IL-1β、MCP-1、TNFα水平的变化。结果表明(图 6), 与对照组相比, 模型组小鼠心肌组织IFNγ、IL-1β、MCP-1、TNFα水平显著升高(P < 0.01), 灯盏乙素可以剂量依赖性地降低IFNγ、IL-1β、MCP-1、TNFα水平(P < 0.05或P < 0.01), 提示灯盏乙素心肌保护作用可能与降低糖尿病小鼠心肌组织炎性因子的生成有关。
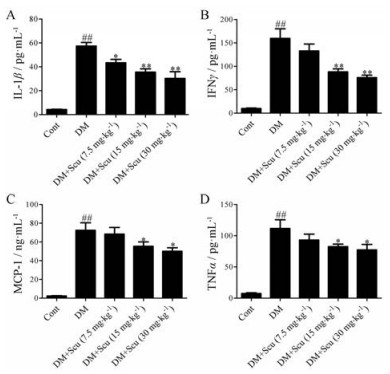
|
Figure 6 Effects of Scu on IL-1β (A), IFNγ (B), MCP-1 (C), TNFα (D) levels in serum of diabetic mice. n = 15, x± s. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs DM group |
Nrf2/ARE信号通路是体内重要的抗氧化信号通路, 本研究推测灯盏乙素的抗氧化作用可能与该通路相关, 根据Western blot的结果(图 7)可知, 与正常组相比, 模型组Nrf2核转位有所增加, 但没有统计学意义; 与模型组相比, 灯盏乙素可以显著增加Nrf2的核转位(P < 0.01), 从而使细胞内源性抗氧化作用不断增强。此外, NFкB是体内非常重要的炎性信号通路, Western blot的结果(图 7)显示模型组细胞核内NFкB水平显著升高(P < 0.01), 而灯盏乙素可以剂量依赖性降低NFкB的核转位(P < 0.01)。以上研究结果提示, 灯盏乙素抗氧化和抗炎作用有可能是通过激活Nrf2信号通路和抑制NFкB信号通路来实现的。

|
Figure 7 Effects of Scu on nuclear transposition of Nrf2 and NFкB in cardiac tissues of diabetic mice. a: Control; b: DM; c: DM+Scu (7.5 mg∙kg-1); d: DM+Scu (15 mg∙kg-1); e: DM+Scu (30 mg∙kg-1). n = 3, x± s. ##P < 0.01 vs control group; **P < 0.01 vs DM group |
PI3K/AKT是非常重要的生存调节信号通路, 可以通过调节下游蛋白激酶级联反应产生生理作用, 在糖尿病心肌病中起到关键作用。Western blot的结果(图 8)显示, 模型组p-AKT表达水平显著降低(P < 0.01), 而灯盏乙素可以升高AKT的磷酸化水平(P < 0.01)。以上研究结果提示, 灯盏乙素心肌保护作用可能与激活PI3K/AKT信号通路有关。
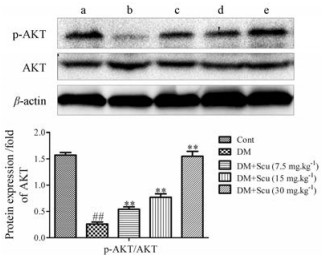
|
Figure 8 Effects of Scu on phosphorylation level of AKT in cardiac tissues of diabetic mice. a: Control; b: DM; c: DM+Scu (7.5 mg∙kg-1); d: DM+Scu (15 mg∙kg-1); e: DM+Scu (30 mg∙kg-1). n = 3, x± s. ##P < 0.01 vs control group; **P < 0.01 vs DM group |
心肌纤维化是糖尿病心肌病的重要特征, 主要表现为大量的胶原沉积于心肌间质, 从而影响心肌收缩及舒张功能, 导致心功能不全, 也与心律失常, 甚至心源性猝死的发生密切相关[6]。心肌纤维化是一个复杂的病理过程, 其中氧化应激损伤、炎症反应常与心肌纤维化并存, 在糖尿病心肌纤维化的发生发展过程中具有十分重要的作用。本研究发现灯盏乙素可以显著改善糖尿病小鼠的心肌收缩功能, 减轻心肌损伤。进一步研究发现其可以显著降低心肌组织胶原酶的沉积, 减轻心肌纤维化水平。
DCM发病机制复杂, 其中氧化应激和炎症反应是非常重要的始动因素。由高糖引起过量的氧自由基, 可诱导细胞膜功能障碍和损伤、通透性增加及离子转运功能障碍, 引起钙超载、炎症因子释放, 进而造成心肌细胞凋亡和心室功能障碍[7]。DCM还涉及心肌炎症反应及炎性因子的生成, 炎性因子不仅引起心肌电生理重构和心律失常, 还直接改变心肌细胞的生理状态, 诱发大量细胞凋亡、坏死、纤维化, 进而导致心力衰竭而危及生命[8]。本研究发现, 灯盏乙素可以降低糖尿病小鼠脂质过氧化产物及增强抗氧化酶活力, 并降低血清中炎性因子的水平, 其抗心肌纤维化作用可能与抗氧化及抗炎作用有关。
Nrf2/ARE通路作为重要的内源性抗氧化应激通路[9], 也是药物减轻DCM非常重要的作用靶点。作为调控细胞对抗氧化损伤的关键转录因子, Nrf2的缺失或激活障碍会提高细胞的氧化应激敏感性[10]。TLRs/NFκB是控制炎性细胞因子生成的重要信号通路, 是糖尿病心肌损伤的重要机制之一[11]。大量的实验研究表明, 糖尿病可以通过多种途径诱导Toll样受体4 (TLR4)的活化, 进而激活NFκB [12]。因此, 抑制TLR4/NFκB信号通路的激活对保护糖尿病心肌损伤非常重要。本研究发现, 灯盏乙素可以显著增加糖尿病小鼠心肌组织Nrf2的核转位, 降低NFκB的核转位。因此, 其抗氧化及抗炎作用可能与激活Nrf2信号通路及抑制NFκB信号通路有关。Nrf2及NFκB信号通路受多种信号通路的调节[7], 本研究发现灯盏乙素可以增加糖尿病小鼠心肌组织AKT的磷酸化, 其对Nrf2及NFκB信号通路的调节可能与激活PI3K/AKT信号通路有关。
有研究发现Nrf2和NFкB信号间的串扰可以调节多种病理生理过程。如Nrf2介导的抗肿瘤作用就是通过激活抗氧化通路及抑制NFкB介导的促炎信号通路来实现的。Nrf2的激动剂可以抑制IKK/IкB的磷酸化和NFкB的核转位。此外, NFκB通过与Nrf2竞争转录激活因子环磷腺苷效应元件结合蛋白(CBP)直接抑制Nrf2的转录[13]。Nrf2的激活可以抑制NFκB, 进而减轻糖尿病心肌病[14]。因此, 基于Nrf2和NFкB信号间串扰的有益调控, 对探寻糖尿病心肌病保护药物提供了新思路。
综上, 本研究证实灯盏乙素可以降低糖尿病小鼠心肌组织氧自由基及炎性因子的生成, 降低心肌纤维化发生, 进而提高糖尿病小鼠的心肌收缩功能。其作用机制可能与激活PI3K/AKT信号通路, 进而激活Nrf2信号通路, 抑制NFкB信号通路有关。
| [1] | Liu Q, Wang SD, Cai L, et al. Diabetic cardiomyopathy and its mechanisms:role of oxidative stress and damage[J]. J Diabetes Invest, 2014, 5: 623–634. DOI:10.1111/jdi.2014.5.issue-6 |
| [2] | Wang C, Li Y, Gao S, et al. Breviscapine injection improves the therapeutic effect of western medicine on angina pectoris patients[J]. PLoS One, 2015, 10: e0129969. DOI:10.1371/journal.pone.0129969 |
| [3] | Guo C, Zhu YR, Weng Y, et al. Therapeutic time window and underlying therapeutic mechanism of breviscapine injection against cerebral ischemia/reperfusion injury in rats[J]. J Ethnopharmacol, 2014, 151: 660–666. DOI:10.1016/j.jep.2013.11.026 |
| [4] | Wang Z, Yu J, Wu J, et al. Scutellarin protects cardiomyocyte ischemia-reperfusion injury by reducing apoptosis and oxidative stress[J]. Life Sci, 2016, 157: 200–207. DOI:10.1016/j.lfs.2016.01.018 |
| [5] | Sun X, Chen RC, Yang ZH, et al. Taxifolin prevents diabetic cardiomyopathy in vivo and in vitro by inhibition of oxidative stress and cell apoptosis[J]. Food Chem Toxicol, 2014, 63: 221–232. DOI:10.1016/j.fct.2013.11.013 |
| [6] | Wang LY, Yang SJ. The function of protein kinase C in myocardial fibrosis[J]. Acta Pharm (药学学报), 2010, 45: 1467–1471. |
| [7] | Zhou X, Ma L, Habibi J, et al. Nebivolol improves diastolic dysfunction and myocardial remodeling through reductions in oxidative stress in the Zucker obese rat[J]. Hypertension, 2010, 55: 880–888. DOI:10.1161/HYPERTENSIONAHA.109.145136 |
| [8] | Hamid T, Guo SZ, Kingery JR, et al. Cardiomyocyte NF-κB p65 promotes adverse remodelling, apoptosis, and endoplasmic reticulum stress in heart failure[J]. Cardiovasc Res, 2011, 89: 129–138. DOI:10.1093/cvr/cvq274 |
| [9] | Brigelius-Flohé R, Flohé L. Basic principles and emerging concepts in the redox control of transcription factors[J]. Antioxid Redox Signal, 2011, 15: 2335–2381. DOI:10.1089/ars.2010.3534 |
| [10] | de Vries D, Kortekaas K, Tsikas D, et al. Oxidative damage in clinical ischemia/reperfusion injury:a reappraisal[J]. Antioxid Redox Signal, 2013, 19: 535–545. DOI:10.1089/ars.2012.4580 |
| [11] | Lorenzo O, Picatoste B, Ares-Carrasco S, et al. Potential role of nuclear factor κB in diabetic cardiomyopathy[J]. Mediators Inflamm, 2011, 2011: 652097. |
| [12] | Ma Y, Zhang X, Bao H, et al. Toll-like receptor (TLR) 2 and TLR4 differentially regulate doxorubicin induced cardiomyopathy in mice[J]. PLoS One, 2012, 7: e40763. DOI:10.1371/journal.pone.0040763 |
| [13] | Liu GH, Qu J, Shen X, et al. NF-κB/p65 antagonizes Nrf2-ARE pathway by depriving CBP from Nrf2 and facilitating recruitment of HDAC3 to MafK[J]. Biochim Biophys Acta, 2008, 1783: 713–727. DOI:10.1016/j.bbamcr.2008.01.002 |
| [14] | Zhong P, Wu LP, Qian YY, et al. Blockage of ROS and NF-κB-mediated inflammation by a new chalcone L6H9 protects cardiomyocytes from hyperglycemia-induced injuries[J]. Biochim Biophys Acta, 2015, 1852: 1230–1241. DOI:10.1016/j.bbadis.2015.02.011 |
 2019, Vol. 54
2019, Vol. 54


