和厚朴酚(honokiol)是传统中药厚朴(Magnoliae officinalis)的主要有效成分之一, 具有抗炎、抗肿瘤、抗氧化等多重活性[1, 2]。但和厚朴酚水溶性极差, 口服生物利用度很低, 一定程度上限制了其应用与开发。纳米混悬剂(nanosuspension)具有粒径小、制备方法简单和载药量高等优势, 在提高难溶药物的溶解度和溶出速率等方面具有重要作用[3], 能够显著增加和厚朴酚的口服生物利用度与疗效[4, 5]。
近年研究发现, 和厚朴酚能够降低糖尿病模型动物血糖水平, 其可能的作用机制包括抗氧化应激[6], 激活转录因子PPARγ[7], 抑制PTP1B活性[8]等, 从多途径改善胰岛素抵抗实现降糖作用。胰高血糖素分泌与肝脏糖异生失衡, 导致肝脏葡萄糖过量输出, 造成空腹与餐后血糖升高, 是2型糖尿病的病理特点, 也是降糖药物研发的新靶点之一。本研究采用Bottom up法制备和厚朴酚纳米混悬剂, 比较其与和厚朴酚混悬液降糖疗效的差异, 并进一步考察和厚朴酚对胰高血糖素与肝脏糖异生是否具有调节作用, 为其有效开发利用奠定实验基础。
材料与方法药品与试剂 盐酸二甲双胍缓释片(格华止), 中美上海施贵宝制药有限公司; 和厚朴酚原料药(纯度 > 98%, 批号: JZ15031502), 南京景竹生物科技有限公司; 羧甲基纤维素钠(CMC-Na)、葡萄糖, Sigma公司; 甲醇、无水乙醇, Greagent公司; 胰岛素与胰高血糖素放射免疫试剂盒, 北京北方生物技术研究所; 泊洛沙姆407 (F127, 批号WPAJ508B), 北京风礼精求商贸有限责任公司; 泊洛沙姆188(F68, 批号20140501), 南京威尔化工有限公司; RIPA蛋白裂解液, 碧云天生物技术有限公司; 蛋白酶抑制剂与磷酸酶抑制剂, Med Chem Express公司; BCA蛋白定量试剂盒、ECL化学发光显色液, 南京诺唯赞公司; p-AMPK、AMPK、p-GSK3β、GSK3β、p-FOXO1、FOXO1、PEPCK1抗体, Cell Signaling公司; PVDF膜、血糖仪试纸, 德国罗氏公司。
实验仪器 AT201十万分之一天平, 瑞士METTLER公司; 85-1型磁力搅拌器, 金坛市医疗仪器厂; RV10型旋转蒸发仪, 德国IKA公司; Milli-Q型纯水机, 美国Millipore公司; JEM-2100型透射电子显微镜, 日本JEOL公司; 马尔文粒径分析仪, 英国Zetasizer Nano-ZS公司; 高速冷冻离心机, 美国Beckman公司; Western blot凝胶电泳转膜系统, 美国Bio-Rad公司; 化学发光凝胶成像系统, 上海Tanon天能公司; ACCU-CHEK血糖仪, 德国罗氏公司。
实验动物 周龄正常雄性C57BL/6J小鼠, 购自上海斯莱克实验动物有限责任公司, 许可证编号为SCXK (沪) 2017-0005。饲养于南京中医药大学附属中西医结合医院SPF级动物中心。动物实验获得南京中医药大学附属中西医结合医院动物伦理委员会批准。适应性喂养1周, 参照文献[9]建立高脂诱导的2型糖尿病小鼠模型。高脂饲料, 上海斯莱克公司(p1004f)持续喂养10周, 小鼠出现多饮、多食、多尿症状, 检测小鼠空腹血糖均值为8.78 mmol·L-1, 而正常饲料喂养对照组小鼠空腹血糖均值为5.88 mmol·L-1, 确认糖尿病模型成功。动物实验方案如下:正常饮食组(normal diet, ND); 高脂饮食组(high fat diet, HFD); 高脂/和厚朴酚CMC钠混悬液组(100 mg·kg-1, HFD/Hono-CMC, 采用0.5% CMC-Na溶解制备和厚朴酚混悬液)、高脂/和厚朴酚纳米混悬剂组(80 mg·kg-1, 为预实验给药14天有效降糖剂量, HFD/Hono-Nano)、高脂/二甲双胍组(200 mg·kg-1, HFD/Met)。连续灌胃给药30天, ND与HFD组以生理盐水为对照。每7天检测小鼠空腹体重(body weight, BW)与血糖(blood glucose, BG)。给药结束后, 进行空腹葡萄糖耐量实验(oral glucose tolerance test, OGTT)。小鼠禁食12 h, 口服葡萄糖2 g·kg-1, 于糖负荷前的0 min, 糖负荷后的30、60、90、120 min尾尖采血测定血糖。并计算血糖曲线下面积(AUC, h·mmol·L-1):
| ${\rm{AUC = 0}}{\rm{.5}} \times \left( {1/2 \times {\rm{B}}{{\rm{G}}_0} + {\rm{B}}{{\rm{G}}_{30}} + {\rm{B}}{{\rm{G}}_{60}} + {\rm{B}}{{\rm{G}}_{90}} + 1/2 \times {\rm{B}}{{\rm{G}}_{120}}} \right) $ |
Western blot实验 取小鼠肝脏组织约100 mg, 1:6加入RIPA蛋白裂解液, 超声匀浆, 充分裂解, 冰浴放置30 min。离心后取上清, 获得总蛋白样品, 采用BCA法蛋白定量。进行SDS-PAGE电泳及转膜, 蛋白上样量为30 μg。PVDF膜用含有5%脱脂奶粉的TBST溶液室温封闭2 h, 加入一抗(1:1 000稀释), 4 ℃孵育过夜。TBST洗膜3次, 每次5 min, 加入辣根过氧化物酶标记的二抗(1:4 000稀释), 室温孵育1 h, TBST洗涤3次, 滴加ECL化学发光显色, 天能化学发光凝胶成像系统采集图像并进行分析。
和厚朴酚羧甲基纤维素钠混悬液配置 取100 mL双蒸水, 置于磁力搅拌器均匀加热至50~60 ℃, 称取0.5 g CMC-Na, 分批加入水中, 磁力搅拌器加热搅拌5~6 h, 直至溶液澄清, 趁热脱脂棉过滤, 冷却即得0.5% CMC-Na溶液。取适量CMC-Na溶液加入和厚朴酚, 磁力搅拌混匀, 配置成浓度为10 mg·mL-1和厚朴酚羧甲基纤维素钠混悬液, 每日给药前混匀。
和厚朴酚纳米混悬剂制备工艺 参照文献[4, 5]采用Bottom up法制备纳米混悬剂。通过预实验, 确定制备方法如下:称取36 mg泊洛沙姆F127与9 mg泊洛沙姆F68 (F127与F68的质量比为4:1)于烧杯中, 加入5 mL水, 搅拌至全部溶解, 形成水相。称取15 mg和厚朴酚溶解于2 mL无水乙醇中, 形成含药有机相。将有机相在磁力搅拌下快速注入水相中形成初悬液, 通过旋转蒸发除去乙醇, 即得和厚朴酚纳米混悬剂。
和厚朴酚纳米混悬剂的形态观察、粒径分布和载药量测定 取厚朴酚纳米混悬剂稀释后滴加于铜网上, 吸去多余液体, 自然晾干, 透射电镜下观察其形态并拍照。采用马尔文激光粒度测定仪测定粒径分布和多分散指数(polydispersity index, PDI)。采用高效液相色谱法(HPLC)测定载药量, 色谱条件: Alltima C18色谱柱(4.6 mm×250 mm, 5 µm), 流动相为甲醇-0.1%磷酸水(体积比75:25), 流速1 mL·min-1, 检测波长290 nm, 柱温30 ℃, 进样量10 µL, 线性范围为0.5~100 µg·mL-1; 将和厚朴酚纳米混悬剂冻干, 精密称量冻干粉的质量为M1, 用适量甲醇溶解, HPLC测定冻干粉中和厚朴酚的质量为M2, 按照如下公式计算载药量(DL): DL=(M2/M1)×100%。
统计学分析 数据用mean ± SEM表示, 采用SPSS 16.0统计软件进行方差分析, 组间比较采用t检验。
结果 1 和厚朴酚纳米混悬剂的形态观察、粒径分布和载药量透射电镜下观察和厚朴酚纳米混悬剂中粒子呈类球形, 与文献[4, 5]报道一致, 如图 1中黑色小球。并通过动态光散射法(马尔文粒径分析仪)测得其平均粒径大小为(37.53 ± 0.49) nm, PDI值为(0.095 ± 0.001), 表明厚朴酚纳米混悬剂粒径较小、尺寸分布均匀。HPLC测定其载药量为28.93%, 与理论值29.41%接近。

|
Figure 1 Transmission electron microscope images of nanosuspensions of honokiol (Hono-Nano) |
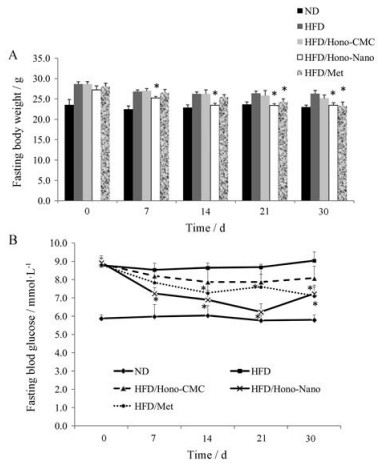
与正常饮食(ND)组小鼠相比, 长期高脂饮食(HFD)诱发小鼠体重增加与血糖升高。自给药7天开始, 与HFD模型组小鼠相比, 和厚朴酚纳米混悬剂组小鼠空腹体重、血糖都显著性降低(图 2A、B)。阳性对照药二甲双胍也能够有效调节小鼠体重与血糖。而在30天的给药周期中, 和厚朴酚CMC混悬液组小鼠体重、血糖虽然也都有下降趋势, 但是与HFD模型组小鼠相比较, 未见显著性差异(图 2A、B)。结果提示, 和厚朴酚纳米混悬剂的降糖效果优于和厚朴酚混悬液。
|
Figure 2 The fasting body weights (A) and blood glucose levels (B) of mice were measured every seven days. Hono-CMC: 100 mg·kg-1; Hono-Nano: 80 mg·kg-1; Met: 200 mg·kg-1. n = 6−8, mean ± SEM. *P < 0.05 vs HFD. HFD: High fat diet; ND: Normal diet; CMC: Sodium carboxymethyl cellulose; Met: Metformin |
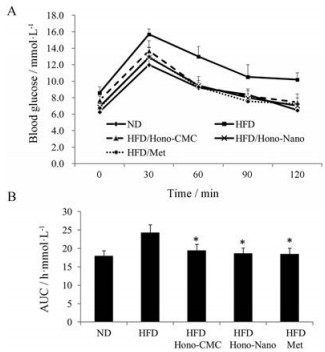
小鼠给药30天后, 进行OGTT实验。如图 3所示, 各给药组小鼠在60、90和120 min时间点的血糖水平均低于HFD模型组小鼠(图 3A), 并且各给药组血糖AUC也显著小于HFD组(图 3B), 表明各给药组小鼠葡萄糖耐受能力均得到有效改善, 和厚朴酚纳米混悬剂效果略微优于和厚朴酚混悬液。
|
Figure 3 The results of oral glucose tolerance test (OGTT, A) and area under curve (AUC, B) were shown. n = 6−8, mean ± SEM. *P < 0.05 vs HFD |
小鼠血清胰岛素(图 4A)与胰高血糖素(图 4B)检测结果显示, 与HFD模型组相比, 和厚朴酚与二甲双胍对HFD小鼠血清胰岛素水平没有显著性影响, 但是小鼠胰高血糖素水平均有显著性降低, 且和厚朴酚给药组与二甲双胍给药组相比, 胰高血糖素值更低, 提示和厚朴酚的降糖效应可能与其参与调控糖异生作用相关。

|
Figure 4 The effects of honokiol on serum insulin (A) and glucagon (B) levels of HFD mice were shown. n = 6−8, mean ± SEM. *P < 0.05 vs HFD |
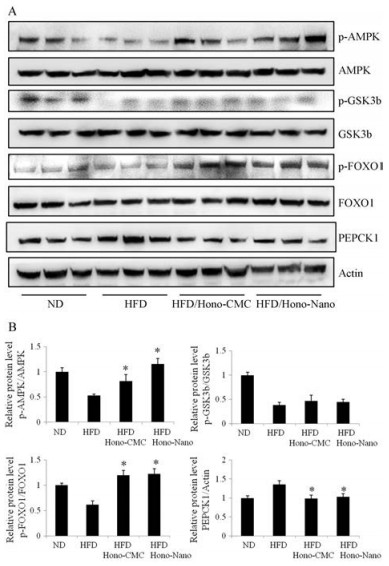
基于和厚朴酚抑制胰高血糖素水平的结果, 本研究进一步考察了其对肝脏糖异生信号通路的作用。Western blot显示, 和厚朴酚能够改变糖异生重要调控分子腺苷酸激活蛋白激酶(AMP-activated protein kinase, AMPK)、糖原合成激酶(glycogen synthase kinase 3b, GSK3b)及Forkhead转录因子(forkhead box protein O1, FOXO1)的激活状态, 并降低磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxykinase, PEPCK1)的表达水平(图 5)。
|
Figure 5 The regulating effects of honokiol on hepatic gluconeogenesis. A: Western blot; B: All the bands were quantified by densitometry and are presented as fold change compared with ND. n = 3, mean ± SEM. *P < 0.05 vs HFD |
AMPK是糖异生作用的负调控因子, 而FOXO1与GSK3b则相反, 是糖异生的正向调控因子。如图 5A、B所示, HFD组与ND组相比较, p-AMPK水平降低, 表明AMPK的活性被抑制; 而p-FOXO1与p-GSK3b的条带减弱, 则表明FOXO1与GSK3b的活性增强, 提示HFD小鼠肝脏糖异生增强。研究检测到, 和厚朴酚显著增加p-AMPK的水平, 激活AMPK分子。同时, 和厚朴酚上调转录因子FOXO1的磷酸化水平, 表明其有效抑制FOXO1的活性。并且和厚朴酚对GSK3b活性也表现出一定的抑制作用, 但与HFD对照组相比, 没有显著性差异。PEPCK1是肝脏糖异生过程中的关键限速酶之一, 其在HFD组中表达水平升高, 而和厚朴酚有效降低其表达水平。以上结果提示和厚朴酚能够有效抑制HFD小鼠肝脏糖异生过程, 从而降低HFD小鼠血糖水平。
讨论肝脏是机体代谢与能量平衡调控的重要器官, 肝脏糖代谢异常是2型糖尿病的主要病理特征, 表现在糖异生与糖原合成功能紊乱, 尤其是糖异生作用的增强[10]。因此, 有效抑制肝脏过度的糖异生作用, 能够降低内源性葡萄糖生成导致的血糖升高, 是治疗2型糖尿病的有效策略。
本研究初步表明, 和厚朴酚通过抑制肝脏糖异生途径实现其降糖疗效的潜在作用机制。AMPK作为细胞内主要“能量感受器”, 是肝脏糖代谢平衡的重要调控分子[11]。二甲双胍、降糖中药红景天和小檗碱, 均能够激活AMPK通路抑制肝糖异生[12-14]。本研究观察到和厚朴酚也能够有效激活AMPK分子, 与报道相一致[15]。同时证实, 和厚朴酚对转录因子FOXO1及糖异生关键限速酶PEPCK具有抑制作用。FOXO1是促进糖异生作用的重要调控因子之一, 参与PEPCK的基因转录表达[16]。2型糖尿病胰岛素抵抗造成FOXO1持续激活[17], 而和厚朴酚对FOXO1活性及PEPCK表达的抑制能够有效降低肝脏糖异生作用。GSK3b也参与了PEPCK的表达调控[18]。GSK3b使肝脏糖原合成酶磷酸化失活, 糖原合成减少, 其功能失衡将造成血糖升高。和厚朴酚能够在一定程度上抑制HFD小鼠肝脏组织GSK3b的活性, 但作用没有显著性差异。
生物医药纳米技术近年得到飞速发展, 其在药物递送、生物成像和生物传感器等方面具有巨大应用前景, 尤其对于改善难溶性药物的溶解度与生物利用度极具产业化应用与发展潜力[19]。Bottom up法是一种常用纳米混悬剂制备技术, 通过将难溶性药物溶解, 再将其滴入反溶剂中, 使药物达到饱和而析出结晶。本研究采用Bottom up法制备和厚朴酚纳米混悬制剂, 其在HFD糖尿病小鼠模型中所表现出的降糖与减重疗效, 均优于和厚朴酚羧甲基纤维素钠混悬液。推测和厚朴酚难溶于水, 纳晶能够改善其溶解度、润湿性和溶出速度, 增加其与生物膜的黏附性, 延长其在胃肠道中的滞留时间, 从而提高口服生物利用度和药效[3]。本研究结果为难溶性药物和厚朴酚的开发应用奠定实验基础, 后续工作将围绕进一步的机制阐明与和厚朴酚纳米混悬剂制备方法的优化展开。
| [1] | Talarek S, Listos J, Barreca D, et al. Neuroprotective effects of honokiol:from chemistry to medicine[J]. Biofactors, 2017, 43: 760–769. DOI:10.1002/biof.v43.6 |
| [2] | Prasad R, Katiyar SK. Honokiol, an active compound of magnolia plant, inhibits growth, and progression of cancers of different organs[J]. Adv Exp Med Biol, 2016, 928: 245–265. DOI:10.1007/978-3-319-41334-1 |
| [3] | Wang Y, Miao X, Sun L, et al. Effects of nanosuspension formulations on transport, pharmacokinetics, in vivo targeting and efficacy for poorly water-soluble drugs[J]. Curr Pharm Des, 2014, 20: 454–473. DOI:10.2174/13816128113199990403 |
| [4] | Ji YB, Zhou XX, Guo RQ, et al. Honokiol nanosuspensions:preparation, in vitro and in vivo evaluation[J]. Acta Pharm Sin (药学学报), 2018, 51: 133–140. |
| [5] | Han M, Yu X, Guo Y, et al. Honokiol nanosuspensions:preparation, increased oral bioavailability and dramatically enhanced biodistribution in the cardio-cerebro-vascular system[J]. Colloids Surf B Biointerfaces, 2014, 116: 114–120. DOI:10.1016/j.colsurfb.2013.12.056 |
| [6] | Li CG, Ni CL, Yang M, et al. Honokiol protects pancreatic beta cell against high glucose and intermittent hypoxia-induced injury by activating Nrf2/ARE pathway in vitro and in vivo[J]. Biomed Pharmacother, 2018, 97: 1229–1237. DOI:10.1016/j.biopha.2017.11.063 |
| [7] | Atanasov AG, Wang JN, Gu SP, et al. Honokiol:a non-adipogenic PPARgamma agonist from nature[J]. Biochim Biophys Acta, 2013, 1830: 4813–4819. DOI:10.1016/j.bbagen.2013.06.021 |
| [8] | Sun J, Fu X, Liu Y, et al. Hypoglycemic effect and mechanism of honokiol on type 2 diabetic mice[J]. Drug Des Devel Ther, 2015, 9: 6327–6342. |
| [9] | Sauter NS, Schulthess FT, Galasso R, et al. The antiinflammatory cytokine interleukin-1 receptor antagonist protects from high-fat diet-induced hyperglycemia[J]. Endocrinology, 2008, 149: 2208–2218. DOI:10.1210/en.2007-1059 |
| [10] | Petersen MC, Vatner DF, Shulman GI. Regulation of hepatic glucose metabolism in health and disease[J]. Nat Rev Endocrinol, 2017, 13: 572–587. DOI:10.1038/nrendo.2017.80 |
| [11] | Kahn BB, Alquier T, Carling D, et al. AMP-activated protein kinase:ancient energy gauge provides clues to modern understanding of metabolism[J]. Cell Metab, 2005, 1: 15–25. DOI:10.1016/j.cmet.2004.12.003 |
| [12] | Kim YD, Park KG, Lee YS, et al. Metformin inhibits hepatic gluconeogenesis through AMP-activated protein kinase-dependent regulation of the orphan nuclear receptor SHP[J]. Diabetes, 2008, 57: 306–314. DOI:10.2337/db07-0381 |
| [13] | Jiang SJ, Dong H, Li JB, et al. Berberine inhibits hepatic gluconeogenesis via the LKB1-AMPK-TORC2 signaling pathway in streptozotocin-induced diabetic rats[J]. World J Gastroenterol, 2015, 21: 7777–7785. DOI:10.3748/wjg.v21.i25.7777 |
| [14] | Lee SY, Lai FY, Shi LS, et al. Rhodiola crenulata extract suppresses hepatic gluconeogenesis via activation of the AMPK pathway[J]. Phytomedicine, 2015, 22: 477–486. DOI:10.1016/j.phymed.2015.01.016 |
| [15] | Seo MS, Kim JH, Kim HJ, et al. Honokiol activates the LKB1-AMPK signaling pathway and attenuates the lipid accumulation in hepatocytes[J]. Toxicol Appl Pharmacol, 2015, 284: 113–124. DOI:10.1016/j.taap.2015.02.020 |
| [16] | Oh KJ, Han HS, Kim MJ, et al. CREB and FoxO1:two transcription factors for the regulation of hepatic gluconeogenesis[J]. BMB Rep, 2013, 46: 567–574. DOI:10.5483/BMBRep.2013.46.12.248 |
| [17] | Maiese K. FoxO transcription factors and regenerative pathways in diabetes mellitus[J]. Curr Neurovasc Res, 2015, 12: 404–413. DOI:10.2174/1567202612666150807112524 |
| [18] | Lochhead PA, Coghlan M, Rice SQ, et al. Inhibition of GSK-3 selectively reduces glucose-6-phosphatase and phosphatase and phosphoenolypyruvate carboxykinase gene expression[J]. Diabetes, 2001, 50: 937–946. DOI:10.2337/diabetes.50.5.937 |
| [19] | Yue PF, Liu Y, Xie J, et al. Review and prospect on preparation technology of drug nanocrystals in the past thirty years[J]. Acta Pharm Sin (药学学报), 2018, 53: 529–537. |
 2019, Vol. 54
2019, Vol. 54


