2. 广西中药药效研究重点实验室, 广西 南宁 530200;
3. 广西农作物废弃物功能成分研究协同创新中心, 广西 南宁 530200;
4. 广西中医药大学广西中医药科学实验中心, 广西 南宁 530200;
5. 天津药物研究院, 天津 300193
2. Guangxi Key Laboratory of Efficacy Study on Chinese Materia Medica, Nanning 530200, China;
3. Guangxi Collaborative Innovation Center of Study on Functional Ingredients of Agricultural Residues, Nanning 530200, China;
4. Guangxi Scientific Experimental Center of Traditional Chinese Medicine, Guangxi University of Chinese Medicine, Nanning 530200, China;
5. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
中药质量问题, 一直是现代中药研究中的一个热点问题。目前, 中药质量标准体系是以《中华人民共和国药典》为核心, 包括部颁标准和地方标准的一个多级标准体系。各级标准对中药(药材、饮片和制剂)的质量控制, 主要是通过控制中药中一种或者几种有效成分或特征成分的含量, 以确保这些成分在样品检验时的质量可控性和稳定性[1]。中药是通过多靶点多通路的作用机制发挥其药效的, 这种复杂机制的化学物质基础正是中药化学成分类型的复杂性以及化学成分生物合成途径的多样性。很显然, 现有的质量标准体系需要进一步的健全和完善。刘昌孝[2]提出“中药质量标志物(Q-marker)”这一中药产品质量控制的新概念, 指出中药效应是确定中药质量标志物(Q-marker)的基础。因此, 深入理解中药的基本属性, 进而阐明其药效及作用机制, 辨析药效物质基础, 最终明确中药质量标志物, 是中药质量控制的关键。
1 中药反向功效是中药“一物多效”的特殊表现一种中药具有多种功效, 不同的中药具有相同的功效, 这是中药功效认知上的普遍现象, 如人参, 既可大补元气, 复脉固脱, 用于体虚欲脱, 肢冷脉微; 又可安神益智, 用于惊悸失眠, 还可补脾益肺, 用于脾虚食少, 肺虚喘咳。又如麻黄, 既可发汗散寒, 用于风寒感冒; 又可宣肺平喘, 治疗胸闷喘咳; 还可利水消肿, 用于治疗风水浮肿。而人参、西洋参、党参、黄芪等虽不同一物, 却均具有“补气”相同功效。麻黄、五加皮、防已、赤小豆等不同功效分类的中药, 均具“利水消肿”的相同功效。对中药这种“一物多效”的共性表现及其物质基础等问题, 已有学者进行了深入的讨论[2]。本文所讨论的是中药“一物多效”中的特殊表现——反向功效。
所谓中药的反向功效, 是指一种中药中具有的两种特性相反的药效作用。这种现象主要有两种类型, 一种类型是同一药物的不同部位表现出相反药性药效, 如, 西瓜瓤湿热, 西瓜皮清凉; 芒果肉湿热, 芒果皮清凉; 中华鲎箭湿热, 中华鲎壳清热; 桑椹补血养血, 桑叶清热凉血, 等等。另一种类型是同一植株部位(药用部位)表现出反向功效, 如西洋参的补气和清热, 一“补”一“泻”; 白术的利水与安胎, 一“利”一“固”; 秦艽的清湿热和清虚热, 一“实”一“虚”; 三七活血、补血与止血, 一“散”一“补”和“一涩”; 再如麻黄的发汗与利水、黄芪的升阳与利水, 一升一降; 何首乌的解毒与润肠, 一为驱邪一为扶正, 凡此种种, 不胜枚举。进一步分析中药反向功效所产生的机制, 一部分可能与该中药的归经属性与核心功效相关, 如白术的核心功效为健脾益气, 通过健脾这一核心功效, 既有助于运脾化湿而利水, 又可助脾固摄以安胎。但更多的时候, 这种特殊的相反功效表现, 与其核心功效并不相关, 如西洋参, 其核心功效是补气, 但其清热与补气之间并无关联。同样, 秦艽的清湿热与清虚热之间也并非通过核心功效来实现。因此, 可以认为, 中药相反功效是中药“一物多效”的一种特殊表现。由于这种特殊的表现在学术界鲜有关注, 对其进行深入研究, 将对临床应用和质量的精准控制提供有益的参考。经对2015版《中华人民共和国药典》(后简称《中国药典》)中收录的具有反向功效的中药品种进行了分析, 具有反向功效的常用中药约占20%~30%左右, 仅选取典型的20种, 如表 1所示。
| Table 1 The typical opposite-effect of TCM in the Chinese Pharmacopoeia (2015 edition) |
目前, 我国中药的最高质量标准是《中国药典》。许多方法包括化学方法、显微方法、生物模式等都用于中药材的检测。但对中药及其饮片质量控制, 仍然是通过对其中的单一成分或某几类成分提取后检测其含量来衡量药材质量的方法应用最为普遍[3]。由于中药有效成分复杂性, 仅利用单一指标成分的定性、定量分析方法, 未能切实、全面地反映其临床功效。因此, 随着色谱技术和波谱技术的飞速进步, 一测多评[4]、指纹图谱[5]、血清药物化学、代谢组学、药代动力学、系统生物学[6]等方法被越来越多的应用于中药质量标准研究。2015年版《中国药典》(一部)在部分中成药、中药材和中药提取物质量标准中采用指纹图谱或特征图谱技术来控制药品质量, 在沉香、心脑健胶囊等29个标准中新增加指纹图谱或特征图谱控制要求, 使2015年版《中国药典》在整体性控制中药质量方面有了大幅度的提高[7]。
中药药效物质基础是什么?化学成分与药效之间如何关联?如何根据中药的性-效-物三元体系来确定质量标志物, 进而进行整体全面的质量控制?这些问题都是在中药质量标准研究中必须要回答的。而对于具有反向功效中药这一类特殊的中药, 则还应该更精准的探究其反向功效与化学成分的关系, 从而明晰同一中药所表现出反向功效的物质基础, 制定更为全面和精准的质量标准。目前, 存在两个层面的问题, 一个是基础研究层面, 未能明确反向功效中药的药效物质基础, 进而阐明功效与物质基础之间的关联性; 另一层面, 现行质量标准即使选择了有效成分作为检测指标, 也未能体现反向功效与物质基础的关联性(表 2[8-34])。以上两个问题, 严重影响了这类药材及其制剂的质量评价和临床应用的安全有效。
| Table 2 The researches and current standards of some typical opposite-effect herbs |
据统计, 现有中药12 807种, 常用者400~600种, 组成方剂约十万首, 用于治疗不同疾病[35]。中药“一物多效、一物多性、一物多用”等特性所体现的传统药物学内涵已被广泛接受[2]。
传统功效差异性的生物学基础包括: ①次生代谢产物生物合成途径的多样性; ②化学成分在植物器官和组织分布的特异性; ③生物合成与植物个体发育阶段的相关性。由于以上三个因素的影响, 使得不同植物的化学成分存在结构类型和数量以及在植物中分布的差异, 从而带来功效的差异性[1, 36]。
在对中药功效差异性的研究中, 可以从以下几方面来概括功效差异的化学生物学实质: ①单一成分可以作用于多靶点产生不同作用; ②同一药材的多个成分具有不同作用; ③不同组织部位的成分差异使得不同部位可以产生不同功效; ④中药材炮制前后的化学成分变化, 使得饮片与原药材产生功效上的差异[1, 36]。
反向功效作为中药“一物多效”的特殊表现形式, 虽未得到足够重视, 但仍可从现有的对传统功效差异性的研究和阐述中获得有益信息。以中医的宏观、整体思维模式与现代医学微观、精细的逻辑理论有机结合, 将是探索和研究反向功效中药科学内涵的可行方法和思路。
4 反向功效中药质量标志物研究的策略与方法中药复杂的生物效应表达形式是以其复杂的化学物质体系为基础的[36]。因此, 从中药的反向功效出发, 通过现代药理研究手段对其相反的传统功效进行验证, 开展化学物质组及其反向功效的相关性研究, 确定反向功效的物质基础, 进一步进行有效化学成分的作用靶点、通路等作用机制研究和化学成分的特有性分析, 确定质量标志物, 是建立系统、科学的中药质量评价体系的关键。本文尝试以三七为例对此进行探讨。
三七活血化瘀、止血生肌、补血养血、消肿定痛的疗效已在长期的临床应用中得到证实, 在心脑血管系统、消化系统、呼吸系统的相关疾病治疗中都表现出良好的疗效[37], 是具有反向功效中药的典型代表。《中国药典》2015年版对三七的质量控制主要是测定其中三七皂苷R1、人参皂苷Rg1及Rb1的含量, 各地方标准如《四川省中药饮片炮制规范》也沿用此规定。很显然, 目前的质量标准未考虑其反向功效的物质基础差异和特点, 并不能全面反映三七药材的质量。本文以三七为例, 根据质量标志物研究的基本原则[1, 36], 通过对三七化学成分、药理作用和物质基础研究现状进行归纳总结, 分析其反向功效的物质基础, 并在此基础上, 提出三七质量标志物研究的策略和方法, 为反向功效中药的质量标志物研究提供借鉴。
4.1 化学物质组的系统研究是质量标志物确定的基本前提自20世纪70年代以来, 研究人员对三七进行了系统的化学成分研究[38]。已从三七中分离得到百余种单体皂苷成分, 其中原人参二醇型皂苷占大多数, 主要包括人参皂苷Rb1、Rd、Rb3、Rc、Rg3和三七皂苷Fc、Fa以及七叶胆苷(绞股蓝皂苷) Ⅸ、ⅩⅦ等; 原人参三醇型皂苷包括三七皂苷R1、R2和人参皂苷Rg1、Re、Rg2等; 还有一类C17侧链变化的四环三萜皂苷, 约占三七皂苷数量的一半。尤以人参皂苷Rg1和Rb1含量最高。三七所含的氨基酸成分中有特殊氨基酸三七素。此外, 三七中还含黄酮类、挥发油、甾醇、炔醇类、糖类、微量元素[39]等多种化学成分。三七中皂苷成分中至今未发现齐墩果酸型皂苷, 这是其与同属植物人参和西洋参的显著区别[38]; 还发现三七挥发油与人参挥发油有8种成分不同[40]。
三七化学物质组研究, 为三七药效物质研究以及化学成分特有性分析提供了基础。
4.2 基于传统功效的药理作用及机制研究是质量标志物确定的重要基础三七“善化血瘀”, 故凡产后、跌打所致瘀血、瘀肿皆可破, 具有活血化瘀之功效。目前对活血功效的研究主要集中表现在三七总皂苷对脑血管系统疾病[41, 42]和心血管系统疾病[43], 如高血脂、动脉粥样硬化[44, 45]等, 可表现出明显的抗血栓、抑制血小板聚集等活性作用[46]。
三七入肝经血分, 功善止血。关于其止血作用的药理研究也验证了这一功效。三七表现出明显止血效果[9]。且有研究发现三七素可能通过促进组织胺使血管收缩从而发挥止血作用[47]。
4.3 反向功效与化学成分关联性分析及药效物质基础的表征是质量标志物确定的必要保障三七止血活血作用与其化学成分密切关联。大量数据表明, 三七的活血有效成分是含有多种皂苷成分的三七总皂苷(PNS), 其中人参皂苷Rg1、Rb1、R1等都是三七活血的主要有效成分[46, 47]。人参三醇皂苷(PTS)活血作用显著[41]。而其止血有效成分主要为特殊氨基酸三七素[48], 还有槲皮苷和钙离子[49]。
根据以上研究, 三七中的人参皂苷类成分应是其活血作用的主要物质基础, 三七素、槲皮苷等是其止血作用的主要物质基础, 这些成分应是三七质量标志物的主要选择。
应用各种色谱波谱联用技术[50]对三七的活血止血有效部位进行化学成分分析, 并考察体内过程对药物作用的影响[51]等方面的研究, 则为进一步开展三七指纹图谱、阐明三七有效部位中药效物质基础及其代谢研究奠定了基础。
4.4 在现有技术条件下, 化学成分可测性是质量标志物确定的必要条件化学成分的可测性是质量标志物的基本条件之一。目前, 对三七化学成分分析的研究主要针对其中皂苷类成分, 如, 采用HPLC法测定三七皂苷R2(S)[52]、R1[53]、人参皂苷F2[52]、Rc、Re、Rd[54]、Rg1、Rb1[53]、七叶胆苷XVII[52]; 采用UPLC法测定三七皂苷K[55]以及5种稀有人参皂苷20(S)-Rg2、20(S)-Rh1、Rk3、20(S)-Rg3及Rk1[56]; 一测多评法也被应用于测定三七中人参皂苷的含量[57]。三七药材及其提取液、三七二醇皂苷(PDS) [58]、三七制剂[59]等的HPLC指纹图谱方法已经建立。还有研究采用核磁共振方法建立不同产地三七的1H NMR指纹图谱[60]。比色法[61]、近红外光谱法[62]被应用于三七药材中皂苷的快速检测。
除了关注皂苷类成分的分析, 也兼顾了其他成分的分析, 如多糖[63]、黄酮[64]、三七素[65]等成分的含量测定, 为三七质量标志物的确定提供了一定的基础。
4.5 三七反向功效质量标志物的研究路径和技术方案以三七化学物质组以及反向功效的实验研究成果为基础, 进行成分与药效的关联性分析, 确定三七的反向功效物质基础, 进一步进行特有性分析和可测性研究, 确定三七的反向功效质量标志物, 为建立三七的质量评价方法, 完善质量标准提供科学支撑和有力保障(图 1)。
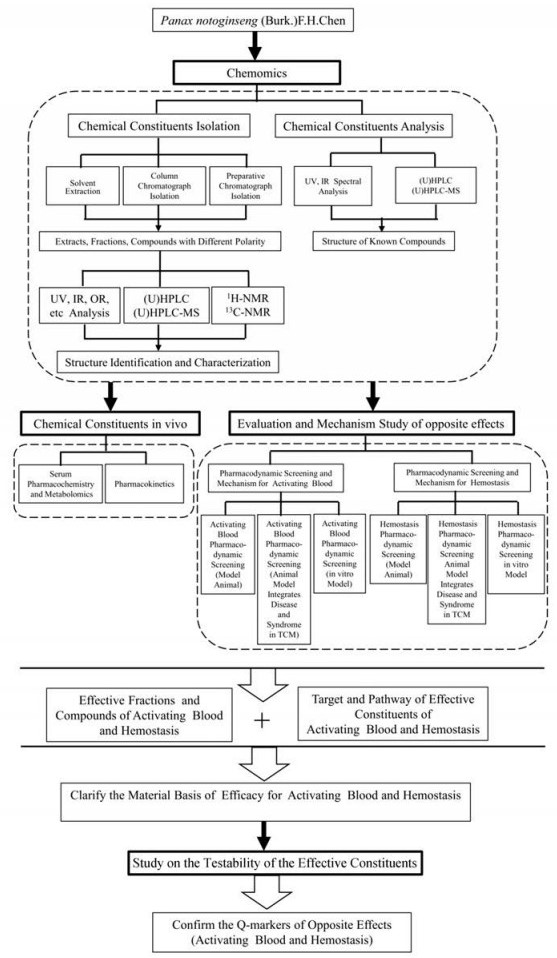
|
Figure 1 The research approach of Q-markers of opposite-effects |
中药质量是对中药有效性和安全性的反映和表征, 是中医临床用药的重要依据。刘昌孝院士提出进行质量标志物研究, 提升了中药质量研究理论的科学性和系统性, 其中特别强调中药的传统功效是质量标志物发现和确定的重要基础。具有反向功效的中药是我国传统中药的一个重要组成部分, 因此, 基于该类中药的反向功效, 阐明反向功效的物质基础, 进而明确物质基础与反向功效的相关性, 并在此基础上确定质量标志物, 是这类中药质量标准制定的基本前提。本文对具有反向功效中药的存在情况、质量标准现状等进行了阐述, 并以三七为例, 根据质量标志物研究原则, 提出了反向功效中药质量标志物研究的策略与方法, 从一个新的研究角度为中药质量标志物研究提供了新思路。
尽管已有研究者关注到三七等中药具有反向功效的特殊性, 在化学物质基础、相反功效与现代药理作用的关系等方面进行了一些研究, 但总的来说, 研究的广度和深度都不够, 更遑论对具有反向功效的中药质量标志物研究的关注。因此, 本文围绕质量标志物这一中药质量评价的核心概念, 首次提出开展反向功效中药质量标志物研究, 以实现对此类中药质量的精确控制的新观点, 无疑对中药质量控制体系的丰富和发展具有积极的意义。
| [1] | Liu CX, Chen SL, Xiao XH, et al. A new concept on quality marker of Chinese materia medica:quality control for Chinese medicinal products[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1443–1457. |
| [2] | Zhang TJ, Xu W, Shen XP, et al. Relation of "property-response-component" and action mechanism of Yuanhu Zhitong Dropping Pills based on quality marker (Q-Marker)[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2199–2211. |
| [3] | Chen ZH, Liu SZ, Zhou B, et al. The discussion on the status of quality standards and several quality evaluation methods of Chinese medicine[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2016, 27: 694–696. |
| [4] | Wang M, Wang M, Zhang M. Research progress of one-test multi-evaluation method in quality control of Chinese medicinal materials and preparations[J]. Pharm Clin Chin Mater Med (中药与临床), 2016, 7: 59–63. |
| [5] | Liu W, Jiang SY. Progress in research and application of fingerprint of traditional Chinese medicine[J]. Chin Pharm (中国药房), 2011, 22: 1819–1822. |
| [6] | Lu L, Liu XD, Zhang PY. Progress in serum pharmacology and serum medicinal chemistry of traditional Chinese medicine[J]. J Emerg Tradit Chin Med (中国中医急症), 2018, 27: 178–181, 188. |
| [7] | Shi SM. Standard update and the quality control system of traditional Chinese medicines[J]. Chin Pharm J (中国药学杂志), 2015, 50: 1752–1753. |
| [8] | Sun FZ, Sun MJ, Lu XW. The research progress of the effects of activating blood and hemostasis of Sanqi[J]. J Med Res (医学研究杂志), 2013, 42: 24–26. |
| [9] | Wang Z, Yang JG, Song SJ, et al. Effect of dencichine on coagulation and the hemostatic mechanism[J]. Chin New Drug J (中国新药杂志), 2014, 23: 356–359. |
| [10] | Xu ZL, Tao XJ, Li M, et al. Effects of ginsenoside Re on the immune function and anti-stress reaction of mice with spleen deficiency[J]. J Pediatr Pharm (儿科药学杂志), 2015, 21: 1–4. |
| [11] | Holly RL, Jane S, Luan AC, et al. High molecular weight polysaccharides are key immunomodulators in North American ginseng extracts:characterization of the ginseng genetic signature in primary human immune cells[J]. J Ethnopharmacol, 2013, 142: 1–13. |
| [12] | Wang LJ, Yu XN, Yang XS, et al. Structural and anti-inflammatory characterization of a novel neutral polysaccharide from North American ginseng (Panax quinquefolius)[J]. Int J Biol Macromol, 2015, 74: 12–17. DOI:10.1016/j.ijbiomac.2014.10.062 |
| [13] | Yang TH, Jia M, Mei QB, et al. Effects of Angelica sinensis polysaccharide on blood coagulation and platelet aggregation[J]. J Chin Med Mater (中药材), 2002, 25: 344–345. |
| [14] | Liu PJ, Hsieh WT, Huang SH, et al. Hematopoietic effect of water soluble polysaccharides from Angelica sinensis on mice with acute blood loss[J]. Exp Hematol, 2010, 38: 437–445. DOI:10.1016/j.exphem.2010.03.012 |
| [15] | Li FL, Li JH, Liu YK, et al. Effects on platelet function and blood flow of ligustrazine and angelica injection in DIC rats[J]. Basic Clin Med (基础医学与临床), 2006, 26: 909–910. |
| [16] | Zhang JY, Liu XP, Nie J. Research on toxicology and hemostatic effect of Danggui San[J]. Chin J Tradit Med Sci Tech (中国中医药科技), 2015, 22: 635–637. |
| [17] | Han YW, Wang B, Wang ZG, et al. Recent research progress in pharmacological effects of glycyrrhizic acid[J]. Chin New Drug J (中国新药杂志), 2012, 21: 2499–2505. |
| [18] | Dong FY, Wang JJ. Anti-inflammatory mechanism of glycyrrhetinic acid and its derivatives[J]. J Dalian Med Univ (大连医科大学学报), 2014, 36: 195–197. |
| [19] | Wang XH, Li JY, Liu XY, et al. The research progress of licorice and its active constituents on regulation of immune system[J]. Chin Tradit Pat Med (中成药), 2016, 38: 392–395. |
| [20] | Chen J, Sun YC, Pei XK, et al. Study on diuretic effect of Atractylodis Macrocephalae Rhizoma[J]. Mod Chin Med (中国现代中药), 2016, 18: 563–567. |
| [21] | Zhang XL, Wang L, Xu L, et al. Effects of Atractylodes macrocephala on the cytomembrane Ca2+-activated K+ currents in human pregnant myometrium smooth muscle cells[J]. Matern Child Health Care Chin (中国妇幼保健), 2009, 24: 366–368. |
| [22] | Wu B, Gu SJ, Fu YM, et al. Study on the purge and reinforcing kidney-yang pharmacological effects of Cistanche deserticola and Cistanche tubulosa[J]. Stud J Tradit Chin Med (中医药学刊), 2003, 21: 539–548. |
| [23] | Jiang R. The molecular mechanism of traditional Chinese medicine in treating oligozoospermia. The 12th National Conference on Integrative Chinese Medicine and Western Medicine and the National Association of Integrative Medicine in the Department of Integrative Medicine and the 2017 Shanghai Integrated Chinese and Western Medicine Association Shanghai Traditional Chinese Medicine Association Urology and Male Professional Committee Annual Meeting (中国中西医结合学会男科专业委员会.第十二次全国中西医结合男科学术大会暨全国中西医结合男科诊疗技术研修班暨2017上海市中西医结合学会上海市中医药学会泌尿男科专业委员会学术年会讲义论文资料汇编)[C]. Shanghai: Chinese Association of Traditional Chinese and Western Medicine, Men's Professional Committee, 2017: 1. |
| [24] | Gao J. Research on Compatibility Rule and Pharmacodynamics of Shou Tai Wan (寿胎丸的药物组成及其补肾安胎的药效学研究)[D]. Guanghzou: Guangzhou University of Chinese Medicine, 2009. |
| [25] | Wang HL, Guan J, Feng J, et al. Effect of total flavonoids of Herba Taxilli on adjuvant arthritis in rats[J]. World Chin Med (世界中医药), 2018, 13: 799–802, 807. |
| [26] | Su S, Liang Y, Zhou XX, et al. Inhibitory effect of effective fractions of mulberry parasitic on leukemia cell line K562[J]. J Hubei Univ Chin Med (湖北中医药大学学报), 2011, 13: 12–15. |
| [27] | Pan YY, Sun WZ, Guo W, et al. Comparative study on the effects of southern Liujinu and northern Liujinu in anti-platelet aggregation and antithrombotic[J]. Chin Tradit Pat Med (中成药), 1998, 20: 45–47. |
| [28] | Zhao YS, Mao FY, Yao HH, et al. Study on diaphoresis, antitussive and diuresis of polysaccharide from Ephedra sinica Stapf[J]. Asian-Pac Tradit Med (亚太传统医药), 2014, 10: 11–13. |
| [29] | Chen Y, Shen SL, Chen HX, et al. Identification of ephedrine and its main metabolites in rats by HPLC-ESI-ITMSn method[J]. Acta Pharm Sin (药学学报), 2005, 40: 838–841. |
| [30] | Ma Y. The research progress of Ephedra sinica Stapf. 2007 Symposium on Key Technologies of Chinese Medicine Drug Innovation and Pharmaceuticals and Proceedings of the Chinese Medicine Association of Traditional Chinese Medicines (2007中药药物创新与制药关键技术研讨会暨中华中医药学会中药化学中药制剂学术会议论文集)[C]. Beijing: Chinese Medicine Chemistry Branch of Chinese Medicine Association, Chinese Medicine Preparation Branch of Chinese Medicine Association, 2007: 10. |
| [31] | Huang L, Wang YN, Wu YY. Research progress of pharma-cological effects of traditional Chinese medicines ephedrae[J]. Chin Foreign Med Treat (中外医疗), 2018, 37: 195–198. |
| [32] | Morrison M, Van Der Heijden R, Heeringa P, et al. Epicatechin attenuates atherosclerosis and exerts anti-inflammatory effects on diet-induced human-CRP and NFκB in vivo[J]. Atheros-clerosis, 2014, 233: 149. DOI:10.1016/j.atherosclerosis.2013.12.027 |
| [33] | Lv XH. A preliminary study on the diuretic action of Cangzhu, Bianxu, Yuanhua and Cheqianzi[J]. Acta Pharm Sin (药学学报), 1966, 13: 454–458. |
| [34] | Wang D, Yuan CL, Lin L, et al. Effects of the polysaccharides in seeds of plantaginis on small intestinal motility disturbance in mice[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2008, 26: 1188–1189. |
| [35] | Zhou W, Zhang HL, Zhao Y. Research and protection of natural medicine resources[J]. J Wuhan Univ Tech (武汉工业学院学报), 2010, 29: 57–61. |
| [36] | Zhang TJ, Wang J, Chen CQ, et al. Method of quality marker research and quality evaluation of Chinese materia medica based on drug properties and effect characteristics[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1051–1060. |
| [37] | Song SF, Han WC, Wang XB, et al. A review on clinical application in promoting blood circulation and controlling bleeding of Sanqi[J]. Clin J Chin Med (中医临床研究), 2016, 8: 147–148. |
| [38] | Bao JC, Liu G, Cong DL, et al. The research progress of chemical composition of Sanqi[J]. Chin Tradit Pat Med (中成药), 2006, 28: 246–253. |
| [39] | Li GL. Modern research and development of Sanqi (I)[J]. Word J Integr Tradit West Med (世界中西医结合杂志), 2008, 3: 619–623. |
| [40] | Lu Q, Li XG. Study on neutral components of volatile oil from Radix Ginseng[J]. Chin Tradit Herb Drugs (中草药), 1988, 19: 5. |
| [41] | Chen JW, Tan MY, Xiang QL, et al. Promoting blood circulation by removing blood stasis of panaxatriol saponins[J]. Pharmacol Clin Chin Mater Clin Med (中药药理与临床), 2008, 24: 38–41. |
| [42] | Wu JX, Sun JB. Effects of Panax notoginseng saponins on cerebral circulation of Sprague-Dawley rats[J]. Chin J Mod Appl Pharm (现代应用药学), 1995, 12: 1–3, 57. |
| [43] | Li L. Effect of Ginsenoside Rg1 on Myocardial Ischemia-Reperfusion Injury in Rats and its Mechanism (人参皂苷Rg1对大鼠心肌缺血再灌注损伤改善作用及机制探讨)[D]. Beijing: Beijing University of Chinese Medicine, 2014. |
| [44] | Mao CG, Huang W, Qi ZB. Effects of Panax notoginseng saponins on hemorheology and blood lipid in diabetic rats[J]. China Pharm (中国药师), 2011, 14: 1094–1096. |
| [45] | Zhou XH, Liu XU, Wen ZY, et al. Study of notoginsenoside R1 relieving liver inflammatory injury by up-regulating miR-146a level in ApoE-/- mice[J]. Tradit Chin Drug Res Pharm (中药新药与临床药理), 2016, 27: 317–321. |
| [46] | Wang F, Liu YY, Liu W, et al. Attenuation effects of PNS, Rl, Rbl, and Rgl on venous thrombosis induced in rat mesentery by photochemical reaction[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2008, 10: 106–111. |
| [47] | Wang Z, Yang JY, Song SJ, et al. Effect of dencichine on coagulation and the hemostatic mechanism[J]. Chin New Drug J (中国新药杂志), 2014, 23: 356–359. |
| [48] | Zheng YH, Gao RL, Zhu DY, et al. Proliferation of hematopoietic progenitor cells from human bone marrow induced by Panax notoginosides[J]. Chin J Integr Tradit West Med Intensive Crit Care (中国中西医结合急救杂志), 2003, 10: 135–137. |
| [49] | Shan LM, Zhao YL, Hong W, et al. Correlation analysis between hemostatic activity and commercial grades of Panax notoginseng[J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 1779–1782. |
| [50] | Liu YY. Pharmacodynamic Substances Studies of Active Fractions from Panax notoginseng (Buck.) F.H. Chen & Fragmentation Behaviors of Quinochalone Compounds from Carthamus tinctorius L. and HSYA's Internal Distribution Studies (三七有效部位药效物质基础研究; 红花中抗脑缺血活性成分质谱裂解行为及分布研究)[D]. Beijing: Peking Union Medical College, 2009. |
| [51] | Feng L, Jiang XH, Zhou J, et al. Studies on absorption kinetics of sanchinoside R1 and ginsenoside Rg1 in rat intestine[J]. Chin Pharm J (中国药学杂志), 2006, 41: 1097–1102. |
| [52] | Chen H, Pan JY, Qi HB, et al. Determination of notoginsenoside R2(S), gypenoside XVⅡ and ginsenoside F2 in Notoginseng Radix et Rhizoma extracts by HPLC[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2015, 32: 1114–1117. |
| [53] | Guo JH, Liu JL, Huang L, et al. Simultaneous determination of notoginsenoside R1 and ginsenoside Rg1 and Rb1 in Panax notoginseng by high performance liquid chromatography[J]. Guangdong Chem Ind (广东化工), 2014, 41: 195–196. |
| [54] | Yan JD, Luo XW, Yan LS, et al. Simultaneous determination of seven compounds of saponins in Panax notoginseng by HPLC[J]. China Pharm (中国药师), 2008, 11: 1411–1413. |
| [55] | Gong YQ, Gao HT, Wang YH, et al. Determination of notogi-nsenoside K in Notoginseng total saponins by ultra performance liquid chromatography method[J]. Drugs Clin (现代药物与临床), 2015, 30: 1072–1074. |
| [56] | Li LJ, Li XW, Ding J, et al. Ionic liquid surfactant-mediated ultrasonic-assisted extraction coupled with HPLC for the deter-mination of five rare ginsenosides in Panax notoginseng (Burk.) F. H. Chen[J]. Chem J Chin Univ (高等学校化学学报), 2016, 37: 454–459. |
| [57] | Li JH, Liu YJ, Huang YL, et al. Simultaneous determination of seven saponins in steamed Panax notoginseng by quantitative analysis of multi-components by single marker[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2017, 28: 2363–2365. |
| [58] | Yu JL, Tang XZ, Zhou F, et al. Analysis of fingerprint of Notoginseng Radix et Rhizoma-panaxadiol saponins and their quality transmitting of components group[J]. Chin J Exp Tradit Med Form (中国实验方剂学), 2018, 24: 18–22. |
| [59] | Lin Y, Sun Y, Xiao XF, et al. Study on fingerprints of Radix Notoginseng, total saponins and its preparation by HPLC method[J]. Tianjin J Tradit Chin Med (天津中医药), 2007, 24: 248–251. |
| [60] | Zhao Y, Pei ZF, Deng ZW. Comparative analysis of 1H NMR fingerprints for Panax notoginseng produced from different areas[J]. Chin J Anal Lab (分析试验室), 2016, 35: 1326–1329. |
| [61] | Shen W, Feng Y, Xu DS, et al. Determination of total saponins in Panax notoginseng flowers by colorimetric method[J]. Chin Tradit Pat Med (中成药), 2007, 29: 1368–1370. |
| [62] | Yan W, Chen MJ, Mei GR, et al. Determination of three saponins in Panax notoginseng by NIR[J]. J Pharm Anal (药物分析杂志), 2016, 36: 691–696. |
| [63] | Zhao YY, Chen W, Zhang YW, et al. Extraction and deter-mination of polysaccharide in Panax notoginseng[J]. J Pharm Anal (药物分析杂志), 2011, 31: 481–483. |
| [64] | Li ZY, Luo YZ. Detection of total flavonoids in Panax notoginseng powder[J]. J Anhui Agric Sci (安徽农业科学), 2010, 38: 14942–14943. |
| [65] | Li L, Wang CY, Qu Y, et al. Content determination of dencichine in Panax Notoginseng by a reversed phase ion-pair chromato-graphy[J]. Chin Pharm J (中国药学杂志), 2015, 40: 4026–4030. |
 2019, Vol. 54
2019, Vol. 54


