2. 山东绿叶制药有限公司长效和靶向制剂国家重点实验室, 山东 烟台 264670;
3. 中国食品药品检定研究院, 北京 102629
2. State Key Laboratory of Long-acting and Targeting Drug Delivery System, Shandong Luye Pharmaceutical Co. Ltd, Yantai 264670, China;
3. National Institutes for Food and Drug Control, Beijing 102629, China
可生物降解的聚合物微球作为一种储库型释药系统, 由于其骨架材料具有良好的生物相容性和生物可降解性, 能增强蛋白类药物的稳定性, 降低毒副作用, 延长药物释放时间, 减少给药频次, 改善患者依从性, 在过去几十年引起了广泛的关注[1-5], 并有多个产品上市。然而, 制备工艺微小的变化都可能改变聚合物微球的关键质量参数, 这有可能改变药物在体内的释放特性[6], 从而产生严重的不良反应和毒性。释药行为是新型释药系统(如口服缓控释制剂、微球、纳米粒等)的重要质量属性, 良好的体外释放度方法既可用于产品的质量控制又可反映药物在体内释放性能以确保产品的有效性和安全性[7, 8], 较体内释放度测定更适于制剂释药行为的评价。体外释放度方法能代替体内方法进行制剂评价的前提是体外释放度方法能较好地反映制剂在体内的释药行为, 即具有体内外相关性(in vitro-in vivo correlation, IVIVC)。FDA药品评价和研究中心(CDER)将IVIVC定义为:描述某一药物缓控释制剂的体外特征(通常是药物的体外释放速率或释放程度)与体内反应(如血浆药物浓度或吸收的药物量)之间相关关系的一种预测性的数学模型[9]。IVIVC分为4个等级: A级相关程度最高, 是体内释放过程与体内响应过程之间的点点对应关系; B级是将体外释放时间平均值与滞留时间平均值或体内释放时间平均值进行比较, 此类相关性不属于点对点相关; C级为体外释放度参数(如t50%, t90%)与药动学参数[血药浓度时间曲线下面积(AUC)、tmax、Cmax]之间的单点对应关系; 多重C级为将1个或多个药代动力学参数与释放度曲线中几个时间点的药物释放量相联系的一种对应关系[6]。IVIVC的建立, 可以在药物开发的各个阶段指导处方筛选以及工艺变更, 有助于制定释放度限度以确保产品的质量, 若成功建立A级IVIVC, 就可豁免生物等效性研究, 减少人体和动物实验数量, 同时减轻监管的压力[10-12]。
不同于传统的口服固体制剂, 对注射用缓释制剂建立IVIVC存在诸多困难, 例如, 释放机制复杂, 通常存在两个或3个释放阶段, 体内药代动力学曲线的去卷积分计算及模型的建立存在困难[3]; 给药方式通常为皮下或肌肉注射, 酶催化或炎症反应的发生使得药物在体内外的释放机制有所不同[4, 13]; 没有标准的体外释放度测定方法, 不能很好地模拟药物在体内的释放行为等[5]。因此, 文献[3, 6]中仅报道了对利培酮和纳曲酮(小分子药物)聚合物微球建立了A级IVIVC。
为了研究是否能对注射用醋酸戈舍瑞林微球建立IVIVC, 本文制备了3种释放速率不同的醋酸戈舍瑞林微球, 以SD大鼠为动物模型, 进行了体内外相关性研究, 最终建立了醋酸戈舍瑞林微球的A级IVIVC模型。
材料与方法主要仪器 Aglient1260系列高效液相色谱系统(美国安捷伦科技有限公司); EM-30 Plus型扫描电镜(韩国库萨姆公司); DSC822E型差示扫描量热仪(瑞士Mettler Toledo公司); Masterizer 2000激光粒度仪(英国马尔文公司); QTRAP5500质谱仪(美国ABSciex公司)。
药品与试剂 醋酸戈舍瑞林(瑞士Bachem公司, 批号: 1068468);戈舍瑞林-D10 (印度Clearsynth公司, 批号: CS-GR-102); PLGA 5050 (山东绿叶制药有限公司, 批号: LY1180045);甲醇(色谱纯, 批号: SJ6SF66957)、乙腈(色谱纯, 批号: DI6DF66786)、四氢呋喃(色谱纯, 批号: I0891701720)均购于德国Merck公司; Tween 20 (化学纯, 批号: 20170323)、二氯甲烷(色谱纯, 批号20170402)、聚乙烯醇(PVA, 批号: 20160203)均购于国药集团化学试剂有限公司; 乙酸(色谱纯, 美国TEDIA公司, 批号: 17060467);甲酸(色谱纯, 美国Anaqua Chemicals Supply公司, 批号: 73C1606TD)。
动物 雄性SD大鼠(济南朋悦实验动物有限公司, 生产许可证号: SCXK (鲁) 2014-0007), 体重: 220~250 g。
醋酸戈舍瑞林微球的制备 采用复乳法(S/O/W法)制备醋酸戈舍瑞林微球。具体制备步骤如下:取PLGA 2 g溶于8 mL二氯甲烷中, 磁力搅拌使之完全溶解作为油相。将醋酸戈舍瑞林原料药加入到油相中, 在11 000 r·min-1条件下高速分散制成S/O型初乳。将PVA(1%, v/v)溶液1 L预冷至8 ℃后置于均质机上, 在2 000 r·min-1条件下, 注入初乳并乳化4 min, 制成S/O/W型复乳。将制备的复乳低速搅拌4 h, 挥发有机溶剂, 将微球过150目筛后用蒸馏水冲洗4次, 于真空冷冻干燥机中冻干即得。
微球的表征
载药量 取醋酸戈舍瑞林微球20.0 mg置于10 mL量瓶中, 加2 mL乙腈超声使之溶解, 用0.1% (v/v)醋酸稀释至刻度, 摇匀。取该溶液约1 mL于1.5 mL离心管中, 以13 000 r·min-1离心10 min, 取上清液作为供试品溶液, 用HPLC测定戈舍瑞林浓度。色谱条件为色谱柱: Ultimate XB-C18, 250 mm × 4.6 mm, 5 μm, 流动相: 0.5%磷酸水-0.5%磷酸乙腈(75:25, v/v); 流速: 1 mL·min-1; 柱温: 40 ℃; 检测波长: 220 nm。按照下式计算微球载药量: DL=WD/WM×100%, 其中DL为微球载药量, WD为微球中总药量, WM为微球总量。
粒度 将微球分散在0.1% Tween 20中, 用马尔文2000粒度仪进行粒度测定。
玻璃化转变温度(Tg) 使用示差扫描量热法(DSC)测定醋酸戈舍瑞林微球Tg。取适量微球于铝坩埚中, 压盖密封, 在0~100 ℃内, 升温速率10 ℃·min-1的条件下测定, 每个样品测两次, 取第2次结果进行分析。
形貌分析 使用扫描电镜(SEM)对制备的醋酸戈舍瑞林微球的形貌进行表征。将醋酸戈舍瑞林微球涂布在粘有导电胶的样品座上, 对样品进行喷金处理。将处理好的样品用SEM进行分析。
体外释放度研究 采用恒温水浴振荡法测定醋酸戈舍瑞林微球的体外释放度。称取醋酸戈舍瑞林微球约20 mg, 置于25 mL塑料离心管中, 加入释放介质5% (v/v)甲醇水5 mL, 放入温度为(45 ± 0.5) ℃、转速为50 r·min-1的恒温水浴振荡器中, 在预定的时间间隔精密量取每份溶液4 mL, 同时补加等体积的释放介质, 取出溶液以13 000 r·min-1转速离心10 min。离心结束后, 取上清液作为供试品溶液, 用HPLC进行测定, 方法同载药量测定。
微球释放机制研究 在体外释放度测定条件下, 分别在不同的时间点取出释放样品, 尽量移除释放介质后25 ℃真空干燥12 h, 使用SEM观察微球形貌。使用凝胶渗透色谱法(GPC)测定PLGA分子量, 具体操作为:取一套聚苯乙烯分子量标准品, 加入四氢呋喃1.5 mL, 作为对照品溶液; 取释放过程中微球约6 mg, 加入四氢呋喃1.5 mL, 振摇溶解, 作为供试品溶液。色谱条件为:色谱柱Styragel® HT3 (300 mm×7.8 mm, 10 μm, Mw: 500~30 000)与色谱柱Styragel®6E (300 mm×7.8 mm, 10 μm, Mw: 5 000~60 000)串联使用; 柱温为30 ℃; 流速为: 1.0 mL·min-1; 进样体积为20 μL; 检测器为示差折光检测器, 检测器温度为35 ℃, 用凝胶渗透色谱软件计算PLGA的Mw。
体内药代动力学研究 注射用醋酸戈舍瑞林微球在SD大鼠体内的药代动力学实验方案经山东绿叶制药有限公司动物伦理委员会批准实施。取醋酸戈舍瑞林微球适量, 加入CMC-Na溶液配成混悬剂后按1.8 mg·kg-1剂量对SD大鼠经肌内注射给药。分别于给药前及给药后不同时间经大鼠眼球后静脉丛取血, 收集到的血液样品置于肝素化试管中, 4 ℃、13 000 r·min-1离心10 min, 将上清液移至EP管中, 分析前将血浆样品置于-80 ℃冰箱中保存。建立的分析方法按照CFDA颁布的《生物样品定量分析方法验证指导原则》进行验证。采用经过方法学考察合格的液相色谱-串联质谱(LC-MS/MS)法[14]测定血浆中戈舍瑞林的浓度。
样品前处理 取大鼠血浆100 μL于离心管中, 加入100 μL内标溶液(戈舍瑞林-D10, 10 μg·L-1)、100 μL甲醇-水(60:40, v/v)、100 μL甲醇, 涡旋混合1 min。上层导入已活化的HLB固相萃取柱(1 cc, 30 mg), 用1 mL甲醇-水(60:40, v/v)洗杂质, 再用1 mL 0.01% (v/v)甲酸甲醇洗脱, 洗脱液置于50 ℃水浴, 用干燥的氮气流吹干, 再用100 μL甲醇-水(60:40, v/v)复溶, 涡旋后取10 μL进样至液质系统。
色谱条件 色谱柱为ZORBAX Eclipse Plus C18柱(50 mm × 2.1 mm, 1.8 μm); 流动相为甲醇(A)和0.02 % (v/v)甲酸水(B); 流速为0.3 mL·min-1; 柱温40 ℃。
质谱条件 离子源:电喷雾离子化源(ESI); 极性:正离子; CE电压: 30 eV; DP电压为40 V; 离子喷射电压: 5 500 V; 温度: 550 ℃; 源内气体1 (N2)压力: 50 psi; 气体2 (N2)压力: 50 psi; 气帘气(N2)压力: 30 psi; 碰撞气压力: 8 psi; 用于定量分析的离子反应为:戈舍瑞林(635.4/607.3), 内标戈舍瑞林-D10 (640.4/612.5)。
IVIVC的建立 根据文献报道[15, 16], 将血药浓度-时间曲线经%AUC法处理后得到体内累积吸收曲线, 使用梯形面积法计算AUC, 公式如下:
| $\begin{array}{l} {\rm{AU}}{{\rm{C}}_{\left( {{t_1} - {t_2}} \right)}} = \left[ {\frac{{{c_1} + {c_2}}}{2}} \right] \times \left( {{t_2} - {t_1}} \right)\\ {F_a}\left( t \right) = {\left( {{\rm{AUC}}} \right)_t}/{\left( {{\rm{AUC}}} \right)_\infty } \end{array}$ |
其中, Fa(t)为在时间t内被吸收的药物的百分数, (AUC)t为在时间t内血药浓度-时间曲线下面积, (AUC)∞为血药浓度-时间曲线下总面积。以体外累积释放度为自变量, 以体内累积释放度为因变量进行线性回归, 建立IVIVC方程, 根据相关系数(r)值判断二者相关性[17]。
统计学方法 采用SPSS 16.0程序进行统计学分析, 实验结果以x± s表示。多样本均数间比较采用单因素方差分析, 显著性差异表示为P < 0.05。
结果与讨论 1 醋酸戈舍瑞林微球的表征3种释放速率不同的醋酸戈舍瑞林微球的物理化学性质见表 1。结果显示, 3种微球的载药量相似, 均为3.5%左右。制备的3种微球制剂(F、M和S)的粒径见图 1A, 3种微球的粒径较相似(P > 0.05), 均在80~87 μm。微球制备时所使用的高分子PLGA分子量不同, 3种微球的玻璃化转变温度略有差异。3种醋酸戈舍瑞林微球的扫描电镜照片见图 1B~D, 3种微球制剂均呈现良好的球形形态, 其中制剂F与制剂M圆整度较好且表面较光滑, 而制剂S圆整度较差, 表面褶皱较多。
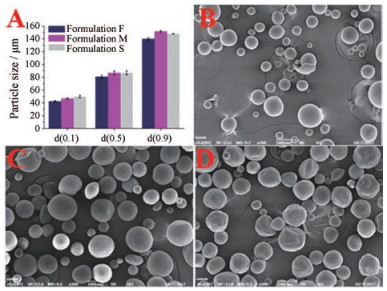
|
Figure 1 Scanning electron microscope (SEM) micrographs of goserelin acetate microspheres. A: Particle size of the goserelin acetate microspheres with different release rates. d (0.1), d (0.5) and d (0.9) are characteristic values of particle size distribution. B: Formulation F; C: Formulation M; D: Formulation S |
| Table 1 Physicochemical properties of the goserelin acetate microspheres with different release rates. n = 3, x± s. Mw: Molecular weight of poly(lactic-co-glycolic acid (PLGA); DL: Drug loading; Tg: Glass transition temperature |
醋酸戈舍瑞林在水中溶解度好, 释放介质体积选择为5 mL便可满足漏槽条件; 醋酸戈舍瑞林在该介质中稳定性较好, 且5% (v/v)甲醇水溶液为Trelstar® Depot (注射用双羟萘酸曲普瑞林)使用的释放介质[18], 由于戈舍瑞林和曲普瑞林都是十肽组成的促性腺激素释放激素(GnRH)类似物, 其释放行为可能具有相似性。因此, 选择5% (v/v)甲醇水作为释放介质。此外, 经过对释放装置和释放温度等影响因素进行考察后, 确定使用恒温水浴震荡法, 在45 ℃条件下考察3种醋酸戈舍瑞林微球的体外释放曲线, 结果如图 2所示。由图可见, 3种醋酸戈舍瑞林微球在5%甲醇水、45 ℃条件下的释放曲线显示, 在释放中后期, 3种微球的释放速度为制剂F > 制剂M > 制剂S, 这是因为用于制备醋酸戈舍瑞林微球的PLGA分子量依次增加, 随着PLGA分子量的增加, 微球降解速率变慢, 使得醋酸戈舍瑞林的释放速率减慢, 该结果与文献报道[19]一致。在释放前期, 制剂S的释放速度快于制剂M与制剂F, 不符合上述微球的释放规律。因此, 本文通过对释放过程中微球的形貌观察及PLGA分子量测定, 并结合释放曲线及文献报道推测醋酸戈舍瑞林微球的释放机制。

|
Figure 2 In vitro release profiles of the goserelin acetate microspheres using sample-and-separate method at 45 ℃ in 5% (v/v) methanol. n = 6, x± s |
根据文献[20]报道, 微球的释放过程主要分为3个阶段——突释阶段、扩散阶段和溶蚀阶段。突释阶段:微球表面被润湿, 黏附在微球表面的药物溶解到介质中; 扩散阶段:微球表面出现一些水性通道, 药物通过这些水性通道从微球内部扩散到介质中; 溶蚀阶段: PLGA降解速度增加, 微球溶蚀, 药物快速释放。微球释放过程中分子量测定结果(图 3)显示, PLGA分子量呈持续下降趋势, 且整个释放过程中, 分子量大小始终为制剂F < 制剂M < 制剂S, 说明PLGA的降解, 微球溶蚀是微球中药物释放的主要途径。图 4为醋酸戈舍瑞林微球制剂F、制剂M和制剂S在释放过程中不同时间点的电镜扫描照片。在释放初期(第1天), 制剂S微球表面褶皱较多, 不平整。因此, 与释放介质接触面积较大, 且表面形成了较多的孔洞, 这与微球体外释放结果(图 2)中释放前期制剂S释放速度快于制剂F和制剂M是一致的, 说明在此阶段扩散作用是微球释放的主要因素。第2天电镜照片显示, 微球之间黏连严重, 内部孔径增大, 不再具有整球形态, 体外释放曲线显示释放速度加快, 说明此时微球处于溶蚀阶段, PLGA的降解是药物释放的主要途径。

|
Figure 3 Molecular weight of PLGA of goserelin acetate microspheres during release |

|
Figure 4 SEM micrographs of the goserelin acetate microsphere during release |
4.1.1专属性 空白血浆中的内源性物质不干扰戈舍瑞林和戈舍瑞林D-10的测定。
4.1.2标准曲线 取空白大鼠血浆制备成系列浓度的戈舍瑞林标准样本, 按照“体内药代动力学研究中样本前处理”项操作。以戈舍瑞林浓度为横坐标, 戈舍瑞林与戈舍瑞林-D10的峰面积比为纵坐标, 用加权(w = 1/x2)最小二乘法进行回归运算, 求得戈舍瑞林标准曲线方程为y = 0.232 x + 0.000 981, r = 0.999 0。
4.1.3准确度和精密度 考察了低、中、高3个浓度的质控样本的精密度和准确度。结果表明, 批内、批间精密度RSD在1.25%~9.07%, 准确度RE在-2.08%~7.96%, 均在可接受范围内。
4.1.4基质效应 空白基质提取后添加相应浓度标准溶液, 以基质存在下的峰面积与不含基质的相应峰面积相比, 计算戈舍瑞林的基质效应。低、高水平的基质效应分别为100.7%和98.9%。
4.1.5稳定性 观察大鼠血浆样品经过3次冷冻-解冻循环, 室温放置3 h, 在-80 ℃下放置60天及样品经处理后室温放置10 h的稳定性。相对标准偏差绝对值均小于10%, 表明大鼠血浆中戈舍瑞林在以上所有条件下均稳定。
4.2 血药浓度-时间曲线大鼠肌内注射醋酸戈舍瑞林微球后, 其血药浓度-时间曲线见图 5。给药后1 h内, 血浆中戈舍瑞林浓度达到第1次峰值, 表现为突释阶段。在该阶段后, 制剂S呈明显的双峰, 在第1~5天血药浓度高于制剂F和制剂M, 这与体外释放曲线前期, 制剂S释放速度快于制剂F和制剂M的情况相对应。从达峰时间来看, 制剂S的达峰时间最长, 制剂M的达峰时间介于S制剂与制剂F之间, 体外释放度测定的醋酸戈舍瑞林微球的释放趋势与醋酸戈舍瑞林在SD大鼠体内的释放趋势一致, 证明体外释放度方法能很好地反映醋酸戈舍瑞林微球在SD大鼠体内的释放情况。

|
Figure 5 Mean plasma concentration-time profiles of goserelin acetate microspheres in SD rats following intramuscular administration at a single dose of 1.8 mg·kg-1. n = 6, x± s |
将3种释放速率不同的醋酸戈舍瑞林微球在SD大鼠体内的血药浓度-时间数据经%AUC法进行处理后, 得到3种微球在SD大鼠体内的累积释放曲线, 结果见图 6。
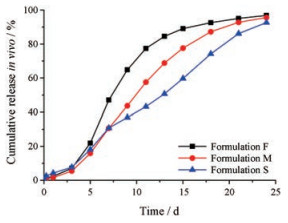
|
Figure 6 In vivo cumulative release profiles of goserelin acetate microspheres with different release rates |
选用释放速率不同的3批微球制剂两两组合建立体内外相关性模型, 即以体外累积释放度为横坐标, 以体内累积释放度作为纵坐标, 绘制相关性曲线, 并用数学公式对相关性曲线进行拟合, 结果见图 7 (A~C), 所得的体内外相关性方程见表 2。结果表明, 体外累积释放度与体内累积释放度之间相关性良好(r > 0.98)。将未参与建模的第3批微球制剂作为外部预测能力验证批次, 将其体外累积释放曲线代入体内外相关性模型计算得到体内累积释放曲线, 并与其在大鼠体内的实际累积释放曲线进行比较, 结果见图 7 (D~F)。由图显示, 预测得到的体内累积释放曲线与实测得到的体内累积释放曲线基本重合, 证明本研究所建立的体内外相关性模型在大鼠体内具有良好的预测能力。
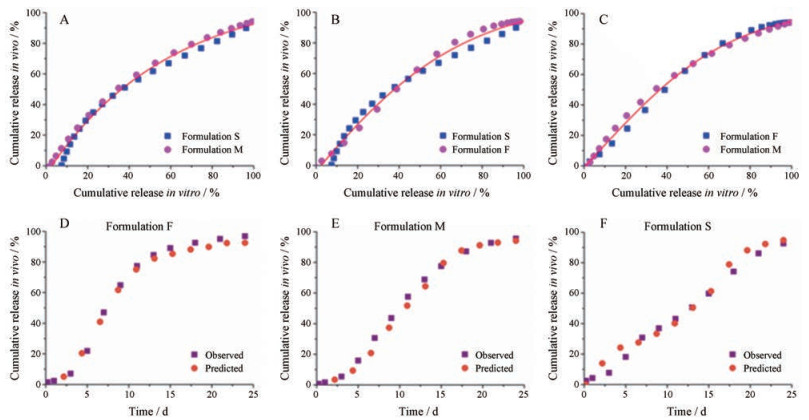
|
Figure 7 In vitro-in vivo correlation (IVIVC) developed for goserelin acetate microspheres. A: IVIVC developed using Formulation S and M; B: IVIVC developed using Formulation S and F; C: IVIVC developed using Formulation F and M; D: Observed and predicted in vivo release profiles of formulation F; E: Observed and predicted in vivo release profiles of formulation M; F: Observed and predicted in vivo release profiles of formulation S |
| Table 2 IVIVC equations and their correlation coefficients established using different microspheres formulation |
本研究采用复乳法(S/O/W法)制备了3种释放速率不同的注射用醋酸戈舍瑞林微球。结合醋酸戈舍瑞林微球在体内外的释放情况及释放过程中PLGA分子量和形貌的研究, 推测其具有3个释放阶段, 即:突释阶段, 微球表面的药物溶解释放; 扩散阶段, 微球内部药物扩散至微球表面后释放; 溶蚀阶段(主要阶段), 随着PLGA的降解, 药物在聚合物溶蚀和扩散的双重作用下完全释放。本文所开发的体外释放度测定方法对不同的醋酸戈舍瑞林微球具有良好的区分能力。文中选择不同的建模批次微球建立IVIVC, 均相关性良好(r > 0.98), 外部预测能力验证结果表明, 所建立的IVIVC方程在大鼠体内具有良好的预测能力。醋酸戈舍瑞林微球IVIVC的建立, 证明本研究所开发体外释放度测定方法可以很好地预测醋酸戈舍瑞林微球在大鼠体内的释药行为, 并且可用于体外释放度方法限度的制定, 同时可指导处方筛选, 加快醋酸戈舍瑞林微球制剂的开发进程。
| [1] | Hickey T, Kreutzer D, Burgess DJ, et al. Dexamethasone/PLGA microspheres for continuous delivery of an anti-inflammatory drug for implantable medical devices[J]. Biomaterials, 2002, 23: 1649–1656. DOI:10.1016/S0142-9612(01)00291-5 |
| [2] | D'Souza SS, Deluca PP. Development of a dialysis in vitro release method for biodegradable microspheres[J]. AAPS PharmSciTech, 2005, 6: E323–E328. DOI:10.1208/pt060242 |
| [3] | Andhariya JV, Shen J, Choi S, et al. Development of in vitro-in vivo correlation of parenteral naltrexone loaded polymeric microspheres[J]. J Control Release, 2017, 255: 27–35. DOI:10.1016/j.jconrel.2017.03.396 |
| [4] | Rawat A, Bhardwaj U, Burgess DJ. Comparison of in vitro-in vivo release of Risperdal® Consta® microspheres[J]. Int J Pharm, 2012, 434: 115–121. DOI:10.1016/j.ijpharm.2012.05.006 |
| [5] | Shen J, Burgess DJ. Accelerated in-vitro release testing methods for extended-release parenteral dosage forms[J]. J Pharm Pharmacol, 2012, 64: 986–996. DOI:10.1111/j.2042-7158.2012.01482.x |
| [6] | Shen J, Choi S, Qu W, et al. In vitro-in vivo correlation of parenteral risperidone polymeric microspheres[J]. J Control Release, 2015, 218: 2–12. DOI:10.1016/j.jconrel.2015.09.051 |
| [7] | Burgess DJ, Crommelin DJ, Hussain AS, et al. Assuring quality and performance of sustained and controlled released parenterals[J]. Eur J Pharm Sci, 2004, 21: 679–690. DOI:10.1016/j.ejps.2004.03.001 |
| [8] | Zhao YQ, Zhou SH, Liu WJ, et al. Discussion of development and validation of dissolution methods for solid oral dosage forms[J]. Acta Pharm Sin (药学学报), 2018, 53: 202–209. |
| [9] | FDA: guidance for industry extended release oral dosage forms: development, evaluation, and application of in vitro/in vivo correlation[EB/OL]. US: Department of Human Health and Human Services, Food and Drug Administration, 1997[2018-08-30]. http://www.fda.gov/cder/guidance/index.htm. |
| [10] | Shen J, Burgess DJ. In vitro-in vivo correlation for complex non-oral drug products:where do we stand?[J]. J Control Release, 2015, 219: 644–651. DOI:10.1016/j.jconrel.2015.09.052 |
| [11] | Suarez-Sharp S, Li M, Duan J, et al. Regulatory experience with in vivo-in vitro, correlations (IVIVC) in new drug applications[J]. AAPS J, 2016, 18: 1379–1390. DOI:10.1208/s12248-016-9966-2 |
| [12] | Roudier B, Davit BM, Beyssac E, et al. In vitro-in vivo correlation's dissolution limits setting[J]. Pharm Res, 2014, 31: 2529–2538. DOI:10.1007/s11095-014-1349-8 |
| [13] | Zolnik BS, Burgess DJ. Evaluation of in vivo-in vitro release of dexamethasone from PLGA microspheres[J]. J Control Release, 2008, 127: 137–145. DOI:10.1016/j.jconrel.2008.01.004 |
| [14] | Zhang S, Han JB, Leng GY, et al. An LC-MS/MS method for the simultaneous determination of goserelin and testosterone in rat plasma for pharmacokinetic and pharmacodynamic studies[J]. J Chromatogr B, 2014, 965: 183–189. DOI:10.1016/j.jchromb.2014.06.028 |
| [15] | D'Souza S, Faraj JA, Giovagnoli S, et al. IVIVC from long acting olanzapine microspheres[J]. Int J Biomater, 2014, 2014: 407065. |
| [16] | Chu DF, Fu XQ, Liu WH, et al. Pharmacokinetics and in vitro and in vivo correlation of huperzine A loaded poly (lactic-co-glycolic acid) microspheres in dogs[J]. Int J Pharm, 2006, 325: 116–123. DOI:10.1016/j.ijpharm.2006.06.032 |
| [17] | Lai HQ, Hu Y, Li XD. The in vitro dissolution of total composition of the tablet of rhizomes of ligusticum chuanxiong components and in vitro-in vivo correlation by the method of area under the absorbance-wavelength curve[J]. Acta Pharm Sin (药学学报), 2015, 50: 788–792. |
| [18] | Trelstar®: depot, clinical pharmacology and biopharmaceutics review for NDA[EB/OL]. US: Department of Human Health and Human Services, Food and Drug Administration, 2000[2018-08-30].https: //www.accessdata.fda.gov/drugsatfda_docs/nda/2000/20-715_Trelstar_biopharmr_P1.pdf. |
| [19] | Gao KP, Chen QH. Research of method for accelerated in vitro drug release from poly-ester microsphere injection[J]. Chin J New Drugs (中国新药杂志), 2009, 18: 614–617. |
| [20] | Somayaji MR, Das D, Przekwas A. A new level a type IVIVC for the rational design of clinical trials toward regulatory approval of generic polymeric long-acting injectables[J]. Clin Pharmacokinet, 2016, 55: 1179–1190. DOI:10.1007/s40262-016-0388-1 |
 2019, Vol. 54
2019, Vol. 54


