2. 华中科技大学同济医学院药学院, 湖北 武汉 430030
2. School of Pharmacy, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
肝癌是一种高度恶性肿瘤疾病。据统计, 2015年我国约有46.61万例新发肝癌病例和42.21万例死亡病例, 其发病率排名前五, 是一种死亡率较高的常见肿瘤疾病[1]。纵观肿瘤治疗领域, 最主要的最有效手段依然是化学药物治疗。然而, 大部分化疗药物的静脉给药极易造成肿瘤细胞的多药耐药性, 更加不幸的是, 肿瘤外包被的紧密细胞基质在药物递送的血管灌注中起到了重要的屏障作用[2, 3]。因此, 如何减轻肿瘤化疗药物的毒副作用, 提高肿瘤药物的靶向性, 增加其抗肿瘤的疗效已成为临床上亟待解决的问题。
另一方面, 微小非编码RNA (microRNA, miRNA)的发现为基因治疗领域开启了一扇新的大门。它可以作为基因表达的主调控因子, 在许多癌症中的启动和进展中扮演着关键的角色。在肝细胞癌(hepatocellular carcinoma, HCC)中, miR-375的异常调节也涉及多种肿瘤发生的各个方面, 包括肝腺瘤、肝硬化和肝癌发展的不同阶段[4, 5]。本课题组及其他已报道相关研究表明, miR-375主要通过抑制下游YAP-1、AEG-1、ATG7等基因的表达而抑制肿瘤的进一步发生[6, 7]。因此, miR-375对于肝癌的替代治疗是一个较理想的靶点。然而, miR-375作为一种基因药物需要借助合适的载体才能进入细胞发挥抗肿瘤效应。
近年来, 基于纳米载体的药物治疗优势不断凸显, 科学家们已经研究出不同种类的药物递送系统, 为此纳米材料的选择尤为重要。通过化学合成的介孔材料被认为是一种十分有前景的智能纳米药物载体[8, 9]。功能性的中空介孔硅由于其独特的结构特点, 如高度均匀可控的介孔孔道、稳定的化学性质、良好的结构耐用性和优良的热稳定性, 使其成为理想的功能性容纳药物的载体材料[10−13]。鉴于肿瘤的发生发展是多因素影响的结果, 因此联合不同作用机制的化疗药物与具有特异性的基因药物进而达到最佳治疗效果, 成为肿瘤治疗的新理念。现已有多项研究成功制备了低毒、可控、稳定和靶向的共载药纳米给药体系[14]。本文以抗肿瘤药物盐酸多柔比星(doxorubicin hydrochloride, DOX)为模型药物, 设计了一种全新的脂质体包被的中空介孔硅纳米材料(LHMSN), 为化疗药物与基因药物在肝癌治疗中的联合应用提供一定的研究基础。
材料与方法药品和仪器 JEM-2100型透射电镜(日本JEOL公司); UV 160U紫外-可见光分光光度计(日本Shimadzu公司); Zeta Plus光动力散射仪(美国Brookhaven Instruments公司); BD FACS C6型流式细胞仪(美国Becton Dickinson公司); Multiskan GO全波长酶标仪(美国Termo Scientific公司); 荧光倒置显微镜(日本Olympus公司); Western blot及转膜设备(美国BioRad公司); Micromeritcs ASAP2010比表面孔径分布测定仪(美国Boynton Beach公司)。
DOX原料药(> 99.8%, 商水生物科技有限公司); 正硅酸四乙酯(tetraethyl orthosilicate, TEOS, 分析纯, 国药集团化学试剂有限公司); 氯化十六烷基三甲基铵(cetyltrimethylammonium chloride, CTAC, 25 wt%)、胆固醇(cholesterol, CHOL) (美国Sigma Aldrich公司); 二油酰基三甲胺丙烷甲基硫酸盐(DOTAP, 美国Alabaster公司); DMEM培养基、胎牛血清(美国Gibco公司); 碘化丙啶(propidium iodine, PI)、MTT、Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术公司); miR-375按照5'-CCCGCGACGAGCCCCUCGCACAA AACGC-3'和5'-GCGUUUUGUUCGUUVGGCUCGC GUGAGG-3'序列由广州锐博公司合成, 其他试剂均为分析纯。
细胞模型 人肝癌HepG2细胞株、Hep3B细胞株和Huh7细胞株均来自中国典型培养物保藏中心。所有人肝癌细胞株培养于含10%胎牛血清DMEM培养液中, 在37 ℃、5% CO2孵箱中孵育, 每1~2天更换1次培养液。
中空介孔硅(HMSN)的合成 本研究对介孔硅经典StÖber合成法[6]进行改良从而合成中空介孔硅, 其方法主要分为3个步骤。①合成模板dSiO2:将TEOS 1 mL、超纯水5 mL、氨水0.8 mL加入至35.7 mL乙醇中搅拌1.5 h形成乳白色dSiO2, 洗涤并用水重悬备用。②合成SiO2@MSN:取2 g CTAC (8 mL)、TEA 20 mg、dSiO2 10 mL溶解于20 mL超纯水室温搅拌1 h后降温至80 ℃, 再加入TEOS 0.15 mL继续搅拌1 h。③合成HMSN:上述混合液加入Na2CO3 636 mg, 50 ℃反应1.5 h。离心收集沉淀, 用1 wt% HCl室温洗涤除去CTAC并用水重悬。
HMSN-DOX的制备 精密量取1 mg·mL−1 HMSN纳米粒水溶液9 mL, 在剧烈搅拌中加入10 mg·mL−1 DOX水溶液1 mL, 超声2 min, 继续搅拌24 h。制备HMSN-DOX纳米粒离心去除上清, 加入超纯水1 mL离心洗涤至上清无色, 最后加超纯水1 mL重悬用。
LHMSN-DOX/miR-375的制备 DOTAP 61.92 mg、CHOL 42.6 mg、DSPE-PEG 28 mg于茄型瓶中, 用10 mL氯仿溶解, 45 ℃水浴旋蒸成膜30 min, 水化挤压得清透均一的脂质体溶液。将制备的HMSN和脂质体(5 mg·mL−1)等体积混合再吹打, 室温下伴随震荡混合1 h, 离心除去额外的脂质体并分散在磷酸盐缓冲液(PBS)中即得LHMSN[15]。制备的LHMSN-DOX按照所需浓度与miR-375涡旋混合即得LHMSN-DOX/miR-375, 使用前现配现用。
水合粒径及zeta电位的测定 取HMSN及LHMSN适量, 采用Zeta Plus粒度电位测定仪于25 ℃测定样品颗粒水合粒径大小、zeta电位值、各自多分散指数(polydispersity index, PDI)和SD值并记录。
表面形态观察 分别取HMSN、LHMSN-DOX样品10 μL轻轻滴到铜网吸附30 min。用干净的滤纸将多余的液体吸弃, 置于透射电镜下观察纳米粒形态(华中科技大学分析测试中心检测)。
载药量的测定 采用紫外分光光度法。取上述制备好的HMSN-DOX 100 μL于5 mL EP管中, 加入4%氢氟酸100 μL混合均匀, 40 ℃反应过夜, 将HMSN中DOX完全释放, 采用紫外480 nm处测定吸光度(A), 从而得到100 μL中DOX载药量(DL)。DL = WDOX/(WDOX+WHMSN), 其中WDOX为DOX含量; WHMSN为HMSN总量。
体外释放度实验 体外DOX释放实验采用透析法, 将LHMSN和HMSN溶液(相当于DOX 2 mg)放入具有1/3气隙的预处理的透析袋中密封, 然后将透析袋分别分散在pH 7.4和5.0的10 mmol·L−1 PBS 30 mL中, 并在黑暗环境中持续搅拌。采用UV分光光度计于1、3、5、6、8、12、20、24、30、48和72 h检测PBS中DOX的浓度。
琼脂糖凝胶电泳实验 配制含有Goldview染色试剂浓度为1% TAE缓冲液的琼脂糖凝胶, 将miR-375或LHMSN-DOX/miR-375 (miRNA剂量为50 pmol)上样, 以电压160 V电泳50 min。使用UV透射仪和数字成像系统(Life Science Technologies, USA)拍照。
细胞荧光摄取实验 将HepG2细胞接种于12孔板中, 培养24 h, 分别加入LHMSN-DOX/miR-375溶液和游离DOX水溶液1 μL (DOX质量浓度为1 μg·mL−1)继续培养0.5 h或8 h, 除去培养基, 洗涤。用4%多聚甲醛溶液固定细胞, 以DAPI染核并用PBS清洗, 于荧光倒置显微镜下观察HepG2细胞的摄取情况。
溶血实验 收集新鲜的血液样本10 mL, 离心(1 500 r·min−1, 10 min, 4 ℃), 洗净, 以Dulbecco的磷酸缓冲盐水(DPBS)重悬得25×108的红细胞5 mL。将4 mL的HMSN、LHMSN和25 kDa聚乙烯亚胺(PEI 25K)分别与同体积红细胞37 ℃孵育1 h。1%的Triton X-100和DPBS分别为阳性和阴性对照。离心分离后(1 500 r·min−1, 10 min, 4 ℃), 使用酶标仪于541 nm下检测A值, 并计算溶血率(HL), 公式如下: HL=(A样品-A阴性组)/(A阳性组-A阴性组)。
体外抗肿瘤活性检测 采用MTT法检测制剂体外抗肿瘤活性。将HepG2细胞接种在96孔板中, 密度为5×103个/孔, 待细胞贴壁后, 分别加入含DOX终质量浓度为0.005、0.01、0.025、0.05、0.1、0.5、1、2.5、5和10 μg·mL−1的DOX、LHMSN-DOX和LHMSN-DOX/miR-375培养基各1 μL, 培养36 h, 加入MTT检测液, 用酶标仪测定490 nm波长处的A值。
流式细胞分析 在6孔板中, 每孔接种4×105个HepG2细胞。贴壁后加入DOX终质量浓度为50 ng·mL−1、miR-375为100 nmol·L−1的游离DOX、LHMSN/miR-375、LHMSN-DOX和LHMSN-DOX/miR-375, 进行培养, 36 h后收集细胞并离心, 用生理盐水冲洗细胞2次, 加入结合缓冲液100 μL, FITC Annexin V和PI各5 μL, 在室温(约25 ℃)条件下孵育30 min, 最后用BD Accuri C6流式细胞仪检测。
肿瘤细胞划痕实验 将HepG2细胞接种于24孔板中, 每孔密度为5×105个细胞。在无菌环境中, 用200 μL移液管尖划过孔底造成垂直伤口。分别加入含DOX、HMSN-DOX、LHMSH-DOX和LHMSH-DOX/miR-375的新鲜培养基分别在0和24 h于显微镜下观察[5]。
细胞transwell侵袭实验 采用transwell小室(直径6.5 mm, 孔径8 μm, 美国康宁公司)进行迁移侵袭实验。在迁移实验中, 将5×104个HepG2细胞接种于含有DOX、HMSN-DOX、LHMSH-DOX和LHMSH-DOX/miR-375的上层无血清培养基中。含10%血清和相同浓度药物的培养基加入上下层小室。培养24 h后, 用棉签擦去上腔的非移行细胞, 其余用4% PFA固定15 h, 然后用1%结晶紫溶液染色, 用显微镜观察计数[5]。
蛋白免疫印记实验 培养6孔板中上述的细胞至70%~80%铺满状态, 按照DOX质量浓度为200 ng·mL−1, miR-375为100 nmol·L−1给予4种不同的制剂(DOX水溶液、HMSN-DOX、LHMSH-DOX和LHMSH-DOX/miR-375)培养36 h, 刮下6孔板中的HepG2细胞加入细胞裂解液置于冰上裂解, 离心, 取上清液。在10%丙烯酰胺凝胶中细胞裂解物电泳分离后转移到PVDF膜上。用含5%脱脂牛奶的TBST溶液封闭1 h, 分别孵育Bax、cleaved caspase-3、Bcl2、AEG-1和YAP-1抗体4 ℃过夜。然后将膜在含有0.1% Tween 20 PBST中洗涤3次, 孵育二抗1 h, 将膜洗涤4次, 并通过ECL发光底物曝光显影, 以β-actin作为内参。
统计学方法 使用Graphpad Prism 6.0软件对所有数据进行统计学分析, 实验所有数据以均数±标准差x± s表示。统计方法采用双侧t检验, P < 0.05为显著性差异。如果数据不符合正态分布, 则采用F检验。
结果 1 纳米载体的制备与表征共载miR-375与DOX脂质−中空介孔硅纳米粒(LHMSN-DOX/miR-375)的制备与结构示意图见图 1。水合粒径及zeta电位测量结果见表 1。每个样品检测5次算其平均值, 水合粒径为192 nm, PDI指数0.005, 且zeta电位值在-32 mV附近, 说明合成的HMSN纳米粒具有高度的均一性和稳定性。脂包被后纳米粒径显著上升, 初步证明HMSN表面成功包裹了磷脂, 同时PDI的上升是由于溶液中可能还有一小部分表面没有包上磷脂的HMSN, 但PDI在此小范围内上升并不会影响纳米粒的稳定性。而电位的翻转是由于表面的阳离子磷脂带正电荷, 包裹之后即掩盖了HMSN本身的电荷属性, 这也进一步验证了HMSN表面成功包裹上磷脂, 而这一正电荷值依旧维持在稳定的电位范围内, 即显示LHMSN为稳定的纳米粒。在偶联miR-375后, 由于核酸的负电性, 电位值呈现微弱的降低, 表明该纳米粒表面的磷脂能够很好地偶联核酸药物。

|
Figure 1 Schematic illustration of synthesis of hollow mesoporous silica nanoparticles (HMSN) (A). The SiO2 cores were synthesized by stirring cetyltrimethylammonium chloride (CTAC) and tetraethyl orthosilicate (TEOS) in water, and then CTAC was extracted with methanol-hydrochloric. The synthesis of lipid bilayer coated mesoporous silica nanoparticles loaded with doxorubicin (DOX) and miR-375 (LHMSN-DOX/miR375) (B). After HMSN loading DOX, lipid bilayer composed of 1, 2-dioleoyl-3-trimethy-lammonium-propane (DOTAP, chloride salt) was then fused to the DOX-loaded cores through film-hydration method. MiR-375 was then loaded by vortex |
| Table 1 The characterization of HMSN, LHMSN-DOX, LHMSN-DOX/miR-375 in phosphate buffer saline (PBS, pH 7.4). n = 5, x± s |
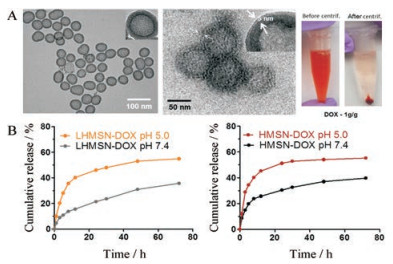
透射电镜结果见图 2A, 在200 kV的TEM拍摄下, 可见HMSN呈现球形, 有很好的均一性和分散性, 表面可见明显的中空及介孔结构, 平均粒径在60 nm左右。脂包被后能看到纳米粒表面一层明显的5 nm左右的脂质层结构, 说明此法能够稳定地制备出脂质-HMSN (LHMSN)。而将制备出的纳米粒10 000 r·min−1离心5 min后发现上清液清透色浅, 而超声后又能很好地均匀分散, 说明制备的脂质HMSN纳米粒能高效地将DOX包载进空腔内部, 体现了制备的LHMSN-DOX系统纳米粒的优良载药特性。
|
Figure 2 Transmission electron microscope (TEM) yxxb-54-1-151s of HMSN and LHMSN/miR-375 and the pictures of LHMSN-DOX solution before and after centrifugation were illustrated (A). The release profiles of LHMSN-DOX and HMSN-DOX in vitro (B). The release of DOX in simulated body fluid pH 7.4 and a pH 5.0 acid fluid at 37 ℃ for 72 h. Each data represented as the mean ± SD (n = 3) |
鉴于肿瘤的微酸环境(pH 5.0~6.5), 本实验在体外模拟了生理环境(pH 7.4)和肿瘤的微环境(pH 5.0)条件以考察DOX的释放特征。如图 2B, 相比于pH 7.4时, 在pH 5.0条件下, LHMSN-DOX中DOX的释放速度明显增大, 并且同等酸性条件下, 没有脂包被结构的HMSN-DOX释放速率低于LHMSN-DOX, 这提示LHMSN-DOX存在一定的酸依赖性, 在肿瘤组织中有较快释放。尽管该释药系统并没有特意设计pH敏感这一特性, 但是脂质材料在酸性条件下更易降解, 这与已报道的文献[10]中脂包被纳米粒中脂质层本身即具有一定的pH响应性一致。因此, 一方面脂质膜可以有效保护包载的药物, 减少制剂到达肿瘤前的泄漏; 另一方面, 脂质核/壳纳米粒的pH敏感性使得药物实现在胞内的迅速释药, 发挥药效。
3 LHMSN-DOX能够有效地偶联miR-375该实验用来验证miR-375是否成功载到纳米粒表面, 如图 3所示。游离的miR-375全部从上样孔迁移至正极, 且背景很干净。而当质量比为200:1(miR-375:LHMSN-DOX)时, 条带上只能看到微弱的亮度而大部分残留在上样孔, 但是随着质量比的降低, 残留量明显减小, 说明LHMSN-DOX能够有效地将miR-375偶联并在200:1时达到最大载药比。

|
Figure 3 Detection of mir-375 loading effciency by agarose gel electrophoresis at LHMSN-DOX/miR-375 ratios from 25:1 to 200:1 (w/w) |
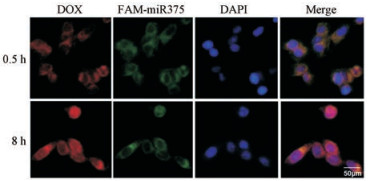
在HepG2细胞中观察其对药物的摄取情况, 使用荧光显微镜在200倍放大的条件下对其进行观察。紫光激发下发出蓝色的DAPI光, 绿光激发下发出FAM标记的miR-375的绿光, 蓝光激发下发出DOX的红光, 同一个颜色激发下不同时间点选用同样的曝光时间, 这样确保在分析时间依赖性摄取差异的过程中避免人为因素的影响。拍摄的图片使用Photoshop进行分析并merge组图, 在0.5 h时DOX和miR-375就能够达到比较好的摄取量, 且随着时间延长(8 h), 摄取量呈显著上升趋势(图 4)。说明该纳米粒在摄取方面有很强的能力并且能够达到比较高的携带效率。此外, 叠加后的图片也显示出很好的一致性。表明制备的LHMSN-DOX/miR-375可以成功携带两种药物进入肿瘤细胞。
|
Figure 4 Cellular uptake of LHMSN-DOX/miR-375 and intracellular distribution of DOX and miR-375 in HepG2 cells after 0.5 h or 8 h incubation. MiR-375 was labeled with FITC (green) and DOX were red |
静脉注射药物应对其生物相容性进行评估以确保对红细胞没有毒性。通过使用不同浓度的载体与红细胞共孵育, 然后测量血红蛋白释放到上清液中的量以评价载体的溶血率。PBS和Triton X-100作为阴性(0%血红蛋白释放)和阳性对照(100%血红蛋白释放)。PEI 25K为已知的具有显著溶血性的阳离子聚合物。由图 5A表明, 在不同浓度下HMSN和LHMSN的血红蛋白释放极低, 提示该纳米载药体系具有良好的安全性, 无不良反应。

|
Figure 5 Hemolysis of LHMSN with red blood cells (RBCs) (A). The positive and negative controls were 1% Triton X-100 in Dulbecco's phosphate-buffered saline (DPBS) and pure DPBS, respectively. Cell viability with different HCC cells (B). Cells were treated with drugs at indicated concentrations of DOX for 48 h. Cell viability was determined by MTT. Viabilities of untreated cells after 48 h culture were used as control and normalized as 100%. Data represented as the mean ± SD (n = 5, x± s. *P < 0.05. Cell apoptosis in HepG2 cells after 36 h treatment followed by flow cytometry analysis (C) |
检测游离DOX、LHMSN、LHMSN-DOX/miR-375对HepG2、Huh7和Hep3B细胞增殖的抑制作用。如图 5B所示, 处理48 h后, 空白载体在高浓度时不会对细胞产生毒性, LHMSN与DOX对HepG2、Hep3B和Huh7细胞的细胞毒性相当, 但与LHMSN-DOX或DOX相比, LHMSN-DOX/miR-375的细胞毒性更高。这表明, 负载于LHMSN内部后并未降低DOX本身的增殖抑制效果, 而由于miR-375的加入, 这一抑制效果显著提高, 并且随着浓度增大抑制增强。即将miR-375与DOX共载入LHMSN显著增强了抗肿瘤活性, 证明DOX与miR-375之间具有协同效应。
采用Annexin V/PI双染法标记细胞, 流式细胞术检测细胞凋亡情况, 细胞被分为4个区域(图 5C): Q1、Q2、Q3和Q4, 分别代表坏死细胞、晚期凋亡细胞、早期凋亡细胞和活细胞。结果显示:处理细胞36 h后, 游离DOX凋亡率为19.31% (Q2+Q3), LHMSN-DOX的凋亡率为18.47%, 说明药物进入载体后完全释放, 同样能够很好地发挥抗肿瘤的目的。而在联合使用miR-375后, LHMSN-DOX/miR-375载体诱导细胞的早期凋亡率为28.89%, 细胞凋亡率明显增高。进一步表明, miR-375和LHMSN-DOX具有协同效应, 与MTT结果一致。
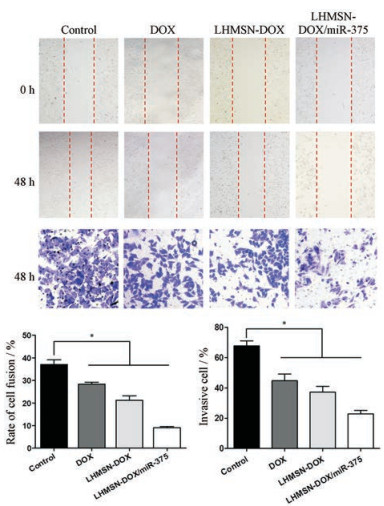
7 LHMSN-DOX/miR-375对HepG2迁移和侵袭能力的影响划痕实验结果如图 6显示, DOX、LHMSN-DOX和LHMSN-DOX/miR-375处理后迁移率分别为22%、20%和9%。与对照组相比, LHMSN-DOX/miR-375能显著降低HepG2细胞迁移。在Transwell实验中, DOX、LHMSN-DOX和LHMSN-DOX/miR-375对HepG2细胞侵袭结果如图 6所示, 与DOX (44%)相比, LHMSN-DOX (37%)显著降低HepG2细胞侵袭, 而LHMSN-DOX/miR-375 (22%)对HepG2细胞侵袭进一步降低。表明纳米化的DOX载药系统能够降低细胞的迁移和侵袭力, 在miR-375协同下抑制效果显著增强。
|
Figure 6 Wound-healing and transwell assay of HepG2 cells were treated with drugs at a concentration of DOX for IC20 for 48 h. All data are shown as mean ± SEM of 3 independent experiments. *P < 0.05 |
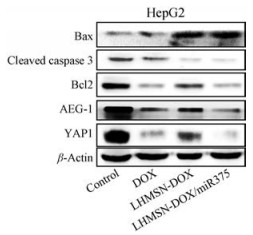
Western blot实验表明(图 7), 在HepG2细胞中, LHMSN-DOX对cleaved caspase-3、Bax和Bcl2三种凋亡蛋白表达的影响相对高于DOX组。这表明负载于LHMSN内部的DOX释放后可以有效诱导肝癌细胞凋亡。而LHMSN-DOX/miR-375组与DOX和LHMSN-DOX组相比则显著增加了Bax和cleaved caspase-3并降低了Bcl2的表达。且对miR-375下游基因AEG-1和YAP1产生了显著的抑制作用。这表明由LHMSN-DOX/ miR-375递送的DOX可以有效递送外源miR-375发挥内源性miR-375作用, 且由于DOX的存在发挥协同作用使凋亡进程大大增强。
|
Figure 7 Western blot of apoptotic-related and miR-375 target proteins in HepG2 and cells after treatment with free DOX, LHMSN-DOX or LHMSN-DOX/miR-375. β-actin was used as loading control |
本研究制备了脂包被中空硅纳米粒共载DOX和miR-375系统, 中空介孔硅表面具有密集分布的介孔、内部空隙巨大及独特的释放药物性质的优点, 同时还兼具有脂质体良好的生物相容性的优势[16]。相比普通介孔材料, 脂质-中空介孔硅纳米粒可以达到很高的载药量, 减少药物的泄漏, 使药物在肿瘤部位聚集。介孔硅表面的脂质材料可以轻松地将基因药物miR-375通过静电吸附作用荷载上去, 进而达到共载药的目的。
本研究中, 同等条件下脂包被后的纳米粒LHMSN释药速度显著降低, 这可能是由于脂质双分子层作为纳米粒的控制阀, 为药物泄露增加了一道屏障。同时, 脂质双分子层由于介孔氧化硅的支撑, 提高了其物理稳定性, 减少制剂到达肿瘤前的泄漏。脂包被纳米粒在低pH条件下释放速度加快, 体现出一定的酸敏感性, 由于酸性条件下脂质层更容易被破坏进而释放出DOX, 这与肿瘤的微酸环境相适应, 使得药物实现在肿瘤细胞内的集中释放, 发挥药效[10]。这一特性可以有效提高治疗效率且降低组织毒性。
电泳结果显示, 在达到合适比例时脂包被纳米粒可以最大限度地将miR-375吸附于纳米粒表面。进一步荧光摄取图片证实共载药纳米系统能同时将DOX和miR-375递送入胞且随时间延长摄取量显著增加。MTT结果证实共载药纳米系统对肿瘤细胞增殖的抑制作用呈浓度依赖性。同一条件下, 与游离的DOX相比, LHMSN-DOX/miR-375呈现出更高的细胞增殖抑制率, 可以推测LHMSN-DOX/miR-375可能通过分子水平的双重作用增加了细胞增殖抑制效应。
肿瘤细胞的迁移和侵袭与肿瘤不良的预后、极高死亡率密切相关。因此, 开发新型药物递送系统降低其转移与死亡率迫在眉睫。而本研究中设计的纳米药物递送系统LHMSN-DOX/miR-375被证实能够有效降低HepG2细胞的迁移和侵袭能力, 具体的作用机制还有待于进一步研究[17]。
Western blot实验表明, 共载药系统对DOX下游凋亡信号Bax、cleaved caspase-3、Bcl2和miR-375下游基因AEG-1的表达均存在一定的抑制作用, 且LHMSN-DOX/miR-375组显著高于其他组。表明共载药系统在蛋白表达水平的抑制作用使两种药物发挥协同抗肿瘤效应。
已知Bax、cleaved caspase-3和Bcl2为DOX作用靶点[18], 同时cleaved caspase-3和Bcl2为miR-375下游基因AEG-1的靶点。故研究中推测DOX和miR-375同时作用可引起细胞凋亡的发生。流式细胞实验也证实, LHMSN-DOX/miR-375通过协同引起肝癌细胞凋亡。
本研究表明, LHMSN-DOX/miR-375作为抗肿瘤药物的智能药物传递系统具有一定的应用前景。然而, 该阶段仅限于体外初步实验, 其体内抗肿瘤活性还有待进一步探索, 同时其肿瘤组织靶向性及对耐药细胞的作用也值得研究与探索。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115–132. DOI:10.3322/caac.21338 |
| [2] | Wang S, Xu Y, Chan HF, et al. Nanoparticle-mediated inhibition of survivin to overcome drug resistance in cancer therapy[J]. J Control Release, 2016, 240: 454–464. DOI:10.1016/j.jconrel.2016.04.018 |
| [3] | Oda K, Uto H, Mawatari S, et al. Clinical features of hepatocellular carcinoma associated with nonalcoholic fatty liver disease:a review of human studies[J]. Clin J Gastroenterol, 2015, 8: 1–9. DOI:10.1007/s12328-014-0548-5 |
| [4] | Tao J, Ji J, Li X, et al. Distinct anti-oncogenic effect of various microRNAs in different mouse models of liver cancer[J]. Oncotarget, 2015, 6: 6977–6988. |
| [5] | Xue HY, Liu Y, Liao JZ, et al. Gold nanoparticles delivered miR-375 for treatment of hepatocellular carcinoma[J]. Oncotarget, 2016, 7: 86675–86686. |
| [6] | He XX, Chang Y, Meng FY, et al. MicroRNA-375 targets AEG-1 in hepatocellular carcinoma and suppresses liver cancer cell growth in vitro and in vivo[J]. Oncogene, 2012, 31: 3357–3369. DOI:10.1038/onc.2011.500 |
| [7] | Wang Y, Lieberman R, Pan J, et al. miR-375 induces docetaxel resistance in prostate cancer by targeting SEC23A and YAP1[J]. Mol Cancer, 2016, 15: 70. DOI:10.1186/s12943-016-0556-9 |
| [8] | Chen F, Hong H, Shi S, et al. Engineering of hollow mesoporous silica nanoparticles for remarkably enhanced tumor active targeting efficacy[J]. Sci Rep, 2014, 4: 5080. |
| [9] | Chen Y, Chen H, Guo L, et al. Hollow/rattle-type mesoporous nanostructures by a structural difference-based selective etching strategy[J]. ACS Nano, 2010, 4: 529–539. DOI:10.1021/nn901398j |
| [10] | Li FF, Zhang XX, Guo SY, et al. Preliminary study on pH-sensitive lipid bilayer-coated mesoporous silica nanoparticles as a novel drug carrier for antitumor drug[J]. Acta Pharm Sin (药学学报), 2013, 48: 291–297. |
| [11] | Fei WD, Tao JY, Song QQ, et al. Advance in research of biodegradable mesoporous silica nanoparticles[J]. Acta Pharm Sin (药学学报), 2018, 53: 716–726. |
| [12] | Deng Li, Su TT, Huang XL, et al. Co-delivery of paclitaxel and cyclosporine by a novel liposome-silica hybrid nano-carrier for anti-tumor therapy via oral route[J]. Acta Pharm Sin (药学学报), 2014, 49: 106–114. |
| [13] | Yu Y, Tao C, Yang H, et al. Preparation of mesoporous silica nanoparticles in different pore size and its use in the solidification of sirolimus loaded self-microemulsifying drug delivery system[J]. Acta Pharm Sin (药学学报), 2017, 52: 985–991. |
| [14] | Su CW, Chiang CS, Li WM, et al. Multifunctional nanocarriers for simultaneous encapsulation of hydrophobic and hydrophilic drugs in cancer treatment[J]. Nanomedicine (Lond), 2014, 9: 1499–1515. DOI:10.2217/nnm.14.97 |
| [15] | Liu J, Stace-Naughton A, Brinker CJ. Silica nanoparticle supported lipid bilayers for gene delivery[J]. Chem Commun (Camb), 2009, 34: 5100–5102. |
| [16] | Tang F, Li L, Chen D. Mesoporous silica nanoparticles:synthesis, biocompatibility and drug delivery[J]. Adv Mater, 2012, 24: 1504–1534. DOI:10.1002/adma.201104763 |
| [17] | Wang B, Chen D, Guo W, et al. Silica nanoparticles suppress fibronectin-mediated adhesion and migration in normal human keratinocytes[J]. J Nanosci Nanotechnol, 2012, 12: 293–299. DOI:10.1166/jnn.2012.5127 |
| [18] | Bao Y, Yin M, Hu X, et al. A safe, simple and efficient doxorubicin prodrug hybrid micelle for overcoming tumor multidrug resistance and targeting delivery[J]. J Control Release, 2016, 235: 182–194. DOI:10.1016/j.jconrel.2016.06.003 |
 2019, Vol. 54
2019, Vol. 54


