2. 南京中医药大学中医儿科学研究所, 江苏 南京 210023;
3. 南京中医药大学药学院, 江苏省中药高效给药系统工程技术研究中心, 江苏 南京 210023
2. Institute of Pediatrics, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. College of Pharmacy, Jiangsu Provincial TCM Engineering Technology Research Center of High Efficient Drug Delivery System DDS, Nanjing University of Chinese Medicine, Nanjing 210023, China
急性肺损伤(acute lung injury, ALI)是炎症因子和氧化应激介导的肺泡上皮细胞及毛细血管内皮细胞损伤, 造成以肺实质弥漫性炎症为主要特征的疾病[1, 2]。尽管目前临床已有糖皮质激素等治疗策略, 但是药效不理想, 且有许多不良反应, 因此, 开发研究有效和安全的药物治疗ALI很必要[3]。
桔梗汤由桔梗和甘草两味药组成, 最早出自张仲景的《伤寒论》, 具有宣肺止咳、祛痰排脓之功效。《金匮要略》记载: “咳而胸满振寒, 脉数、咽干、不渴, 时时出浊唾腥臭, 久久吐脓如米粥者, 为肺痈, 桔梗汤主之”。现代研究表明桔梗汤具有抗炎、祛痰等作用[4, 5]。有研究显示桔梗汤对脂多糖(lipopolysaccharide, LPS)诱导的ALI小鼠具有保护作用[3], 但其作用机制还有待进一步研究。LPS是细胞内毒素的主要成分, 被认为可诱导肺部炎症, 是ALI的主要致病因素之一。LPS可以通过激活许多炎症细胞释放促炎因子, 触发最有效的炎症反应[3]。LPS会导致磷脂酰胆碱(phosphatidylcholine, PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)、磷脂酰甘油(phosphatidyl glycerol, PG)、磷脂酰丝氨酸(phosphatidyl serine, PS)、磷脂酰肌醇(phosphatidylinositol, PI)等磷脂(phospholipid, PL)的代谢紊乱[6]。
脂质组学是研究生物体内脂质代谢变化以及脂质调控在生命活动中作用的有效手段[7], 作为代谢组学的重要分支, 越来越得到人们的关注[8]。脂质种类繁多, 生物样品基质复杂, 所以脂质组学的分析需要借助先进的分离技术和检测手段, 目前主要以色谱-质谱联用技术为主[9, 10]。本文基于UHPLC-Q-Exactive Orbitrap/MS脂质组学方法[11, 12], 分析空白对照组、ALI模型组以及给药组的小鼠肺组织中磷脂代谢变化情况, 研究桔梗汤对ALI脂质代谢的调控, 尝试从脂质代谢的角度阐述桔梗汤治疗ALI的作用机制。
材料与方法试剂 自制去离子水(美国Millipore公司); 地塞米松(批号: 161206)购于浙江仙琚制药股份有限公司; 脂多糖(LPS, 美国Sigma公司); 磷酸盐缓冲液(PBS):氯化钠8.0 g、氯化钾0.2 g、磷酸氢二钠1.56 g、磷酸二氢钾0.1 g, 超纯水溶解并定容至1 L, 置高压蒸汽灭菌锅灭菌, 于室温冷却, 在超净台中分装备用; 冰醋酸(批号: 15080553613, 纯度: 99.5%)购于南京化学试剂有限公司; 甲醇、乙腈均为99.8%质谱纯, 购自德国Merck公司; 异丙醇、甲酸铵和乙酸铵均为99.8%质谱纯, 甲基叔丁基醚(methyl tert-butyl ether, MTBE)购于美国ROE公司; 内标: lyso PE (17︰1) (批号: LM171LPE-11)、SM (17︰0) (批号: 170SM-13)和PE (17︰0/17︰0) (批号: LM170PE-19)购于Avanti Polar Lipids公司。
仪器 LLegra64R高速冷冻离心机(美国Beckman公司); Vortex-Genie2涡旋振荡器(美国Scientific industries公司); Savant SPD1010真空离心浓缩仪(美国Thermo公司); THZ-C恒温震荡仪(太仓市强乐实验设备有限公司); Revco UXF型超低温冰箱(美国Thermo Fisher公司); KQ-500B型超声波清洗器(昆山市超声仪器有限公司); CPA225D型十万分之一电子天平(德国Sartorius公司); U3000高效液相色谱仪(美国Dionex公司); Q-Exactive四极杆-静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific公司); Xcalibur 2.1 SP1数据处理系统(美国赛默飞公司)。
实验动物 SPF级BALB/c雄性健康小鼠, 32只, 体重18~22 g, 8周龄, 购于南京青龙山动物养殖场, 动物合格证号: SCXK-苏-2016-0003。适应性饲养3天, 开始进行动物实验, 饲养条件:室温24~26 ℃, 相对湿度55%, 12 h光暗昼夜循环, 分笼饲养, 自由进食饮水。
药品制备 桔梗汤制备:取甘草药材200 g, 桔梗药材100 g, 加水1.5 L, 浸泡0.5 h后煎煮2 h, 取药液进行减压浓缩(75 ℃), 药液体积浓缩至原有的1/3, 加入95%乙醇, 调节药液乙醇浓度为70%, 于4 ℃冰箱内静置24 h后去除沉淀, 药液在45 ℃下减压浓缩回收乙醇, 制成终浓度为含有生药3 g·mL-1的药液(100 mL), 保存于−80 ℃备用。
LPS致BALB/c小鼠ALI模型制备[13] 以密封铝罐为工具, 将棉花倒入一定量乙醚放置罐底, 在其上层铺盖一层干燥棉花, 迅速将小鼠放入罐内并轻轻摇动数秒, 待小鼠四肢瘫软、呼吸急促后取出, 取1.25 mg·mL-1脂多糖40 μL滴入鼻腔, 待小鼠将药液全部吸入鼻腔后放入笼中。
实验分组 32只BALB/c雄性小鼠随机分为4组, 分别为空白对照组、ALI模型组、地塞米松(阳性药)组、桔梗汤组。
给药方案 将上述所有小鼠适应性饲养于无病原体环境中3天后进行实验, 以灌胃方式给药, 空白对照组、ALI模型组给予生理盐水, 阳性药组给予10 mg·mL-1地塞米松, 桔梗汤组给予1.35 g·kg-1的桔梗汤药液(按照人临床等效剂量折算小鼠给药量), 给药体积为10 mL·kg-1, 连续给药7天。
样本采集 第7天给药1 h后, 对小鼠按组别依次进行LPS致ALI造模, 造模方法见LPS致BALB/c小鼠ALI模型制备。造模后6 h, 小鼠脱颈处死, 解剖并采集左肺中叶用10%甲醛固定, 剩余肺组织, 放入冰箱−80 ℃保存, 备用。实验方案经南京中医药大学实验动物伦理委员会批准实施。
肺组织病理切片处理 取已经用甲醛固定的肺组织, 乙醇梯度脱水, 2次二甲苯透明, 石蜡包埋, 切片, 用苏木精-伊红(HE stain)染色, 通过光镜观察肺部形态。
肺组织UHPLC-Q-ExactiveOrbitrap/MS样本处理 称取肺组织约20 mg于2 mL离心管中, 加入超纯水200 μL, 球磨机上匀浆10 min。取组织匀浆液20 μL于1.5 mL的离心管中, 加入含内标[lyso PE (17︰1), SM (17︰0), PE (17︰0/17︰0)]的冰甲醇溶液225 μL, 涡旋10 s, 加入冰甲基叔丁基醚(MTBE), 涡旋10 s后于4 ℃振荡10 min后加入冰超纯水188 μL, 涡旋20 s后于4 ℃、14 000 r·min-1离心2 min, 吸取上清液350 μL至1.5 mL的离心管中, 真空挥干, 放置于−20 ℃待测。于挥干后的样本中加入复溶液(甲醇-甲苯, 9︰1) 110 μL, 涡旋10 min, 超声10 min, 4 ℃、14 000 r·min-1离心10 min后取上清进样分析。
色谱条件 色谱柱: ACQUITY CSH C18 (100 mm×2.1 mm, 1.7 µm), 流速: 0.3 mL·min-1, 正离子模式的流动相: A:乙腈-水(6︰4) + 10 mmol·L-1甲酸铵+0.1%甲酸; B:异丙醇-乙腈(9︰1) + 10 mmol·L-1甲酸铵+ 0.1%甲酸。负离子模式的流动相: A:乙腈-水(6︰4) + 10 mmol·L-1乙酸铵; B:异丙醇-乙腈(9︰1) + 10 mmol·L-1乙酸铵。流动相梯度: 0~4 min, 15%~30% B; 4~5 min, 30%~48% B; 5~22 min, 48%~82% B; 22~23 min, 82%~99% B; 23~24 min, 99% B; 24~24.2 min, 99%~15% B; 24.2~30 min, 15% B。柱温: 65 ℃, 进样量: 2 μL (正离子)/5 μL (负离子)。
质谱条件 Q-Exactive四极杆-静电场轨道阱高分辨质谱仪, 电离源: HESI源。扫描模式:正(+)/负(−)离子模式。质谱参数:喷雾电压: 3.5 kV (+)和3.0 kV (−), 离子源温度: 306 ℃ (+)和325 ℃ (−), 毛细管温度: 300 ℃, 鞘气和辅助气均为氮气, 鞘气流: 275 kPa, 辅助气流: 104 kPa, S-lens: 50, 扫描范围: m/z 215~1 800。
数据处理及统计方法 将UHPLC-Q-Exactive Orbitrap MS正、负离子两种模式检测获得的样本及QC的raw谱图文件, 经Abf Converter转换为abf格式, 导入MS-DIAL[14]软件中进行峰识别和峰对齐处理。物质鉴定是将一级和二级碎片离子和软件内置的Lipidblast数据库匹配, MS-DIAL运算后生成的结果经MS-FLO[15]标记处理, 手动检验筛选, 删除重复峰、标记同位素峰以及拆分不同离子加合峰, 同时保证dot product和reserve dot不小于700。整理得到的数据矩阵, 经R语言归一化, 以减少仪器误差, 保留生物误差。根据QC聚集程度以及RSD, 挑选最优的归一化方法, 整理后用Metaboanalyst 4.0网站, 采用正交偏最小二乘判别分析(OPLS-DA)和热图等多变量统计分析[16]; 同时用METDA网站进行非参数检验(Kruskal-Wallis test), 并根据各物质在样本中的峰高的中值计算fold change值, 选取P < 0.05及fold change > 1.2或fold change < 0.83筛选所得的物质为差异性代谢物。
结果 1 各组小鼠肺组织病理学观察空白对照(control)、ALI模型(model)、地塞米松(positive)和桔梗汤(Jiegeng Decotion)各组小鼠的肺组织HE染色结果见图 1。结果显示, 空白对照组小鼠的肺呈现正常形态, 肺泡壁很薄, 支气管腔内无渗出物, 黏膜上皮无变性坏死脱落, 管壁及周围组织无炎性细胞浸润。ALI模型组小鼠肺形态出现异常, 肺泡壁增厚, 支气管上皮细胞出现变性、坏死, 腔内见坏死细胞及大量渗出物, 病变处结构不清晰, 出现炎性细胞浸润。地塞米松组和桔梗汤组的总体病变程度较ALI模型组低, 肺形态有异常, 支气管周围出现部分炎细胞浸润。

|
Figure 1 Pathological change of lung tissue of mice in each group |
采用3种方式来监测实验操作误差并进行仪器稳定性考察: ①进实验样本前先进8针QC样本平衡系统; ②监测内标物质在所有样本中的峰高值, 并计算其RSD; ③每进8针实验样本进一针空白溶剂样本和QC样本, 利用包括QC样本在内的所有样本的主成分分析和各物质在QC样本中的变异度来检测仪器的重复性和可靠性。
经计算, 正离子模式下肺组织样品中内标物质lyso PE (17︰1)和SM (17︰0)峰高的RSD值分别为4.67%和7.77%;负离子模式下肺组织样品中内标物质lyso PE (17︰1)和PE (17︰0/17︰0)峰高的RSD值分别为6.14%和9.74%。所有实验样本与QC样本一起进行PCA分析, 相较于实验样本, QC样本在PCA图中均较集中, 表明本实验操作与仪器条件相对稳定。
3 磷脂组学分析将一级和二级碎片离子和软件内置的LipidBlast数据库匹配。图 2是PS 18︰0~20︰3的二级质谱碎裂图谱, 纵轴0刻度以上的黑色部分为LipidBlast数据库的数据图谱, 0刻度以下红色部分为MS-DIAL给出的PS 18︰0~20︰3的图谱, 数据碎片与LipidBlast数据库进行匹对, 由图可见, 碎片与LipidBlast数据库完全匹对, 表明物质鉴定准确。
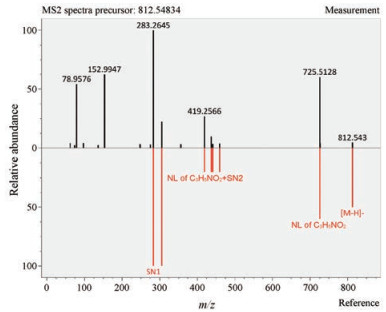
|
Figure 2 Selected lipid (PS 18︰0-20︰3) with matching fragmentation patterns to the LipidBlast library with MS-DIAL software |
正离子模式的数据经鉴定运算和处理后得到333个变量, 涉及122个磷脂, 主要为PC、PE、PG、PS等脂质。其中含量最丰富的是PC和PE。
负离子模式的数据经鉴定运算和处理后得到252个变量, 涉及159个磷脂, 主要为PE、PC、PG、PI、PS等脂质。其中含量最丰富的是PE。
4 非靶标磷脂组学代谢分析比较正负离子模式下空白对照组与ALI模型组小鼠肺组织中磷脂代谢物的水平, 将正负离子模式下各组数据集进行正交偏最小二乘判别分析(orthogonal partial least square-discriminate analysis, OPLS-DA), 图 3中每个点代表一个样本, 从图中可以看出, 空白对照组与ALI模型组有较好的区分度, 提示空白对照组小鼠与ALI模型组小鼠肺组织磷脂有差异; 地塞米松组与桔梗汤组均与ALI模型组有很好的区分, 提示地塞米松组与桔梗汤组对ALI小鼠肺组织磷脂有一定的调节作用。
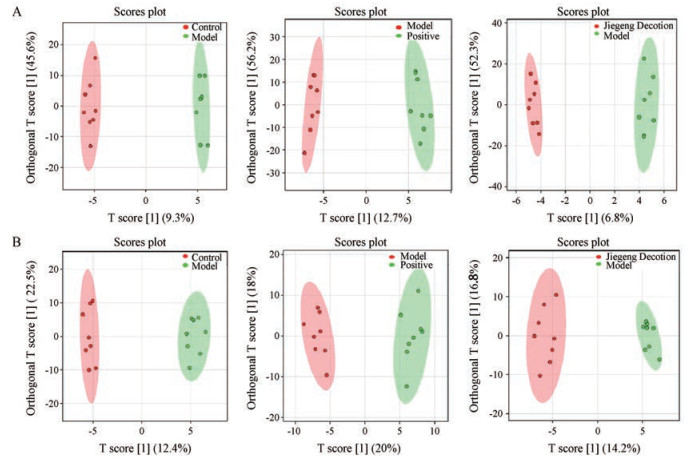
|
Figure 3 Orthogonal partial least square-discriminate analysis (OPLS-DA) score plots of lung of mice in each group. A: Positive ion mode; B: Negative ion mode |
经OPLS-DA分析后, 通过P < 0.05及fold change > 1.2或fold change < 0.83寻找差异性磷脂代谢物。空白对照组与ALI模型组小鼠, 正离子模式下, 共得到11个差异性磷脂, 均为PC类脂质, 负离子模式下, 共得到16个差异性磷脂, 包括PC、PE、PS、PG、PI等; ALI模型组与桔梗汤组小鼠, 正离子模式下, 共得到9个差异性磷脂, 主要为PC类磷脂; 负离子模式下, 共得到22个差异性磷脂, 包括PC、PE、PS、PG、PI等。
对正离子模式下的差异性磷脂进行聚类分析(图 4A), 从图中可以看出, 空白对照组与ALI模型组有显著的差异, PC类等磷脂的含量在ALI模型组呈现显著上调的趋势, 地塞米松较少有回调作用, 桔梗汤对其有显著的回调作用。提示桔梗汤对LPS诱导的ALI引起的磷脂代谢紊乱具有较好的调节作用。

|
Figure 4 Heatmap of identified differential phospholipids of lung (A) positive ion mode and (B) negative ion mode. Each square in the heatmap represents the corresponding average intensity value of a phospholipid of samples in each group, red represents the increase in concentration and blue represents the decrease in concentration. PC: Phosphatidylcholine; PE: Phosphatidyl ethanolamine; PG: Phosphatidyl glycerol; PS: Phosphatidyl serine; PI: Phosphatidylinositol |
对负离子模式下的差异性磷脂进行聚类分析(图 4B), 空白对照组与ALI模型组有明显的差异; 与空白对照组相比, ALI模型组中PC、PE、PG、PS、PI类磷脂的含量呈现不同程度的上调或者下调, 地塞米松部分对其有回调作用, 桔梗汤对其均有一定的调节作用, 表示PC、PE、PS、PG、PI类的物质在LPS诱导的ALI情况下出现代谢紊乱, 桔梗汤对其有一定的回调作用, 提示桔梗可以调控LPS诱导的ALI引起的磷脂代谢紊乱, 且作用优于地塞米松。
讨论肺表面活性物质是由肺泡Ⅱ型(alveolar type Ⅱ, ATⅡ)上皮细胞分泌的脂质-蛋白质复合物, 其中约90%为脂质[17]。脂质是细胞的重要组成物质, 参与机体的生命活动, 并为机体提供能量[18], 其代谢异常与多种疾病的发生密切相关。脂质中约90%为磷脂, 研究表明, 在人类肺部疾病中, PC、PE、PG、PS和PI等磷脂均会出现代谢紊乱[6]。
本文结果表明, PC、PE、PG、PS和PI类等在ALI模型中会出现代谢紊乱, 与阳性药地塞米松相比, 桔梗汤对其有较好的调节作用, 为桔梗汤更好地运用于ALI的治疗提供了代谢层面的依据。
LPS通过LBP转运给CD14, 再与CD14结合形成LPS-LBP-CD14的复合物, 激活NF-κB, 与TLR4结合触发细胞内级联信号传导反应: LPS促进T辅助细胞TH1和TH2产生炎介质TNF-α、IL-6、IL-1β, 触发炎症反应作用; LPS大量进入机体后, 肺巨噬细胞经刺激后释放炎症因子, 并促使多形核白细胞(PMN, 主要为中性粒细胞)在肺中聚集, PMN被活化后, 释放活性氧簇ROS, 过量的ROS会引起脂质过氧化, 产生炎症反应, 并损伤肺组织, 从而导致ALI[1, 19-23], LPS诱导ALI的通路见图 5。桔梗皂苷与甘草皂苷对许多急性非特异性炎症有明显的抗炎作用[3], 桔梗汤给药后对ALI导致的磷脂代谢紊乱起一定的调节作用; PI和PG等磷脂可通过干扰多个位点的LBP-CD14-TLR4阻断TLR4传导信号, 以调节炎性反应[6, 19]。推测桔梗汤可以通过调节LPS导致的磷脂紊乱, 阻断TLR4传到信号, 减少中性粒细胞的积聚, 促进机体产生抗氧化因子, 调节氧化/抗氧化平衡, 减少致炎因子的释放, 减少活性氧簇ROS从而减少脂质过氧化, 从而调节炎症反应来缓解ALI。
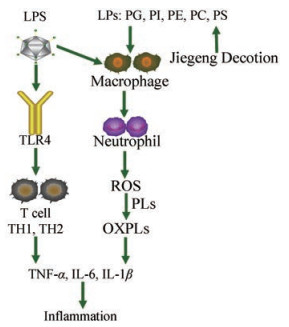
|
Figure 5 Pathway of lipopolysaccharide (LPS)-induced acute lung injury (ALI). PL: Phospholipid; PE: Phosphatidyl ethanolamine; PG: Phosphatidyl glycerol; PS: Phosphatidyl serine; PI: Phosphatidylinositol |
| [1] | Chen ZY, Yao R, Wang L, et al. Protective effect of liensinine on lipopolysaccharide (LPS)-induced acute lung injury in mice[J]. Acta Lab Anim Sci Sin (中国实验动物学报), 2018, 26: 343–348. |
| [2] | Zimmermann KK, Spassov SG, Strosing KM, et al. Hydrogen sulfide exerts anti-oxidative and anti-inflammatory effects in acute lung injury[J]. Inflammation, 2017, 41: 249–259. |
| [3] | Tao J, Nie Y, Hou Y, et al. Chemomics-integrated proteomics analysis of Jie-Geng-Tang to ameliorate lipopolysaccharide-induced acute lung injury in mice[J]. Evid-Based Complement Alternat Med, 2016, 2016: 1–12. |
| [4] | Shan JJ, Zou JS, Xu JY, et al. Research advances of Jiegeng Tang[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2012, 18: 304–306. |
| [5] | Zhao XY, Zhu GW. Correlation between compatibility and efficacy of Platycodon grandiflorum and medicinal herbs[J]. China's Naturop (中国民间疗法), 2014, 22: 58–59. |
| [6] | Fessler MB, Summer RS. Surfactant lipids at the host-environment interface:metabolic sensors, suppressors, and effectors of inflammatory lung disease[J]. Am J Respir Cell Mol Biol, 2016, 54: 624–635. DOI:10.1165/rcmb.2016-0011PS |
| [7] | Yang ZP, Xu F, Zhao XJ, et al. Serum lipidomics study of polycystic ovarian syndrome based on liquid chromatography-mass spectrometry[J]. Chin J Anal Chem (分析化学), 2015, 43: 1445–1451. |
| [8] | Jia ZX. Research on Lipidomics Analysis Technology and Its Application in the Study of Disease-related Potential Biomarkers and Mechanism of Traditional Chinese Medicine (脂质组学分析技术的研究及其在与疾病相关潜在生物标志物和中药作用机制研究中的应用)[D]. Beijing: Peking Union Medical College, 2016. |
| [9] | Qian WJ, Yang R, Xie T, et al. Metabolomics on Pudilan Xiaoyan Oral Liquid in treatment of influenza A/H1N1-induced pneumonia based on GC-MS[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 2258–2264. |
| [10] | Liu HW, Bai Y. Lipidomics and its analytical methods[J]. Chin J Chromatogr (色谱), 2017, 35: 86–90. DOI:10.3724/SP.J.1123.2016.08006 |
| [11] | Cajka T, Smilowitz JT, Fiehn O. Validating quantitative untargeted lipidomics across nine liquid chromatography-high-resolution mass spectrometry platforms[J]. Anal Chem, 2017, 89: 12360–12368. DOI:10.1021/acs.analchem.7b03404 |
| [12] | Tsugawa H, Cajka T, Kind T, et al. MS-DIAL:data-independent MS/MS deconvolution for comprehensive metabolome analysis[J]. Nat Methods, 2015, 12: 523–526. DOI:10.1038/nmeth.3393 |
| [13] | Cui WW, Jin X, Zhang YF, et al. Effects of Lianhua Qingwen Capsules on IKK/IκB/NF-κB signal pathway in the mouse with LPS-induced acute lung injury[J]. Chin Tradit Pat Med (中成药), 2015, 37: 953–958. |
| [14] | Kind T, Wohlgemuth G, Lee DY, et al. FiehnLib:mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry[J]. Anal Chem, 2009, 81: 10038–10048. DOI:10.1021/ac9019522 |
| [15] | DeFelice BC, Mehta SS, Samra S, et al. Mass spectral feature list optimizer (MS-FLO):a tool to minimize false positive peak reports in untargeted liquid chromatography-mass spectroscopy (LC-MS) data processing[J]. Anal Chem, 2017, 89: 3250–3255. DOI:10.1021/acs.analchem.6b04372 |
| [16] | A JY, He J, Sun RB. Multivariate statistical analysis for metabolomic data:the key points in principal component analysis[J]. Acta Pharm Sin (药学学报), 2018, 53: 929–937. |
| [17] | Han S, Mallampalli RK. The role of surfactant in lung disease and host defense against pulmonary infections[J]. Ann Am Thorac Soc, 2015, 12: 765–774. DOI:10.1513/AnnalsATS.201411-507FR |
| [18] | Gross RW, Han X. Lipidomics at the interface of structure and function in systems biology[J]. Chem Biol, 2011, 18: 284–291. DOI:10.1016/j.chembiol.2011.01.014 |
| [19] | Zheng FJ. To Explore the Mechanism of Jiawei Jiegeng Decoction in Treating Acute Lung Injury Induced by Endotoxin from Toll-like Receptor Pathway (从Toll样受体通路探讨加味桔梗汤治疗内毒素致急性肺损伤的作用机制)[D]. Beijing: Beijing University of Chinese Medicine, 2007. |
| [20] | Hu YZ, Li M, Zhang TT, et al. Preparation of liposomal artesunate dry powder inhalers and the effect on the acute lung injury of rats[J]. Acta Pharm Sin (药学学报), 2016, 51: 1906–1912. |
| [21] | Zheng FJ, Li YH, Wang GQ, et al. Effect of Qingre Jiedu herbs in combination with Jiegeng decoction on expression of NF-κB p65 in ALI[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2008, 23: 586–589. |
| [22] | Zheng FJ, Li YH, Wang GQ, et al. Experimental study about synergistic action of Platycodon root decoction on antiinflammatory effect of heat-clearing and detoxicating herbs[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2008, 26: 944–946. |
| [23] | Zhou YJ, Wang H, Li L, et al. Inhibitory effect of kaempferol on inflammatory response of lipopolysaccharide-stimulated human mast cells[J]. Acta Pharm Sin (药学学报), 2015, 50: 702–707. |
 2019, Vol. 54
2019, Vol. 54


