2. 江苏省中医药研究院和中国中医科学院江苏分院中药代谢组研究室, 江苏 南京 210028;
3. 南京中医药大学附属中西医结合医院呼吸科, 江苏 南京 210028
2. Department of Metabolomics, Jiangsu Province Academy of Traditional Chinese Medicine and Jiangsu Branch of Chinese Academy of Traditional Chinese Medicine, Nanjing 210028, China;
3. Department of Respiratory Medicine, Affiliated Hospital of Integrated Traditional Chinese and Western Medicine to Nanjing University of Chinese Medicine, Nanjing 210028, China
茯苓是多孔菌科真菌茯苓[Poria cocos (Schw.) Wolf]的干燥菌核, 具有利水渗湿、健脾宁心的功效[1]。文献报道茯苓中主要次生代谢产物三萜酸类化合物具有免疫调节[2]、抗炎[3]、抗肿瘤[4]等多种生物活性。在对茯苓三萜酸类化合物进行生物活性或者作用机制研究时, 常先以乙醇为溶剂进行提取, 再用乙酸乙酯等有机溶剂对乙醇提取物进行进一步萃取[5, 6], 此有效部位的提取和萃取过程对今后深入的开发工艺研究有决定性影响。进一步的溶剂萃取既增加时间和材料成本, 也会导致更多的潜在环境污染。因此对茯苓乙醇提取物和进一步的乙酸乙酯萃取物的化学一致性进行系统评价, 可为科学评估乙酸乙酯等溶剂萃取的价值提供参考, 然而这方面的研究还未见文献报道。
茯苓中的三萜酸类化合物以羊毛脂甾烷型四环三萜结构为主, 其紫外吸收强度较弱, 传统的HPLC-UV法只能对总三萜酸中含量相对较高的成分进行定量分析且不能提供结构信息[7, 8]。超高效液相色谱串联四级杆飞行时间质谱法(UPLC-QTOF-MS/MS)由于其高效分离能力和高分辨、高灵敏度特性, 已成为中药活性成分快速分离鉴定的有力工具。同时各种定量方法的开发, 也极大地扩展了UPLC-QTOF-MS/MS的应用范围[9, 10]。本研究拟采用UPLC-QTOF-MS/MS技术, 首先通过全扫描模式对醇提物和乙酸乙酯萃取物中主要成分进行定性鉴定, 再通过二级质谱结合定向扫描子离子的策略, 在Q-TOF上建立模拟三重四级杆质谱(TQ-MS)的多反应监测(mMRM)模式, 对乙醇提取物和乙酸乙酯萃取物中检测到的三萜酸类成分进行绝对定量或相对定量, 评价三萜酸类成分在萃取过程中的转移率和富集率。为科学评估使用乙酸乙酯进一步萃取的价值提供依据。
材料与方法仪器 Waters Acquity UPLCTM系统(美国Waters公司, 配有二元高压泵, 自动进样器, 柱温箱); Waters Synapt G2-S QTOF质谱仪(美国Waters公司, 配备电喷雾离子源以及MassLynx v4.1质谱工作站); Mettler百万分之一电子天平(瑞士Mettler公司)。
试剂 11个三萜酸类化合物对照品均购自成都克洛玛生物科技有限公司, 包括16α-羟基松苓新酸(16α-hydroxydehydrotrametenolic acid, HDTA)、16α-羟基氢化松苓新酸(16α-hydroxytrametenolic acid, HTA)、茯苓新酸B (poricoic acid B, PAB)、去氢土莫酸(dehydrotumulosic acid, DTUA)、茯苓新酸A (poricoic acid A, PAA)、猪苓酸C (polyporenic acid C, PAC)、3-O-乙酰基-16α-羟基松苓新酸(3-O-acetyl-16α-hydroxydehydrotrametenolic acid, AHDTA)、3-O-乙酰-16α-羟基-氢化松苓新酸(3-O-acetyl-16α-hydroxytrametenolic acid, AHTA)、去氢茯苓酸(dehydropachymic acid, DPA)、茯苓酸(pachymic acid, PA)和松苓新酸(dehydrotrametenolic acid, DTA), 所有对照品纯度按HPLC面积归一化法测定均≥95%;内标甘草次酸(glycyrrhetinic acid, GA)购自成都曼斯特生物科技有限公司, HPLC纯度≥98%;乙腈为质谱纯(美国Thermo Fisher Scientific公司); 甲醇为色谱纯(德国Merck公司); 甲酸为质谱纯(美国Sigma-Aldrich公司); 水为屈臣氏蒸馏水; 其他试剂均为分析纯。茯苓药材(编号JSPACM-33-20)采自贵州, 经邹叶廷鉴定, 并由李松林研究员核实为多孔菌科真菌茯苓Poria cocos (Schw.) Wolf的干燥菌核。样品标本存于南京中医药大学附属中西医结合医院中药质量研究室。
色谱条件 采用Waters Acquity HSS T3色谱柱(2.1 mm×100 mm, 1.8 μm); 流动相为A:乙腈(含0.1%甲酸)和B:水(含0.1%甲酸); 梯度洗脱, 0~2 min, 5%~45% A, 2~5 min, 45%~65% A, 5~14 min, 65%~90% A, 14~16 min, 90~95% A, 16~17 min, 95%~5% A, 17~20 min, 5% A; 流速0.3 mL·min-1; 柱温35 ℃, 样品箱温度15 ℃; 进样量5 μL。
质谱条件 电喷雾离子源采用负离子扫描模式, 以氮气为雾化气和锥孔气, 毛细管电压2.5 kV, 锥孔气流速50 L·h-1, 离子源温度100 ℃, 去溶剂化温度450 ℃, 去溶剂气流速800 L·h-1, 扫描时间0.2 s。在全扫描模式下进行定性分析, 使用MSE Centroid的数据采集形式在分辨率模式下采集数据, 扫描范围m/z 100~1 200, 锥孔电压为40 V, MSE碰撞能量低能量设置为6 V、高能量设置为30~60 V。定量时使用MS/MS的数据采集形式在灵敏度模式下采集数据, 使用Q选择待定量化合物的母离子, 通过限定TOF的扫描时间和扫描范围, 使其定向扫描母离子裂解产生的稳定的子离子(母离子不易裂解则仍然选定母离子), 以此模拟MRM中使用特定的离子对进行定量的方法。所设置的各通道优化后的mMRM参数见表 1。所得的数据采用Waters公司软件MassLynx v4.1分析处理。
| Table 1 MS parameters for 21 channels in mMRM (mimic multiple reaction monitoring) mode (Cone voltage: 50 V) |
供试品溶液的制备 取茯苓块粉碎过筛(80目), 精密称定茯苓粉末3.0 g, 加入75%乙醇150 mL超声提取30 min, 用75%乙醇补足减失重量, 过滤。滤液13 000 r·min-1离心10 min。取上清液2 mL, 水浴60 ℃蒸干后以甲醇2 mL复溶, 用甲醇稀释10倍, 并在稀释过程中加入GA, 使其质量浓度为0.1 μg·mL-1, 过0.22 μm滤膜, 取续滤液即得乙醇提取物供试品溶液。续取离心后的上清液100 mL, 水浴蒸干, 60 ℃干燥称重, 加入水15 mL混悬后, 用乙酸乙酯30 mL萃取两次, 合并两次萃取后的乙酸乙酯层, 水浴60 ℃蒸干, 干燥称重。再加入甲醇100 mL复溶, 取2 mL稀释10倍, 稀释过程中加入GA, 使其质量浓度为0.1 μg·mL-1, 过0.22 μm滤膜, 取续滤液即得乙酸乙酯萃取物供试品溶液。
对照品溶液的制备 精密称取11个对照品适量, 用甲醇配置为1.0 mg·mL-1的对照品储备液。吸取相同量的11个对照品储备液混合, 配置为0.09 mg·mL-1的混合对照品溶液。混合对照品溶液用甲醇逐级稀释, 并在稀释过程中加入GA, 使每个浓度的稀释液中GA均为0.1 μg·mL-1。
线性和灵敏度 将制备好的一系列混合对照品溶液在上述的液相条件和全扫描模式与mMRM模式下进行分析, 并用内标对峰面积进行矫正, 用矫正后的峰面积(Y)对分析物的浓度(X)作线性回归, 绘制标准曲线。灵敏度以最低检测限(LOD)和最低定量限(LOQ)来评价, 其中以信噪比3的浓度作为LOD, 以信噪比10的浓度作为LOQ。
精密度 将同一份混合对照品溶液在上述液相条件和质谱模式下分析, 日内精密度以1天内连续进样6次进行评价, 日间精密度的实验连续3天内进行, 用RSD表示日内精密度和日间精密度。
重复性 精密称取同批茯苓样品6份, 按“供试品溶液的制备”项下方法平行制备6份供试液, 在上述色谱质谱条件下进样分析, 记录各分析物色谱峰峰面积并计算RSD。
稳定性 取同一份乙醇提取物供试品溶液, 分别于0、2、6、10、12和24 h进样分析, 记录11种分析物的峰面积并计算RSD。
加样回收率 精密称取9份茯苓粉末样品, 每份各1.5 g, 分别精密加入相当于样品中化合物含量0.5、1和1.5倍的对照品, 按上述方法制备醇提物供试品溶液, 进样分析, 计算回收率。
含量测定 按上述方法制备乙醇提取物和乙酸乙酯萃取物供试品溶液, 进样分析, 根据标准曲线计算乙醇提取物和乙酸乙酯萃取物中11个成分的含量, 其余分析物按照结构相近的对照品的标准曲线进行相对定量分析。并根据公式(1)和(2)计算分析物的转移率和富集率。其中乙醇提取物中分析物的含量=乙醇提取物中分析物的质量/乙醇提取物的质量, 乙酸乙酯萃取物的计算类推。
| ${\rm{转移率 = }}\frac{{{\rm{乙酸乙酯萃取物中分析物的质量\;\;}}}}{{{\rm{乙醇提取物中分析物的质量}}}} \times 100{\rm{\% }} $ | (1) |
| ${\rm{富集率 = }}\frac{{{\rm{乙酸乙酯萃取物中分析物的质量\;\;}}}}{{{\rm{乙醇提取物中分析物的质量}}}} \times 100{\rm{\% }} $ | (2) |
混合对照品溶液, 乙醇提取物和乙酸乙酯萃取物供试品溶液在上述液相条件和质谱全扫描下进行分析, 所得的代表性总离子流图见图 1A和1B。首先通过与对照品的分子离子峰和保留时间比对, 指认了乙醇提取物和乙酸乙酯萃取物中的11个化合物(表 2)。其次, 结合文献[4, 11-18]数据, 根据化合物的保留时间(tR)、精确分子质量以及碎片信息, 推测并鉴定了另外12个三萜酸类化合物(表 2)。
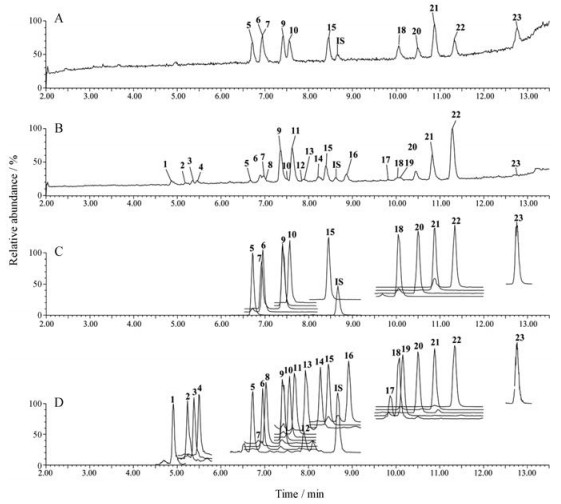
|
Figure 1 Total ion chromatograms of reference compounds (A) and ethanol extracts (B) in negative full scan mode. Extraction ion chromatograms of reference compounds (C) and ethanol extracts (D) in mMRM mode. The peak numbers were in accordance with Table 2 |
| Table 2 Identified triterpene acids in ethanol extracts and acetic ether extracts. #Components identified by comparing with reference compounds |
茯苓中的三萜酸类化合物按照其母核结构可分为闭环型和3, 4-开环型两大类。
以对照品DPA (21)为例解析闭环型化合物的碎裂规律。在低能量质谱中发现准分子离子[M−H]− m/z 525.358 9和甲酸加和离子[M−H+HCOOH]− m/z 571.363 0;在高能量质谱中发现6个碎片离子m/z 507.343 4、481.365 0、479.348 4、465.337 0、463.318 4和353.208 4, 由于DPA的结构中存在-OH、-COOH、-OCOCH3、-CH3, 以及支链-C9H15O2基团, 因此这6个碎片推测对应于[M−H−H2O]−、[M−H−CO2]−、[M−H−HCOOH]−、[M−H−CH3COOH]−、[M−H−HCOOH−CH4]−和[M−H−C9H16O2−CH4]−。依此碎裂规律共鉴定了20个闭环型化合物(化合物1~6、9和11~23)。
以对照品PAB (7)为例解析开环型化合物的碎裂规律。在低能量质谱图中发现准分子离子[M−H]− m/z 483.311 1, 高能量质谱发现主要碎片m/z 423.288 3、409.274 0、391.263 7和325.183 0, 因PAB结构中有-OH、-COOH、-CH3、-C8H13O2支链和开环处特征支链-C2H4COOH, 故这些碎片推测对应于[M−H−CO2−CH4]−、[M−H−C2H5COOH]−、[M−H−C2H5COOH−H2O]−和[M−H−CH4−C8H14O2]−。依此碎裂规律共鉴定了3个开环型化合物(化合物7、8和10)。所鉴定的23个化合物结构见图 2。
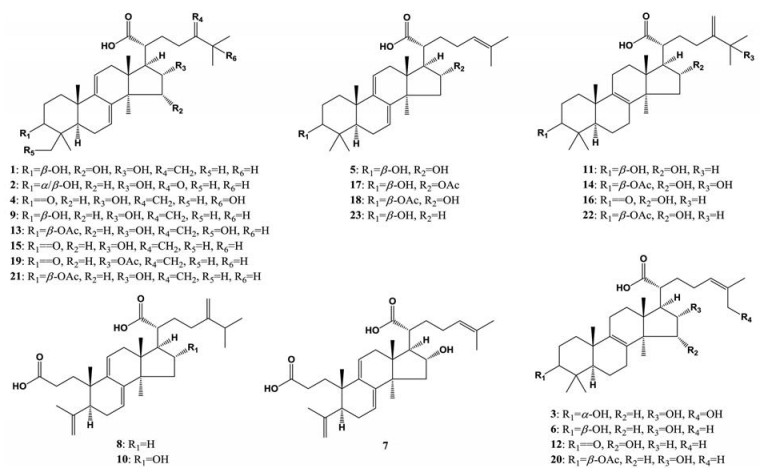
|
Figure 2 Chemical structures of the identified triterpene acids |
能量下仍以准分子离子峰为基峰, 碎片丰度较低, 因此离子对的母、子离子均选准分子离子峰。但对于开环的茯苓三萜酸类化合物如PAA, 在高碰撞能量下易产生[M−H−C2H5COOH]−碎片, 丰度仅次于准分子离子峰, 因此被选定为离子对中的子离子。
2.2 色谱质谱条件的优化比较了正负离子模式下茯苓三萜酸类化合物的响应, 发现在负离子模式下, 有更好的稳定性和更低的背景干扰, 于是选择在负离子模式进行定量分析。优化了色谱分离条件, 使主要分析物之间, 分析物和内标之间均达到基线分离, 符合定量条件。在mMRM模式下, 为了提高定量离子的响应, 对每个通道的锥孔电压和碰撞能量分别进行了优化, 优化值见表 1。所得的代表性堆积提取离子色谱图见图 1C和1D。
3 mMRM模式和全扫描模式的比较 3.1 线性范围采用两种模式分别做线性, 结果如表 3所示。除了化合物20, 其他化合物在mMRM模式的线性回归系数均比在全扫描模式的数值高。此外mMRM模式线性范围更宽。以线性范围最低浓度为例, 除化合物5、10、15在两模式下数值相等, 其他化合物在mMRM模式的线性范围最低浓度是全扫描模式相应数值的25%~67%。对线性范围最高浓度进行分析, 除化合物5~7、10、15、18和22在两模式下数值相等, 其他化合物在mMRM模式的线性范围最高浓度是全扫描模式相应数值的1.5~2倍。
| 表 3 Calibration curve of mMRM mode, and comparison of sensitivity, linearity and range between mMRM and Full scan mode (n = 3) |
对LOD与LOQ进行分析(表 3), 除化合物5、10、21和23在两模式下数值相等, 其他化合物在mMRM模式的LOD是全扫描模式相应数值的33%~60%;除化合物22在两模式下数值相等, 其他化合物在mMRM模式的LOQ是全扫描模式相应数值的22%~50%。
4 方法学考察采用mMRM模式对茯苓乙醇提取物和乙酸乙酯萃取物进行定量分析。线性回归系数r2为0.991 2~0.999 9, 表明线性良好; 日内精密度2.39%~6.46%, 日间精密度1.83%~8.26%, 表明仪器精密度良好; 稳定性RSD 2.49%~5.28%, 表明样品在24 h内稳定性良好; 重复性RSD 3.35%~7.94%, 表明方法的重复性良好; 加样回收率86.00%~110.53%, RSD 0.70%~10.99%, 表明方法的准确度良好。
5 含量测定在mMRM模式下对乙醇提取物和乙酸乙酯萃取物中的11个有对照品的化合物进行了绝对定量, 对其他12个暂无对照品的化合物进行了相对定量, 并计算了萃取过程转移率和富集率, 结果见表 4。23个化合物在提取物和萃取物中均能检测到, 表明乙酸乙酯萃取没有影响所测三萜类组分的化学组成; 除化合物1、4、8和19外, 其余化合物的转移率均在在86%~99%之间, 表明乙醇提取物和乙酸乙酯萃取物总体具有较好的化学一致性。值得注意的是化合物1和4的转移率较低, 可能是其发生降解转化成了其他含量低于检测限的成分导致; 而化合物8和19的转移率均超过了100%, 对于化合物8, 可能是由相应的闭环三萜酸类发生开环转化导致, 而其前体化合物可能由于这种转化而低于检测限; 对于化合物19, 可能由化合物15发生酯化反应导致[19]。除了上述转移率异常的化合物外, 其余化合物的富集率均达到3~6倍, 表明萃取除去了大量杂质, 提高了三萜类组分的相对含量。
| Table 4 ontents or relative contents, transfer rate and enrichment rate of 23 components in ethanol extracts and acetic ether extracts (n = 3, x±s) |
TQ-MS的MRM模式通过母离子和子离子的共同特征, 实现了对目标化合物的高选择性定量分析, 被广泛用于定量分析中。而QTOF-MS的高分辨特性使其在定性分析中占据绝对优势。为了达到同时定性和定量分析的目的, 也有文献[20]报道利用QTOF-MS在Full scan模式下通过提取离子的方法进行定量分析, 但是全扫描模式专属性差, 线性范围窄, 这极大地限制了QTOF在定量分析中的应用。本实验建立的mMRM模式, 通过限定扫描时间和扫描的质量范围, 并优化了质谱条件, 采用离子对进行定量分析。与全扫描模式相比, mMRM模式具有更好的灵敏度和更宽的线性范围。
本实验在同一台LC-QTOF-MS/MS仪器上对茯苓醇提物和后续乙酸乙酯萃取物进行同时定性定量分析, 发现三帖酸类组分在萃取过程中基本得到了转移, 乙醇提取物和后续乙酸乙酯萃取物具有较高的化学一致性; 不仅如此, 乙醇提取物在经过乙酸乙酯萃取后三帖酸类组分的相对含量提高了3~6倍, 后续萃取达到了富集有效成分的目的。本研究结果不但为科学评估后续乙酸乙酯萃取的必要性提供了证据, 而且为综合评价中药提取物在萃取前后的化学一致性提供了参考方法。
| [1] | Wang YZ, Zhang J, Zhao YL, et al. Mycology, cultivation, traditional uses, phytochemistry and pharmacology of Wolfiporia cocos (Schwein.) Ryvarden et Gilb.:a review[J]. J Ethnopharmacol, 2013, 147: 265–276. DOI:10.1016/j.jep.2013.03.027 |
| [2] | Yu SJ, Tseng J. Fu-ling, a chinese herbal drug, modulates cytokine secretion by human peripheral blood monocytes[J]. Int J Immunopharmacol, 1996, 18: 37–44. |
| [3] | Jeong JW, Lee HH, Han MH, et al. Ethanol extract of Poria cocos reduces the production of inflammatory mediators by suppressing the NF-κB signaling pathway in lipopolysaccharide-stimulated RAW 264.7 macrophages[J]. BMC Complement Altern Med, 2014, 14: 101. DOI:10.1186/1472-6882-14-101 |
| [4] | Akihisa T, Nakamura Y, Tokuda H, et al. Triterpene acids from Poria cocos and their anti-tumor-promoting effects[J]. J Nat Prod, 2007, 70: 948–953. DOI:10.1021/np0780001 |
| [5] | Wang DL, Chen WD, Xu XX. Anti-inflammatory effect of triterpene acids from Poria cocos[J]. Anhui Med Pharm J (安徽医药), 2009, 13: 1021–1023. |
| [6] | Zhang XS, Rao ZG, Hu P, et al. Preventive effect of triterpenes from Poria cocos on liver injury in mice[J]. Food Sci (食品科学), 2012, 33: 270–273. |
| [7] | Zhang LQ, Jia Y, Luo J, et al. UPLC determination of determine dehydrotumulosic acid etc. six active compounds in Poria[J]. Chin Pharm J (中国药学杂志), 2012, 47: 1080–1083. |
| [8] | Che S, Li Q, Huo YS, et al. RP-HPLC simultaneous determination of five triterpenoid acids in different parts of Poria cocos by UV wavelengths switch[J]. Acta Pharm Sin (药学学报), 2010, 45: 494–497. |
| [9] | Liu KY, Song YG, Liu YL, et al. An integrated strategy using UPLC-QTOF-MSE and UPLC-QTOF-MRM (enhanced target) for pharmacokinetics study of wine processed Schisandra Chinensis fructus in rats[J]. J Pharm Biomed Anal, 2017, 139: 165–178. DOI:10.1016/j.jpba.2017.02.043 |
| [10] | Chindarkar NS, Park HD, Stone JA, et al. Comparison of different time of flight-mass spectrometry modes for small molecule quantitative analysis[J]. J Anal Toxicol, 2015, 39: 675–685. DOI:10.1093/jat/bkv057 |
| [11] | Zheng Y, Yang XW. Two new lanostane triterpenoids from Poria cocos[J]. J Asian Nat Prod Res, 2008, 10: 289–292. DOI:10.1080/10286020701782742 |
| [12] | Akihisa T, Uchiyama E, Kikuchi T, et al. Anti-tumor-promoting effects of 25-methoxyporicoic acid A and other triterpene acids from Poria cocos[J]. J Nat Prod, 2009, 72: 1786–1792. DOI:10.1021/np9003239 |
| [13] | Ukiya M, Akihisa T, Tokuda H, et al. Inhibition of tumor-promoting effects by poricoic acids G and H and other lanostane-type triterpenes and cytotoxic activity of poricoic acids A and G from Poria cocos[J]. J Nat Prod, 2002, 65: 462–465. DOI:10.1021/np0103721 |
| [14] | Xia B, Zhou Y, Tan HS, et al. Advanced ultra-performance liquid chromatography-photodiode array-quadrupole time-of-flight mass spectrometric methods for simultaneous screening and quantification of triterpenoids in Poria cocos[J]. Food Chem, 2014, 152: 237–244. DOI:10.1016/j.foodchem.2013.11.151 |
| [15] | Zhao Y, Li SQ, Li HJ, et al. Lanostane triterpenoids from the fungus Ceriporia lacerate associated with Acanthaster planci[J]. Chem Nat Compd, 2013, 49: 653–656. DOI:10.1007/s10600-013-0701-2 |
| [16] | Cai TG, Cai Y. Triterpenes from the fungus Poria cocos and their inhibitory activity on nitric oxide production in mouse macrophages via blockade of activating protein-1 pathway[J]. Chem Biodivers, 2011, 8: 2135–2143. DOI:10.1002/cbdv.v8.11 |
| [17] | Wu LF, Wang KF, Mao X, et al. Screening and analysis of the potential bioactive components of Poria cocos (Schw.) Wolf by HPLC and HPLC-MSn with the aid of chemometrics[J]. Molecules, 2016, 21: 18. |
| [18] | Liu XT, Winkler AL, Schwan WR, et al. Antibacterial compounds from mushrooms Ⅱ:lanostane triterpenoids and an ergostane steroid with activity against Bacillus cereus isolated from Fomitopsis pinicola[J]. Planta Med, 2010, 76: 464–466. DOI:10.1055/s-0029-1186227 |
| [19] | Pasandide B, Khodaiyan F, Mousavi ZE, et al. Optimization of aqueous pectin extraction from Citrus medica peel[J]. Carbohydr Polym, 2017, 178: 27–33. DOI:10.1016/j.carbpol.2017.08.098 |
| [20] | Zhu L, Xu J, Zhang S, et al. Qualitatively and quantitatively comparing secondary metabolites in three medicinal parts derived from Poria cocos (Schw.) Wolf using UHPLC-QTOF-MS/MS-based chemical profiling[J]. J Pharm Biomed Anal, 2018, 150: 278–286. DOI:10.1016/j.jpba.2017.11.066 |
 2019, Vol. 54
2019, Vol. 54


