2. 信达生物制药(苏州)有限公司, 江苏 苏州 215123
2. Innovent Biologics Suzhou Co. Ltd, Suzhou 215123, China
抗体药物作为一种具有独特优势的生物靶向治疗药物, 以其高特异性、有效性和安全性的特点, 已成为近年来全球研发的热点。随着抗体药物临床适应症的不断扩大, 在许多重大疾病的治疗中逐步发挥了不可取代的作用。2017年全球抗体市场规模首次突破千亿美元, 占据全球药物市场总销售额的十分之一, 已成为医药产业一个重要的细分领域和增长点。2017年艾伯维公司(Abbvie)的修美乐(Humira®)以184亿美元的年销售额成为“全球药王”。抗体药物已成为整个制药行业中发展最快的领域之一, 截止2017年FDA已经累计批准上市了70多个抗体药物, 目前开发的抗体药物中已经有550多种处于临床研发阶段, 超过50个已进入了临床Ⅲ期研究阶段。
目前临床在研的治疗性抗体药物中均为IgG类型, 主要为IgG1、IgG2和IgG4亚型。具体选择何种IgG亚型作为抗体药物框架开发, 主要根据抗体作用机制和取决于Fc介导的效应功能[1], 如ADCC (antibody dependent cellular cytotoxicity, 抗体依赖的细胞毒作用)效应和CDC (complement dependent cytotoxicity, 补体依赖的细胞毒作用)效应。效应功能与IgG和Fc受体FcγR等的亲和力相关, 其顺序为IgG1 > IgG4 > IgG2[2-4]。目前市场上的治疗性抗体药物绝大多数为IgG1类型, 若针对膜抗原, 则可以发挥抗体介导的ADCC效应和CDC效应。而像近年发展较快的针对肿瘤免疫检查点(check point) PD-1和PD-L1的抑制性抗体, 其作用机制是以抗PD-1和PD-L1抗体阻断PD-1/PD-L1信号通路, 解除对T细胞的抑制, 从而杀伤肿瘤细胞, 作用机制不同于以往抗肿瘤抗体依赖ADCC等活性杀伤肿瘤细胞的机制[5, 6], 因此已上市的抗PD-1抗体nivolumab (Opdivo®)、pembrolizumab (Keytruda®)在设计时均采用了ADCC活性弱的IgG4亚型, 而Roche的PD-L1抗体atezolizumab (Tecentriq®)虽然采用了IgG1亚型但突变除去了糖基化位点, 消除了ADCC活性[7, 8]。选择IgG4分子作为治疗性抗体药物开发的框架, 一个潜在的风险就是野生型IgG4分子存在潜在的Fab臂交换(FAE, Fab-Arm Exchange), 导致分子铰链区的稳定性问题。IgG4与IgG1在铰链区二硫键稳定性有所不同; IgG4在铰链区的序列为-CPS228C-, 相比IgG1的-CPP228C-, IgG4两条重链间的二硫键倾向于重排, 首先形成半抗体分子(half molecule)的结构, 然后两个半抗体分子通过CH3区域的非共价相互作用在天然非变性状态下仍然结合在一起; 在还原性环境中, 两个不同的IgG4半分子分开, 重排并发生二硫键氧化(经历Redox过程)形成Fab臂交换, 形成双特异抗体形式[9, 10]。研究结果表明, 通过铰链区突变(S228P), 即把第228位的丝氨酸(Ser)改构为IgG1序列的脯氨酸(Pro), 可以极大的降低FAE的发生, 增强IgG4的稳定性[11]。此外, 有文献报道把IgG4的CH3区域的第409位的精氨酸突变为IgG1序列保守的赖氨酸(Lys)也可以降低FAE的发生[12]。早期开发的IgG4类抗体药物并没有对铰链区序列进行改构以避免FAE的发生, 例如Biogen公司开发的以α4β1和α4β7为靶点的用于治疗多发性硬化症的natalizumab (Tysabri®)就是IgG4野生型, 实验已经证明这个抗体药物分子可与人体内源IgG4发生Fab臂交换[13]。虽然到目前为止尚无任何数据表明natalizumab与人体内源IgG4发生Fab臂交换后会降低治疗效果或产生不良反应, 但是在IgG4治疗性抗体药物开发的策略中, 人们还是更倾向于将IgG4框架稳定化, 即通过IgG4铰链区序列的改构(S228P)来减少或消除Fab臂交换效应[2, 14]。虽然很多文献已证明上述S228P改构的效应, 但是监管机构仍建议在分子表征中进行证明性研究。
传统研究FAE的方法主要为ELISA方法, 即利用FAE后形成双特异性抗体可以结合两个不同抗原的特性, 采用桥接式ELISA (Bridging-ELISA)法来检测。近年来, 一些新颖的方法被开发用于检测FAE。例如采用荧光共振能量转移(FRET)的方法[15], 两种荧光素基团分别标记两种IgG4分子, 如果发生FAE形成杂合抗体后, 激发一种荧光会引发另一种荧光的响应, 从而检测到FAE, 但是这种方法需要对抗体分子预先标记, 可能会影响抗体与抗原的结合。一般的SEC-HPLC无法区分不同的IgG分子, 通过木瓜蛋白酶将其中一种IgG4分子酶切获得Fc片段(~50 kDa), 再与另一种完整的IgG4分子(~150 kDa)孵育, FAE后形成的杂合抗体分子量大约为100 kDa, 通过普通的SEC-HPLC即可分离出这3种形式, 从而检测FAE的发生[16]。与FRET方法相似, 这种酶切方法预先改变了抗体的分子形式, 可能无法真实反映抗体行为。此外, 混合色谱(mixed-mode chromatography)也可用于FAE的检测[15]。
液质联用(LC-MS)方法已经广泛应用于单克隆抗体药物的表征, 包括完整和还原分子量的检测、肽图氨基酸序列的分析、脱酰胺和氧化等杂质的鉴定和定量分析等[8]。LC-MS法也已用于体外(in vitro)缓冲液中IgG4分子FAE的检测[13, 17]。在这种简单反应环境中, 只要参与FAE反应的两种IgG4分子的分子量达到一定的差异, 所形成的杂合抗体即可与原IgG4分子在MS图谱上得到分离。LC-MS法与ELISA法相比, 具有快速和无需额外处理抗原(例如包被和生物素化)的优点, 可在几分钟内获得检测结果。而对于在复杂条件下的体外(in vitro)研究, 例如在人血清中反应以模拟人体内环境, 以及动物体内(in vivo)反应, 受限于反应环境中含有许多其他高丰度蛋白的干扰, ELISA法仍然不可替代。为了方便研究FAE, 可先将血清中的内源IgG去除以及采用不表达内源IgG的SCID小鼠模型, 从而将FAE反应限制在两个IgG4分子之间。在这种情况下, LC-MS法仍然可以作为一种简便和正交(orthogonal)的分析方法去研究FAE的发生。
信迪利单抗(sintilimab)是一种全人源抗PD-1抗体, 用于肿瘤的免疫治疗。与国外已上市的抗PD-1抗体nivolumab和pembrolizumab相同, 信迪利单抗是IgG4κ型抗体, 在早期开发时, 为提高抗体的稳定性, 将铰链区的序列-CPSC-改构为-CPPC- (S228P), 以去除潜在的FAE风险。本研究构建表达了sintilimab以及sintilimab改构前的野生型(-CPSC-) (sintilimab-wt), 采用LC-MS方法评估了sintilimab在体外和动物体内实验中的FAE稳定性。结果表明, 改构后的sintilimab分子稳定性提高, 其半抗体分子含量明显低于未做改构的野生型, 在体外和体内sintilimab不与其他野生型IgG4分子发生FAE。
材料与方法供试品及试剂 信迪利单抗(sintilimab)和野生型信迪利单抗(即铰链区未改构型, 简称sintilimab-wt), 以及另一个野生型IgG4分子TGN1412均由信达生物制药(苏州)有限公司提供, 在CHO-S细胞中表达和纯化。Pembrolizumab (批号6302604005)购自美国Merck公司。人AB型血清购自美国Gemini公司; C.B17 SCID小鼠购自北京维通利华实验动物技术有限公司; NEM和GSH购自美国Sigma公司; Protein A琼脂糖珠购自美国GE公司; C4色谱柱(ACQUITY UPLC Protein BEH C4 Column, 300 Å, 1.7 µm, 2.1 mm × 50 mm)购自美国Waters公司; SDS-PAGE预制胶(4%~15%, 12-well)购自美国Bio-Rad公司(货号456-1085)。
仪器 液质联用仪Utimate3000 Q-Exactive购自美国Thermo Scientific公司; Beckman PA800 Plus毛细管电泳仪购自美国Beckman公司; 凝胶成像系统(Chemidoc XRS+)购自美国Bio-Rad公司。
SDS-PAGE 将各抗体样品稀释到2 mg·mL-1, 取20 μL与非还原上样缓冲液1:1混合, 70 ℃加热10 min, 冷却至室温后离心, 取8 μg上样到4%~15% 12-well Bio-Rad预制胶, 同时加样5 μL预染分子量Marker, 200 V电压恒压电泳25 min左右。停止电泳, 将凝胶置于考马斯亮蓝染色液中摇晃40 min染色, 再脱色至背景无色、条带清晰。用凝胶成像系统拍照分析。
非还原型CE-SDS 取样品100 μg, 加入pH 6.5样品缓冲液使总体积为85 μL (样品缓冲液体积≥70 μL), 加入内标(10 kDa) 2 μL和250 mmol·L-1的NEM溶液5 μL, 混匀后70 ℃加热10 min, 冷却至室温后, 将样品加入进样管中, 用Beckman PA800 Plus毛细管电泳仪进行凝胶电泳检测。
PBS缓冲液FAE实验 分别取100 μg sintilimab、sintilimab-wt和pembrolizumab与100 μg TGN1412混合, 加10 μL的100 mmol·L-1 GSH (终浓度为1 mmol·L-1), 补加PBS至终体积为1 mL, 37 ℃水浴孵育。各样品平行制备5份, 分别在0、1、2、6和20 h取出用LC-MS法分析。
去除内源IgG的人血清中FAE实验 取3 mL Protein A琼脂糖珠加入到10 mL色谱柱, 用6 mL PBS清洗3次。加入3 mL人血清与Protein A琼脂糖珠混合后, 置于旋转混合仪, 室温孵育2 h, 收集过滤血清, 再将过滤血清重复以上步骤, 最终获得去除内源IgG的人血清, 保存于-20 ℃待用。分别取100 μg sintilimab、sintilimab-wt、pembrolizumab与100 μg TGN1412混合, 真空浓缩干燥。分别用100 μL去除内源IgG的人血清复溶各样品, 并加入GSH至3 mmol·L-1终浓度, 在37 ℃水浴孵育过夜(18 h)。然后, 再向各样品加入Protein A琼脂糖珠, 置于旋转混合仪, 室温孵育2 h。使用150 μL PBS和去离子水依次清洗Protein A琼脂糖珠3次, 最后用1%甲酸/水溶液100 μL洗脱, 并真空干燥浓缩。各样品加超纯水至100 μL, 使用LC-MS法检测各样品内抗体分子量。
SCID小鼠实验 分别将sintilimab、sintilimab-wt、pembrolizumab与TGN1412混合, 用PBS稀释至终质量浓度为1 mg·mL-1, 按10 mg·kg-1的剂量通过尾静脉注射进5周龄免疫缺陷的雌性C.B17 SCID小鼠。24 h后, 取小鼠全血200 μL, 离心(5 000 r·min-1, 5 min)分离出血清。向各血清样品中加入Protein A琼脂糖珠, 置于旋转混合仪, 室温孵育2 h。使用PBS 150 μL和去离子水依次清洗Protein A琼脂糖珠3次, 最后用1%甲酸/水溶液100 μL洗脱, 并真空干燥浓缩。各样品加超纯水至30 μL, 使用LC-MS法检测各样品内抗体分子量。
LC-MS检测 采用Dionex Ultimate 3000 UHPLC和Q-Exactive液质联用系统对抗体分子量进行检测。液相参数:色谱柱为ACQUITY UPLC BEH C4 300 Å (2.1 mm × 50 mm, 1.7 μm), 进样体积为10 μL, 柱温为80 ℃, 流速为0.2 mL·min-1, 检测波长为214 nm; 流动相A为含0.1%甲酸的水溶液, 流动相B为含0.1%甲酸的乙腈溶液, 实际分离为5 min内B相梯度为10%~98%。Q-Exactive质谱仪离子源参数:鞘气流速为35 arb, 辅助气流速为12 arb, 喷雾电压为3.8 kV, 离子传输管温度为320 ℃, S-lens RF level为80%, 辅助器加热器温度为200 ℃。Q-Exactive数据采集方法参数:采用全MS模式扫描, 运行时间为2~18 min, 选择正离子模式, 源内CID电压为0 eV, microscans为10, 分辨率为17 500, AGC Target为3e6, Maximum IT为200, 扫描范围为1 500~4 500 m/z, 数据类型设为profile。质谱产生的数据用Biopharma Finder (Thermo Scientific)软件进行解卷积分析分子量。
结果为考察信迪利单抗铰链区序列的改构(S228P)效果, 本研究同时构建了sintilimab、未改构的野生型(sintilimab-wt)以及另一野生型IgG4单抗TGN1412, 并在CHO-S细胞中表达和纯化。sintilimab与sintilimab-wt相比, 只有铰链区氨基酸S228P的变化, 其他氨基酸序列则完全一致。TGN1412为德国TeGenero制药公司研发的针对CD28的抗体, 用于治疗风湿性关节炎和白血病, 但在临床Ⅰ期发生严重不良反应而终止试验。TGN1412同样为典型的野生型IgG4分子, 铰链区序列为-CPS228C-, 根据文献报道会与其他野生型IgG4分子发生FAE[13]。此外, Merck公司的抗PD-1抗体pembrolizumab已经被报道证明不会发生FAE[18], 本文用其作为对照。
1 半抗体分子检测半抗体分子的存在是IgG4分子间发生FAE的分子基础[9]。将这几种抗体在非还原条件下变性后用SDS-PAGE胶进行分离, 并用考马斯亮蓝染色。如图 1所示, 在胶上~75 kDa的地方可以观察到半抗体分子的存在。Sintilimab-wt和另一个野生型IgG4 TGN1412, 在胶上可看到明显的分子自身半抗体分子条带, 而sintilimab以及pembrolizumab的自身半分子条带非常微弱。
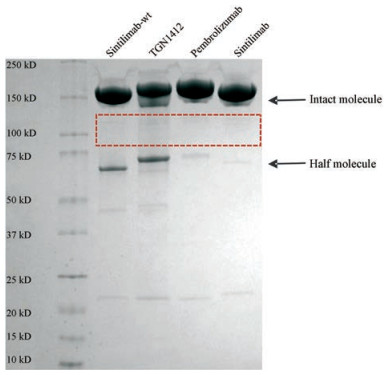
|
Figure 1 Analysis of half-molecules present in various IgG4 mAbs as indicated by non-reduced SDS-PAGE |
进一步对各抗体分子中的半抗体分子含量进行定量分析, 用非还原CE-SDS (图 2)检测各个IgG4分子中的半抗体分子含量。从图 2上观察到了半抗体分子紫外吸收峰, 其中TGN1412的半抗体分子含量最高, 达到11.6%, sintilimab-wt中半抗体分子含量为5.3%, sintilimab的半抗体分子含量仅为0.1%, pembrolizumab的半抗体分子含量为0.5%。由此可见, sintilimab的铰链区序列的改构(S228P)极大降低了sintilimab自身半抗体分子的生成, 半抗体分子含量仅为改构前的2%。值得注意的是, sintilimab中的半抗体分子含量也远低于pembrolizumab。
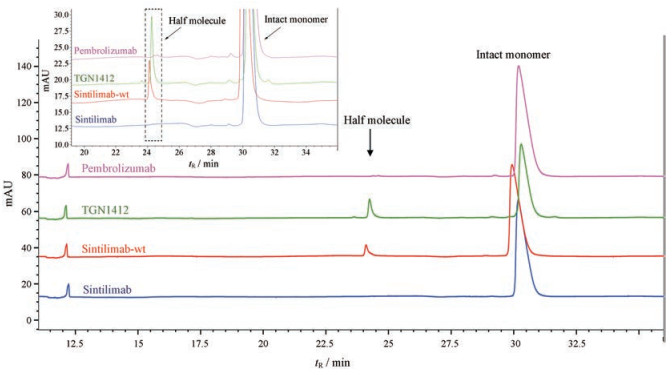
|
Figure 2 Analysis of half antibody molecules presented in various IgG4 mAbs as indicated by non-reduced CE-SDS (insert as zoomed-in graph) |
为考察sintilimab是否会发生FAE, 分别将sintilimab、sintilimab-wt与TGN1412在不同的环境(包括体内和体外)中混合, 利用LC-MS法对结果进行检测。反应环境包括PBS缓冲液、人血清和SCID小鼠。
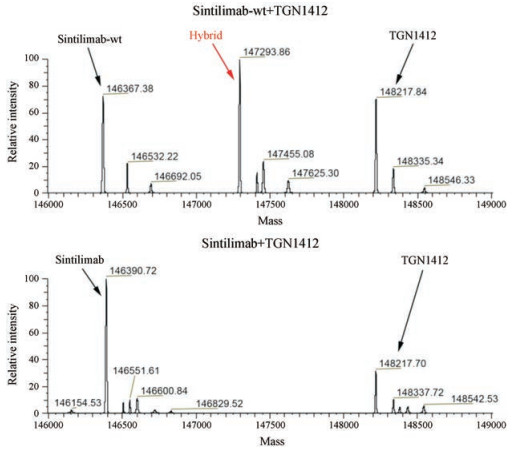
2 PBS缓冲液实验为分析sintilimab-wt、sintilimab是否会发生FAE, 将sintilimab-wt、sintilimab分别与TGN1412在PBS缓冲液中混合, 加入还原剂谷胱甘肽(GSH)在37 ℃孵育, 在不同时间(0、1、2、6和20 h)取样后直接用LC-MS法检测。结果如图 3所示, 在孵育1 h后即可明显观察到sintilimab-wt与TGN1412发生FAE后形成的杂合抗体(hybrid), 并且随着时间的延长而增加, 到6 h的时候FAE基本停止, 杂合抗体的含量与20 h的结果基本一致; 与此相反的是, 即使混合孵育时间达到20 h, sintilimab与TGN1412之间仍未检测到FAE的发生。Pembrolizumab与TGN1412在PBS缓冲液中混合, 加GSH做同样的时间点取样LC-MS检测。结果显示pembrolizumab同sintilimab一样, 孵育20 h后仍然未见杂合抗体的产生(结果未显示)[18]。

|
Figure 3 Time course study of Fab-arm exchange analysis between sitilimab-wt or sitilimab and TGN1412 in PBS |
人血清内含有丰富的蛋白质、生长因子、激素和脂类等复杂成分, 相比PBS缓冲液, 可以在体外更好地模拟人体内生理环境。血清中含有大量的白蛋白、IgG等高丰度蛋白, 为了排除血清中高丰度的内源IgG的干扰, 用Protein A琼脂糖珠先将人血清中的内源IgG去除, 再加入还原剂GSH (终浓度3 mmol·L-1), 然后将sintilimab-wt、sintilimab分别与TGN1412在血清中混合37 ℃孵育18 h, 最后用1%甲酸从Protein A琼脂糖珠上洗脱出外源IgG分子, 浓缩体积后直接上样LC-MS检测。结果(图 4)显示, 与在PBS缓冲液中的结果相同, sintilimab-wt与TGN1412发生FAE形成杂合抗体(Hybrid), 而sintilimab与TGN1412在人血清中不发生FAE。在LC-MS的质谱图谱上并没有观察到其他多余的蛋白质峰, 而且血清中反应18 h后sintilimab-wt和杂合抗体的含量与在PBS中反应20 h后的含量相似, 说明用Protein A琼脂糖珠去除内源IgG和亲和富集外源IgG的效果显著。
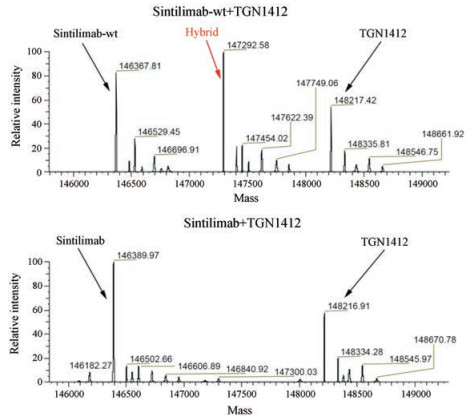
|
Figure 4 Fab-arm exchange analysis between sitilimab-wt or sitilimab and TGN1412 in IgG-removed human serum after 18 hours mixing |
将sintilimab-wt、sintilimab分别与TGN1412混合后, 按10 mg·kg-1的剂量静脉注入免疫缺陷的SCID小鼠, 24 h后取血。与处理人血清类似, 采用Protein A琼脂糖珠从血清中亲和富集外源IgG分子, 1%甲酸洗脱并浓缩后直接用LC-MS法检测。结果如图 5显示, sintilimab-wt与TGN1412发生FAE形成杂合抗体(Hybrid), 而IBI308与TGN1412在SCID小鼠中不会发生FAE。
|
Figure 5 Fab-arm exchange analysis between sitilimab-wt or sitilimab and TGN1412 in SCID mice serum after 24 hours injection |
综合以上的体外实验(PBS缓冲液和人血清)和动物体内(SCID小鼠)实验结果, sintilimab的铰链区序列的改构(S228P)消除了FAE发生, 提高了IgG4结构的稳定性。
讨论随着重组抗体药物的迅速发展, 将会出现越来越多的采用IgG4结构的抗体药物。新近上市的IgG4抗体药物均对铰链区的序列进行了改构(S228P), 并且已经证明铰链区序列的改构会消除IgG4分子FAE的风险。信迪利单抗作为一种全人源IgG4型抗PD-1创新抗体, 本研究验证了该产品铰链区的稳定性。LC-MS方法无需额外的样品处理, 可以直接用于缓冲溶液中FAE发生的评估, 但是对于在较复杂反应环境如血清和动物体内的使用还很少有相关报道。本文用LC-MS方法对信迪利单抗铰链区的稳定性做了系统性的研究, 从PBS缓冲液到人血清, 再到SCID小鼠。结果表明, 信迪利单抗铰链区序列改构(S228P)后, 与未改构的野生型相比, 结构稳定, 消除了Fab臂交换的风险。
在SCID小鼠中的反应, 利用Protein A琼脂糖珠亲和富集出加入人血清中的全部外源IgG分子。与采用的亲和富集策略不同的是, Merck公司研究人员在用LC-MS检测pembrolizumab在SCID小鼠内稳定性的时候, 采用生物素化的PD-1去亲和富集PD-1抗体包括可能FAE后形成的杂合抗体[18]。IgG4抗体在发生FAE交换形成双特异性杂合抗体后, 对抗原的亲和力会有所下降, 如果用抗原来制备亲和柱来做亲和分离, 亲和力的不同有可能会导致杂合抗体回收率的减少, 无法准确反映抗体真实行为, 而使用Protein A琼脂糖珠来做亲和分析, 无需制备亲和柱, 不用考虑亲和力的不同, 提高了检测的可靠性。对于在人血清中的反应, 作者首先用Protein A琼脂糖珠去除了人内源IgG pool, 反应后, 又用Protein A琼脂糖珠亲和分离富集出加入人血清中的外源IgG分子。与PBS结果相比, 从LC-MS谱图结果上并未发现其他的蛋白峰, 说明在这个过程中未引入或引入的其他蛋白包括内源IgG的量是非常低的, Protein A琼脂糖珠去除内源IgG和减少其他污染蛋白的效果是非常好的。
结合本文实验结果, 可以看到对于以IgG4分子为框架开发的抗体药物, 铰链区的序列改构(S228P)可以极大地提高抗体药物的稳定性。LC-MS法作为一种简便快速的方法, 结合Protein A纯化等手段, 可以在体内和体外实验中对IgG4类抗体药物的稳定性进行有效的评估。
| [1] | Jiang XR, Song A, Bergelson S, et al. Advances in the assessment and control of the effector functions of therapeutic antibodies[J]. Nat Rev Drug Discov, 2011, 10: 101–111. DOI:10.1038/nrd3365 |
| [2] | Salfeld JG. Isotype selection in antibody engineering[J]. Nat Biotechnol, 2007, 25: 1369–1372. DOI:10.1038/nbt1207-1369 |
| [3] | Carter PJ. Potent antibody therapeutics by design[J]. Nat Rev Immunol, 2006, 6: 343–357. DOI:10.1038/nri1837 |
| [4] | Martin WL, West AP Jr, Gan L, et al. Crystal structure at 2.8 A of an FcRn/heterodimeric Fc complex:mechanism of pH-dependent binding[J]. Mol Cell, 2001, 7: 867–877. DOI:10.1016/S1097-2765(01)00230-1 |
| [5] | Topalian SL, Drake CG, Pardoll DM. Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity[J]. Curr Opin Immunol, 2012, 24: 207–212. DOI:10.1016/j.coi.2011.12.009 |
| [6] | Li Y, Li F, Jiang F, et al. A mini-review for cancer immunotherapy:molecular understanding of PD-1/PD-L1 pathway and translational blockade of immune checkpoints[J]. Int J Mol Sci, 2016, 17: 1151. DOI:10.3390/ijms17071151 |
| [7] | Lee HT, Lee JY, Lim H, et al. Molecular mechanism of PD-1/PD-L1 blockade via anti-PD-L1 antibodies atezolizumab and durvalumab[J]. Sci Rep, 2017, 7: 5532. DOI:10.1038/s41598-017-06002-8 |
| [8] | Rogstad S, Faustino A, Ruth A, et al. A retrospective evaluation of the use of mass spectrometry in FDA biologics license applications[J]. J Am Soc Mass Spectrom, 2017, 28: 786–794. DOI:10.1007/s13361-016-1531-9 |
| [9] | Rispens T, Ooijevaar-de Heer P, Bende O, et al. Mechanism of immunoglobulin G4 Fab-arm exchange[J]. J Am Chem Soc, 2011, 133: 10302–10311. DOI:10.1021/ja203638y |
| [10] | Schuurman J, Perdok GJ, Gorter AD, et al. The inter-heavy chain disulfide bonds of IgG4 are in equilibrium with intra-chain disulfide bonds[J]. Mol Immunol, 2001, 38: 1–8. DOI:10.1016/S0161-5890(01)00050-5 |
| [11] | Angal S, King DJ, Bodmer MW, et al. A single amino acid substitution abolishes the heterogeneity of chimeric mouse/human (IgG4) antibody[J]. Mol Immunol, 1993, 30: 105–108. DOI:10.1016/0161-5890(93)90432-B |
| [12] | Labrijn AF, Rispens T, Meesters J, et al. Species-specific determinants in the IgG CH3 domain enable Fab-arm exchange by affecting the noncovalent CH3-CH3 interaction strength[J]. J Immunol, 2011, 187: 3238–3246. DOI:10.4049/jimmunol.1003336 |
| [13] | Labrijn AF, Buijsse AO, van den Bremer ET, et al. Therapeutic IgG4 antibodies engage in Fab-arm exchange with endogenous human IgG4in vivo[J]. Nat Biotechnol, 2009, 27: 767–771. DOI:10.1038/nbt.1553 |
| [14] | Beck A, Wurch T, Bailly C, et al. Strategies and challenges for the next generation of therapeutic antibodies[J]. Nat Rev Immunol, 2010, 10: 345–352. DOI:10.1038/nri2747 |
| [15] | Yang X, Zhang Y, Wang F, et al. Analysis and purification of IgG4 bispecific antibodies by a mixed-mode chromatography[J]. Anal Biochem, 2015, 484: 173–179. DOI:10.1016/j.ab.2015.06.014 |
| [16] | Rispens T, den Bleker TH, Aalberse RC. Hybrid IgG4/IgG4 Fc antibodies form upon 'Fab-arm' exchange as demonstrated by SDS-PAGE or size-exclusion chromatography[J]. Mol Immunol, 2010, 47: 1592–1594. DOI:10.1016/j.molimm.2010.02.021 |
| [17] | van der Neut Kolfschoten M, Schuurman J, Losen M, et al. Anti-inflammatory activity of human IgG4 antibodies by dynamic Fab arm exchange[J]. Science, 2007, 317: 1554–1557. |
| [18] | Yang X, Wang F, Zhang Y, et al. Comprehensive analysis of the therapeutic IgG4 antibody pembrolizumab:hinge modification blocks half molecule exchange in vitro and in vivo[J]. J Pharm Sci, 2015, 104: 4002–4014. DOI:10.1002/jps.24620 |
 2019, Vol. 54
2019, Vol. 54


