心血管疾病(cardiovascular disease, CVD)是全世界范围内引起死亡的主要原因。动脉粥样硬化是引起CVD的主要原因[1], 其症状通常在心肌梗塞、脑卒中和外周动脉疾病等并发症发生后才被发现。动脉粥样硬化是脂质代谢失衡和持续炎症反应的结果[2], 积极研究和发现动脉粥样硬化的发病机制和抗动脉粥样硬化药物的药理作用及其机制, 对于防治动脉粥样硬化以及心血管疾病具有重要的意义。
小檗碱(berberine, BBR)是中药黄连的主要有效成分, 属于异喹啉类生物碱, 又名黄连素。国内外研究发现BBR具有多种药理作用, 如胃肠炎、细菌性痢疾、调血脂、抗内皮损伤、抗炎、抗血栓等作用[3]。高脂饲养的ApoE−/−小鼠是国际公认的动脉粥样硬化的动物模型[4]。本研究将通过高脂饲养ApoE−/−小鼠构建动脉粥样硬化模型, 从调节炎症和影响脂质代谢方面对BBR抗动脉粥样硬化作用以及机制进行较为全面的探讨。
材料与方法动物 7周龄的ApoE−/−雄性小鼠购买于北京维通立华实验动物技术有限公司(合格证号: 11400700248689)。实验动物饲养于中国医学科学院医药生物技术研究所SPF级动物房, 每日光照12 h, 并于实验开始前1周适应饲养。所有动物实验饲养及操作严格遵守中国医学科学院医药生物技术研究所以及国家和北京市动物福利伦理与保护相关规定。
高脂饲料 高脂饲料由南通特洛菲饲料有限公司提供(TP-26300), 普通饲料由中国医学科学院医药生物技术研究所动物房提供。饲料都经过高温灭菌处理。
主要试剂 BBR (纯度98%以上)购自南京泽朗生物科技有限公司; 组织总胆固醇(total cholesterol, TC)来源于北京普利莱基因技术有限公司; 组织甘油三酯(triglyceride, TG)试剂盒购自Biovision公司; 小鼠游离脂肪酸(free fatty acids, FFA)酶联免疫分析试剂盒来源于森贝伽(南京)生物科技有限公司; ATP结合盒转运体A1 (ATP-binding cassette transporter A1, ABCA1)、低密度脂蛋白受体(LDL receptor, LDLR)和清道夫受体B族Ⅰ型(scavenger receptor class B type Ⅰ, SR-BI)抗体购自Novus公司; 腺苷酸活化蛋白激酶(adenosine 5'-monophosphate (AMP)-activated protein kinase, AMPK)、p-AMPK、乙酰辅酶A羧化酶(ACC)、p-ACC、p-NF-κB-p65、p-ERK和ERK抗体购自Cell Signalling Technology公司; p-JNK、JNK、p-p38、p38和NF-κB-p65抗体购自Bioworld公司; GAPDH抗体和β-actin抗体购自Santa Cruz公司; RIPA裂解液、山羊抗兔、山羊抗鼠等二抗购自中衫金桥; 炎症因子试剂盒来源于Bio-Rad公司(M60009RDPD); BCA法蛋白浓度测定试剂盒购自Thermo Fisher公司; ECL化学发光液购自Millipore公司; 谷丙转氨酶(ALT)、谷草转氨酶(AST)以及尿素(Urea)测定试剂盒购自中生北控生物科技股份有限公司。
Western blot RIPA裂解液提取细胞中总蛋白。称取一定量的组织, 加入适量的RIPA裂解液, 用匀浆机破碎组织。将样品置于冰上裂解30 min, 13 000 r·min−1、4 ℃下离心20 min。BCA法测蛋白浓度。通过10% SDS-PAGE分离蛋白质(每孔30 μg), 然后将蛋白转移到聚偏二氟乙烯膜(PVDF)上。5%脱脂乳封闭膜1 h, 然后孵育相应的一抗, 4 ℃过夜。TBST洗3次, 每次10 min。然后孵育相应的二抗, 室温条件下孵育1 h, TBST洗3次, 使用蛋白发光液在Tanon 5200全自动化学发光图像分析系统成像。
ApoE−/−小鼠动脉粥样硬化模型构建及处理 将7周龄的ApoE−/−小鼠随机分为对照组(5只)、模型组(10只)、BBR组[BBR-L: 50 mg·kg−1、BBR-H: 150 g·kg−1, 溶于0.5%羧甲基纤维素钠(sodium salt of carboxy methyl cellulose, CMC-Na), 每组10只], 普通饲料喂养1周。从8周龄开始, 模型组和BBR给药组喂养高脂饲料, 对照组继续喂养普通饲料; BBR组同时灌胃给予一定剂量的BBR, 模型组和对照组灌胃给予0.5% CMC-Na。10周后, 动物禁食过夜。眼底静脉丛取血, 静置2 h, 室温离心15 min, 吸取血清储存于-80 ℃冰箱。脱颈椎处死小鼠后固定小鼠, 先留取新鲜的肝脏组织, 立即冻于液氮中, 然后转移到-80 ℃冰箱储存。取好肝脏后, 剪开胸腔, 剪去胸骨, 暴露心脏, 立即进行心脏灌流, 先用生理盐水灌入大约10 mL, 然后换成4%多聚甲醛灌入大约3~5 mL。分离自主动脉至髂骨总分支的动脉全长, 置于4%多聚甲醛中固定过夜, 然后置于20%蔗糖中。
主动脉油红染色 将主动脉用PBS漂洗, 在解剖显微镜(Leica公司, DM2500)下小心去除主动脉周围的脂肪组织及其他组织, 并将其纵向剪开。用蒸馏水漂洗血管3次, 60%异丙醇浸泡10 min进行同步化。将同步化的血管放入现配的油红工作液中, 缓慢摇晃浸泡15 min。然后在60%异丙醇中分色1 min, 双蒸水漂洗3次, 在解剖镜下用相机立即拍照保存。
炎症因子的测定 使用Bio-Rad悬液芯片试剂盒(M60009RDPD), 按照试剂盒方法测定小鼠巨噬细胞上清以及小鼠血清中的TNF-α、IL-6、IL-1β和IL-10的水平。
TC、TG测定 按照试剂盒说明书进行测定肝脏TC等含量。将肝脏组织称重后加入裂解液(10 μL·mg−1), 用匀浆机破碎组织。静置10 min。取适量上清转移到1.5 mL离心管, 70 ℃加热10 min, 室温2 000 r·min−1离心5 min, 取上清按照说明书酶标仪550 nm条件下分别测定TC和TG的含量。BCA法蛋白定量试剂盒做蛋白含量测定, 并以每mg蛋白浓度校正含量。
FFA酶联免疫分析 按照试剂盒说明书进行测定。称取一定量小鼠肝脏组织标本, 加入一定量PBS, 将标本匀浆充分, 3 000 r·min−1离心20 min, 收集上清。设置空白孔、待测样品孔和标准样品孔。按照说明书在450 nm测各孔吸光度来计算FFA的含量。利用BCA法测定样品的蛋白浓度, 以每毫克蛋白浓度校正含量。
ALT、AST及Urea水平测定 按照试剂盒的说明进行测定。吸取20 μL ApoE−/−小鼠血清, 加入80 μL生理盐水稀释5倍, 在7100型全自动生化分析仪测定小鼠血清的3个指标, 最后根据标准品计算样品的浓度。
统计学分析 所有数据均以mean ± SEM表示, 组间统计学差异采用one-way ANOVA和Dunnett's test进行比较。P值小于0.05被认为有显著性差异。
结果 1 BBR对高脂饮食的ApoE−/−小鼠主动脉斑块的作用ApoE−/−小鼠在喂养高脂饲料后会产生明显的主动脉粥样硬化病变症状。油性红O能特异性地使组织和细胞内脂质以及脂蛋白等染色, 主动脉油红染色呈红色部位说明存在动脉粥样硬化斑块。如图 1A、B所示, 与对照组相比, 模型组小鼠主动脉中斑块的面积显著增加, 这说明动脉粥样硬化造模成功; 与模型组相比, 给予BBR可以显著减少主动脉斑块的面积。
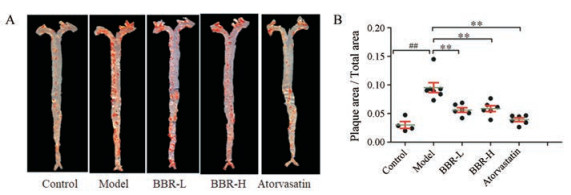
|
Figure 1 Berberine (BBR) treatment reduced atherosclerotic lesions in ApoE−/− mice. A: Representative yxxb-54-1-104s of enface staining for the lesions of each group of mice were shown; B: Quantitative analysis of enface staining lesions was shown. n = 4 for control group, n = 7 for model group, n = 6 for each other group, mean ± SEM. ##P < 0.01; **P < 0.01 |
动脉粥样硬化是一种慢性炎性疾病, 因此, 本研究检测了BBR处理后对血清中炎症因子的影响。小鼠血清炎症因子测定实验结果表明, 与对照组相比, 模型组小鼠血清中IL-1β、IL-6、TNF-α水平显著升高(P < 0.05) (图 2), 这也说明在动脉粥样硬化发生过程中确实伴随着炎症的增加。与模型组相比, BBR高、低剂量组均可以显著降低血清中促炎因子IL-1β (图 2A)、IL-6 (图 2B)、TNF-α (图 2C)的水平, 并升高抑炎因子IL-10的水平(图 2D), 这说明BBR在高脂饮食的ApoE−/−小鼠中具有很好的抗炎作用。
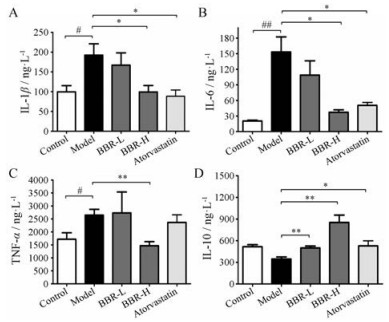
|
Figure 2 Effect of BBR on serum inflammatory factors in ApoE−/− mice. Inflammatory factors were measured by suspension microarray kit. A: IL-1β; B: IL-6; C: TNF-α; D: IL-10. n = 4−5 for control group, n = 7−10 for each other group, mean ± SEM. #P < 0.05, ##P < 0.01; *P < 0.05, **P < 0.01 |
小鼠肝脏总胆固醇TC、TG、FFA测定结果表明, 与对照组相比, 模型组小鼠肝脏中TC、TG、FFA水平显著升高(P < 0.05);与模型组相比, BBR高、低剂量组均可以显著降低TC、TG、FFA的水平(图 3), 这些结果表明BBR能显著减少高脂饮食的ApoE−/−小鼠中肝脏中胆固醇和脂质聚积。
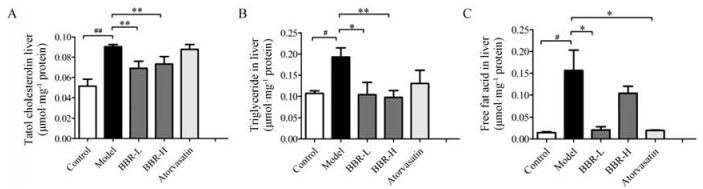
|
Figure 3 Effect of BBR on cholesterol distribution in liver of ApoE−/− mice. BBR treatment lowers liver TC (A), TG (B) and FFA (C) in ApoE−/− mice on HFD. n = 4−5 for control group, n = 7−10 for each other group, mean ± SEM. #P < 0.05, ##P < 0.01; *P < 0.05, **P < 0.01 |
丝裂原活化蛋白激酶(mitogen activated protein kinases, MAPKs)和核因子κB (nuclear factor κB, NF-κB)是主要的两条调节炎症反应的信号通路。MAPKs通路主要由p38分裂原激活蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)、c-Jun氨基末端激酶(c-jun-N-terminal kinase, JNK)和细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase, ERK)组成。因此, 本文考察了BBR对炎症的抑制作用是否与这两条通路相关。肝脏Western blot结果(图 4)表明, 与模型组相比, BBR治疗组能显著减少p38 MAPK、ERK和JNK的磷酸化, 说明BBR能通过MAPK通路调节炎症反应。此外, 与模型组相比, BBR治疗组能显著减少p65的磷酸化。这些结果提示, BBR可能是通过调节MAPKs和NF-κB信号通路的活化而发挥抗炎作用。
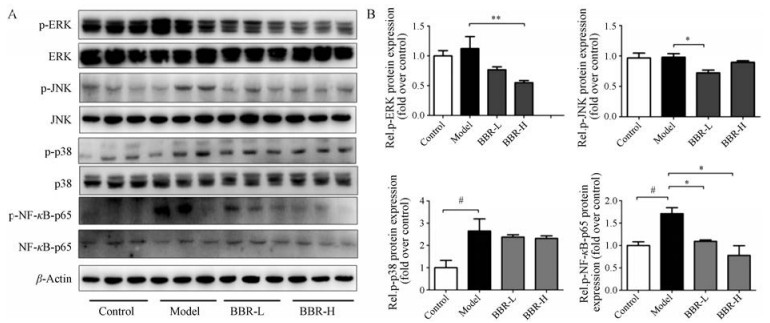
|
Figure 4 Effect of BBR on MAPKs and NF-κB pathways in liver of ApoE−/− mice. The protein expression related to inflammatory pathway were measured. Representative bands of Western blot results are shown (A), and the abundances were normalized to that of β-actin (B). n = 5 for control group, n = 6 for each other group, mean ± SEM. #P < 0.05; *P < 0.05, **P < 0.01 |
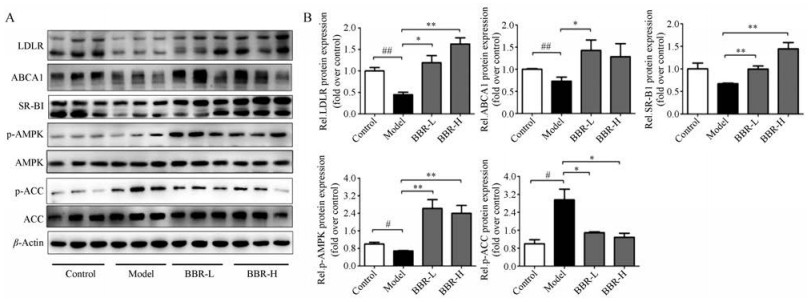
巨噬细胞泡沫化及脂质聚积在动脉粥样硬化的发生发展过程中起到很重要的作用, 并且有研究表明BBR可以调节AMPK及LDLR等来减少脂质的聚积[5−9]。AMPK是生物能量代谢调节的关键分子。ACC是脂肪酸合成的关键酶, 在脂类代谢调节方面具有重要作用。AMPK激活后通过磷酸化作用抑制ACC活性, 增强脂肪酸氧化作用, 进而抑制脂肪合成。LDLR介导的富含胆固醇的LDL内吞, 是体内清除血浆中胆固醇的重要途径之一。ABCA1和SR-BI等是胆固醇逆转运(reverse cholesterol transport, RCT)过程中的关键受体。
BBR能显著减少高脂饮食的ApoE−/−小鼠中肝脏中脂质聚积(图 5), 因此, 本研究检测BBR抑制脂质聚积的机制是否与AMPK、LDLR、ABCA1以及SR-BI这些受体等有关。结果表明, BBR给药组能显著增加LDLR蛋白水平, 增加RCT关键蛋白ABCA1和SR-BI的表达, 且能上调p-AMPK并抑制其下游蛋白ACC的磷酸化, 而上调p-AMPK、LDLR、ABCA1及SR-BI这些蛋白都对BBR减少肝脏脂质聚积有益。
|
Figure 5 Effects of BBR on cholesterol metabolism related gene expression in liver of ApoE−/− mice. Gene expressions were measured by Western blot analysis. Representative bands of Western blot results are shown (A), and the abundances were normalized to that of β-actin (B). n = 5 for control group, n = 6 for each other group, mean ± SEM. #P < 0.05, ##P < 0.01; *P < 0.05, **P < 0.01 |
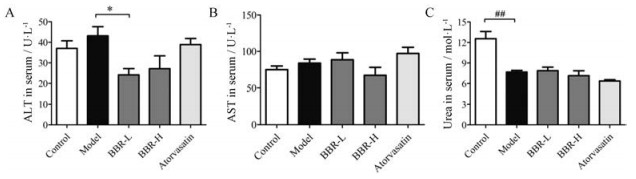
本文测定了ApoE−/−小鼠血清中的ALT、AST及Urea的水平, 以评估在所用剂量下BBR的毒性。结果显示, BBR在两个剂量下均没有升高ApoE−/−小鼠血清中的ALT (图 6A)、AST (图 6B)及Urea (图 6C)的水平, 提示在所用剂量下, BBR无明显肝肾毒性。
|
Figure 6 Evaluation of hepatotoxicity and nephrotoxicity of BBR in ApoE−/− mice. (A) ALT, (B) AST and (C) urea levels in the serum were measured by the tissue ALT, AST and urea kits, respectively. n = 4−5 for control group, n = 7−10 for each other group, mean ± SEM. ##P < 0.01; *P < 0.05 |
当前的研究表明, 动脉粥样硬化是一种慢性炎症性疾病[10], 其特征是包括胆固醇在内的脂质聚积在血管壁, 并且伴随血管炎症的增加。因此, 调节炎症、减少胆固醇在内的脂质聚积对动脉粥样硬化的预防和治疗有益, 是临床防治动脉粥样硬化的基本方案之一[3]。
研究发现, BBR作为中药黄连的主要有效成分, 具有多种药理作用, 如抗炎、调血脂、抗内皮损伤等作用。尽管已经有一些BBR在ApoE−/−小鼠中调血脂、抗动脉粥样硬化方面的作用和机制报道[11−15], 但是这些研究相对比较分散, 通常只设置一个给药剂量, 对BBR的机制考察又都集中在一个方面, 这对于BBR作为一个调血脂药的临床前研究远远不够。因此, 在本论文中, 课题组设置两个相对合理的剂量组(BBR-L: 50 mg·kg−1和BBR-H: 150 mg·kg−1), 除了考察并比较了不同剂量的BBR在抗炎和降脂方面的作用和机制外, 还考察了BBR的肝肾毒性, 为BBR的临床前以及临床研究提供科学支持。
本研究在肝脏中考察了BBR抗炎和降脂方面的机制。主动脉斑块是一个非常重要的抗动脉粥样硬化的评价指标, 所以, 本研究将所有的血管进行油红染色来考察BBR对主动脉斑块的影响。而考虑到肝脏在动脉粥样硬化的发生与发展中起着十分重要的作用[16], 并且已有文献选用肝脏组织来做机制研究[6, 17, 18], 所以, 本研究也选择了小鼠肝脏来考察BBR抗炎和降脂的作用机制。
BBR具有很好的抗炎作用[19], MAPKs和NF-κB是主要的两条调节炎症反应的信号通路。NF-κB被激活, 致炎细胞因子及细胞趋化因子分泌增多, 促发炎症发生[3]。MAPKs通路主要由p38、JNK和ERK组成。MAPKs和NF-κB信号转导途径参与炎症反应, 在抗炎抗动脉硬化中有重要的调节作用。研究表明, BBR可以抑制NF-κB活化, 下调p38、ERK、JNK及MAPK信号通路的活性表达, 从而抑制巨噬细胞、中性粒细胞在损伤血管局部聚集及表面黏附分子表达, 减少降低血管损伤后炎症因子IL-6、TNF-α的合成, 发挥抗炎功效[20, 21]。本研究结果表明, 在高脂饮食的ApoE−/−小鼠中, 给予BBR确实能显著降低血清中促炎性因子IL-1β、IL-6、TNF-α等的表达, 并且BBR高剂量(BBR-H)组抗炎效果较低剂量(BBR-L)组好。机制研究表明, BBR能显著下调包含p38、ERK和JNK的MAPKs信号通路, 抑制NF-κB的活化, 这说明BBR在高脂饮食的ApoE−/−小鼠体内抗炎作用与抑制MAPKs和NF-κB通路相关。相比BBR-L组, BBR-H组下调JNK、ERK和p65的磷酸化程度更高, 说明BBR不同剂量的抗炎作用与其对MAPK和NF-κB通路的调节能力相关。
多项基础实验及临床研究结果均证实BBR及其衍生物具有调脂功效。在新西兰兔给予高脂饮食构建的动脉粥样硬化模型中, 与模型组相比, BBR干预组显著降低血清中的TC和低密度脂蛋白胆固醇(LDLC)水平, 减少粥样硬化斑块面积和脂质沉积扩大动脉管腔径[22, 23]。宋丹青教授课题组[24]等发现BBR的衍生物在体外可以拮抗清道夫受体CD36从而抗动脉粥样硬化。蒋建东教授课题组[6]发现BBR能通过增强LDLR蛋白表达发挥调血脂作用。Li等[25]研究发现BBR给药4周能够有效调节高脂饮食的ApoE−/−小鼠的血清脂质水平, 减少炎性介质对血管内皮的损伤并抑制血管钙化, 从而改善动脉粥样硬化发挥心血管保护作用。AMPK信号通路是脂质代谢过程中重要的信号通路。本研究结果显示, BBR高、低两个剂量组均能显著减少主动脉中的斑块面积, 没有显著性差别。BBR给药显著减少肝脏中TC、TG及FFA的含量, 并且这种对脂质的调节作用可能与上调LDLR、ABCA1、SR-BI等的表达, 增加AMPK的磷酸化有关。相比BBR-L组, BBR-H组对LDLR、SR-BI、p-AMPK的作用更强。此外, 本研究发现BBR在两个剂量下均无肝肾毒性, 在此剂量下安全性较好。
以上研究表明, BBR给药12周能够有效抑制高脂饮食的ApoE−/−小鼠主动脉中斑块的发生发展, 其机制可能与抑制炎症和调节包含胆固醇在内的脂质聚积有关。随着BBR抗动脉粥样硬化的研究的逐步深入, BBR将来很可能成为一种重要的治疗动脉粥样硬化乃至心血管疾病的药物。
| [1] | Frostegard J. Immunity, atherosclerosis and cardiovascular disease[J]. BMC Med, 2013, 11: 117. DOI:10.1186/1741-7015-11-117 |
| [2] | Weber C, Noels H. Atherosclerosis:current pathogenesis and therapeutic options[J]. Nat Med, 2011, 17: 1410–1422. DOI:10.1038/nm.2538 |
| [3] | Jia YJ, Li JJ. Anti-atherosclerosis effect of berberine and its mechanism[J]. Chin J Arterioscler (中国动脉硬化杂志), 2013, 21: 364–368. |
| [4] | Jawien J. The role of an experimental model of atherosclerosis:ApoE-knockout mice in developing new drugs against atherog-enesis[J]. Curr Pharm Biotechnol, 2012, 13: 2435–2439. DOI:10.2174/1389201011208062435 |
| [5] | Chang XX, Yan HM, Xu Q, et al. The effects of berberine on hyperhomocysteinemia and hyperlipidemia in rats fed with a long-term high-fat diet[J]. Lipids Health Dis, 2012, 11: 86. DOI:10.1186/1476-511X-11-86 |
| [6] | Kong W, Wei J, Abidi P, et al. Berberine is a novel cholesterol-lowering drug working through a unique mechanism distinct from statins[J]. Nat Med, 2004, 10: 1344–1351. |
| [7] | Lee YS, Kim WS, Kim KH, et al. Berberine, a natural plant product, activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states[J]. Diabetes, 2006, 55: 2256–2264. DOI:10.2337/db06-0006 |
| [8] | Zhang M, Lv X, Li J, et al. Sodium caprate augments the hypoglycemic effect of berberine via AMPK in inhibiting hepatic gluconeogenesis[J]. Mol Cell Endocrinol, 2012, 363: 122–130. DOI:10.1016/j.mce.2012.08.006 |
| [9] | Wang Q, Zhang M, Liang B, et al. Activation of AMP-activated protein kinase is required for berberine-induced reduction of atherosclerosis in mice:the role of uncoupling protein 2[J]. PLoS One, 2011, 6: e25436. DOI:10.1371/journal.pone.0025436 |
| [10] | Viola J, Soehnlein O. Atherosclerosis-a matter of unresolved inflammation[J]. Semin Immunol, 2015, 27: 184–193. |
| [11] | Chen J, Cao J, Fang L, et al. Berberine derivatives reduce atherosclerotic plaque size and vulnerability in ApoE-/- mice[J]. J Transl Med, 2014, 12: 326. DOI:10.1186/s12967-014-0326-7 |
| [12] | Feng M, Zou Z, Zhou X, et al. Comparative effect of berberine and its derivative 8-cetylberberine on attenuating atherosclerosis in ApoE-/- mice[J]. Int Immunopharmacol, 2017, 43: 195–202. DOI:10.1016/j.intimp.2016.12.001 |
| [13] | Zhu L, Zhang D, Zhu H, et al. Berberine treatment increases Akkermansia in the gut and improves high-fat diet-induced atherosclerosis in ApoE-/- mice[J]. Atherosclerosis, 2018, 268: 117–126. DOI:10.1016/j.atherosclerosis.2017.11.023 |
| [14] | Li H, He C, Wang J, et al. Berberine activates peroxisome proliferator-activated receptor gamma to increase atherosclerotic plaque stability in ApoE-/- mice with hyperhomocysteinemia[J]. J Diabetes Investig, 2016, 7: 824–832. DOI:10.1111/jdi.2016.7.issue-6 |
| [15] | Feng M, Kong SZ, Wang ZX, et al. The protective effect of coptisine on experimental atherosclerosis ApoE-/- mice is mediated by MAPK/NF-κB-dependent pathway[J]. Biomed Pharmacother, 2017, 93: 721–729. DOI:10.1016/j.biopha.2017.07.002 |
| [16] | Ponziani FR, Pecere S, Gasbarrini A, et al. Physiology and pathophysiology of liver lipid metabolism[J]. Expert Rev Gastroenterol Hepatol, 2015, 9: 1055–1067. DOI:10.1586/17474124.2015.1056156 |
| [17] | Song D, Fang G, Mao SZ, et al. Chronic intermittent hypoxia induces atherosclerosis by NF-κB-dependent mechanisms[J]. Biochim Biophys Acta, 2012, 1822: 1650–1659. DOI:10.1016/j.bbadis.2012.07.010 |
| [18] | Liu Y, Major AS, Zienkiewicz J, et al. Nuclear transport modulation reduces hypercholesterolemia, atherosclerosis, and fatty liver[J]. J Am Heart Assoc, 2013, 2: e000093. |
| [19] | Lee S, Lim HJ, Park HY, et al. Berberine inhibits rat vascular smooth muscle cell proliferation and migration in vitro and improves neointima formation after balloon injury in vivo. Berberine improves neointima formation in a rat model[J]. Atherosclerosis, 2006, 186: 29–37. DOI:10.1016/j.atherosclerosis.2005.06.048 |
| [20] | Hu Y, Chen X, Duan H, et al. Chinese herbal medicinal ingredients inhibit secretion of IL-6, IL-8, E-selectin and TXB2 in LPS-induced rat intestinal microvascular endothelial cells[J]. Immunopharmacol Immunotoxicol, 2009, 31: 550–555. DOI:10.3109/08923970902814129 |
| [21] | Wang QZ, Guo Y, Han LM, et al. The inhibitory effect of berberine on COX-2 by ERK and JNK signal transduction pathway[J]. J Fourth Mil Med Univ (第四军医大学学报), 2009, 30: 2935–2939. |
| [22] | Xu WT, Huang JJ, Zhu LB, et al. Effect of berberine on vulnerable plaque and blood lipid in rabbit atherosclerosis[J]. Suzhou Univ J Med Sci (苏州大学学报(医学版)), 2010, 2: 280–283. |
| [23] | Qiu HM, Yang FJ, Zhang Q, et al. Effect of berberine on lipid metabolism and atherosclerosis and its mechanism[J]. J Chongqing Med Univ (重庆医科大学学报), 2012, 37: 661–664. |
| [24] | Li YH, Wang L, Hong B, et al. Synthesis of 13-hexyl berberine analogues and structure-activity relationship of CD36 antagonistic activity[J]. Acta Pharm Sin (药学学报), 2010, 45: 1128–1133. |
| [25] | Li XM, Wang QZ, Shi J, et al. Berberine improves vascular inflammatory response and calcification in atherosclerotic mice[J]. Basic Clin Med (基础医学与临床), 2018, 38: 163–168. |
 2019, Vol. 54
2019, Vol. 54


