巴豆霜为大戟科植物巴豆Croton tiglium L.的干燥成熟果实经去皮制霜后制得的炮制品, 具有峻下冷积、逐水退肿、豁痰利咽、蚀疮的功效。因其有大毒, 临床应用受到一定限制。有毒中药采用配伍的方法以监制其毒性而用之于临床, 为历代医家所推崇, 并逐渐形成了相反相成、相畏相杀等中药配伍减毒理论[1]。因此, 寻找可监制巴豆霜峻猛之性的中药进行配伍应用可有效改善其临床应用安全性。
大枣为鼠李科枣属药用植物枣Ziziphus jujuba Mill.的干燥成熟果实, 其药性甘缓, 具有顾护脾胃、缓解药性之功。《金匮要略》中, 应用大枣有58方之多, 且常用于峻剂之中, 以缓和药物峻烈之性, 如十枣汤之用大枣缓解大戟、甘遂、芫花之峻猛之性。本课题组前期研究也显示, 大枣与大戟类药材配伍应用可有效减缓大戟类药材的胃肠毒性[2, 3]。而巴豆霜与大戟、甘遂均来源于大戟科植物, 功能与主治亦类同, 皆具有峻猛之性, 且长于利水, 可用于二便不利。现代研究表明, 其与大戟、甘遂所含的主要活性成分均为结构相似的二萜及其内酯类[4]。以此推测大枣与巴豆霜配伍应用时可能存在共性的减毒规律。为验证这一推测, 本研究依据巴豆霜具有峻下冷积、逐水退肿药性与功效认识, 开展了大枣与巴豆霜配伍对小鼠排尿量及胃肠系统毒性的干预作用研究, 以期为巴豆霜临床安全用药提供数据支持, 为中药配伍减毒研究提供示范。
材料与方法实验动物 雄性KM小鼠, 体重(20 ± 2) g, SPF级, 由中国人民解放军第四军医大学实验动物中心提供, 许可证号: SCXK (军) 2012-0017。动物饲养室温度(22 ± 2) ℃, 湿度(55 ± 10) %, 12 h明暗交替。动物福利和所有实验方案均按照中华人民共和国国家科学技术委员会“实验动物管理条例”的规定进行, 并经南京中医药大学动物伦理委员会批准。
药品及试剂 巴豆霜产自四川, 大枣产自山西柳林, 均由南京中医药大学段金廒教授鉴定, 分别为大戟科植物巴豆Croton tiglium L.干燥成熟果实的炮制加工品和鼠李科植物枣Ziziphus jujuba Mill.的干燥成熟果实。生理盐水购自辰欣药业股份有限公司(批号: 1711112703);血清白介素-6 (interleukin-6, IL-6)、白介素-2 (interleukin-2, IL-2)、胃泌素(gastrin, Gas)和生长抑素(somatostatin, SS)酶联免疫分析试剂盒购自南京奥青生物技术有限公司; 琼脂糖(英杰公司, 75510-019); EB-溴化乙锭清除液(生工生物工程有限公司, EX328); PowerSoil® DNA提取试剂盒(美国MoBio公司, 12888); 5×反应缓冲液、脱氧核糖核苷三磷酸(dNTP, 10 mmol·L-1)、5×High GC Buffer (美国Sigma公司); Axy Prep DNA Gel Extration kit试剂盒(美国Axygen公司, AP-GX-500); TruSeq Nano DNA LT Sample Prep kit试剂盒(武汉锦奥生物科技有限公司, FC-121-4001或FC-121-4002); Agencourt AMPure XP Beads kit试剂盒(美国Beckman Coulter公司, A63881); Quant-iT PicoGreen dsDNA Assay kit试剂盒(Invitrogen公司, P7589); Agilent High Sensitivity DNA kit试剂盒(美国Agilent Technologies公司, 5067-4626);水为Millipore超纯水。
仪器与设备 R-210旋转蒸发仪(瑞士BUCHI公司); ST60-4微孔板恒温振荡器(Thermo Fisher Scientific公司); EnSpire酶标仪(珀金埃尔默股份有限公司); SPX-150BX生化培养箱(天津市泰斯特仪器有限公司); BT125电子分析天平(赛多利斯科学仪器有限公司); Direct-Q5纯水制备仪(Millipore公司); MLS-3750高压蒸汽灭菌器(SANYO公司); Microfuge 22R Centrifuge高速离心机(Beckman Coulter公司); RS232G紫外分光光度计(Eppendorf公司); DYY-6C电泳仪、PCR仪2720、凝胶成像系统、台式紫外分析仪(BG公司); Agilent 2100生物分析仪(Agilent公司); BioTek FLx800荧光分析酶标仪(BioTek公司); QuantiFluor TBS380荧光计(Promega公司); Illumina Miseq高通量测序仪(Illumina公司)。
供试药物的制备 根据实验设计所需浓度进行大枣(Jujubae Fructus, JF)单味药水提液的制备, 药材加入10倍量水, 浸泡0.5 h, 加热回流2 h, 提取2次, 药液过滤, 减压浓缩至浓度为每毫升约含1 g生药。取巴豆霜(Crotonis Semen Pulveratum, CT)粉碎过120目筛, 临用前加纯水混悬或与大枣水提液均匀混合, 用纯水稀释至所需浓度。
动物分组、给药及样品的采集 取健康KM小鼠48只, 随机分为6组, 每组8只, 分别为空白对照组(control)、巴豆霜低剂量组(0.039 g·kg-1·d-1, CTL)、巴豆霜高剂量组(0.078 g·kg-1·d-1, CTH)、大枣水提液组(9.75 g·kg-1·d-1, JF)、巴豆霜低剂量与大枣配伍组(巴豆霜0.039 g·kg-1·d-1, 大枣9.75 g·kg-1·d-1, JFCTL)、巴豆霜高剂量与大枣配伍组(巴豆霜0.078 g·kg-1·d-1, 大枣9.75 g·kg-1·d-1, JFCTH)。适应性饲养7天后, 于第8天灌服给药, 空白组灌服等剂量的纯水, 每天灌胃1次, 给药体积均为15 mL·kg-1体重, 连续10天。于给药第9天进行排尿量测定, 给药前禁食24 h, 不禁水, 实验前轻压小鼠下腹部, 排尽遗尿后每鼠腹腔注射1.0 mL生理盐水作水负荷, 同时单次灌服给药。各鼠分置于铺有两层滤纸的倒扣烧杯内, 记录给药后每小时滤纸的增重, 连续观察3 h。于给药第10天, 收集新鲜粪便0.1 g于1.5 mL无菌离心管中, 置于-80 ℃冰箱中保存备用(用于肠道菌群测定)。第11天摘眼球取血1.5 mL, 3 500 r·min-1离心10 min, 取上层血清, 置于-80 ℃冰箱保存, 用于测定IL-2、IL-6、Gas与SS水平; 取小肠于组织固定液中用于病理切片分析。
粪便基因组DNA的提取与检测 取粪便样品采用MoBio PowerSoil® DNA Isolation Kit (12888)试剂盒进行DNA提取。运用0.8%琼脂糖凝胶电泳对提取的DNA进行分子大小判断, 运用紫外分光光度法进行定量。
PCR扩增及高通量测序[5] 对16S rDNA的V4高可变区进行扩增, 扩增引物为: 5'-ACTCCTACGGGA GGCAGCA-3', 后引物序列为: 5'-GGACTACHVGGG TWTCTAAT-3'。扩增产物用琼脂糖凝胶纯化后再利用Illumina公司的TruSeq Nano DNA LT Library Prep Kit构建基因文库。最后用MiSeq Reagent Kit V4 (600cycles)进行2×300 bp的双端测序。测序后原始数据采用FLASH 1.2.7软件(http://ccb.jhu.edu/software/FLASH/)进行双端拼接处理。最后, 根据每个样本所对应的Index信息(即Barcode序列), 将连接后的序列识别分配入对应样本(要求Index序列完全匹配), 从而获得每个样本的有效序列。
统计学方法 数据以x± s表示, SPSS22.0统计软件进行统计学处理。多组间比较尿量、血清生理指标和小肠病理评分采用ANOVA方差分析, 差异菌属采用Kruskal-Wallis检验[6]。
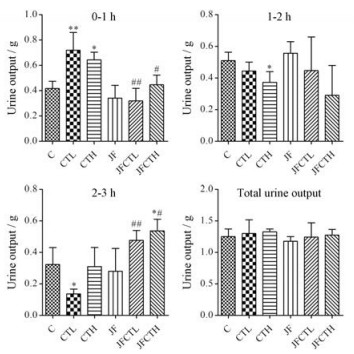
结果 1 大枣配伍巴豆霜对小鼠尿量的影响研究结果显示(图 1), 巴豆霜低剂量组与高剂量组小鼠第1 h内尿量与空白对照组比较均显著增加(P < 0.05), 巴豆霜低剂量组第3 h内尿量与空白对照组比较显著减少(P < 0.05), 巴豆霜高剂量组第2 h内尿量与空白对照组比较显著减少(P < 0.05), 3 h总尿量各组与空白对照组比较均无统计学差异(P > 0.05);大枣水提液组与空白对照组比较均无统计学差异(P > 0.05)。研究结果揭示, 巴豆霜低、高剂量均表现出一定的利尿作用, 起效快但维持时间短, 且在利尿后出现尿量减少现象; 大枣水提液未表现出促进或抑制利尿的作用。
|
Figure 1 Urine output of mice in each group. n = 8, x± s. *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs the same dose of Crotonis Semen Pulveratum (CT) groups. C: Control group; CTL: Low-dose CT group; CTH: High-dose CT group; JF: Jujubae Fructus group; JFCTL: Combined application of low-dose CT and JF group; JFCTH: Combined application of high-dose CT and JF group |
巴豆霜低、高剂量配伍大枣组小鼠, 与相应剂量单用巴豆霜组比较, 第1 h内尿量均显著减少(P < 0.05), 第3 h尿量明显增加(P < 0.05)。巴豆霜配伍大枣后总尿量与空白对照组和等剂量巴豆霜组比较未见显著差异(P > 0.05)。
2 大枣配伍巴豆霜对小鼠血清指标的影响研究结果显示(图 2), 巴豆霜低剂量与高剂量组小鼠血清IL-2、IL-6、SS与Gas水平与空白对照组比较均明显降低(P < 0.05), 大枣组SS水平与空白对照组比较显著降低(P < 0.01), 其他指标无显著变化。

|
Figure 2 Serum indicators of mice in each group. n = 8, x± s. *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs the same dose of CT groups. IL-2: Interleukin-2; IL-6: Interleukin-6; SS: Somatostatin; GAS: Gastrin |
巴豆霜低、高剂量配伍大枣后, 与单用相应剂量巴豆霜组比较, 血清IL-2、IL-6和Gas水平显著增加(P < 0.01), 且高剂量巴豆霜与大枣配伍应用较单用巴豆霜尚可增加SS的分泌。
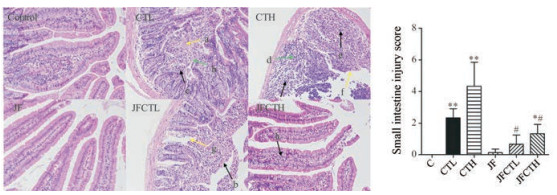
3 大枣配伍巴豆霜对小鼠小肠组织的影响小肠病理组织评分标准为:溃疡(无溃疡为0分, 溃疡小于3 mm为1分, 溃疡大于3 mm为2分)、炎症(无炎症为0分, 轻度炎症为1分, 重度炎症为2分)、病变深度(无病变为0分, 黏膜层为1分, 黏膜下层为2分, 肌层为3分)。小肠组织HE染色结果见图 3。镜下观察可见空白对照组小鼠小肠组织无明显异常; 与空白对照组小鼠比较, 巴豆霜高、低剂量均可对小鼠小肠组织造成损伤, 表现为隐窝减少、肠组织局部结构不清、肠黏膜上皮脱落、组织中有炎性细胞, 组织损伤评分与空白对照组有显著性差异(P < 0.01), 且呈现出一定的剂量依赖性; 大枣组与空白对照组未见显著差异(P > 0.05);巴豆霜与大枣配伍后与相应剂量的巴豆霜单用组比较, 炎症与病变深度均表现出一定的改善趋势, 组织损伤评分具有显著差异(P < 0.05)。
|
Figure 3 Pathological sections of small intestine HE staining (×200). a: Mucus can be seen in some portion; b: Local structure of intestinal tissue was indistinct, and intestinal mucosal epithelial cells shed; c: A small amount of mononuclear cell infiltration can be seen in the tissue; d: The numbers of intestinal crypt structure disappeared extensively; e: A large number of inflammatory cells can be seen in the tissue, mainly lymphocytes, with a small number of monocytes; f: Large area of necrotic intestinal tissue can be seen, and intestinal villus lost; g: Lymphatic vessels expanded; h: A small amount of lymphocytic infiltration. n = 8, x± s. *P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs the same dose of CT groups |
运用QIIME软件对样品序列进行识别与分析, 发现粪便样品高质量序列比例均为65%以上, 且各组样品之间无显著性差异。序列长度分布在300~500 bp内, 长度为450 bp的序列最多, 达450 000多条, 从序列长度的分布来看, 与16S rDNA-V4区序列长度大致吻合, 可用于后续分析。
将相似度高于97%的高质量序列归为一个OTU, 并将丰度值低于全体样本测序总量0.001%的OTU去除, 并将除去稀有OTU的序列与相关数据库Green Genes进行比对。所有样品在门分类水平上, OTU数量最多可达到1 162, 最少为647。各组样品中能分类至门、纲、目、科、属、种的有效OTU数如表 1所示。
| Table 1 Statistics table of operational taxonomic unit (OTU) demarcation and classification level identification. n = 6, x± s |
对各组中每个样本在分类学水平上的菌群数量进行统计, 用柱状图表示在门和属分类学水平上的菌群组成比例(图 4)。在门分类水平上, 各组样品中菌群的整体结构无显著差异(图 4A), 在空白对照组、各给药组中主要的门分类有Firmicutes、Bacteroidetes、Verrucomicrobia、Actinobacteria、Deferribacteres、Proteobacteria、TM7、Tenericutes、Cyanobacteria, 其中Firmicutes的相对丰度最高, 在群落结构上占有绝对优势, Bacteroidetes和Verrucomicrobia次之。在属分类水平上(图 4B), 在空白对照组、各给药组中相对丰度较高的为S24-7_ukn、Akkermansia、Lactobacillus、Bacteroides、Lachnospiraceae_ukn。

|
Figure 4 The differences in the community composition between the phylum (A) and the genus (B) units. The width of different patches indicates the relative abundance ratio of different species |
Beta多样性(beta diversity)分析是用于评价不同样本在菌群结构多样性方面差异的重要指标。本研究采用SIMCA-P软件对所有组小鼠的粪便菌群多样性数据进行主成分(principal components analysis, PCA)分析, 将各样品在属水平的相对丰度提取主成分因子, 绘制PCA图(图 5), 结果显示, 巴豆霜组、大枣组以及巴豆霜与大枣配伍组均与空白对照组处于不同区域, 提示小鼠在给药10天后, 可引起肠道菌群结构发生变化。

|
Figure 5 PCA analysis of mouse gut microbiota treated with CTL, CTH, JF, JFCTL and JFCTH |
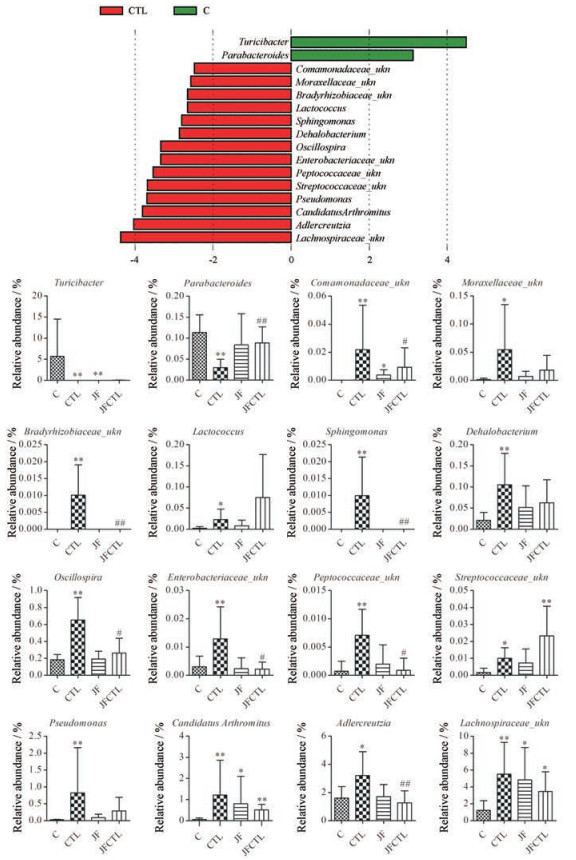
为进一步分析各组间的差异菌属及药物的调节作用, 采用Galaxy在线分析平台(http://huttenhower.sph.harvard.edu/galaxy)提交属水平的相对丰度矩阵进行LEfSe分析。结果显示(图 6、7), 大枣、巴豆霜低剂量、巴豆霜高剂量、巴豆霜低剂量与大枣合用、巴豆霜高剂量与大枣合用可分别引起13、16、7、7、15个属相对丰度的上调或者下调。低剂量巴豆霜引起了Comamonadaceae_ukn、Moraxellaceae_ukn、Bradyrhizobiaceae_ukn、Lactococcus、Sphingomonas、Dehalobacterium、Oscillospira、Enterobacteriaceae_ukn、Peptococcaceae_ukn、Streptococcaceae_ukn、Pseudomonas、Candidatus Arthromitus、Adlercreutzia和Lachnospiraceae_ukn的上调, Parabac-teroides和Turicibacter的下调; 配伍大枣后, Parabacteroides属相对丰度显著升高, Comamonadaceae_ukn、Bradyrhizobiaceae_ukn、Sphingomonas、Oscillospira、Enterobacteriaceae_ukn、Peptococcaceae_ukn和Adler-creutzia属显著降低; 此外, 研究发现巴豆霜配伍大枣后Lactococcus和Streptococcaceae_ukn属相对于低剂量巴豆霜组有升高趋势, 但未见显著性差异。高剂量巴豆霜引起了Bilophila、Pseudomonas、Streptococcus、Comamonadaceae_ukn、Moraxellaceae_ukn和Lactococcus的上调, Turicibacter的下调; 配伍大枣后, 可使Bilophila相对丰度显著降低, 且发现Pseudomonas、Moraxellaceae_ukn和Lactococcus相对于高剂量巴豆组有升高趋势, 未见显著性差异, 但与空白对照组比均显著升高。
|
Figure 6 LefSe analysis and relative abundance of differential bacteria genus of gut microbiota for samples of CTL, JF and JFCTL groups. n = 6, x± s. *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs the same dose of CT groups |

|
Figure 7 LefSe analysis and relative abundance of differential bacteria genus of gut microbiota for samples of CTH, JF and JFCTH groups. *P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs the same dose of CT groups |
巴豆霜为巴豆经制霜后所得炮制加工品, 有大毒, 临床多入丸散服用。在遵循传统用法的基础上, 为充分暴露药物的毒副作用, 本研究采用直接粉碎后加纯水混悬灌服的给药方式, 分别以《中国药典》 (2015年版一部)中高限剂量及高限剂量的两倍作为巴豆霜的给药剂量。在此基础上, 配伍大枣应用以揭示大枣对其毒性及药效的影响。
巴豆霜为中医临床常用峻下逐水药物, 以通利二便为其主要作用途径, 临床应用时常可致泄泻及瞬时排尿量增加。已有研究显示, 当泄泻时, 肠道中常驻菌大量排出, 外源菌相应增加, 肠道微生态失去平衡, 抑制肠黏膜免疫功能的发挥, 从而发生一系列生理病理变化[7]。因此, 基于肠道菌群结构、血清免疫因子及排尿量为指标可以更为客观地揭示巴豆霜的毒效作用, 以及大枣对其毒性及药效的干预作用。
本研究结果显示, 巴豆霜具有一定的利尿作用, 且呈现起效快但维持时间短, 在利尿后出现尿量减少的作用特征; 大枣与巴豆霜配伍后, 可显著减少其1 h内尿量, 提示大枣具有减缓巴豆霜逐水作用的趋势。且大枣可显著上调单用巴豆霜后下降的血清IL-2与IL-6水平。IL-2和IL-6为重要的免疫因子, 能够刺激参与免疫反应。研究结果提示, 巴豆霜具有一定的抑制机体免疫作用, 配伍大枣后, 可显著减缓其免疫毒性。
研究表明, 胃肠运动主要受胃肠神经系统的支配和体液因素的影响, 胃肠激素是调节胃肠运动的重要因素, 它主要通过血液循环以内分泌的形式作用于胃肠道平滑肌细胞相对应的受体来调节肠胃[8], Gas和SS就是胃肠道主要的激素, SS可减少Gas的分泌。研究结果显示, 巴豆霜低剂量与高剂量组小鼠血清Gas和SS水平与空白对照组比较均明显降低, 且均可在一定程度上造成小鼠小肠组织病理损伤, 表明巴豆霜可使受试动物胃肠运动产生紊乱趋势, 表现出一定的胃肠毒性, 其与大枣配伍后可使降低的Gas和SS水平均显著升高, 且小肠组织病理分析显示大枣可显著减轻巴豆霜对小鼠小肠组织造成的损伤。上述结果提示, 两药配伍应用后大枣表现出减缓巴豆霜胃肠毒性的作用。但日常观察发现, 小鼠给予巴豆霜后仅见软便现象, 并未观察到稀便, 配伍大枣组与单用巴豆霜组未见显著差异, 各组小鼠的粪便颜色未见肉眼可见的差异, 提示巴豆霜给药时间较短或对胃肠功能损伤程度较低, 有待后续研究观察。
在肠道菌群落结构方面, 发现与空白对照组相比, 巴豆霜组小鼠肠道菌从门到属均发生改变。低剂量巴豆霜配伍大枣后, 显著改善其引起的Parabacteroides属相对丰度降低, Comamonadaceae_ukn、Bradyrhizobiaceae_ukn、Sphingomonas、Oscillospira、Enterobacteriaceae_ukn、Peptococcaceae_ukn和Adlercreutzia属相对丰度升高。Sphingomonas产生的鞘糖脂与自然杀伤(NK) T细胞的活化相关[9, 10], 已有研究发现在肠道微生物群中微生物Sphingomonas的优势与肠黏膜中促炎反应的瞬时增加和血浆中特异性(炎性)细胞因子瞬时升高水平一致[11]。长时间给予低剂量巴豆霜后, Sphingomonas相对丰度升高, 可能引起肠黏膜炎症以及影响免疫系统, 与小肠组织病理分析结果一致。在配伍大枣后, Sphingomonas相对丰度显著降低, 趋于正常水平, 推测合用后可减缓巴豆霜的毒性作用。Oscillospira是一类研究较少的厌氧细菌属[12], 但已有文献报道在炎性环境中繁殖的Oscillospira在炎症性肠病中过多繁殖, 甚至可增加炎症和结肠炎的发病率[13], 且在验证噬菌体是否对人类无害的实验中发现噬菌体攻击后, 肠道通透性受损的标志物增加的同时Oscillospira的丰度也增加[14]。长时间给予低剂量巴豆霜后, Oscillospira相对丰度升高, 表明低剂量巴豆霜可能破坏肠道通透性, 引起炎症。在配伍大枣后, Oscillospira相对丰度显著降低并趋于正常, 推测合用后巴豆霜毒性降低。
高剂量巴豆霜配伍大枣后, 显著改善其引起的Bilophila相对丰度升高。已发现Bilophila是各种化脓性感染的严重病原体, 其除了可以诱导炎症外, 还可以将牛磺酸还原成具有细胞毒性的硫化物如H2S等[15-18]。长时间给予高剂量巴豆霜后, Bilophila细菌相对丰度增加, 预示肠道炎症的发生。在配伍大枣后, Bilophila相对丰度显著降低并趋于正常, 推测两药合用后可使巴豆霜毒性降低, 研究结果与小肠组织病理学观察一致。
此外, 值得注意的是, 大枣配伍低剂量及高剂量巴豆霜后并未回调巴豆霜引起的Lactococcus、Streptococcaceae_ukn、Pseudomonas、Moraxellaceae_ukn相对丰度升高现象, 反而有增加这4种菌属相对丰度的趋势, 但组间未显示显著差异。已有文献报道Lactococcus是一类与炎症相关的益生菌群, 可产生短链脂肪酸并支持肠屏障的完整性, 促进免疫耐受, 并降低胃肠道感染的风险[19]; 而Streptococcaceae、Pseudomonas、Moraxellaceae细菌通常被认为是致病菌, 易导致感染性疾病[20-22]。因此, 上述变化趋势值得进一步深入研究。
综上所述, 大枣与巴豆霜配伍应用可在血清免疫指标、肠道运动、肠道损伤、肠道菌群结构等方面表现出一定的配伍减毒效应。此外, 两药合用后除表现出的配伍减毒效应外, 大枣尚可减缓巴豆霜的逐水药势, 呈现出一定的降效作用趋势, 其作用机制有待进一步研究。
| [1] | Guo S, Tang YP, Su SL, et al. Progress in studies on reducing the toxicity of Chinese medicines by using compatibility in the last ten years[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2008, 14: 74–79. |
| [2] | Zong QQ, Tang YP, Shen XC, et al. Effecs of ethanol extracts of Radix Kansui on the contraction of isolated ileal smooth muscle of rabbits[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2008, 19: 438–440. |
| [3] | Luo D, Wang YQ, Guo S, et al. Effects of bioactive extracts from Fructus Jujubae in attenuating the inflammation induced by Radix Kansui[J]. J Chin Pharm Univ (中国药科大学学报), 2009, 40: 238–243. |
| [4] | Wu XA, Zhao YM. Advance on chemical composition and pharmacological action of Croton L[J]. Nat Prod Res Dev (天然产物研究与开发), 2004, 16: 467–472. |
| [5] | Dai XX, Cai HD, Su SL, et al. Regulatory effect of the leaves of Rehmannia glutinosa Libosch on intestinal microflora in diabetic nephropathy rats[J]. Acta Pharm Sin (药学学报), 2017, 52: 1683–1691. |
| [6] | Xu HY, Wang YL, Wang DF, et al. Effect of Huangqin Tang on the gut microbiota in rats with ulcerative colitis model determined by high-throughput sequencing[J]. Acta Pharm Sin (药学学报), 2017, 52: 1673–1682. |
| [7] | Peng Y, Li XB. Pi-deficiency and gastrointestinal microbiota[J]. World Chin J Dig (世界华人消化杂志), 2012, 20: 3287–3291. DOI:10.11569/wcjd.v20.i34.3287 |
| [8] | Zhou L, Ke MY. Neuro Gastroenterology and Motivation:Basic and Clinical (神经胃肠病学与动力:基础与临床)[M]. Beijing: Science Press, 2005: 83. |
| [9] | El Aidy S, Van Baarlen P, Derrien M, et al. Temporal and spatial interplay of microbiota and intestinal mucosa drive establishment of immune homeostasis in conventionalized mice[J]. Mucosal Immunol, 2012, 5: 567–579. DOI:10.1038/mi.2012.32 |
| [10] | Duan RD, Nilsson A. Metabolism of sphingolipids in the gut and its relation to inflammation and cancer development[J]. Prog Lipid Res, 2009, 48: 62–72. DOI:10.1016/j.plipres.2008.04.003 |
| [11] | El AS, Derrien M, Aardema R, et al. Transient inflammatory-like state and microbial dysbiosis are pivotal in establishment of mucosal homeostasis during colonisation of germ-free mice[J]. Benef Microbes, 2014, 5: 67–77. DOI:10.3920/BM2013.0018 |
| [12] | Gophna U, Konikoff T, Nielsen HB. Oscillospira and related bacteria-from metagenomic species to metabolic features[J]. Environ Microbiol, 2017, 19: 835–841. |
| [13] | Lu S, Zuo T, Zhang N, et al. High throughput sequencing analysis reveals amelioration of intestinal dysbiosis by squid ink polysaccharide[J]. J Funct Food, 2016, 20: 506–515. DOI:10.1016/j.jff.2015.11.017 |
| [14] | Tetz GV, Ruggles KV, Zhou H, et al. Bacteriophages as potential new mammalian pathogens[J]. Sci Rep, 2017, 7: 7043. DOI:10.1038/s41598-017-07278-6 |
| [15] | D'Hoe K, Conterno L, Fava F, et al. Prebiotic wheat bran fractions induce specific microbiota changes[J]. Front Microbiol, 2018, 9: 31. DOI:10.3389/fmicb.2018.00031 |
| [16] | Song JJ, Tian WJ, Kwok LY, et al. Effects of microencapsulated Lactobacillus plantarum LIP-1 on the gut microbiota of hyperlipidaemic rats[J]. Br J Nutr, 2017, 118: 481–492. DOI:10.1017/S0007114517002380 |
| [17] | Hale VL, Chen J, Johnson S, et al. Shifts in the fecal microbiota associated with adenomatous polyps[J]. Cancer Epidemiol Biomarkers Prev, 2017, 26: 85–94. DOI:10.1158/1055-9965.EPI-16-0337 |
| [18] | Liang T, Su W, Zhang Q, et al. Roles of sphincter of oddi laxity in bile duct microenvironment in patients with cholangiolithiasis:from the perspective of the microbiome and metabolome[J]. J Am Coll Surg, 2016, 222: 269–280. DOI:10.1016/j.jamcollsurg.2015.12.009 |
| [19] | Jeon HJ, Yeom Y, Kim YS, et al. Effect of vitamin C on azoxymethane (AOM)/dextran sulfate sodium (DSS)-induced colitis-associated early colon cancer in mice[J]. Nutr Res Pract, 2018, 12: 101–109. DOI:10.4162/nrp.2018.12.2.101 |
| [20] | Xu J, Lian F, Zhao L, et al. Structural modulation of gut microbiota during alleviation of type 2 diabetes with a Chinese herbal formula[J]. ISME J, 2015, 9: 552–562. DOI:10.1038/ismej.2014.177 |
| [21] | Yellin AE, Heseltine PN, Berne TV, et al. The role of Pseudomonas species in patients treated with ampicillin and sulbactam for gangrenous and perforated appendicitis[J]. Surg Gynecol Obstet, 1985, 161: 303–307. |
| [22] | Li PG, Yang C, Yue R, et al. Modulation of the fecal microbiota in sprague-dawley rats using genetically modified and isogenic corn lines[J]. J Agric Food Chem, 2018, 66: 551–561. DOI:10.1021/acs.jafc.7b05285 |
 2019, Vol. 54
2019, Vol. 54


