慢性肝脏疾病严重危害人类健康, 纤维化是继发于各种慢性因素引起的肝脏损伤和炎症后组织修复过程中的代偿反应, 肝纤维化的进一步发展会导致肝硬化、肝功能衰竭和肝癌[1]。研究发现, 肝纤维化是一种可逆性病变, 如果能在这一阶段给予有效的治疗, 对慢性肝炎的治疗、肝硬化及肝癌等严重致死性疾病的预防具有重要的意义[2]。
目前认为活化的肝星状细胞(hepatic stellate cell, HSC)是肝纤维化发生时细胞外基质(extracellular matrix, ECM)的主要来源, 而转化生长因子β1 (transforming growth factor-β1, TGFβ1)是导致肝纤维化的最重要的细胞因子之一[3]。TGFβ1信号通路在启动并促进HSC活化过程中发挥重要作用, 此外还可促进胶原(collagen)的合成以及α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)组成以及应力纤维形成[4, 5]。外源的TGFβ1可以激活肝星状细胞LX-2并且导致肝纤维化相关基因的大量表达, 如TGFβ、collagen、MMP等。TGFβ-Smad通路是自激活通路, 通路激活后产生更多的TGFβ, 使该通路以及星状细胞维持在激活状态[4]。Hippo通路被公认为是肝脏发育的重要调节通路, 其通路下游主要的效应分子Yes相关蛋白(yes-associated protein, YAP)在肝星状细胞活化早期就会被激活[6]。Hippo通路和TGFβ-Smad通路密切相关[7], YAP不仅可以与TGFβ-Smad通路中的Smad2/3/4复合体相互作用, 激活下游关键转录因子, 促进ECM的沉积[8, 9], 而且YAP易位到细胞核后, 与转录因子TEAD 1~4相互作用, 促进下游靶基因结缔组织因子(connective tissue grow factor, CTGF)、SPP1和TGFβ等基因的表达, TGFβ1的表达增多, 又会进一步促进细胞纤维化程度[10]。
化合物pepstatin Pr (图 1)是pepstatin A的衍生物, 由本所陈明华副研究员从链霉菌CPCC 202950的大米发酵产物中分离得到[11]。Pepstatin A作为天冬氨酸蛋白酶抑制剂, 可以抑制胃蛋白酶、肾素、组织蛋白酶D (cathepsin D)等天冬氨酸蛋白酶。cathepsin D是组织蛋白酶家族中必需的天冬氨酸肽酶, 可以调节多种过程, 包括细胞生长、肿瘤生物学和组织稳态[12]。最近的数据显示, cathepsin D也参与肝损伤和纤维发生[13]。
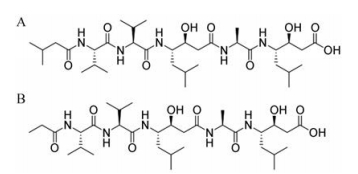
|
Figure 1 The structures of pepstatin A (CAS: 26305-03-3, A) and pepstatin Pr (CAS: 50655-19-1, B) |
试剂与仪器 CO2培养箱(Thermo公司); 单功能化学发光酶标仪SpectraMaxRL (Molecular Devices公司); 7500 Fast Real-Time PCR system (Applied Biosystems公司); 化学发光仪(上海Tanon公司)。DMEM高糖培养基、Trizol (Invitrogen公司); 胰酶、PBS (中科迈晨(北京)科技有限公司); Bright-Glo单荧光素酶测定试剂盒(Promage公司); 脱脂奶粉(OXOID公司); PVDF膜、化学发光液(Millipore公司); RNA纯化试剂盒Nucleospin RNA Clean-up (Macherey-Nagel产品); 胞浆胞核提取试剂盒(北京普利莱基因技术有限公司); 逆转录试剂盒、Fast Start Universal Probe Master (ROX) (Roche公司); Taqman探针ACTA2 (表达α-SMA的基因)、COL1A1 (Thermo Fisher公司); COL1A1抗体、α-SMA抗体、TGFβ1 (Abnova公司); GAPDH、cathepsin D、p-Smad2 (S465/467)、Smad2 (Cell Signaling Technology公司); Second antibody (北京中杉金桥生物技术有限公司)。
磺酰罗丹明B (SRB)比色法 将处于对数生长期的LX-2细胞以1.5×104个/孔接种于96孔培养板, 细胞贴壁后, 将完全培养基更换为无血清培养基, 24 h后加药, 分别设置空白对照组、TGFβ1 (2 ng·mL-1)诱导组、以及含有TGFβ1 (2 ng·mL-1)和pepstatin Pr (50、100和200 μmol·L-1)的无血清培养基, 每个浓度设4个复孔, 在37 ℃、5% CO2条件下培养, 24 h后加入三氯乙酸(TCA) 50 μL固定细胞, l h后弃固定液, 蒸馏水清洗并干燥后, 加SRB溶液染色, 用1%醋酸洗涤晾干后, 每孔加入150 μL Tris-HCl溶解, 于波长515 nm处测定OD值。
单荧光素酶 稳定表达COL1A1启动子的单克隆细胞株(LX-2-COL细胞)于DMEM培养基、5% CO2恒温37 ℃细胞培养箱中培养, 待细胞汇合度至90%~95%时, 以1.5×104个/孔将细胞铺至96孔板中, 细胞贴壁后加入梯度浓度的pepstatin Pr, 加药24 h后, 吸弃原培养基, PBS洗1次, 使用Bright-Glo单荧光素酶测定试剂盒测定荧光值。
Real-time PCR 取对数生长期的LX-2细胞铺于6孔板中, 每孔细胞数为2×105个, 细胞贴壁后, 将完全培养基更换为无血清培养基, 24 h后加TGFβ1诱导同时加药, 即分别更换为无血清培养基、含有TGFβ1 (2 ng·mL-1)或含有TGFβ1 (2 ng·mL-1)和pepstatin Pr (20、40和80 μmol·L-1)的无血清培养基, 继续于5% CO2恒温37 ℃细胞培养箱中培养24 h。采用Trizol法提取细胞的总RNA, 并使用RNA纯化试剂盒进行纯化。纯化后的RNA使用Roche公司的逆转录试剂盒合成cDNA, 以得到的cDNA为模板, 采用Roche公司的FastStart Universal Probe Master (ROX)进行real-time PCR反应。
Western blot 细胞处理同real-time PCR, 收取蛋白样品加入上样缓冲液, 或根据胞浆胞核提取试剂盒说明书分别提取浆蛋白和核蛋白, 进行SDS-PAGE电泳分离蛋白, 采用湿转的方法将蛋白转至PVDF膜上, 5%脱脂奶粉封闭2 h, 孵育一抗于4 ℃摇床过夜, 然后PBST洗3次, 加入相应的二抗, 室温孵育2 h, 弃去二抗, PBST洗3次, 将化学发光液A液和B液1︰1混合, 加到膜上, 采用化学发光仪进行图像采集。
统计学分析 所有数据以x±s表示, 采用Image J软件进行灰度扫描, GraphPad Prism 5软件对数据进行分析和作图, 两样本均数比较采用t检验, 多个样本均数比较采用单因素方差分析, 以P < 0.05为具有统计学显著性差异。
结果 1 化合物pepstatin Pr对LX-2细胞存活的影响SRB方法检测不同浓度的pepstatin Pr (50、100和200 μmol·L-1)作用于无血清及TGFβ1诱导处理后24 h的LX-2细胞, 没有表现出细胞毒性, 结果表明, pepstatin Pr在200 μmol·L-1之内对体外培养的LX-2细胞无细胞毒性(图 2), 为后续研究的药物浓度确定提供了一定的依据。
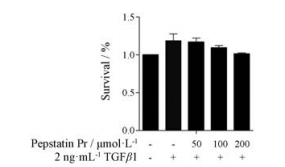
|
Figure 2 The viability of LX-2 cells was analyzed by sulforhodamine B assay after pepstatin Pr treatment. n = 3, x±s |
本研究应用基于COL1A1启动子的高通量抗肝纤维化筛选模型[14], 采用单荧光素酶基因报告检测系统检测不同浓度的pepstatin Pr (3、20、50和100 μmol·L-1)及阳性对照25 μmol·L-1表没食子儿茶素没食子酸酯(EGCG)对LX-2-COL1A1细胞中COL1A1启动子活性的影响[15], 结果表明, 不同浓度的pepstatin Pr能够显著抑制COL1A1启动子的活性, 20和50 μmol·L-1 pepstatin Pr的抑制率分别为56.05%和62.39%, 阳性对照25 μmol·L-1 EGCG的抑制率为61.58%, 相比于空白对照组均能够显著抑制COL1A1启动子的活性(P < 0.01或P < 0.05) (图 3A)。Real-time PCR和Western blot结果显示, pepstatin Pr处理由TGFβ1诱导的LX2细胞24 h后, 能够浓度依赖性地抑制肝纤维化标志物COL1A1以及α-SMA的mRNA和蛋白表达水平(图 3B~D), 并且具有时间依赖性(图 3E)。
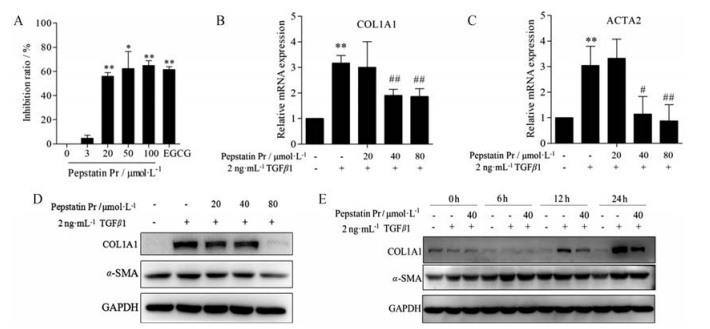
|
Figure 3 Pepstatin Pr inhibited fibrogenesis genes expression in LX-2 cells. A: Pepstatin Pr significantly inhibited COL1A1 promoter activity in LX-2 cells, data were analyzed by Bright-Glo luciferase assay system. B-E: Data were analyzed by real-time PCR and Western blot assay. The mRNA/protein expression levels were normalized against GAPDH. n = 3, x±s. *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs TGFβ1 group |
采用Western blot方法检测化合物pepstatin Pr在LX-2细胞中对cathepsin D蛋白表达的影响, 结果显示, 加入TGFβ1诱导后, pro-cathepsin D以及cathepsin D的表达水平无明显变化, 而加入不同浓度的化合物pepstatin Pr作用24 h后, cathepsin D蛋白表达明显降低, 证明pepstatin Pr作为pepstatin A的衍生物, 可以抑制cathepsin D的蛋白表达水平(图 4)。
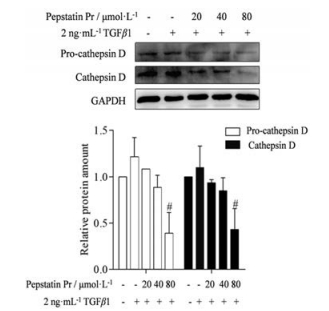
|
Figure 4 Pepstatin Pr inhibited the expression of cathepsin D in LX-2 cells. Data were analyzed by Western blot assay and the protein expression levels were normalized against GAPDH. n = 3, x±s. #P < 0.05 vs TGFβ1 group |
肝纤维化发生过程中, 多种促炎、促纤维化因子以自分泌和旁分泌的形式作用于HSC, 使其发生活化和表型转化, 具备增殖、纤维形成、收缩反应和趋化性等特性, 其中TGFβ1是促进肝纤维化的关键细胞因子, 加入外源TGFβ1可诱导LX2细胞活化, 而在HSC活化的早期, Hippo通路下游主要的效应分子YAP激活并调节基因的表达。研究表明, YAP的抑制会导致TGFβ表达降低, 从而抑制下游Smad复合物的活性[8, 16, 17]。在LX2细胞中, 加入TGFβ1诱导同时加pepstatin Pr作用24 h后, 采用Western blot方法检测化合物pepstatin Pr对YAP及其旁系同源蛋白PDZ结合域转录共激活因子(transcriptional coactivator with PDZ-binding motif, TAZ)的表达, 结果显示, 化合物pepstatin Pr能够抑制LX-2细胞中YAP、TAZ、CTGF的蛋白表达水平(图 5A、B)。检测细胞浆和细胞核蛋白显示, 相比于TGFβ1诱导组, 化合物pepstatin Pr作用后, 也分别降低了胞浆和胞核中YAP的蛋白水平(图 5C)。化合物pepstatin Pr能够抑制LX-2细胞中TGFβ1及p-Smad2的蛋白表达水平(图 5D), 表明pepstatin Pr可以通过调控YAP-TGFβ-Smad通路抑制由TGFβ1诱导的肝星状细胞活化。
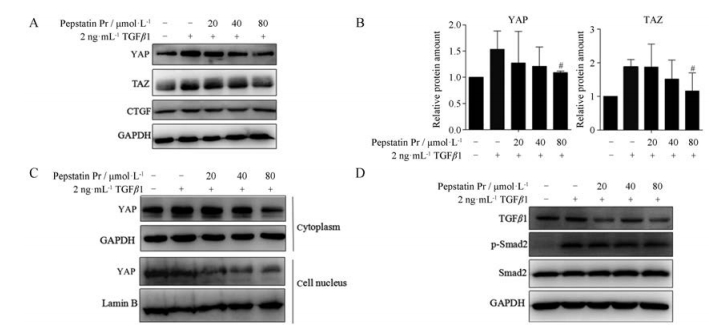
|
Figure 5 Pepstatin Pr showed its anti-fibrosis effect relating to Hippo and TGFβ-Smad pathway in LX2 cells induced by TGFβ1. Pepstatin Pr inhibited the expression of YAP and TAZ (A-C), TGFβ1 and p-Smad2 (D) in LX-2 cells and the protein expression levels were normalized against GAPDH. n = 3, x±s, #P < 0.05 vs TGFβ1 group. YAP: Yes-associated protein; TAZ: Transcriptional coactivator with PDZ-binding motif |
Pepstatin A作为天冬氨酸蛋白酶抑制剂, 可以抑制胃蛋白酶、肾素、cathepsin D等天冬氨酸蛋白酶, 研究发现pepstatin A不仅与肾和心肌纤维化相关, 与肝纤维化也有一定的联系[16, 17]。本研究在筛选中发现化合物pepstatin Pr对COL1A1启动子具有良好的抑制作用, 进而探讨了pepstatin Pr在人肝星状细胞LX-2中的抗肝纤维化效果。
转化生长因子β (TGFβ)是慢性肝脏病最重要的细胞因子, 作用于从最初的肝损伤到炎症和纤维化, 再到肝硬化和肝细胞癌的各个阶段。肝损伤诱导的TGF-β水平和活性增强, 肝细胞破坏并介导肝脏星状细胞和成纤维细胞活化, 产生肌成纤维细胞和细胞外基质过度沉积[4]。TGF-β1诱导肌成纤维细胞标志物α-SMA和CTGF的转录激活[18]。Smad蛋白家族是TGF-β1关键的下游信号, 包括膜受体激活Smads (Smad1、2、3、5、8)、通用Smad (Smad4)及抑制性Smads (Smad6、7)三大类[4]。静息HSC会通过Smad活化响应TGF-β诱导, 而肌成纤维细胞通过自分泌TGF-β信号传导完全刺激并显示出强烈的内在R-Smad活化。YAP是Hippo通路的关键节点蛋白, 在肝脏发育[10]、肝纤维化[8]以及肝癌[6]的发生发展有重要调节作用, YAP去磷酸化入核后, 可以与其他转录因子相互作用, 促进下游靶基因CTGF、TGFβ1等的表达。YAP激活是肝星状细胞活化的关键驱动因素, 抑制YAP是治疗肝纤维化的一种新方法。Western blot结果显示, 化合物pepstatin Pr能够抑制LX-2细胞中YAP及其旁系同源物TAZ及其下游CTGF、蛋白表达水平, 并抑制Smad2的磷酸化水平, 表明Pepstatin Pr的体外抗肝纤维化作用可能与YAP-TGFβ-Smad通路相关。
最近的数据显示, cathepsin D也参与肝损伤和纤维发生[13]。如在实验性纤维发生和肝硬化和肝细胞癌的临床患者中观察到cathepsin D激活[19]。Kristensen等[20]通过蛋白质组学分析发现, HSC活化期间cathepsin D的表达上调。此外, Moles等[21]发现cathepsin D在HSC活化中起关键作用, 促进其纤维化潜能, 表明抑制cathepsin D的表达可能与肝纤维化的治疗有关。目前文献[12]表明, 联合治疗可以通过下调cathepsin D来调节HSC活化的持续期, 从而抑制ECM的广泛积累, 这是调节纤维化潜能和抑制肝纤维化的关键步骤。本研究发现, 化合物pepstatin Pr作为pepstatin A的衍生物, 能够显著地下调pro-cathepsin D以及cathepsin D的蛋白表达水平, 说明pepstatin Pr可以通过下调cathepsin D发挥体外抗肝纤维化作用。
综上所述, 化合物pepstatin Pr能够抑制LX-2细胞中肝纤维化标志物的表达, 其体外抗肝纤维化作用可能与其下调cathepsin D的蛋白水平, 进而抑制YAP-TGFβ-Smad信号通路相关。
| [1] | Torok NJ. Recent advances in the pathogenesis and diagnosis of liver fibrosis[J]. J Gastroenterol, 2008, 43: 315–321. DOI:10.1007/s00535-008-2181-x |
| [2] | Trappoliere M, Caligiuri A, Schmid M, et al. Silybin, a component of sylimarin, exerts anti-inflammatory and anti-fibrogenic effects on human hepatic stellate cells[J]. J Hepatol, 2009, 50: 1102–1111. DOI:10.1016/j.jhep.2009.02.023 |
| [3] | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets[J]. J Cell Mol Med, 2006, 10: 76–99. DOI:10.1111/jcmm.2006.10.issue-1 |
| [4] | Dooley S, ten Dijke P. TGF-β in progression of liver disease[J]. Cell Tissue Res, 2012, 347: 245–256. DOI:10.1007/s00441-011-1246-y |
| [5] | Dooley S, Hamzavi J, Breitkopf K, et al. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats[J]. Gastroenterology, 2003, 125: 178–191. DOI:10.1016/S0016-5085(03)00666-8 |
| [6] | Mannaerts I, Leite SB, Verhulst S, et al. The Hippo pathway effector YAP controls mouse hepatic stellate cell activation[J]. J Hepatol, 2015, 63: 679–688. DOI:10.1016/j.jhep.2015.04.011 |
| [7] | Ge M, Liu H, Zhang Y, et al. The anti-hepatic fibrosis effects of dihydrotanshinone I are mediated by disrupting the Yes-associated protein and transcriptional enhancer factor D2 complex and stimulating autophagy[J]. Br J Pharmacol, 2017, 174: 1147–1160. DOI:10.1111/bph.13766 |
| [8] | Zhang H, von Gise A, Liu Q, et al. Yap1 is required for endothelial to mesenchymal transition of the atrioventricular cushion[J]. J Biol Chem, 2014, 289: 18681–18692. DOI:10.1074/jbc.M114.554584 |
| [9] | Narimatsu M, Labibi B, Wrana JL, et al. Analysis of Hippo and TGFβ signaling in polarizing epithelial cells and mouse embryos[J]. Differentiation, 2016, 91: 109–118. DOI:10.1016/j.diff.2016.01.003 |
| [10] | Wang C, Zhang L, He Q, et al. Differences in Yes-associated protein and mRNA levels in regenerating liver and hepatocellular carcinoma[J]. Mol Med Rep, 2012, 5: 410–414. |
| [11] | Chen MH, Chang SS, Dong B, et al. Ahmpatinin iBu, a new HIV-1 protease inhibitor, from Streptomyces sp. CPCC 202950[J]. RSC Adv, 2018, 8: 5138–5144. DOI:10.1039/C7RA13241G |
| [12] | Cao W, Li Y, Li M, et al. Txn1, Ctsd and Cdk4 are key proteins of combination therapy with taurine, epigallocatechin gallate and genistein against liver fibrosis in rats[J]. Biomed Pharmacother, 2017, 85: 611–619. DOI:10.1016/j.biopha.2016.11.071 |
| [13] | Gohda E, Nagahama J, Nakamura O, et al. Increased activities of liver cathepsins T and D in carbon tetrachloride-treated rats[J]. Biochim Biophys Acta, 1984, 802: 362–371. DOI:10.1016/0304-4165(84)90184-3 |
| [14] | Zhao SS, Wang JX, Wang YC, et al. Establishment and application of a high-throughput drug screening model based on COL1A1 promoter for anti-liver fibrosis[J]. Acta Pharm Sin (药学学报), 2015, 50: 169–173. |
| [15] | Yu DK, Zhang CX, Zhao SS, et al. The anti-fibrotic effects of epigallocatechin-3-gallate in bile duct-ligated cholestatic rats and human hepatic stellate LX-2 cells are mediated by the PI3K/Akt/Smad pathway[J]. Acta Pharmacol Sin, 2015, 36: 473–482. DOI:10.1038/aps.2014.155 |
| [16] | Moles A, Tarrats N, Morales A, et al. Acidic sphingomyelinase controls hepatic stellate cell activation and in vivo liver fibrogenesis[J]. Am J Pathol, 2010, 177: 1214–1224. DOI:10.2353/ajpath.2010.091257 |
| [17] | Liu PP, Liu HH, Sun SH, et al. Aspirin alleviates cardiac fibrosis in mice by inhibiting autophagy[J]. Acta Pharmacol Sin, 2017, 38: 488–497. DOI:10.1038/aps.2016.143 |
| [18] | Uemura M, Swenson ES, Gaca MD, et al. Smad2 and Smad3 play different roles in rat hepatic stellate cell function and alpha-smooth muscle actin organization[J]. Mol Biol Cell, 2005, 16: 4214–4224. DOI:10.1091/mbc.e05-02-0149 |
| [19] | Leto G, Tumminello FM, Pizzolanti G, et al. Cathepsin D serum mass concentrations in patients with hepatocellular carcinoma and/or liver cirrhosis[J]. Eur J Clin Chem Clin Biochem, 1996, 34: 555–560. |
| [20] | Kristensen DB, Kawada N, Imamura K, et al. Proteome analysis of rat hepatic stellate cells[J]. Hepatology, 2000, 32: 268–277. DOI:10.1053/jhep.2000.9322 |
| [21] | Moles A, Tarrats N, Fernandez-Checa JC, et al. Cathepsins B and D drive hepatic stellate cell proliferation and promote their fibrogenic potential[J]. Hepatology, 2009, 49: 1297–1307. DOI:10.1002/hep.22753 |
 2019, Vol. 54
2019, Vol. 54


