环糊精(cyclodextrin, CD)是由葡萄糖苷键连结成的一类具有疏水性空腔和亲水性外壳的环状化合物[1]。它可以将难溶性药物分子包裹在其空腔内形成包合物从而显著增加药物的溶解度[2]。药物与CD分子的包合过程存在一个动态平衡, 包合常数(K)能反映包合过程中药物与CD分子间结合力的强弱[3]。相溶解度法是K值的常用测定方法[4], K值越大, 则药物与CD之间越容易形成包合物, 且形成的包合物越稳定[5]。
近年来研究发现, CD在提高难溶性药物溶解度的同时, 常伴随着药物渗透性的下降, 从而部分甚至完全抵消了药物溶解度增加对药物口服吸收的贡献[6]。这是因为CD分子外壳呈亲水性, 难以透过胃肠道, 包合在CD空腔中的药物受CD渗透性低的影响渗透性也会降低[7, 8]。有研究表明, 在药物-CD包合物体系中加入一种物质作为竞争剂, 与药物竞争CD的疏水性空腔, 可使药物从空腔中置换出来, 增加游离药物的浓度, 提高药物渗透性[5]。尤其对于自身具有高渗透性的BCS Ⅱ类药物而言, 竞争剂的加入可显著改善CD渗透性低对药物口服吸收的不利影响。
Tokumura等[9]采用比格犬体内实验筛选出DL-苯丙氨酸作为竞争剂将氟桂利嗪从CD空腔中竞争出来, 增加其口服生物利用度。Tokumura等[10]证实桂利嗪作为竞争剂将氟比洛芬从CD空腔中竞争出来, 增加了小鼠的口服吸收。以上研究均采用整体动物实验, 存在操作繁琐、耗时等缺点, 不适合大量竞争剂的初步快速筛选。
本研究基于药物渗透性强则细胞摄取增强的原理, 采用相平衡溶解度法首先测定了药物与羟丙基倍他环糊精(hydroxypropyl-beta-cyclodextrin, HPCD)的K值[11]。选择K值大的桂利嗪(cinnarizine, CN)为竞争剂, K值小的香豆素6 (coumarin 6, C6)和9-十八烷基小檗碱(9-octadecane berberine, BD)分别作为模型药物, 与HPCD形成包合物。随后考察CN的加入是否影响Caco-2[12]和A549细胞对C6和BD的摄取, 以此验证体外细胞摄取作为竞争剂快速筛选方法的可行性。
材料与方法仪器 气浴恒温振荡器(THZ-82BA, 金坛市白塔金昌实验仪器厂); 磁力搅拌器(Big squid, 德国IKA公司); 荧光光谱仪(美国HORIBA Instruments squid公司); 双束可见紫外分光光度计(TU-1901, 北京普析通用仪器有限责任公司); 激光共聚焦显微镜(LSM 710, 德国Zessi公司)。
试剂 HPCD (西安德立化工有限公司); 9-十八烷基小檗碱(实验室自制); 桂利嗪(上海源叶生物科技有限公司); 甲醇(天津市大茂化学试剂厂); DMEM培养基(赛默飞世尔仪器有限公司); 胎牛血清(Thermo Scientific公司); 4%多聚甲醛固定液(广州永津生物科技有限公司); 二甲基亚砜(DMSO, 分析纯, 天津市致远化学试剂有限公司)。
细胞 Caco-2细胞(国家细胞库); A549细胞(中山大学实验动物中心)。
相溶解度法测定C6-HPCD、BD-HPC和CN-HPCD的包合常数 精密称取HPCD 10.001 3 g溶于蒸馏水中, 得到一系列不同浓度(4%、8%、12%、16%和20%)的HPCD溶液。取HPCD溶液各10 mL, 分别加入过量C6、BD和CN并置于25 ℃振荡器中振荡48 h, 静置24 h后取上清液用0.45 μm水系微孔滤膜过滤。C6-HPCD包合物的续滤液经乙醇稀释后用紫外分光光度法测定457 nm处的吸光度值, BD-HPCD包合物的续滤液用甲醇稀释后测定350 nm处的吸光度值, 而CN-HPCD包合物的续滤液则用DMSO稀释后于258 nm下测定吸光度。然后分别根据C6、BD和CN的标准曲线计算药物在相应浓度HPCD溶液中的溶解度。最后以HPCD浓度为横坐标, 药物溶解度为纵坐标绘制平衡相溶解度图, 计算C6、BD和CN与HPCD的K值[4]。计算公式为:
竞争剂对药物-HPCD包合物溶解度的影响 根据相溶解度实验中各药物K值大小, 选择K值较大的CN作为竞争剂。取C6-HPCD包合物溶液用蒸馏水稀释至质量浓度0.1和0.3 μg·mL-1溶液, 取BD-HPCD包合物溶液稀释至1和3 μg·mL-1溶液。随后各精密量取1 mL, 分别加入10 μL不同浓度(10、30、50和100 μg·mL-1)的CN DMSO溶液, 混匀, 以不加CN的空白组作为对照, 避光搅拌4 h。静置24 h后在15 000 r·min-1、4 ℃条件下离心15 min, 取上清液用0.45 μm微孔滤膜过滤, 所得续滤液经乙醇稀释10倍后测定C6 (激发波长467 nm, 发射波长500 nm)和BD (激发波长351 nm; 发射波长532 nm)的荧光强度, 根据标准曲线计算C6和BD-HPCD包合物溶液的溶解度。
细胞摄取
样品配制 将包合物母液用DMEM培养基稀释至质量浓度为0.1和0.3 μg·mL-1的C6-HPCD包合物溶液和质量浓度为1和3 μg·mL-1的BD-HPCD包合物溶液。然后将上述溶液分别与不同浓度(10、30、50和100 μg·mL-1) CN溶液按体积比100:1混合均匀, 平衡30 min[13], 以不加CN溶液的空白组作为对照。
激光共聚焦显微镜观察 分别将1 mL Caco-2细胞按每孔1×105个和1 mL A549细胞按每孔5×104个接种至激光共聚焦皿中, 孵育24 h使其贴壁生长后, 加入1 mL含药培养基继续孵育2 h。随后吸出培养基用磷酸盐缓冲液(PBS)洗涤3遍, 加4%多聚甲醛固定20 min, 再用冷PBS洗涤2遍后, 置于激光共聚焦显微镜下拍摄, 并采用Image J对每张图的荧光强度进行定量分析。
统计学方法 实验数据表示为x±s。统计分析采用IBM SPSS 25.0。统计学的显著、非常显著和极非常显著差异分别表示为P < 0.05、P < 0.01和P < 0.001。
结果 1 包合常数的测定由表 1可知, CN与HPCD的K值为826.7, 远大于89.7 (C6与HPCD)和42.6 (BD与HPCD)。K值大的药物更容易与环糊精形成包合物, 并且能竞争环糊精上的结合位点, 将K值小的药物置换出来。本文选择CN作为竞争剂(CN在其他研究中也常被用作竞争剂)[14], 考察其在HPCD体系中对C6和BD的竞争作用。
| Table 1 Inclusion constants (K) of coumarin 6 (C6), 9-octadecane berberine (BD) and cinnarizine (CN) with hydroxypropyl-beta- cyclodextrin (HPCD) |
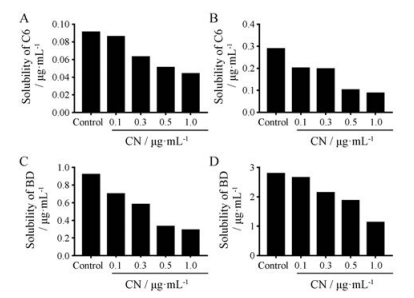
不同浓度CN对药物-HPCD包合物溶液中药物溶解度的影响如图 1所示。随着竞争剂CN浓度的增加, 药物-HPCD包合物体系中C6和BD两种药物的溶解度都呈浓度依赖性地下降。
|
Figure 1 The solubility of drugs in HPCD solution after adding different concentrations of CN. C6-HPCD solution containing 0.1 μg·mL-1 C6 (A) and 0.3 μg·mL-1 C6 (B); BD-HPCD solution containing 1 μg·mL-1 BD (C) and 3 μg·mL-1 BD (D) |
采用激光共聚焦显微镜观察CN的加入对两种细胞分别摄取包合物溶液中两种药物的影响。
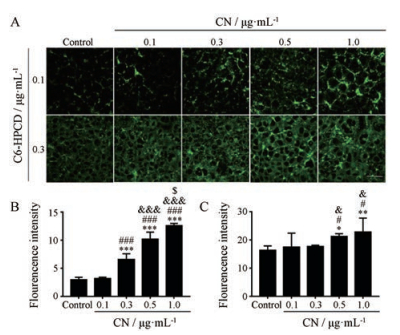
3.1 在Caco-2和A549细胞上CN对C6-HPCD中C6摄取的影响Caco-2细胞对不同浓度C6-HPCD溶液加入CN溶液后的摄取呈明显差异(图 2)。对照组中, 对高浓度(0.3 μg·mL-1) C6-HPCD溶液摄取明显增高, 在高、低浓度的C6-HPCD中加入不同浓度的CN后, Caco-2细胞对C6的摄取随CN浓度升高而增强(图 2A)。从荧光定量结果可知, 相较于低浓度(0.1 μg·mL-1) C6-HPCD溶液(图 2B), 随CN浓度的增加, Caco-2细胞对高浓度(0.3 μg·mL-1) C6-HPCD溶液中C6的摄取增强的现象不是很显著(图 2C)。
|
Figure 2 The effect of CN concentrations on uptake of C6 by Caco-2 cells in C6-HPCD solution. Imaging of C6 uptake by Caco-2 cells in C6-HPCD solution by laser confocal microscope (A); quantization analysis was performed on C6-HPCD solution containing 0.1 μg·mL-1 C6 (B) and 0.3 μg·mL-1 C6 (C). n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control; #P < 0.05, ###P < 0.001 vs 0.1 μg·mL-1 CN; & P < 0.05, & & & P < 0.001 vs 0.3 μg·mL-1 CN; $P < 0.05 vs 0.5 μg·mL-1 CN. Scale bar = 50 μm |
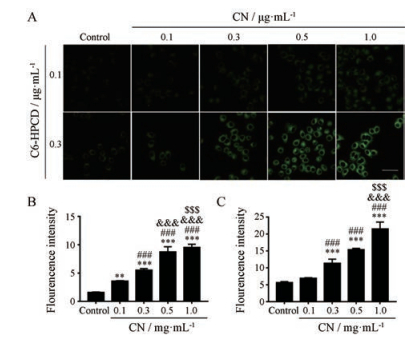
在A549细胞上, CN对C6-HPCD包合物摄取的影响(图 3A)与在Caco-2细胞上类似。稍有不同的是, 从定量结果可以看出(图 3B, C), 随CN浓度的升高, A549细胞对低浓度(0.1 μg·mL-1)或高浓度(0.3 μg·mL-1) C6-HPCD中C6的摄取均明显增强, 且呈现浓度依赖性。
|
Figure 3 The effect of CN concentrations on uptake of C6 by A549 cells in C6-HPCD solution. Imaging of C6 uptake by A549 cells in C6-HPCD solution by laser confocal microscope (A); quantization analysis was performed on C6-HPCD solution containing 0.1 μg·mL-1 C6 (B) and 0.3 μg·mL-1 C6 (C). n = 3, x±s. **P < 0.01, ***P < 0.001 vs control; ###P < 0.001 vs 0.1 μg·mL-1 CN; & & & P < 0.001 vs 0.3 μg·mL-1 CN; $$$P < 0.001 vs 0.5 μg·mL-1 CN. Scale bar = 50 μm |
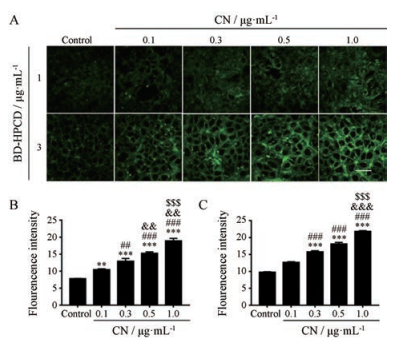
在Caco-2和A549细胞上CN的加入对BD-HPCD中BD摄取的结果见图 4、5。无论是低浓度(1 μg·mL-1)还是高浓度(3 μg·mL-1) BD-HPCD, 随CN浓度的增加, 两种细胞对BD-HPCD中BD的摄取都呈现出浓度依赖性增强。
|
Figure 4 Effect of CN with increasing concentrations on uptake of BD by Caco-2 cells in BD-HPCD solution. Imaging of BD uptake by Caco-2 cells in BD-HPCD solution by laser confocal microscope (A); quantization analysis was performed on BD-HPCD solution containing 0.1 μg·mL-1 C6 (B) and 0.3 μg·mL-1 C6 (C). n = 3, x±s. **P < 0.01, ***P < 0.001 vs control; ##P < 0.01, ###P < 0.001 vs 0.1 μg·mL-1 CN; & & P < 0.01, & & & P < 0.001 vs 0.3 μg·mL-1 CN; $$$P < 0.001 vs 0.5 μg·mL-1 CN. Scale bar = 50 μm |
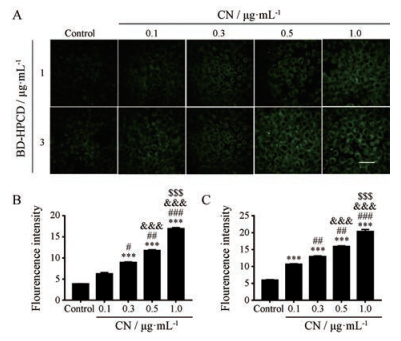
|
Figure 5 Effect of CN with increasing concentrations on uptake of BD by A549 cells in BD-HPCD solution. Imaging of BD uptake by A549 cells in BD-HPCD solution by laser confocal microscope (A); quantization analysis was performed on BD-HPCD solution containing 0.1 μg·mL-1 C6 (B) and 0.3 μg·mL-1 C6 (C). n = 3, x±s.***P < 0.001 vs control; #P < 0.05, ##P < 0.01, ###P < 0.001 vs 0.1 μg·mL-1 CN; & & & P < 0.001 vs 0.3 μg·mL-1 CN; $$$P < 0.001 vs 0.5 μg·mL-1 CN. Scale bar = 50 μm |
相溶解度的结果(图 1)显示, 由于包合物体系中加入的竞争剂CN竞争性地争夺药物-HPCD的结合位点, 随着平衡时间延长, 难溶性药物C6和BD从包合物溶液中析出, 导致溶解度降低。
细胞摄取实验结果(图 2)表明, 随着CN浓度的升高, C6-HPCD中更多的C6被置换出来并被摄取。结果(图 2A)显示, Caco-2细胞对高浓度(0.3 μg·mL-1) C6-HPCD溶液摄取明显增高, 可能是因为药物与HPCD的包合作用存在动态平衡, 高浓度中含游离药物多, 所以细胞摄取较多。荧光定量结果(图 2C)可能是因为0.3 μg·mL-1 C6-HPCD中游离C6浓度较高, 已经接近Caco-2细胞的饱和摄取水平, 所以随CN浓度的增加摄取增强的现象不是很明显。
结合相溶解度实验和细胞摄取实验结果, 随着竞争剂CN的加入, 药物-HPCD包合物中的C6和BD被包合常数更大的CN成功地从HPCD空腔中置换出来。相溶解度结果显示, CN加入后, 包合物溶液中C6和BD的溶解度均下降, 然而细胞摄取实验结果显示加入CN后增加了C6和BD的摄取, 这是因为溶解度实验只存在药物从包合物中游离的过程, 随着平衡时间延长, 难溶性的游离药物析出越多。而在细胞摄取实验中不仅存在药物的游离, 还存在细胞对药物的摄取过程, 即被竞争出的游离药物尚未析出就已经被细胞摄取了, 所以最终显示出CN提高包合物中药物渗透性的作用。由此可见, 细胞摄取是一个联动的测定药物渗透性的方法: CN将药物-HPCD包合物中的药物竞争游离出来, 随即被细胞摄取。与相溶解度实验相比, 本方法不仅能够体现竞争剂置换游离药物的能力, 还能评价细胞对游离药物的摄取, 即药物渗透性的大小, 增加了竞争剂筛选的准确性。本方法与离体灌肠或动物实验相比, 操作相对简单、实验周期短, 适合于研究初期对竞争性的快速筛选。
本文首次通过细胞摄取建立了环糊精包合物竞争剂筛选的方法。但本方法仅在两个细胞株及两个模型药物上显示了CN可以通过对药物-HPCD结合位点的竞争作用提高游离药物浓度从而增强细胞对药物的摄取(提高渗透性)。方法的可行性还需要在更多细胞株及更多药物和竞争剂中得到验证, 以及与体内方法进行比较, 从而对方法的可行性进行评估。值得注意的是, 实验所用的药物-HPCD包合物中药物的浓度及竞争剂的浓度均较低。在细胞摄取实验时发现包合物中药物浓度会影响竞争剂的竞争效果, 如在高浓度(0.3 μg·mL-1) C6-HPCD下, CN对C6在Caco-2细胞中的摄取影响较小。因此, 高浓度竞争剂针对高浓度包合物、低浓度竞争剂针对高浓度包合物以及高浓度竞争剂针对低浓度包合物的影响均值得进一步研究。此外, 本文所用的竞争剂CN是一种药物, 如果要扩大竞争剂的应用范围, 应该从辅料或添加剂中筛选有效的竞争剂, 并同时考虑竞争剂的药理作用、胃肠道稳定性及其可能与主药之间产生的相互作用等多种因素。
| [1] | Davis ME, Brewster ME. Cyclodextrin-based pharmaceutics:past, present and future[J]. Nat Rev Drug Discov, 2004, 3: 1023–1035. DOI:10.1038/nrd1576 |
| [2] | Del Valle EMM. Cyclodextrins and their uses:a review[J]. Process Biochem, 2004, 39: 1033–1046. DOI:10.1016/S0032-9592(03)00258-9 |
| [3] | Xu XY, Yun F, Di LQ, et al. Research progress in gastrointestinal transportation of cyclodextrin inclusion complex and its mechanism[J]. Chin Tradit Herb Drug (中草药), 2012, 43: 2062–2065. |
| [4] | Wu XF, Zheng XK, Yao HJ, et al. Inclusion constant of β-CD and paeonol measured by phase solubility method[J]. China J Chin Mater Med (中国中药杂志), 2005, 30: 501–503. |
| [5] | Thompson D, Larsson A. Modeling competitive guest binding to β-cyclodextrin molecular printboards[J]. J Phys Chem B, 2006, 110: 16640–16645. DOI:10.1021/jp062553n |
| [6] | Dahan A, Miller JM, Hoffman A, et al. The solubility-permeability interplay in using cyclodextrins as pharmaceutical solubilizers:mechanistic modeling and application to progesterone[J]. J Pharm Sci, 2010, 99: 2739–2749. DOI:10.1002/jps.22033 |
| [7] | Porat D, Dahan A. Active intestinal drug absorption and the solubility-permeability interplay[J]. Int J Pharm, 2017, 537: 84–93. |
| [8] | Dahan A, Miller JM. The solubility-permeability interplay and its implications in formulation design and development for poorly soluble drugs[J]. AAPS J, 2012, 14: 244–251. DOI:10.1208/s12248-012-9337-6 |
| [9] | Tokumura T, Nanba M, Tsushima Y, et al. Enhancement of bioavailability of cinnarizine from its β-cyclodextrin complex on oral administration with DL-phenylalanine as a competing agent[J]. J Pharm Sci, 2010, 75: 391–394. |
| [10] | Tokumura T, Muraoka A, Machida Y. Improvement of oral bioavailability of flurbiprofen from flurbiprofen/β-cyclodextrin inclusion complex by action of cinnarizine[J]. J Pharm Biopharm, 2009, 73: 202–204. DOI:10.1016/j.ejpb.2009.04.018 |
| [11] | Chen AJ, Liu M, Dong LN, et al. Study on the inclusion interaction of hydroxypropyl-β-cyclodextrin with three kinds of coumarins by phase solubility method (中国化学会成立80周年第十六届全国化学热力学和热分析学术会议论文集)[C]. Wuhan: Chinese Chemical Society, 2012: 1-2. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGHY201210006218.htm |
| [12] | Yang HT, Wang GJ. Caco-2 cell monolayers model and its application in pharmacy[J]. Acta Pharm Sin (药学学报), 2000, 35: 797–800. |
| [13] | Tang C, Qian Z, Huang Y, et al. A fluorometric assay for alkaline phosphatase activity based on β-cyclodextrin-modified carbon quantum dots through host-guest recognition[J]. Biosens Bioelectron, 2016, 83: 274–280. DOI:10.1016/j.bios.2016.04.047 |
| [14] | Muraoka A, Tokumura T, Machida Y. In-vitro evaluation of cinnarizine as a competing agent to β-cyclodextrin inclusion complexes:effect of cinnarizine on the membrane permeation rate of progesterone from its β-cyclodextrin inclusion complex[J]. Yakugaku Zasshi, 2008, 128: 89–95. DOI:10.1248/yakushi.128.89 |
 2019, Vol. 54
2019, Vol. 54


