2. 中国药科大学, 江苏 南京 210009;
3. 美国普霖斯通制药公司, 美国 新泽西 08512
2. China Pharmaceutical University, Nanjing 210009, China;
3. Prinston Pharmaceutical, New Jersey 08512, US
溶解度是小分子化学药物的一个重要物理性质。首先, 溶解度对药物在人体内溶解、吸收的动力学有重要的影响[1], 其次, 溶解度对开发药物口服固体制剂体外溶出度方法, 尤其是开发对药物体内释放和吸收有指导意义的溶出度方法具有非常重要的影响。
盐酸奈必洛尔(nebivolol hydrochloride, NBL, 图 1)是美国FDA2007年批准上市的第三代β受体阻滞剂。为了选择溶解度接近漏槽条件下限的溶出介质从而为研发NBL仿制药建立有区分性的溶出度方法, 本文研究了NBL在不同pH、不同卤盐及不同盐浓度下的溶解度, 并发现了一些值得进一步研究的现象。
|
Figure 1 Nebivolol hydrochloride (NBL) |
药品 NBL (纯度100.0%, 华海药业股份有限公司, 批号: D5283-16-002);奈必洛尔仿制药(上海普霖贝利生物医药研发有限公司, 20 mg, 批号: PB-1603-18002);参比制剂(美国Forest Pharmaceuticals公司, 20 mg, 批号: W00849);盐酸、NaCl、NaBr (分析纯, 国药集团化学试剂有限公司); NaI (分析纯, 上海阿拉丁生化科技股份有限公司); 磷酸、甲醇(色谱纯, 霍尼韦尔中国有限公司); 纯化水采用ELGA水纯化系统(英国ELGA公司)制得。
仪器 Bluepard® THZ-300/300C型恒温培养摇床; 1260 series高效液相色谱仪、Cary 60紫外分光光度计(美国安捷伦公司); Sciex API 4000质谱仪(美国AB公司)。
溶解度测定 采用高效液相色谱法测定NBL在37 ℃下饱和溶解度。色谱柱为Waters Atlantis® T3, C18 (50 mm×4.6 mm, 5 µm), 流动相为乙腈(含0.1%甲酸): H2O (含5 g·L-1甲酸铵和0.1%甲酸) (40:60), 流速为1.0 mL·min-1, 柱温45 ℃, 检测波长280 nm, 进样量20 µL。在纯化水加入适量盐酸和规定量的盐(NaCl、NaBr、NaI或KCl)后配制成不同pH值和不同盐浓度的溶剂, 并用pH计测定pH值。加入NaI的溶剂在放置24 h后溶液呈微黄色。将过量NBL (粉末状)加入含有25 mL溶剂的50 mL量瓶中(每个pH值条件下的样品制备两份), 放入恒温培养摇床在37 ℃条件下以180 r·min-1速度振摇(托盘振幅为20 mm)。24 h后取出并用手摇晃数秒, 移取约8 mL混合物至10 mL塑料离心管中, 在37 ℃高速离心(10 000 r·min-1) 10 min, 取2 mL上清液加入已含有2 mL稀释液的5 mL塑料样品管中(稀释液为甲醇和水的混合物, 其比例为7:3), 封口, 手摇使内容物混合均匀。取适量的样品液放入HPLC小瓶内, 采用外标法定量并计算溶解度。10 mL塑料离心管中剩余的上清液用于测定每个饱和溶液的pH值。
体外溶出度实验 按照《中国药典》2015年版溶出度与释放度测定法第二法(桨法)装置, 以pH 1.2盐酸(含有0.034 mol·L-1 NaCl) 900 mL为溶出介质, 转速50 r·min-1, 温度(37±0.5) ℃。用紫外分光光度计检测NBL溶出度, 检测波长为280 nm。
体内生物等效性试验 体内生物等效性试验方案经伦理委员会审查批准并得到受试者知情同意。血浆中奈必洛尔浓度采用LC-MS/MS方法进行定量分析, 色谱柱为Phenomenex Kinetex Biphenyl (50 mm×3.0 mm, 2.6 µm)。40例健康的受试者被随机地分为人数相同的两组。奈必洛尔仿制药(A)和参比制剂(B)在双盲情况下分别给这两组健康的受试者在空腹状态下服用。一个组内的每个受试者按AB顺序先服用A 1片再服用B 1片, 在服用这两片药片之间有一个为期两周的清洗期; 另一个组内每个受试者按BA顺序先后服用B和A各1片, 在服用这两片药片之间同样有一个为期两周的清洗期。在本文中, 受试者服用仿制药时称为Treatment A, 而服用参比制剂时称为Treatment B。于服药后0、0.25、0.5、0.75、1、1.25、1.5、1.75、2、2.5、3、3.5、4、5、6、8、12、16、24、36、48和72 h取血。采用内标法定量, 以奈必洛尔-d4为内标, 在25 ℃柱温条件下进行梯度洗脱。
受试者年龄23~64岁, 身高151.1~192.6 cm, 体重50~100.4 kg, 身体质量指数(BMI) 20.8~29.8。受试者中白人21人, 黑人9人, 西班牙裔6人, 其余为亚裔。因第26号受试者退出了此项试验, 故共有39例受试者的数据用于体内生物等效性的研究。
结果与讨论 1 盐酸奈必洛尔在不同pH值、不同卤盐及不同浓度的介质中的溶解度 1.1 不同pH值的水中盐酸奈必洛尔的溶解度奈必洛尔在水中的溶解度很低, 只有0.040 3 mg·mL-1[2]; 与盐酸反应生成NBL在水中的溶解度上升, 文献[3]中报道的值为0.761 mg·mL-1, 增加了近20倍。通常的解释是:奈必洛尔极性不强, 形成盐酸盐后, 分子的极性增加, 从而易于溶解在极性溶剂水中。采用“成盐”的方法可增加难溶的弱碱性药物分子的溶解度[4]。在37 ℃条件下, 测得NBL在水里的溶解度为1.5 mg·mL-1, 约为文献中报道数值的2倍。这个差别应是温度造成的。向水里加盐酸使其pH值从中性降低到酸性或强酸性后, 测得NBL的溶解度随着pH值的降低而降低(表 1和图 2)。经典溶解度的理论可以解释表 1中溶解度的变化趋势: NBL分子里含有氯离子, 而盐酸分子里也含有氯离子。当加入较多盐酸而使溶剂(水)的pH值降低时, 溶剂里的氯离子增多。同离子效应发挥作用, 溶剂中过多的氯离子促使溶解平衡向溶解的逆方向移动, 从而抑制了NBL分子的溶解。因此, 水里添加的盐酸越多, NBL的溶解度越低。
| Table 1 Solubility of NBL in different pH at 37 ℃. a: The pH of solvent in the absence of NBL. The pH was adjusted using hydrochloric acid; b: The pH of the supernatant of the mixture of the solvent and NBL (in excess) after being shaken mechanically at 37 ℃ for 24 hours; c: This is the pH of purified water generated in analytical lab and no hydrochloric acid was added. Unless otherwise stated in this paper, the solubility values are raw data without being rounded. These individual values may reflect variability of the determination of the solubility. The number of decimal places does not reflect the number of significant figures. For example, 1.515 does not mean the number of significant figures is four |

|
Figure 2 Average solubility of NBL in different pH at 37 ℃ |
按美国药典配制的模拟胃液(不含胃蛋白酶)的pH值约为1.2。此介质含有0.034 mol·L-1 NaCl。NBL在此介质中的溶解度为0.073 mg·mL-1, 低于pH 1.2 (不含NaCl)时NBL的溶解度(0.100 mg·mL-1)。表 2和图 3显示, 在pH 1.2条件下, NaCl的浓度越高, NBL的溶解度越低。
| Table 2 Solubility of NBL at pH 1.2 in the presence of different concentration of sodium chloride at 37 ℃. a: The pH of solvent in the absence of NBL. The pH was adjusted using hydrochloric acid; b: The pH of the supernatant of the mixture of the solvent and NBL (in excess) after being shaken mechanically at 37 ℃ for 24 hours |

|
Figure 3 Average solubility of NBL at pH 1.2 in the presence of different concentration of NaCl at 37 ℃ |
用同离子效应亦可解释NBL的溶解度变化趋势。而一些弱碱性的药物分子的溶解度随着pH值降低而降低、随着溶液中氯离子浓度的升高而降低的实验数据早已发表。例如, 在pH 3.1~1.1区间, 盐酸氟哌啶醇(haloperidol hydrochloride)的溶解度随pH值降低而降低[5]; 在pH 3.45~0.90区间, 盐酸非那吡啶(phenazopyridine hydrochloride)的溶解度随着pH值降低而降低[6]。而Streng等[7]曾在1984年报道,在NaCl和HCl的双重影响下一些弱碱性药物分子溶解度降低的现象。值得注意的是, Streng在讨论观察到的结果时较为严谨, 没有将溶解度降低的现象称为同离子效应, 但其他文献[8, 9]在提及同离子效应时引用了此文结果。
举例说明同离子效应一词中“同离子”这个概念。当AgCl溶解在水中并达到平衡后, 其状态可用下式表示:
| $ \text{AgCl}\rightleftharpoons \text{A}{{\text{g}}^{\text{+}}}+\text{C}{{\text{l}}^{-}} $ | (1) |
式中的氯离子来自于溶解的氯化银。如果向(1)式表示的已达到平衡的体系中加入此体系已含有的组分, 例如通过加入NaCl而引入Cl-, 则加入的氯离子使平衡向其左侧移动, 这个使平衡发生移动的现象称为“同离子效应”; 如果向(1)式表示的已达到平衡的体系中加入此体系未含有的组分, 例如加入含有溴离子的盐NaBr而使平衡发生了某种变化, 其效应不应称为“同离子效应”。溴离子和氯离子有其共同点, 二者皆为阴离子。就其所带电荷而言, 溴离子和氯离子都是(1)式中Ag+的“反离子” (counterion)。但溴离子与氯离子不是严格意义上的同离子。加入溴离子对(1)式所产生的任何效应, 不应视为同离子效应。
1.3 pH 2.0条件下卤离子浓度不同时盐酸奈必洛尔的溶解度为了探究“同离子效应”是否是造成NBL溶解度降低的驱动力, 使用盐酸将水的pH值调至2.0, 然后分别加入不含氯离子的NaBr和NaI, 实验结果见图 4A。在pH 2.0条件下, 只要加入盐, 即使所加的盐里不含氯离子而含溴离子或碘离子, NBL的溶解度皆降低。

|
Figure 4 Solubility of NBL at pH 2.0 (A), pH 3.0 (B), and pH 3.0 (adjusted with phosphoric acid, C) in the presence of sodium halide at 37 ℃ |
在pH 3.0条件下添加盐和不添加盐时的溶解度见图 4B。加入NaBr或NaI同样使NBL溶解度降低。由此可见, 来自NaCl的氯离子不是造成NBL溶解度降低的唯一驱动力。
1.5 以磷酸调节pH时卤盐浓度对盐酸奈必洛尔溶解度的影响磷酸是实验室常用的酸化剂。用磷酸来替代盐酸调节介质的pH值并且以卤化钠作为添加剂时, 亦出现溶解度降低的现象。pH 3.0条件下不同盐浓度时NBL的溶解度见图 4C。
1.6 同离子效应不是NBL溶解度降低的真正驱动力、至少不是唯一驱动力经典溶解度理论中的一些概念(如离子强度、卤离子的离子半径、极化率等)或盐析可以定性地解释本文中NBL溶解度随着盐的浓度增加而降低的现象。此外, 当NaCl被NaBr或NaI替代时, 0.05 mol·L-1溴盐导致溶解度降低的幅度大于0.05 mol·L-1氯盐, 其原因可能是溴离子的离子半径比氯离子大, 相同摩尔浓度的溴离子对溶剂化的溶质分子周围的溶剂分子的竞争力强于氯离子。0.05 mol·L-1碘盐引起的溶解度降低幅度与0.05 mol·L-1溴盐导致的降低幅度相似, 其原因可能是碘离子的离子半径虽然比溴离子更大, 但碘离子的极化率高于溴离子, 对溶剂化的溶质分子周围的溶剂分子产生的影响比溴离子弱。因此, 用等摩尔的碘盐替代溴盐没有引起NBL溶解度进一步降低。
NBL在介质中的溶解度至少受下列因素的影响: NBL的晶格能、盐的阳离子和盐的阴离子的溶剂化能等。介质中各种离子的存在不可避免地影响了溶质分子的溶剂化能。当NBL在介质中的溶解度达到饱和时,
| $ {E_{{\rm{液}}}} = {E_{{\rm{固}}}} $ |
式中E液是包含介质、卤离子等在内的液相的能量, E固是由NBL分子组成的固相的能量。这个等式决定了介质中NBL的溶解度。如果向介质中加入氯离子、溴离子或碘离子引起介质的物理性质发生变化(如引起液相中溶质分子的溶剂化能发生变化等), 则NBL在此介质中的溶解度将不可避免地改变。将加入氯离子而使NBL溶解度降低的现象(图 3)与加入溴离子、碘离子而使NBL溶解度降低的现象(图 4)相比, 可见氯化钠的作用与溴化钠、碘化钠的作用类似:对已溶解于介质中的NBL分子产生盐析效应。由此可见, 氯离子的同离子效应不是NBL溶解度降低的真正驱动力, 至少不是NBL溶解度降低的唯一驱动力。曾有研究者在同一篇文献中用氯化钠的盐析效应和氯离子的同离子效应来解释某些药物分子溶解度降低、盐析常数增加的现象[10]。如果将本文中氯离子浓度增加造成NBL溶解度降低的现象称为“同离子效应”, 则此效应仍属于卤离子盐析效应的范畴, 即卤离子族中氯离子的盐析效应。近年来, 将盐析用于药物合成的后处理步骤以便降低产物溶解度、提高萃取的得率亦有新进展[11]。
2 盐酸奈必洛尔的体外溶出曲线和空腹体内血药浓度-时间曲线 2.1 盐酸奈必洛尔仿制药和参比制剂在pH 1.2介质中溶出度曲线测定NBL的溶解度和理解卤离子的盐析效应不是本文的最终目的。其目的是利用卤离子的盐析效应将NBL在酸性介质中的溶解度降低到漏槽条件下限以便找到具有适当区分性的溶出度方法。而有适当区分性的溶出度方法一般是指含有相同原料药但处方或工艺不同的制剂成品在用该方法检测溶出度时, 其溶出曲线表现出差异。NBL是BCS Ⅱ类药物。开发固体口服制剂体外溶出度方法时, 所使用的介质不宜是此药物的优良溶剂亦不宜是此药物的不良溶剂。否则, 药物分子在前一种情形下溶出太快从而使溶出度方法失去必要的区分性; 而在后一种情形下药物有效成分几乎不溶出因此无法为制剂处方研发者提供必要的溶出度信息。在开发NBL仿制药的过程中, 需要寻找有适当区分性的溶出介质。通过调节pH和加入盐, 有目的地将NBL的溶解度降低到漏槽条件的下限(即饱和溶液所需介质体积的3倍左右)[12], 并在这样的介质中将仿制药的溶出行为与参比制剂的溶出行为进行比较。
胃液pH值一般在1~3之间, 0.01 mol·L-1盐酸介质的pH大约在此范围的中点[13-15]。在进行溶出度实验时, 0.01 mol·L-1盐酸介质900 mL可以溶解至少15片NBL (20 mg/片)。而用盐酸将pH值调节至1.2并加入NaCl使其浓度达到0.034 mol·L-1后, 900 mL介质只能溶解大约3片NBL (即漏槽条件的下限)。在此介质中, NBL产品开发阶段的两个处方与参比制剂的溶出曲线见图 5A。FDA有关指导原则推荐使用相似因子(f2)评价仿制药与参比制剂的溶出度差异[16]。f2 > 50时, 两条溶出曲线为相似。通过计算, 仿制药处方1与参比制剂溶出曲线f2为37, 而仿制药处方2与参比制剂溶出曲线f2为49。二者的f2均小于50, 故两种处方与参比制剂溶出行为不相似。仿制药处方3和参比制剂溶出曲线的对比见图 5B。二者的溶出行为相似。

|
Figure 5 Dissolution profiles (dissolution parameters: pH 1.2 buffer containing 0.034 mol·L-1 NaCl, 900 mL; paddle, 50 r·min-1). A: Comparison of reference listed drug (RLD) with formulations 1 and 2; B: Comparison of RLD with formulation 3 |
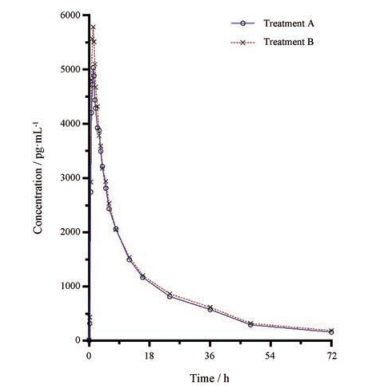
当使用仿制药处方3进行人体生物等效性试验时, 空腹条件下的试验数据符合体内生物等效的接受标准(图 6和表 3), 从而证明了空腹条件下此处方和参比制剂生物等效。图 6与图 5B之间似乎呈现某种程度的相关。若要得到更可靠的结论, 还需要进行体外体内相关性的研究和分析。
|
Figure 6 Profiles of average concentration of plasma nebivolol vs time under fasting condition (0-72 h). Treatment A denotes the generic drug while Treatment B denotes reference listed drug |
| Table 3 Bioequivalence analysis results for plasma nebivolol (Treatment A vs Treatment B under fasting condition). *Presented as median; **Presented as arithmetic mean |
溶解度数据是开发具有适当区分性溶出度方法的重要信息。本文中NBL在不同pH值、不同盐浓度条件下溶解度的变化趋势提供了酸性条件下调节溶解度使之接近漏槽条件下限的有效途径, 使研发人员较为迅速地确定了具有适当区分性的体外溶出介质, 缩短了空腹条件下与参比制剂体内生物等效的仿制药产品开发的时间。在开发具有适当区分性的溶出度方法时, 漏槽条件的下限是一个值得重视和利用的条件。这是因为药物分子在介质中的溶解度越高, 制剂中药物分子的溶出速度越快, 则越容易削弱溶出度方法的区分性。如果药物有效成分是弱碱的盐酸盐且其溶解度在酸性介质中较高而造成介质的区分性较弱时, 可考虑本文介绍的“盐析”方法(即加入适量的盐)将该药物在酸性介质中的溶解度调控到漏槽条件的下限。毋庸讳言, 对不同处方有区分性的溶出介质不一定能预测这些处方中的药物在体内溶出或吸收的快慢。但是, 在具有区分性的溶出介质中观察到相似或不相似的溶出曲线时, 这些溶出行为对仿制药的研发有一定的参考价值。
| [1] | Huang Y, Zhan XC, Lv FJ, et al. Air humidity solubility assay[J]. Acta Pharm Sin (药学学报), 2016, 51: 1472–1475. |
| [2] | Nemichand SK, Laxman SD. Solubility enhancement of nebivolol by micro emulsion technique[J]. J Young Pharm, 2016, 8: 356–367. DOI:10.5530/jyp |
| [3] | Avachat A, Raut V. Solubility and dissolution enhancement of nebivolol hydrochloride using hydrophilic carriers[J]. Asian J Pharm Sci, 2012, 7: 337–345. |
| [4] | Sweetana S, Akers MJ. Solubility principles and practices for parenteral drug dosage form development[J]. Pda J Pharm Sci Technol, 1996, 50: 330–342. |
| [5] | Li S, Wong SM, Sethia S, et al. Investigation of solubility and dissolution of a free base and two different salt forms as a function of pH[J]. Pharm Res, 2005, 22: 628–635. DOI:10.1007/s11095-005-2504-z |
| [6] | Serajuddin ATM, Jarowski CI. Effect of diffusion layer pH and solubility on the dissolution rate of pharmaceutical bases and their hydrochloride salts Ⅰ:Phenazopyridine[J]. J Pharm Sci, 1985, 74: 142–147. DOI:10.1002/jps.2600740208 |
| [7] | Streng WH, Hsi SK, Helms PE, et al. General treatment of pH-solubility profiles of weak acids and bases and the effects of different acids on the solubility of a weak base[J]. J Pharm Sci, 1984, 73: 1679–1684. DOI:10.1002/jps.2600731203 |
| [8] | Serajuddin ATM. Salt formation to improve drug solubility[J]. Adv Drug Deliv Rev, 2007, 59: 603–616. DOI:10.1016/j.addr.2007.05.010 |
| [9] | Pudipeddi M, Serajuddin A, Grant D, et al. Solubility and dissolution of weak acids, bases, and salts[M]//Stahl PH, Wermuth CG. Handbook of Pharmaceutical Salts Properties, Selection, and Use. Zürich: Wiley-VCH, 2008: 19-40. |
| [10] | Miyazaki S, Inoue H, Nadai T, et al. Solubility characteristics of weak bases and their hydrochloride salts in hydrochloric acid solutions[J]. Chem Pharm Bull, 1979, 27: 1441–1447. DOI:10.1248/cpb.27.1441 |
| [11] | Hyde AM, Zultanski SL, Waldman JH, et al. General principles and strategies for salting-out informed by the hofmeister series[J]. Org Process Res Dev, 2017, 21: 1355–1370. DOI:10.1021/acs.oprd.7b00197 |
| [12] | United State Pharmacopeia 37, especially the sink conditions as defined in subsection entitled Medium in <1092>[S]. Rockville: United States Pharmacopeial Convention, 2014. |
| [13] | Lindahl A, Ungell AL, Knutson L, et al. Characterization of fluids from the stomach and proximal jejunum in men and women[J]. Pharm Res, 1997, 14: 497–502. DOI:10.1023/A:1012107801889 |
| [14] | Hörter D, Dressman JB. Influence of physicochemical properties on dissolution of drugs in the gastrointestinal tract[J]. Adv Drug Deliv Rev, 2001, 46: 75–87. DOI:10.1016/S0169-409X(00)00130-7 |
| [15] | Bakatselou V, Oppenheim RC, Dressman JB. Solubilization and wetting effects of bile salts on the dissolution of steroids[J]. Pharm Res, 1991, 8: 1461–1469. DOI:10.1023/A:1015877929381 |
| [16] | FDA. Guidance for Industry:Bioavailability and Bioequivalence Studies for Orally Administered Drug Products-General Considerations[M]. Rockville: Food and Drug Administration, 2003. |
 2019, Vol. 54
2019, Vol. 54


