索拉非尼(sorafenib, SFN)是口服多激酶抑制剂, 具有双重的抗肿瘤作用, 既可阻断RAF/MEK/ERK介导的细胞信号传导通路而直接抑制肿瘤细胞的增殖, 又可抑制VEGF和血小板衍生生长因子(PDGF)受体而阻断肿瘤新生血管形成, 间接抑制肿瘤细胞的生长[1-3]。临床上主要用于包括肝癌、肾癌及胃癌等多种肿瘤的治疗[4-6]。目前有关SFN给药系统的研究主要集中在固体脂质纳米粒、纳米乳、胶束和微球等[7-10]。已有研究表明, SFN与其他抗肿瘤药物联合使用, 如与多柔比星、尼洛替尼、培美曲塞和顺铂等可提高其抗肿瘤效果[11-14]。
SFN的用药形式为甲苯磺酸盐, 属于BCS Ⅱ类药物[15], 具有较好的渗透性, 但在水中溶解度差, 口服生物利用度低。因此, 增加SFN溶解度和溶出度对提高SFN口服生物利用度具有重要的作用。本课题组前期构建索拉菲尼纳米骨架给药系统[sorafenib loaded nanomatrix drug delivery system (MSNM@SFN)][16], 可增加SFN的溶解度与溶出度, 进而提高其口服生物利用度, 显示出良好的体内外抗乳腺肿瘤的作用, 但该MSNM@SFN对转移性乳腺癌的抗肿瘤作用较差。
非甾体抗炎药在临床上广泛应用于止痛、解热和抗炎等症状, 其主要作用靶点是环氧化酶(COX), 包括与体内稳态相关的COX-1亚型和与炎症反应、肿瘤发展密切相关的COX-2亚型[17]。部分临床前研究和临床研究表明, 非甾体抗炎药物与抗肿瘤药物联用, 可显著提高抗肿瘤疗效[18, 19], 显示出非甾体抗炎药物潜在的应用价值。氟灭酸(flufenamic acid, FFA)是一种非甾体抗炎药, 其解热消炎效果强于阿司匹林, 临床上主要用于类风湿关节炎的治疗, 有研究报道FFA能够降低肿瘤侵袭能力、抑制肿瘤生长和转移[20]。因此, 将MSNM@SFN与FFA联合使用, 即将FFA抗肿瘤侵袭和转移的作用与MSNM@SFN抗乳腺肿瘤的作用结合, 以期产生抗转移性乳腺肿瘤的疗效。
考虑到MSNM@SFN与FFA的联用与常规的药物联用不同, MSNM@SFN是具有增溶SFN的效果, 若联合使用的FFA对该SFN的增溶效果产生影响, 将极有可能影响SFN的药效。因此, 本文考察了FFA对MSNM@SFN中SFN的溶解度、溶出度和药动学行为的影响, 以确保这种联合使用对MSNM@SFN没有影响。
材料与方法材料与药品 索拉非尼甲苯磺酸盐(sorafenib tosylate, 上海迈瑞尔化学技术有限公司, 纯度99%); 对照品经无水甲醇多次重结晶获得; FFA (北京百灵威科技有限公司); 介孔二氧化硅纳米骨架材料(Sylysia®350, Sylysia, 日本Fuji Silysia有限公司); 羟丙甲基纤维素(hydroxypropyl methylcellulose, HPMC, 天津化学有限公司); 二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000 (DSPE-PEG2000, 日本NOF公司); 其他试剂为分析纯或色谱纯。
主要仪器 BT-9300H激光粒度分布仪(丹东市百特仪器有限公司); RigakuDmax/2400仪(D/MAX-2000 X, 日本Rigaku公司); Q 100 V 9.8 Build 296差示扫描量热法分析仪(美国Thermal Analysis公司); 高效液相色谱仪(日本岛津公司); pH/ACT计(德国赛多利斯公司)。
实验动物 SD大鼠, 雌性, 体重(200±10) g, 由北京大学医学部实验动物中心提供, 饲养环境为:温度20~25 ℃, 相对湿度50%~60%, 自然光照明, 自动饮水, 给予固体饲料, 笼具定时清洗, 消毒。SD大鼠在灌胃给药前一晚禁食过夜。动物实验均按照国际动物实验指导原则进行。
索拉非尼纳米骨架给药系统(MSNM@SFN)的制备 采用溶剂蒸发法制备MSNM@SFN, 无水甲醇溶解SFN, 其他材料用二氯甲烷溶解或分散[16]。在磁力搅拌的条件下, 将适量SFN溶液逐滴加入到适量Sylysia分散液中, 超声30 min; 再将适量HPMC分散液逐滴加入到SFN-Sylysia混合液中, 室温下恒速搅拌24 h后, 40 ℃下减压旋蒸除去溶剂。取适量的DSPE-PEG2000溶液溶解上述混合物后, 超声30 min, 40 ℃下减压旋蒸除去溶剂, 即得到产物MSNM@SFN。处方比例为SFN:Sylysia:HPMC:DSPE-PEG2000 = 1:3:3:3 (w/w/w/w)。
索拉非尼纳米骨架给药系统联合氟灭酸(MSNM@SFN&FFA) 的制备将MSNM@SFN与FFA按照SFN:FFA = 4:1 (w/w)的比例混合均匀, 得索拉非尼纳米骨架给药系统联合氟灭酸(MSNM@ SFN & FFA)。
MSNM@SFN&FFA粒径的测定 取适量MSNM@ SFN & FFA, 加蒸馏水分散均匀, 室温条件下, 采用激光粒度分布仪对MSNM@SFN&FFA的粒径进行测定。
粉末X-ray衍射(powder X-ray diffraction, PXRD)测定MSNM@SFN&FFA 采用RigakuDmax/2400仪, 设定参数为: Cu-Kα radiation (λ = 1.541 nm), 电压40 kV, 电流100 mA, 对MSNM@SFN&FFA进行测定, 2θ扫描范围为3~40°, 扫描速度为4°·min-1。
差示扫描量热法(differential scanning calorimetry, DSC)测定MSNM@SFN&FFA 采用DSC分析仪对MSNM@SFN&FFA进行测定, 温度范围: 10~170 ℃, 升温速率: 10 ℃·min-1。
MSNM@SFN&FFA中SFN溶解度的测定 将过量SFN的MSNM@SFN&FFA分别放置于pH 1.2、5.0、6.8、7.4磷酸盐缓冲液(phosphate buffered saline, PBS)和去离子水中, 在37 ℃水浴条件下震荡48 h。10 000 r·min-1离心后, 将所得上清液过滤, 收取续滤液, 采用HPLC法测定MSNM@SFN&FFA中SFN的溶解度。
MSNM@SFN&FFA中SFN体外的溶出 取含3.0 mg SFN的MSNM@SFN&FFA, 分别置于含0.1% Tween-80的人工胃液(pH 1.2)或含0.1% Tween-80的人工肠液(pH 6.8)溶出介质600 mL, 在0、2、5、12、20、40和60 min取样, HPLC法测定SFN浓度。
大鼠体内药动学 SD大鼠6只, 分别按照SFN剂量20 mg·kg-1, 灌胃给予MSNM@SFN&FFA, 于0、0.5、1、2、4、6、8、9、10、12和24 h时间点取血约0.5 mL, 10 000 r·min-1离心5 min, 收集血清0.1 mL, 加无水甲醇0.4 mL沉淀蛋白, 10 000 r·min-1离心10 min, 取上清0.3 mL, 氮气吹干, 加入无水甲醇0.1 mL超声复溶, 取样品20 μL, 采用HPLC法进行测定。绘制血药浓度-时间曲线。采用WinNonlin version 3.1 (Pharsight Corp., Mountain View, CA)软件非房室模型计算药动参数。
HPLC测定色谱条件 色谱柱: Epic C 18, 5 μm, 120 A, 250 mm × 4.6 mm; 流动相:甲醇-乙腈-1%醋酸(38:35:27, v/v/v); 检测波长: 265 nm; 柱温: 40 ℃; 流速: 1 mL·min-1; 进样量: 20 μL。
统计学方法 所有数据用x±s表示。采用单因素方差分析(ANOVA), 经过Bonferroni校验, P < 0.05认为有显著性差异。
结果 1 MSNM@SFN和MSNM@SFN&FFA的制备采用溶剂挥发法制备MSNM@SFN, SFN以无定型状态分散于MSNM@SFN之中, MSNM@SFN为白色固体。按照SFN:FFA = 4:1 (w/w)比例, 将MSNM@SFN和FFA进行混合, 得白色固体状物质MSNM@SFN&FFA。由于MSNM@SFN中, SFN:Sylysia:HPMC:DSPE-PEG为1:3:3:3 (w/w/w/w), 而MSNM@SFN&FFA中, SFN:FFA为4:1 (w/w)。因此, MSNM@SFN&FFA中, MSNM@SFN:FFA为40:1 (w/w)。
2 MSNM@SFN&FFA的粒径MSNM@SFN及MSNM@SFN&FFA的粒径测定结果见表 1。由表中可见, MSNM@SFN的粒径为(5.30±0.08) μm, MSNM@SFN&FFA的粒径为(5.43±0.02) μm, 两者结果相近, 说明加入FFA对MSNM@SFN的粒径几乎不产生任何影响。
| Table 1 The particle size of sorafenib (SFN) loaded nanomatrix drug delivery system (MSNM@SFN) and MSNM@SFN&FFA (n = 3, x±s). FFA: Flufenamic acid |
MSNM@SFN及MSNM@SFN&FFA的粉末X-ray衍射测定结果见图 1。由图可见, MSNM@SFN无明显结晶衍射峰, 呈无定型状态。FFA具有两个明显的结晶衍射峰(2θ分别为24.52°和30.84°)。MSNM@ SFN & FFA无明显结晶衍射峰, 呈无定型状态。说明FFA对MSNM@SFN的结晶性几乎不产生任何影响。
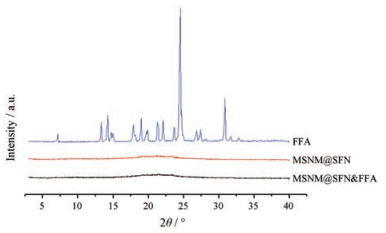
|
Figure 1 The powder X ray diffraction (PXRD) patterns of FFA, MSNM@SFN and MSNM@SFN&FFA |
MSNM@SFN及MSNM@SFN&FFA的DSC测定结果见图 2。由图可见, MSNM@SFN无明显吸热峰, 呈无定型状态。FFA具有1个明显的吸热峰(134.48 ℃)。MSNM@SFN&FFA无明显吸热峰, 呈无定型状态。说明FFA对MSNM@SFN的结晶性几乎不产生任何影响。
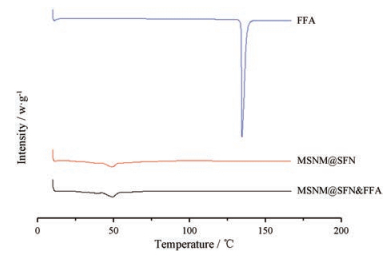
|
Figure 2 Differential scanning calorimetry (DSC) thermograms of FFA, MSNM@SFN and MSNM@SFN&FFA |
MSNM@SFN与MSNM@SFN&FFA中SFN溶解度测定结果见表 2。由表可见, MSNM@SFN中SFN的溶解度为(186.48±8.28) μg·mL-1, 而MSNM@SFN&FFA中SFN的溶解度为(188.72±0.28) μg·mL-1, 两者之间相差约2.24 μg·mL-1, 变化率为(1.20±0.15) %, 说明两者在水中溶解度的差别相对较小。此外, 不同pH条件下溶解度结果表明, MSNM@SFN&FFA中SFN的溶解度与MSNM@SFN中SFN的溶解度结果相似, 变化率小于5%。上述结果说明, 加入FFA不会影响原MSNM@ SFN对SFN的增溶效果。
| Table 2 The solubility of SFN in MSNM@SFN and MSNM@ SFN & FFA (n = 3, x±s). PBS: Phosphate buffered saline |
MSNM@SFN&FFA中SFN的溶出情况如图 3所示, 在人工胃液(pH 1.2)溶出介质中, SFN能够从MSNM@SFN&FFA中快速溶出, 在5 min时溶出量达80%以上(图 3A)。在人工肠液(pH 6.8)溶出介质中, SFN从MSNM@SFN&FFA中也可快速溶出, 在20 min时溶出量达90%以上(图 3B)。将MSNM@SFN&FFA中SFN在人工胃液和人工肠液的溶出量与相应的MSNM@SFN中SFN的溶出量[16]相比, 可知MSNM@ SFN和MSNM@SFN&FFA中SFN的溶出行为几乎没有差异。
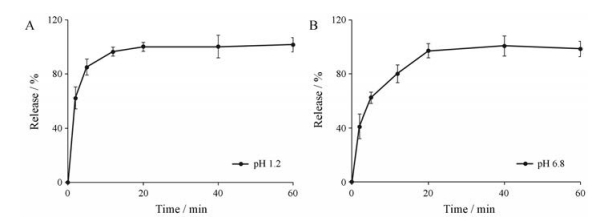
|
Figure 3 In vitro release of SFN from MSNM@SFN&FFA in mimicked GI fluids of pH 1.2 (A) and pH 6.8 (B) (n = 3, x±s) |
大鼠单次口服给予MSNM@SFN&FFA, 其体内SFN的血药浓度-时间曲线见图 4, 与MSNM@SFN中SFN的体内血药浓度-时间曲线[16]相似。采用非房室模型处理药动参数, 结果见表 3, 与MSNM@SFN中SFN的主要药动学参数Cmax、AUC、tmax和t1/2相比, MSNM@SFN&FFA中SFN的主要药动参数与其相近, 几乎没有差异。

|
Figure 4 In vivo plasma concentration-time curve of SFN after oral administration of a single dose of MSNM@SFN&FFA at 20 mg·kg-1 SFN in SD rats (n = 6, x±s) |
| Table 3 Pharmacokinetic parameters of SFN after oral administration of MSNM@SFN&FFA (n = 6, x±s). a: Data were came from reference 16. **P < 0.01 vs SFN suspension |
据报道, 肿瘤在生长过程中会形成由肿瘤细胞、细胞基质和浸润性炎性细胞等或细胞因子构成的肿瘤微环境。该微环境不仅能够滋养肿瘤细胞生长, 更能通过抑制机体免疫功能促进肿瘤细胞实现免疫逃避, 为肿瘤发生和发展提供合适的条件。非甾体抗炎药物可通过影响肿瘤微环境中COX-2/PGE2信号通路, 进改善肿瘤的炎性微环境, 增强机体自身的肿瘤免疫, 起到抑制肿瘤细胞增殖、侵袭与转移的作用[21, 22]。因此, 非甾体抗炎药物与化疗药物联合使用有望产生更好的抗肿瘤效果, 为转移性肿瘤的治疗提供新的选择。
本课题组前期成功构建MSNM@SFN, 具有增加SFN溶解度、溶出度和体内生物利用度的特点, 具有良好的体内外抗乳腺肿瘤药效[16]。但初步针对转移性乳腺肿瘤的体内药效研究发现, 该MSNM@SFN的药效并不明显。因此, 采用MSNM@SFN和非甾体抗炎药物FFA联合使用, 即将FFA抗肿瘤侵袭与转移的作用与MSNM@SFN抗乳腺肿瘤的作用结合, 以期产生抗转移性乳腺肿瘤的疗效。
联合给药是临床上治疗疾病的常用手段, 药物-药物的相互作用则是联合给药需重点考察的项目, 既需要保证联合给药的有效性, 又需要保证联合给药的安全性。考虑到与常规的药物联用不同, 该MSNM@SFN是具有增溶SFN的效果, 若联合使用的FFA对该SFN的增溶效果产生影响, 将极有可能影响SFN的药效。因此, 本研究重点考察FFA对MSNM@SFN中SFN的溶解度、溶出度和药动学行为的影响, 以确保这种联合使用不影响MSNM@SFN的增溶效果。
实验结果显示, FFA对MSNM@SFN中SFN的溶解度、溶出度及体内药动学行为几乎无影响, 表明MSNM@SFN中SFN的增溶效果不受联合使用的FFA的影响。该结果为后期开展MSNM@SFN&FFA抗转移性乳腺肿瘤的体内外药效奠定了实验基础。鉴于该联合使用中, MSNM@SFN与FFA均是固体-固体形式进行混合, 临用前加水性介质分散, 并立即口服给药。因此, 仅选择了溶解度、溶出度和体内药动学行为作为考察指标, 在后续的研究中, 还需设计实验, 针对其相关稳定性方面继续开展深入细致的研究。此外, 本研究还考察了MSNM@SFN和MSNM@SFN&FFA在粒径、X-衍射及DSC的区别, 结果显示, MSNM@SFN和MSNM@SFN&FFA的上述检测结果基本一致, 也表明FFA的引入不会影响MSNM@SFN的性质。需要指出的是, 由于MSNM@SFN&FFA中, MSNM@SFN:FFA为40:1 (w/w), 即FFA在MSNM@SFN&FFA中仅占约2.5%。因此, FFA的结晶峰与吸热峰均未在MSNM@ SFN & FFA中出现, 同时, 也未见任何与SFN相关的结晶峰或吸热峰出现, 说明FFA对MSNM@SFN的无定型性质无显著影响。
综上所述, 本研究通过粒径、X-衍射、DSC、溶解度、溶出度和大鼠体内药动学行为等实验证明, FFA对MSNM@SFN的性质无任何显著影响, FFA的引入不会影响MSNM@SFN中SFN的增溶效果及潜在的活性。上述结果为该药物联合使用提供了有力的数据支持。
| [1] | Wilhelm S, Carter C, Lynch M, et al. Discovery and development of sorafenib:a multikinase inhibitor for treating cancer[J]. Nat Rev Drug Discov, 2006, 5: 835–844. DOI:10.1038/nrd2130 |
| [2] | Gadaleta-Caldarola G, Infusino S, Divella R, et al. Sorafenib:10 years after the first pivotal trial[J]. Future Oncol, 2015, 11: 1863–1880. DOI:10.2217/fon.15.85 |
| [3] | Yao JW, Sun W, Cheng J, et al. Advances in the study of structural modifications of multi-target anticancer drug sorafenib[J]. Acta Pharm Sin (药学学报), 2012, 47: 1111–1119. |
| [4] | Zhu AX, Rosmorduc O, Evans TR, et al. SEARCH:a phase Ⅲ, randomized, double-blind, placebo-controlled trial of sorafenib plus erlotinib in patients with advanced hepatocellular carcinoma[J]. J Clin Oncol, 2015, 33: 559–566. DOI:10.1200/JCO.2013.53.7746 |
| [5] | Rini BI, Escudier B, Tomczak P, et al. Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS):a randomised phase 3 trial[J]. Lancet, 2011, 378: 1931–1939. DOI:10.1016/S0140-6736(11)61613-9 |
| [6] | Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359: 378–390. DOI:10.1056/NEJMoa0708857 |
| [7] | Benizri S, Ferey L, Alies B, et al. Nucleoside-lipid-based nanocarriers for sorafenib delivery[J]. Nanoscale Res Lett, 2018, 13: 17. DOI:10.1186/s11671-017-2420-2 |
| [8] | Izadiyan Z, Basri M, Fard Masoumi HR, et al. Modeling and optimization of nanoemulsion containing sorafenib for cancer treatment by response surface methodology[J]. Chem Cent J, 2017, 11: 21. DOI:10.1186/s13065-017-0248-6 |
| [9] | Zhang L, Gong F, Zhang F, et al. Targeted therapy for human hepatic carcinoma cells using folate-functionalized polymeric micelles loaded with superparamagnetic iron oxide and sorafenib in vitro[J]. Int J Nanomedicine, 2013, 8: 1517–1524. |
| [10] | Chen J, Sheu AY, Li W, et al. Poly(lactide-co-glycolide) microspheres for MRI-monitored transcatheter delivery of sorafenib to liver tumors[J]. J Control Release, 2014, 184: 10–17. DOI:10.1016/j.jconrel.2014.04.008 |
| [11] | Abou-Alfa GK, Johnson P, Knox JJ, et al. Doxorubicin plus sorafenib vs doxorubicin alone in patients with advanced hepatocellular carcinoma:a randomized trial[J]. JAMA, 2010, 304: 2154–2160. DOI:10.1001/jama.2010.1672 |
| [12] | Archibald M, Pritchard T, Nehoff H, et al. A combination of sorafenib and nilotinib reduces the growth of castrate-resistant prostate cancer[J]. Int J Nanomedicine, 2016, 11: 179–200. |
| [13] | Booth L, Roberts JL, Tavallai M, et al. [Pemetrexed + sorafenib] lethality is increased by inhibition of ERBB1/2/3-PI3K-NFκB compensatory survival signaling[J]. Oncotarget, 2016, 7: 23608–23632. |
| [14] | Möckelmann N, Rieckmann T, Busch CJ, et al. Effect of sorafenib on cisplatin-based chemoradiation in head and neck cancer cells[J]. Oncotarget, 2016, 7: 23542–23551. |
| [15] | Benet LZ, Broccatelli F, Oprea TI. BDDCS applied to over 900 drugs[J]. AAPS J, 2011, 13: 519–547. DOI:10.1208/s12248-011-9290-9 |
| [16] | Guo Y, Zhong T, Duan XC, et al. Improving anti-tumor activity of sorafenibtosylate by lipid-and polymer-coated nanomatrix[J]. Drug Deliv, 2017, 24: 270–277. DOI:10.1080/10717544.2016.1245371 |
| [17] | Gurpinar E, Grizzle WE, Piazza GA. NSAIDs inhibit tumorigenesis, but how?[J]. Clin Cancer Res, 2014, 20: 1104–1113. DOI:10.1158/1078-0432.CCR-13-1573 |
| [18] | Pereg D, Lishner M. Non-steroidal anti-inflammatory drugs for the prevention and treatment of cancer[J]. J Intern Med, 2005, 258: 115–123. DOI:10.1111/jim.2005.258.issue-2 |
| [19] | Ulrich CM, Bigler J, Potter JD. Non-steroidal anti-inflammatory drugs for cancer prevention:promise, perils and pharmacogenetics[J]. Nat Rev Cancer, 2006, 6: 130–140. DOI:10.1038/nrc1801 |
| [20] | Féau C, Arnold LA, Kosinski A, et al. Novel flufenamic acid analogues as inhibitors of androgen receptor mediated transcription[J]. ACS Chem Biol, 2009, 4: 834–843. DOI:10.1021/cb900143a |
| [21] | Knapp DW, Glickman NW, Widmer WR, et al. Cisplatin versus cisplatin combined with piroxicam in a canine model of human invasive urinary bladder cancer[J]. Cancer Chemother Pharmacol, 2000, 46: 221–226. DOI:10.1007/s002800000147 |
| [22] | Hida T, Kozaki K, Ito H, et al. Significant growth inhibition of human lung cancer cells both in vitro and in vivo by the combined use of a selective cyclooxygenase 2 inhibitor, JTE-522, and conventional anticancer agents[J]. Clin Cancer Res, 2002, 8: 2443–2447. |
 2019, Vol. 54
2019, Vol. 54


