2. 中国药科大学药学院, 江苏 南京 211198
2. Department of Pharmaceutics, China Pharmaceutical University, Nanjing 211198, China
布洛芬(IBU)是一种常见的消炎、解热类镇痛药, 属于生物药剂学分类系统Ⅱ类(biopharmaceutics classification system Ⅱ, BCS Ⅱ)药物, 其水溶性差(41.5 μg·mL-1, 20 ℃), 溶出度低[1], 使其固体口服制剂生物利用度较低[2]。
药物共晶是指将一种药物与另一种非活性或活性药物通过非共价键以固定化学计量比结合在同一晶格中形成的晶体, 可改善药物的理化性质, 如提高稳定性、机械性能、溶解度及生物利用度等。如烟酰胺(NIC)与IBU及氟比洛芬形成共晶后, 不仅提高了溶出度, 改善了吸湿性, 而且显著提高了可压性[3]。此外, 当两种活性药物成分组合成共晶时, 还能起到协同作用, 近几年来已成为改善药效, 获得新的适应症或降低不良反应的创新性技术。诺华公司研发的治疗心力衰竭的共晶制剂沙库巴曲缬沙坦片(商品名EntrestoTM)就是利用共晶技术结合沙库巴曲和缬沙坦两种药物的协同药理作用制成的复方制剂, 2015年经FDA和EMA批准上市, 我国已进口。
通过共晶技术与共晶配体(如NIC[3-11]、氨基酸[12]、草酸[13]、柠檬酸[13]、2-氨基嘧啶[14]等)提高IBU溶出已成为共晶研究的典型范例, 其中以IBU-NIC共晶的研究最为广泛。然而, 大多数IBU-NIC共晶文献专注于制备方法条件的优化、共晶的物理化学表征和单晶结构解析等晶体学研究, 对于共晶提高IBU溶出的原因归属于NIC对IBU溶解度的提高[3, 11], 而对于NIC增溶IBU的机制并不明晰。IBU-NIC共晶溶于水后药物与共晶配体在固体状态中两者间的氢键(IBU羧基上的-OH与NIC吡啶环上的-N=C以及IBU羧基上的C=O与另一NIC分子酰胺键中-NH2形成氢键[6])由于水的作用而解离[15], 本质上相当于两种物质分别溶于水中。本研究通过络合模型、荧光光谱法和拉曼光谱法等解析NIC对难溶性药物IBU增溶作用的机制, 既是对NIC增溶行为本质的探究, 又是对IBU-NIC共晶增加布洛芬溶解/溶出机制的深入与补充。
材料与方法药品与试剂 IBU (湖北百科格莱制药有限公司, 纯度99.9%); NIC (天津中瑞药业股份有限公司, 纯度99.7%); 盐酸(分析纯, 南京化学试剂股份有限公司); 乙腈(色谱纯, 上海安谱试验科技股份有限公司); 磷酸二氢钠(分析纯, 西陇化工股份有限公司); 实验用水为采用Milli-Q水纯化系统(美国Millipore公司)制得。
主要仪器 Shimadzu RF-6000荧光分光光度计(光源为脉冲式氙灯, 激发和发射通带均为1.5 nm)、Shimadzu高效液相色谱仪(LC-10AD泵, SPD-10A检测器)、Shimadzu LabSolutions工作站(日本岛津公司); LabRAM HR800拉曼光谱仪(法国HORIBA科学仪器事业部, LabSpac5工作站); RC-806智能溶出仪(天津市天大天发科技有限公司); 压片机(Carver 4350, 美国Carver公司)。
相溶解度研究 前期研究发现NIC可显著提高IBU溶解度, 为了进一步考察不同浓度NIC对IBU增溶作用, 探索两者的络合模型, 进行了相溶解度研究。将过量IBU加至5 mL含不同浓度的NIC水溶液中(0.02、0.04、0.06、0.18、0.37、0.69、0.96、1.27、1.46和1.66 mol·L-1), 置25 ℃水浴中, 磁力搅拌48 h, 平衡后将混悬液过0.22 μm滤膜, 收集续滤液, HPLC法测定滤液中IBU和NIC的浓度, 平行3份样品进行相溶解度研究的测定。分析采用Shimadzu高效液相色谱系统, 以0.05 mol·L-1磷酸二氢钠(pH 2.6)-乙腈(40:60)为流动相, 流速0.8 mL·min-1, 使用Ultimate XB C18色谱柱(150 mm × 4.6 mm, 5 μm)进行分离, 柱温40 ℃, 进样体积20 μL, 检测波长为264 nm。
荧光光谱 称取一定量的IBU或NIC, 置100 mL量瓶中, 加入pH 6.8磷酸盐缓冲液溶解, 配制成0.01 mol·L-1 IBU或0.01 mol·L-1 NIC溶液。另配制含不同摩尔比(1:5、1:2、1:1、2:1和5:1)的IBU-NIC溶液, 其中IBU浓度固定为0.01 mol·L-1。以295 nm为激发波长[16], 采用RF-6000荧光分光光度计对上述各溶液在300~400 nm内进行荧光扫描, 记录荧光光谱。
拉曼光谱 同上配制成0.1 mol·L-1 IBU或0.1 mol·L-1 NIC溶液。另配制两者浓度均为0.1 mol·L-1的IBU与NIC溶液(摩尔比为1:1)。分析采用LabRAM HR800拉曼光谱仪, 以523 nm为激发波长, 分辨率为3.5 cm-1, 在400~2 800 nm波段内进行拉曼光谱测定。
特性溶出 分别称取IBU及等摩尔比的IBU-NIC物理混合物各150 mg, 使用液压机在1.0吨压力下压制(10 s)成致密规整的药片, 将药片的底面和侧面用蜂蜡模型包裹, 使其只有一个表面外露与溶出介质接触, 表面积为1.33 cm2[17]。
按照2015版《中国药典》通则0931第二法(桨法)装置, 溶出介质为900 mL去离子水, 溶出温度37 ℃, 转速100 r·min-1。分别于5、10、15、20、40、60、90和120 min时取样, 0.22 μm滤膜过滤后, 采用上述HPLC法测定溶液中IBU浓度, 平行3份样品进行特性溶出的测定。
非漏槽条件下的溶出 按照2015版《中国药典》通则0931第三法(小杯法)装置, 溶出介质为去离子水100 mL, 溶出温度25 ℃, 转速50 r·min-1。分别称取适量IBU及等摩尔比的IBU-NIC物理混合物(约相当于IBU 600 mg, 过饱和状态)过80目筛后, 加至溶出介质中, 分别于5、15、30、45、60 min和2、4、10、12、24 h时取样, 0.22 μm滤膜过滤, 采用上述HPLC法测定溶液中IBU浓度, 绘制药物浓度-时间曲线, 平行6份样品进行过饱和溶出的测定。
结果与讨论 1 相溶解度研究不同浓度NIC水溶液中IBU的溶解度曲线见图 1。随着NIC浓度增加, IBU溶解度显著增加, 且在高浓度的NIC溶液中发生正性偏离, IBU溶解度呈单调递增的趋势。
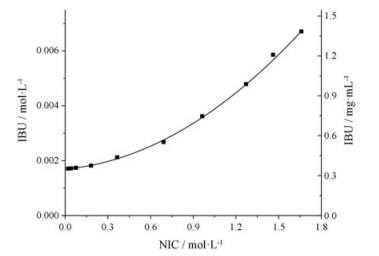
|
Figure 1 Influence of nicotinamide (NIC) concentration on the solubility of ibuprofen (IBU) in water |
假设溶液中存在的两种物质分子分别为难溶性物质D和易溶性物质L, 若在溶液中D分子与L分子之间无络合效应, 则D的溶解度通常与溶液中L的浓度无关, 其溶解度相图为一条水平线; 若二者之间存在络合反应, 则D的溶解度曲线随L浓度发生变化[18]。络合物可分为可溶型和不可溶型两种类型, 其中可溶型分为AL、AP或AN型, 即分别表现为D分子与L分子浓度呈线性相关、L分子在高浓度时发生正性偏离或发生负性偏离。结合IBU与NIC在水中的溶解度相图表明其两者之间的络合属于AP型。
假设IBU和NIC在溶液中存在1:1和1:2的络合, 溶液中的浓度表示如下:
| $ \begin{align} & \left[ \text{IBU} \right]\text{+}\left[ \text{NIC} \right]\overset{{{K}_{1:1}}}{\leftrightarrows}\left[ \text{IBU}\cdot \text{NIC} \right] \\ & \left[ \text{IBU}\cdot \text{NIC} \right]+\left[ \text{NIC} \right]\overset{{{K}_{1:2}}}{\leftrightarrows}\left[ \text{IBU}\cdot \text{NI}{{\text{C}}_{\text{2}}} \right] \\ \end{align} $ |
其中[IBU]是IBU在水中摩尔溶解度, [NIC]是NIC摩尔浓度, [IBU·NIC]是1:1络合物的浓度, [IBU·NIC2]是1:2络合物的浓度, 络合常数K1:1和K1:2表示为:
| ${K_{1:1}} = \frac{{\left[ {{\rm{IBU}} \cdot {\rm{NIC}}} \right]}}{{\left[ {{\rm{IBU}}} \right]\left[ {{\rm{NIC}}} \right]}}$ | (1) |
| ${K_{1:2}} = \frac{{\left[ {{\rm{IBU}} \cdot {\rm{NI}}{{\rm{C}}_2}} \right]}}{{\left[ {{\rm{IBU}} \cdot {\rm{NIC}}} \right]\left[ {{\rm{NIC}}} \right]}}$ | (2) |
整理公式(1)和(2)可得以下公式, 计算得到K1:1和K1:2:
| $ \begin{array}{l} \frac{{\left[ {{\rm{IB}}{{\rm{U}}_{{\rm{total}}}}\left] - \right[{\rm{IB}}{{\rm{U}}_{{\rm{water}}}}} \right]}}{{\left[ {{\rm{NI}}{{\rm{C}}_{{\rm{total}}}}} \right] - 2\left( {\left[ {{\rm{IB}}{{\rm{U}}_{{\rm{total}}}}\left] - \right[{\rm{IB}}{{\rm{U}}_{{\rm{water}}}}} \right]} \right)}} = {\rm{A}} + \\ \;\;\;\;{\rm{B}}\left\{ {\left[ {{\rm{NI}}{{\rm{C}}_{{\rm{total}}}}} \right] - 2\left( {\left[ {{\rm{IB}}{{\rm{U}}_{{\rm{total}}}}\left] - \right[{\rm{IB}}{{\rm{U}}_{{\rm{water}}}}} \right]} \right)} \right\} \end{array} $ | (3) |
其中[IBUtotal]和[NICtotal]分别为IBU和NIC的总摩尔浓度, [IBUwater]为水溶液中NIC的浓度为零时IBU溶解度, 上述公式可以简化为:
| $\begin{array}{l} \frac{{\left[ {{\rm{IB}}{{\rm{U}}_{{\rm{complex}}}}} \right]}}{{\left[ {{\rm{NI}}{{\rm{C}}_{{\rm{total}}}}\left] { - 2} \right[{\rm{IB}}{{\rm{U}}_{{\rm{complex}}}}} \right]}}{\rm{ = A}} + {\rm{B}}(\left[ {{\rm{NI}}{{\rm{C}}_{{\rm{total}}}}} \right] - \\ 2\left[ {{\rm{IB}}{{\rm{U}}_{{\rm{complex}}}}} \right]) \end{array}$ | (4) |
其中[IBUcomplex]为产生络合的IBU浓度, 定义A和B表示如下:
| ${\rm{A}} = \frac{{{K_{1:1}}\left[ {{\rm{IB}}{{\rm{U}}_{{\rm{water}}}}} \right]}}{{1 - {K_{1:1}}\left[ {{\rm{IB}}{{\rm{U}}_{{\rm{water}}}}} \right]}}$ | (5) |
| ${\rm{B}} = \frac{{{K_{1:1}}{K_{1:2}}\left[ {{\rm{IB}}{{\rm{U}}_{{\rm{water}}}}} \right]}}{{{{(1 - {K_{1:1}}[{\rm{IB}}{{\rm{U}}_{{\rm{water}}}}])}^2}}}$ | (6) |
根据公式(4)作图(图 2), A和B可分别由直线的斜率和截距计算得到, 进而可以得到络合常数K1:1和K1:2分别为0.24和4.00, 且具有较好的拟合度(r2 > 0.98)。结果表明, NIC在低浓度时与IBU按1:1络合, 而在高浓度时可能发生1:2络合。
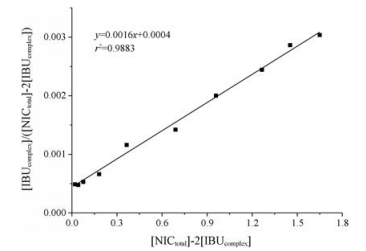
|
Figure 2 Plot of equation (4) for determination of K1:1 and K1:2 for the complexation of IBU and NIC |
为验证溶液中IBU与NIC分子之间是否存在络合效应, 采用荧光淬灭法进行分析[19]。由图 3可知, 含0.01 mol·L-1 IBU水溶液在340 nm处产生了较强的荧光峰, 而0.01 mol·L-1 NIC水溶液在该波长并无荧光发射。当两者处于同一溶液体系时, 随着NIC摩尔浓度的提高, IBU的荧光峰强度逐渐降低, 当IBU与NIC摩尔比为1:5时, IBU的荧光峰强度显著降低, 说明NIC的存在影响了IBU的荧光强度。
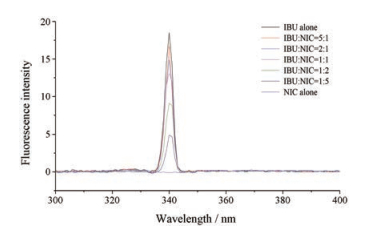
|
Figure 3 Fluorescence spectra of solutions containing 0.01 mol·L-1 IBU, 0.01 mol·L-1 NIC, and 0.01 mol·L-1 IBU with NIC at various molar ratios (5:1, 2:1, 1:1, 1:2 and 1:5) |
荧光光谱法通常用于研究药物-DNA相互作用和液体状态下的小分子化合物间的相互作用[20, 21]。绝大多数能产生荧光的物质含有芳香环或杂环, 分子中π电子共轭程度的增加会减小最高占据分子轨道(highest occupied molecular orbital, HOMO)和最低未占分子轨道(lowest unoccupied molecular orbital, LUMO)间的能量差, 提高荧光量子产率[22]。除了分子结构, 分子所处的外界环境, 如溶剂、pH和荧光熄灭剂等都会影响荧光效率[23]。在本研究中, 利用IBU具有发射荧光的特性, 根据NIC对药物的荧光淬灭, 来证明二者在水溶液中具有一定的相互作用。
在IBU分子中(图 4a), 由于其苯环结构中π电子共轭程度较大, 离阈π电子容易吸收光子能量被激发, 从而发生π→π*跃迁[24], 使得IBU产生荧光峰。在NIC分子中(图 4b), 吡啶环结构中氮原子上未成对n电子对与π电子形成较大的共轭体系, 但由于与其直接相连的酰胺基团具有较大的偶极矩, 降低了吡啶环结构的共轭程度, 体系整体能量升高, 能级间能量差值升高, 离域π电子难被激发[25, 26], 因此, NIC不产生荧光峰。

|
Figure 4 Electrostatic potential at the surface of IBU (a) molecular and NIC (b) molecular |
当IBU一定量时, 随NIC加入量的增加, IBU荧光强度逐渐降低, 且在荧光光谱中并没有新的明显荧光峰出现, 可见NIC对IBU产生荧光淬灭作用, 形成了不产生荧光的基态络合物。NIC的吡啶环自身具有极性, 使其具有较大的偶极矩, 当两者相互靠近时, NIC分子偶极所产生的电场可能使IBU苯环结构的电子云变形, 破坏其共轭结构, 离域π电子难被激发[27], 进而影响IBU的荧光峰强度, 这可能是NIC对IBU产生荧光淬灭作用的原因。
3 拉曼光谱测定相比红外光谱法, 拉曼光谱法具有受水和玻璃影响小、高检测灵敏度的特点。在本研究中, 通过拉曼光谱测定水溶液中IBU与NIC分子的对称性振动和非极性基团振动来探究络合作用的位点。由于0.01 mol·L-1的IBU和NIC溶液所产生的拉曼吸收弱, 吸收峰不明显。因此, 采用0.1 mol·L-1溶液体系进行拉曼光谱研究, 结果如图 5所示, 其主要吸收峰位归属表如表 1[28]、表 2[29, 30]所示。
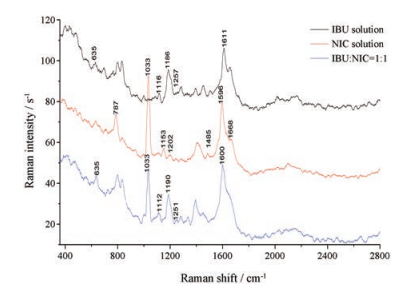
|
Figure 5 Raman spectra of aqueous solutions containing 0.1 mol·L-1 IBU, 0.1 mol·L-1 NIC, and 0.1 mol·L-1 IBU with NIC at the molar ratio of 1:1 |
| Table 1 Vibrational frequencies of 0.1 mol·L-1 IBU alone and the complexation with NIC (molar ratio, 1:1). υ: Stretching vibration; β: In-plane bending vibration; ρ: In-plane rocking vibration; ω: Out-of-plane rocking vibration; δ: Scissoring vibration; τ: Twisting vibration; υas: Asymmetrical stretching vibration; βtrig: In-plane trigonal radial breathing bending vibration |
| Table 2 Vibrational frequencies of 0.1 mol·L-1 NIC alone and the complexation with IBU (molar ratio, 1:1) |
由表 1可知, 当IBU与NIC存在于同一溶液体系时, 1 611 cm-1 (IBU分子苯环上CC面内伸缩振动)处拉曼峰消失; 1 257 cm-1 (IBU分子苯环的面外摇摆振动及其取代基的面内摇摆振动)处拉曼峰蓝移至1 251 cm-1; 1 186 cm-1 (IBU分子异丙基上C-H伸缩振动)处拉曼峰红移至1 190 cm-1; 1 116 cm-1 (IBU分子苯环上C-H面内弯曲振动、C-H扭曲振动、C-C-H变形振动)处拉曼峰蓝移至1 112 cm-1; 632 cm-1 (IBU分子苯环上CC变形振动)处拉曼峰红移至635 cm-1。IBU分子的以上信号峰皆产生明显的位移甚至消失, 其中大多数为苯环振动所致, 而IBU分子所产生的其他信号峰则无明显变化。
由表 2可知, 当NIC与IBU存在于同一溶液体系时, 1 668 cm-1 (NIC分子C=O伸缩振动)处拉曼峰消失; 1 596 cm-1 (NIC分子吡啶环上C-H面内摇摆振动、CC伸缩振动及C=N伸缩振动)处拉曼峰红移至1 600 cm-1; 1 485 cm-1 (NIC分子吡啶环上C-H面内摇摆振动、CC伸缩振动及C=N伸缩振动)处拉曼峰消失; 1 202 cm-1 (NIC分子吡啶环上C-H面内摇摆振动以及C=N伸缩振动)处拉曼峰消失; 1 153 cm-1 (NIC分子吡啶环上CC伸缩振动、C-H面内摇摆振动以及三角环“呼吸”弯曲振动)处拉曼峰消失; 787 cm-1 (NIC分子吡啶环面内弯曲振动以及酰胺基团与吡啶环间的CC伸缩振动)处拉曼峰消失。NIC分子的以上信号峰均消失, 其中大多为吡啶环振动所致, 而NIC分子所产生的其他信号峰则无明显变化。
当IBU和NIC存在于同一溶液体系中时, 二者环结构所产生的峰信号皆发生明显变化, 这可能是由于IBU的苯环和NIC的吡啶环之间的偶极-偶极作用力所引起的, 在空间上NIC的吡啶基团可能与IBU苯环上靠近产生芳香环之间的相互作用, 从而形成稳定的络合物[27]。
IBU分子的苯环结构、羧基相距较远, 因而苯环上的正负电荷中心距离相差较小, 偶极矩较小; 而NIC的吡啶环本身具有极性, 正负电荷中心不重合, 具有较大的偶极矩; 当两者相互靠近时, NIC分子偶极所产生的电场对IBU分子发生影响, 使IBU苯环结构的电子云变形(即电子云被吸向NIC分子吡啶环中N原子的邻对位即正电一极), 正、负电荷中心相对位移, 不再重合, 从而产生偶极, 诱导偶极和固有偶极相互吸引, 这可能是IBU与NIC在溶液中存在络合作用的原因。
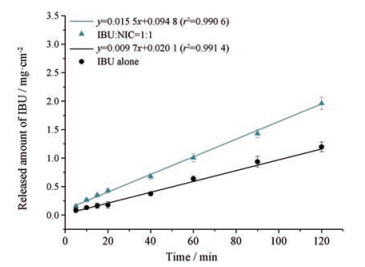
4 特性溶出曲线IBU、IBU-NIC物理混合物(摩尔比1:1)的特性溶出曲线见图 6, 单独IBU的特性溶出曲线呈现良好的线性, 溶出速率为0.009 7 mg·cm-2·min-1。IBU与等摩尔的NIC制备成物理混合物后, 其特性溶出速率提高了1.6倍(0.015 5 mg·cm-2·min-1)。由此可见, 在水溶液体系中NIC的存在可显著提高IBU溶出速率。这是由于溶解状态的NIC通过络合作用促进了IBU溶出。
|
Figure 6 Intrinsic dissolution profiles of IBU from IBU alone and physical mixture of IBU and NIC (molar ratio, 1:1) in water (n = 3, x±s) |
为测定IBU在含有NIC的水溶液体系中的过饱和度及其维持过饱和状态的时间, 本研究测定了非漏槽条件下的溶出。IBU、IBU-NIC物理混合物在非漏槽条件下的溶出曲线如图 7所示。物理混合物在溶出前1 h内快速溶出, 溶出质量浓度约至0.27 mg·mL-1, 呈现“spring”效应[31], 而单独IBU药物溶出缓慢, 仅为0.05 mg·mL-1; 随着溶出的继续, 物理混合物溶液中药物浓度维持在高浓度水平(约0.35 mg·mL-1), 而单独IBU药物溶解度低(仅约0.06 mg·mL-1)。由此可见, 在水溶液体系中NIC的存在可显著提高IBU溶出速率与溶出度。体系中IBU通过与NIC的络合作用, 显著提高了IBU溶出速率及溶出度, 这将有利于BCS Ⅱ药物IBU的口服体内吸收。

|
Figure 7 Non-sink dissolution profiles of IBU from IBU alone and physical mixture of IBU and NIC (molar ratio, 1:1) in water (n = 6, x±s) |
在溶液中, 随着NIC浓度增加, IBU的溶解度单调提高, 表现出Ap型络合。IBU与等摩尔NIC制备成物理混合物后, 其在水中的溶出速率提高了约1.6倍。NIC对IBU荧光淬灭现象表明在水溶液中两者形成了水溶性络合物; 进一步拉曼光谱分析表明络合的形成可能源于IBU的苯环和NIC的吡啶环之间的偶极-偶极作用力。与单独IBU相比, IBU与NIC的物理混合物溶出度显著增强, 并且保持持久的高过饱和度, 有利于IBU的体内吸收。该研究为探索药物增溶及溶液中络合物的形成机制提供了新思路。
| [1] | Stead JA, Freeman M, John EG, et al. Ibuprofen tablets:dissolution and bioavailability studies[J]. Int J Pharm, 1983, 14: 59–72. DOI:10.1016/0378-5173(83)90114-X |
| [2] | Luan LB, Mao FF, Tu XD. Bioavailability study of ibuprofen tablets[J]. Acta Pharm Sin (药学学报), 1987, 22: 769–776. |
| [3] | Chow SF, Chen M, Shi L, et al. Simultaneously improving the mechanical properties, dissolution performance, and hygroscopicity of ibuprofen and flurbiprofen by cocrystallization with nicotinamide[J]. Pharm Res, 2012, 29: 1854–1865. DOI:10.1007/s11095-012-0709-5 |
| [4] | Dhumal RS, Kelly AL, York P, et al. Cocrystalization and simultaneous agglomeration using hot melt extrusion[J]. Pharm Res, 2010, 27: 2725–2733. DOI:10.1007/s11095-010-0273-9 |
| [5] | Kelly AL, Gough T, Dhumal RS, et al. Monitoring ibuprofen-nicotinamide cocrystal formation during solvent free continuous cocrystallization (SFCC) using near infrared spectroscopy as a PAT tool[J]. Int J Pharm, 2012, 426: 15–20. DOI:10.1016/j.ijpharm.2011.12.033 |
| [6] | Berry DJ, Seaton CC, Clegg W, et al. Applying hot-stage microscopy to co-crystal screening:a study of nicotinamide with seven active pharmaceutical ingredients[J]. Cryst Growth Des, 2008, 8: 1697–1712. DOI:10.1021/cg800035w |
| [7] | Alshahateet SF. Synthesis and supramolecularity of hydrogen-bonded cocrystals of pharmaceutical model rac-ibuprofen with pyridine derivatives[J]. Mol Cryst Liq Cryst, 2010, 533: 152–161. DOI:10.1080/15421406.2010.526557 |
| [8] | Sun X, Yin Q, Ding S, et al. Solid-liquid phase equilibrium and ternary phase diagrams of ibuprofen-nicotinamide cocrystals in ethanol and ethanol/water mixtures at (298.15 and 313.15) K[J]. J Chem Eng Data, 2015, 60: 1166–1172. DOI:10.1021/je5011455 |
| [9] | Müllers KC, Paisana M, Wahl MA. Simultaneous formation and micronization of pharmaceutical cocrystals by rapid expansion of supercritical solutions (RESS)[J]. Pharm Res, 2015, 32: 702–713. DOI:10.1007/s11095-014-1498-9 |
| [10] | Soares FLF, Carneiro RL. Green synthesis of ibuprofen-nicotinamide cocrystals and in-line evaluation by Raman spectroscopy[J]. Cryst Growth Des, 2013, 13: 1510–1517. DOI:10.1021/cg3017112 |
| [11] | Shen ZM, Xie C, Du W, et al. Preparation of ibuprofen-nicotinamide cocrystal and its solubility measurement[J]. Chem Indust Eng (化学工业与工程), 2014, 31: 38–42. |
| [12] | Othman MF, Jamburi N, Anuar N, et al. 5th International conference on chemical and process engineering[C]. 2016, 69: 03002. |
| [13] | Othman MF, Anuar N, Ad Rahman S, et al. Cocrystal screening of ibuprofen with oxalic acid and citric acid via grinding method[J]. IOP Conf Ser Mater Sci Eng, 2018, 358: 012065. DOI:10.1088/1757-899X/358/1/012065 |
| [14] | Sarraguca MC, Ribeiro PRS, Santos AO, et al. A PAT approach for the on-line monitoring of pharmaceutical co-crystals formation with near infrared spectroscopy[J]. Int J Pharm, 2014, 471: 478–484. DOI:10.1016/j.ijpharm.2014.06.003 |
| [15] | Chow SF, Shi L, Ng WW, et al. Kinetic entrapment of a hidden curcumin cocrystal with phloroglucinol[J]. Cryst Growth Des, 2014, 14: 5079–5089. DOI:10.1021/cg5007007 |
| [16] | Jasinska A, Ferguson A, Mohamed WS, et al. The study of interactions between ibuprofen and bovien serum albumin[J]. Food Chem Biotechnol, 2009, 73: 15–24. |
| [17] | Qian S, Li Z, Heng W, et al. Charge-assisted intermolecular hydrogen bond formed in coamorphous system is important to relieve the pH-dependent solubility behavior of lurasidone hydrochloride[J]. RSC Adv, 2016, 6: 106396–106412. DOI:10.1039/C6RA18022A |
| [18] | Higuchi T, Connors KA. Phase-solubility techniques[M]//Charles. Advances in Analytical Chemistry and Instrument. New York: Wiley, 1965: 117-122. |
| [19] | Eftink MR, Ghiron CA. Fluorescence quenching studies with proteins[J]. Anal Biochem, 1981, 114: 199–227. DOI:10.1016/0003-2697(81)90474-7 |
| [20] | Kumar CV, Asuncion EH. DNA binding studies and site selective fluorescence sensitization of an anthryl probe[J]. J Am Chem Soc, 1993, 115: 8547–8553. DOI:10.1021/ja00072a004 |
| [21] | Herbich J, Waluk J, Thummel RP, et al. Mechanisms of fluorescence quenching by hydrogen bonding in various aza aromatics[J]. J Photochem Photobiol A Chem, 1994, 80: 157–160. DOI:10.1016/1010-6030(94)01050-1 |
| [22] | Yamaguchi Y, Matsubara Y, Ochi T, et al. How the π conjugation length affects the fluorescence emission efficiency[J]. J Am Chem Soc, 2008, 130: 13867–13869. DOI:10.1021/ja8040493 |
| [23] | Martin R, Clarke GA. Fluorescence of benzoic acid in aqueous acidic media[J]. J Phys Chem, 1978, 82: 81–86. DOI:10.1021/j100490a020 |
| [24] | Tsuzuki S, Honda K, Uchimaru T, et al. The magnitude of the CH/π interaction between benzene and some model hydrocarbons[J]. J Am Chem Soc, 2000, 122: 3746–3753. DOI:10.1021/ja993972j |
| [25] | Brealey GJ. Misassignment of the multiplicity forbidden transitions in pyridine[J]. J Chem Phys, 1956, 24: 571–573. DOI:10.1063/1.1742547 |
| [26] | Knight AEW, Parmenter CS. Radiative and nonradiative processes in the firs excited singlet state of azabenzene vapors[J]. Chem Phys, 1976, 15: 85–102. DOI:10.1016/0301-0104(76)89009-X |
| [27] | Meyer EA, Castellano RK, Diederich F. Interactions with aromatic rings in chemical and biological recognition[J]. Angew Chem Int Ed, 2003, 42: 1210–1250. DOI:10.1002/anie.200390319 |
| [28] | Jaworska A, Malek K, Marzec KM, et al. Nicotinamide and trigonelline studied with surface-enhanced FT-Raman spectroscopy[J]. Vib Spectrosc, 2012, 63: 469–476. DOI:10.1016/j.vibspec.2012.09.004 |
| [29] | Jubert A, Legarto ML, Massa NE, et al. Vibrational and theoretical studies of non-steroidal anti-inflammatory drugs ibuprofen[J]. J Mol Struct, 2006, 783: 34–51. DOI:10.1016/j.molstruc.2005.08.018 |
| [30] | Etcheverry SB, Barrio DA, Cortizo AM, et al. Three new vanadyl (Ⅳ) complexes with non-steroidal anti-inflammatory drugs (ibuprofen, naproxen and tolmetin). Bioactivity on osteoblast-like cells in culture[J]. J Inorg Biochem, 2002, 88: 94–100. DOI:10.1016/S0162-0134(01)00368-3 |
| [31] | Guzmán HR, Tawa M, Zhang Z, et al. Combined use of crystalline salt forms and precipitation inhibitors to improve oral absorption of celecoxib from solid oral formulations[J]. J Pharm Sci, 2007, 96: 2686–2702. DOI:10.1002/jps.20906 |
 2019, Vol. 54
2019, Vol. 54


