2. 陕西省中医药研究院, 陕西 西安 71000
2. Shanxi Chinese Medicine Research Institute, Xi'an 710003, China
结核病(tuberculosis)是一类由结核分枝杆菌(mycobacterium tuberculosis, MTB)引起的对人类的生命与健康产生极大威胁的慢性传染病[1, 2]。目前临床上常用的异烟肼、利福平和乙胺丁醇等抗结核药物使用已超过半个世纪, 但疗效均不显著, 且需大剂量长期使用, 不良反应大, 易诱导结核杆菌的耐药性的产生[3, 4]。迫切需要开发具有新的作用机制, 并且能有效应对结核杆菌的新药。
近几年来, 从天然药物中提取有效成分及单体作为抗结核药物的研究已经取得了一些进展[5, 6], 青蒿素(artemisinin)就是其中代表。青蒿素是我国药学人员于20世纪70年代从菊科植物黄花蒿中提取的一种含过氧化基团结构的倍半萜内酯化合物, 主要衍生物包括青蒿琥酯(artesunate)、二氢青蒿素(dihydroartemisinin)、蒿甲醚(artemethere)和蒿乙醚(arteether)等, 其针对临床各型疟疾的治疗效果显著[7, 8]。近年来陆续有研究报道青蒿素类药物也具有抗菌、抗肿瘤、抗纤维化和抗病毒等多种药理作用[9-13]。因此, 拓展青蒿素及其衍生物的用途, 开发其潜在的药用价值, 具有重要意义。
尽管近来研究表明青蒿素及其衍生物对结核杆菌有一定活性, 但其抗菌活性有待进一步提高[14, 15]。青蒿素在水中低溶解度不可避免地影响其成药性及剂型的制备。有研究[16-18]表明, 水溶性精氨酸分子中的胍基结构能有效扰乱细菌细胞壁, 促进其连接的小分子穿透细菌细胞壁进入细菌。本研究拟将青蒿素通过琥珀酸连接1个精氨酸分子, 形成一个新的水溶性更好的青蒿素衍生物。由于精氨酸分子中极性基团的加入, 研究测定了合成的衍生物溶解度, 并进一步测定了其体外抗结核分枝杆菌的活性。
材料与方法材料 结核分枝杆菌H37Rv购自北京生物制品研究所; 人白血病单核巨噬细胞THP-1购自中国科学院上海细胞库。菌株和细胞均由陕西省中医药研究院实验室培养传代保存。
试剂和仪器 实验中所有1H和13C核磁共振图谱使用Agilent 400 MHz DD2及Agilent 600 MHz DD2型核磁共振波谱仪(Agilent公司)测定; 四甲基硅烷(TMS)为内标(Aldrich公司)。除非特别声明, 所有涉及的反应都在氮气保护的条件下操作, CDCl3、methanol-d4和C2D6OS等溶剂和试剂均为市售分析纯, 购于安耐吉试剂公司。
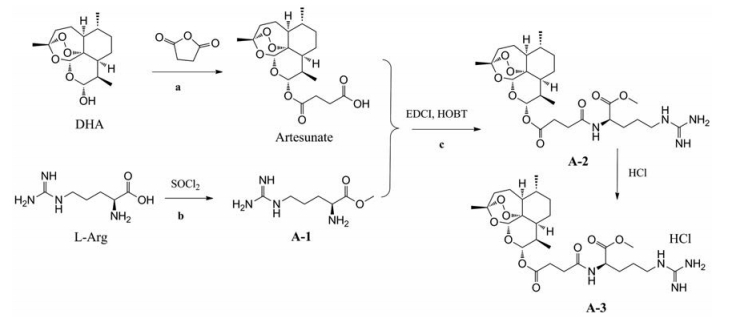
目标化合物的合成 按照合成路线图 1, 以二氢青蒿素(DHA)为原料, 根据文献[19]报道, 首先合成青蒿琥酯。同时, 以L-精氨酸(L-Arg)为原料制备合成L-精氨酸甲酯(A-1)[20]。然后通过缩合反应, 以青蒿琥酯和L-精氨酸甲酯为原料, 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)、1-羟基苯并三唑(HOBT)为缩合试剂, 在DMF中常温搅拌2~3 h, 获得目标化合物A-2。将A-2溶于氯仿溶液中, 搅拌下通入干燥氯化氢气体至pH 4, 浓缩旋出氯仿, 再通过冷却结晶可获得目标物盐酸盐A-3。化合物经HPLC测定含量, 经核磁共振波谱仪确认化学结构。
|
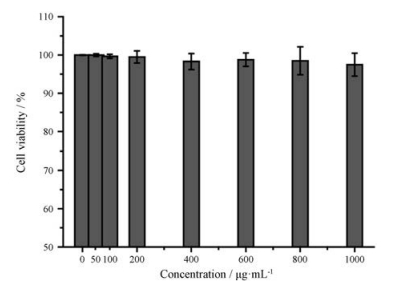
Figure 1 Cytotoxicity test of different concentrations of A-3 on THP-1 cells (n = 3, x±s) |
目标化合物的溶解度测试 取过量待测化合物(约500 mg)和对照药物加入2 mL不同的溶液(纯水、pH 4.0醋酸盐缓冲液、pH 7.0磷酸盐缓冲液及pH 9.0硼酸盐缓冲液), 于5 mL具塞锥形瓶中, 将锥形瓶放置到含磁力搅拌的恒湿水浴槽中, 控制温度25 ℃, 一式三份, 搅拌24 h。静置后取样品离心(10 000 r·min-1, 5 min), 取上清液, 采用紫外分光光度仪于220 nm处测定吸光度值, 与标准品对比后计算溶解度。
|
Scheme 1 Synthesis routes of target compounds. Reagents and conditions: a: Et3N, CH2Cl2, RT, 1 h; b: SOCl2, CH3OH, overnight; c: EDCI, HOBT, DMF, RT, 2-3 h |
体外抗结核分枝杆菌活性 采用美国临床实验室标准化协会(CLSI)推荐的平皿二倍稀释法测定目标化合物及对照药的最低抑菌浓度(MIC), 阳性对照药为异烟肼。于无菌平皿内加入药液1 mL, 再加入融化的50 ℃ MH培养基14 mL, 混匀, 使每皿内含药物终质量浓度依次为2、1、0.5、0.2、0.1、0.05、0.02和0.01 mg·mL-1; 待冷却后用Denlay多点接种仪接种细菌, 接种菌量约为每毫升1×105菌落形成单位(CFU)。置于35~37 ℃培养箱内培养24 h, 观察并记录结果, 无菌生长的平皿中所含药物最小浓度即MIC。
MTT法测定目标化合物对细胞THP-1的毒性 将THP-1细胞接种于96孔板, 每孔4×104个细胞。向孔内加入RPMI-1640培养液(含10%胎牛血清) 100 μL, 其中分别含有药物质量浓度为0、50、100、200、400、600、800和1 000 μg·mL-1, 设为实验组; 不含药物的RPMI-1640培养液作为空白对照。于第4天向96孔细胞培养板上每孔加入5 mg·mL-1 MTT 10 μL, 继续培养4 h后, 取出细胞培养板, 离心弃上清液, 每孔加DMSO 100 μL, 混匀后室温放置20 min, 于570 nm测定吸光值(A), 按下述公式计算巨噬细胞存活率(CL)。
| $ {\rm{CL}}\left( \% \right) = \left( {{A_{{\rm{感染}}}}{\rm{ - }}{A_{{\rm{对照}}}}} \right)/\left( {{A_{{\rm{未感染}}}} - {A_{{\rm{对照}}}}} \right) \times 100\% $ |
化合物对巨噬细胞胞内H37Rv株抑制作用检测 细菌与巨噬细胞的比例为10:1 (H37Rv 1×107/mL, THP-1细胞数1×106/mL)混合, 在终浓度为100 mmol·L-1丙二醇甲醚醋酸酯(PMA)中诱导细胞分化。96孔板每孔加菌悬液100 μL, 感染4 h后, 每孔加含不同浓度目标化合物100 μL继续培养, 给药质量浓度为0、100、200、400、600、800和1 000 μg·mL-1, 用RPMI-1640完全培养液作空白对照, 100 μg·mL-1青蒿素和100 μg·mL-1异烟肼作为阳性对照。以加细菌悬液时作为细菌感染零时, 分别于感染后0、4及7天去除板上培养液, 每孔加入1% Triton X-100裂解细胞50 μL。待其全部裂解后, 每孔加RPMI-1640细胞培养液50 μL, 终止裂解。混匀后每孔分别以1:10和1:100稀释, 接种于正常培养基37 ℃培养14天后计算CFU。
统计学处理 各组数据结果采用x±s表示, 采用t检验进行各组间均数比较, P < 0.05为差异显著, P < 0.01为差异极显著。
结果 1 中间体青蒿琥酯的合成二氢青蒿素(5.28 mmol, 1 500 mg)溶于75 mL干燥的二氯甲烷中, 室温下搅拌。将琥珀酸(6.33 mmol, 630 mg)和三乙胺(26.4 mmol, 3.7 mL)分别滴加到上述混合液中, 室温反应1 h。反应加饱和柠檬酸(pH 2, 2×20 mL)洗涤两次, 加无水硫酸镁干燥。柱层析分离纯化, 获得目标化合物无色固体青蒿琥酯(2 027 mg, 收率65%); 纯度99%。1H NMR (400 MHz, CDCl3) δ 5.53 (d, 1H, J= 9.9 Hz), 4.76 (s, 1H), 2.42 (m, 2H), 2.34 (m, 4H), 2.20 (m, 1H), 1.88~1.08 (m, 10H), 1.36 (m, 3H), 0.89~0.78 (m, 6H)。
2 中间体化合物A-1的合成二氯亚砜(18.8 mmol, 3 280 mg)溶于10 mL甲醇中, 反应液降温至-10 ℃, 然后加入精氨酸(11.5 mmol, 2 000 mg)。室温反应过夜, 减压旋出溶剂并加入乙醚20 mL, 降温至-20 ℃重结晶获得无色固体目标物A-1 (2 160 mg, 收率98%); 纯度99%。1H NMR (400 MHz, D2O) δ 3.68 (s, 3H), 3.15 (m, 2H), 1.91 (m, 2H), 1.64 (m, 2H)。
3 目标化合物A-2及A-3的合成青蒿琥酯(1 mmol, 384 mg)和L-精氨酸甲酯A-1 (1 mmol, 188 mg)溶于5 mL DMF中, 常温下搅拌, 然后向该混合液中加入EDCI (1 mmol, 191 mg)和HOBT (0.2 mmol, 27 mg)。常温下继续反应2~3 h。检测反应完毕, 旋出DMF然后加乙酸乙酯萃取, 饱和碳酸氢钠溶液洗涤3次, 加无水硫酸镁干燥, 柱层析分离纯化得到目标物A-2。得淡黄色油状物204 mg, 收率37%;纯度99%。进一步通过氯化氢气体成盐后结晶得到化合物A-3。1H NMR (400 MHz, methanol-d4) δ 5.45 (m, 1H), 4.79 (m, 1H), 4.11 (1H), 3.83 (s, 3H), 3.37 (1H), 3.28~3.26 (m, 2H), 2.35~1.50 (m, 18H), 1.34 (m, 3H), 0.94~0.84 (m, 6H); 13C NMR (100 MHz, CDCl3) δ 174.8, 169.3, 157.2, 104.0, 103.1, 87.7, 80.8, 55.0, 52.8, 52.5, 44.5, 40.6, 40.5, 37.2, 36.1, 34.4, 30.9, 28.6, 28.5, 27.3, 24.9, 24.5, 24.4, 24.2, 19.6, 12.1。
4 目标化合物的溶解度测试合成的目标化合物在水和不同pH值的缓冲液中的溶解度见表 1。与青蒿素相比, A-2在水中的溶解度达到2.34 mg·mL-1, 是青蒿素的19.8倍; 同时目标化合物的盐酸盐A-3在水中的溶解度进一步增加, 可达到青蒿素的27.8倍。在不同pH值的缓冲溶液中, A-2和A-3在pH 4.0缓冲液中的溶解度比pH 7.0及pH 9.0缓冲液中略有增加。
| Table 1 Solubility of the synthesized compounds |
合成的化合物对H37Rv菌株的抑菌活性见表 2。并以青蒿素、精氨酸和异烟肼为对照。结果表明, 青蒿素对于结核分枝杆菌MIC为100 μg·mL-1, 目标化合物A-2和A-3 MIC分别为20和10 μg·mL-1, 相对青蒿素提高了5~10倍。与合成的化合物A-2及A-3相比, 精氨酸未表现出明显抗菌活性, 阳性对照药物异烟肼则显示了更强的抗菌活性。由于化合物A-3在实验中显示比A-2更强的活性, 以下实验采用A-3进行。
| Table 2 In vitro anti-tuberculosis test for synthesized compounds. MIC: Minimal inhibitory concentration |
化合物A-3对THP-1巨噬细胞的体外毒性检测结果见图 1。当给予A-3 100 μg·mL-1后, 随着给药剂量增加至1 000 μg·mL-1, 细胞存活率无明显降低。
7 化合物A-3对THP-1巨噬细胞的胞内H37Rv菌株抑制作用化合物A-3对感染了H37Rv细菌的THP-1巨噬细胞的胞内细菌的抑制作用见图 2。在第4天和第7天时, 与空白对照相比, A-3在100~1 000 μg·mL-1浓度内, 甚至在较低浓度(100和200 μg·mL-1)下可显著抑制胞内细菌的生长(P < 0.05或P < 0.01), 其作用强于100 μg·mL-1青蒿素, 但不如阳性对照药物异烟肼。

|
Figure 2 In vitro inhibition of the intracellular bacteria growth of A-3 on THP-1 cells (n = 3, x±s). CFU: Colony-forming units. *P < 0.05, **P < 0.01 vs blank group; #P < 0.05 vs artemisinin |
目前临床上常用的抗结核药物如异烟肼、利福平等的使用已经超过半个世纪, 新的抗结核药物非常稀缺, 迫切需要开发具有新的作用机制, 并有效抑制或杀灭结核菌的新药。
本研究利用青蒿素本身具有的过氧化桥环结构, 在细菌内部可释放出活性氧簇ROS发挥其抗结核杆菌活性, 进一步通过共价键引入具有穿透细菌细胞壁功能的精氨酸残基, 并对其溶解度及体外抗结核杆菌和抗胞内结核杆菌感染的效果进行考察。结果显示所合成的化合物不仅显著提高了青蒿素的溶解度, 而且提高了对结核杆菌和胞内感染结核杆菌的抑制活性。
在合成步骤中, 通过使用双功能性的琥珀酸作为连接桥, 将精氨酸和青蒿素通过共价键连接起来。精氨酸不仅增加分子的溶解度, 而且可以破坏细菌细胞壁, 从而增加细菌对青蒿素分子的摄取。
溶解度实验结果表明, 合成的化合物A-2及A-3在水中的溶解度可达约2~3 mg·mL-1, 并在酸性缓冲盐溶液中进一步提高。这可能是在青蒿素的结构上引入了多个羰基及呈弱碱性的胍基, 显著增强了目标化合物的极性。说明在酸性溶液中或引入酸根有利于增加其在水中的溶解度。
体外抑菌实验表明, 合成的化合物MIC可达到10~20 μg·mL-1, 明显低于青蒿素的MIC, 虽不及阳性对照药物异烟肼, 仍展现了较好的抗菌活性。人单核白血病巨噬细胞中的细胞毒性实验表明合成的化合物对于细胞本身的毒性很小。在胞内感染模型实验中, 化合物A-3显示出比青蒿素更优异的抑制胞内细菌繁殖的作用, 是具有成药潜力的抗结核先导化合物。值得一提的是, 本研究尚未进行合成的化合物对耐药性结核杆菌的药效实验, 目前这部分实验正在筹划中, 还需要进一步研究探讨。
| [1] | Wei FH, Xu LH. Role of autophagy in Mycobacterium tuberculosis infection[J]. Chin J Veter Med (中国兽医杂志), 2018, 54: 65–68. |
| [2] | Coll F, Phelan J, Hill-Cawthorne GA, et al. Genome-wide analysis of multi-and extensively drug-resistant Mycobacterium tuberculosis[J]. Nat Genet, 2018, 50: 307–316. DOI:10.1038/s41588-017-0029-0 |
| [3] | Geng YH, Li ZQ. Research progress of the anti-tuberculosis drugs[J]. China Pharm (中国药业), 2016, 25: 10–17. |
| [4] | Zhuo WJ, Liu ZH, Qian M, et al. Analysis of rpoB mutation in rifampicine resistant tubercle bacillus with different resistance phenotype to first line antituberculosis drugs[J]. Mod Hosp (现代医院), 2014, 14: 4–6. |
| [5] | Chaudhary S, Sharma V, Jaiswal PK, et al. Stable tricyclic antitubercular ozonides derived from artemisinin[J]. Org Lett, 2015, 17: 4948–4951. DOI:10.1021/acs.orglett.5b02296 |
| [6] | Choi WH. Novel pharmacological activity of artesunate and artemisinin:their potential as anti-tubercular agents[J]. J Clin Med, 2017, 6: 30. DOI:10.3390/jcm6030030 |
| [7] | Yang GX, Zheng X, Sun GX, et al. Research progress on artemisinin and its derivatives[J]. World Latest Med Inf (世界最新医学信息文摘), 2013, 13: 26–28. |
| [8] | Guo ZR. Development of artemisinin antimalarial drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 157–164. |
| [9] | Wang ZJ, Li YR, Wu WC, et al. Advances in pharmacological studies of artemisinin and its derivatives[J]. Guangxi Med J (广西医学), 2018, 40: 1222–1224. |
| [10] | Li B, Zhou H. Advances on the study of the pharmacological effects of artemisinin and its derivatives[J]. Chin J Clin Pharm Therapeut (中国临床药理学与治疗学), 2010, 15: 572–576. |
| [11] | Wang J, Zheng CY, Liu L, et al. Progress in synthesis and anticancer activities of artemisinin derivatives[J]. World Notes Antibiot (国外医药-抗生素分册), 2018, 39: 68–73. |
| [12] | Li T, Chen H, Liu XG, et al. Immunoregulatory effect of artesunate on allergic contactdermatitis and its mechanism[J]. Acta Pharm Sin (药学学报), 2012, 47: 884–889. |
| [13] | Wang CM, Chen J, Jiang M, et al. Relationship between artesunate influence on the process of TGF-β1 induced alveolar epithelial cells transform intomesenchymal cells and on idiopathic pulmonary fibrosis[J]. Acta Pharm Sin (药学学报), 2014, 49: 142–147. |
| [14] | Zhan NY, Nie G, Huang HQ, et al. Preliminary study of artesunate and dihydroartemisinin reversing the susceptibility of RFP or INH resistant Mycobacterium tuberculosis[J]. J Sun Yat-sen Univ (中山大学学报), 2009, 30: 8–11. |
| [15] | Bai J, Sun HF, Chen XF. Studies on the anti-mycobaterium tuberculosis activity of 4 Chinese medicinal herbs[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2007, 18: 77–78. |
| [16] | Ma QQ, Shan AS, Dong N, et al. De novo design of a Leu-Arg-rich antimicrobial peptide[J]. Acta Vet Zootech Sin (畜牧兽医学报), 2011, 42: 804–807. |
| [17] | Zhao WC, Han LL, Peng YJ, et al. Effect of basic amino acids on the biological activity of helical antimicrobial peptide[J]. Chem J Chin Univ (高等学校化学学报), 2018, 439: 681–687. |
| [18] | He DX, Chen L, Zhao JW, et al. Research trends of aminoglycosides-aminoglycoside derivatives containing guanidyl groups[J]. World Notes Antibiot (国外医药-抗生素分册), 2006, 27: 79–83. |
| [19] | Zhou FW, Lei HS, Fan L, et al. Design, synthesis, and biological evaluation of dihydroartemisinin-fluoroquinolone conjugates as a novel type of potential antitubercular agents[J]. Bioorg Med Chem Lett, 2014, 24: 1912–1917. DOI:10.1016/j.bmcl.2014.03.010 |
| [20] | Bardts M, Ritter H. Novel copolymers showing interactions of amidinium-carboxylate groups in water[J]. J Polym Res, 2011, 18: 151–155. DOI:10.1007/s10965-010-9401-9 |
 2019, Vol. 54
2019, Vol. 54


