口服制剂中的药物只有溶解于胃肠道分泌液中, 才能充分接触胃肠道黏膜实现有效吸收。在生物药剂学分类系统(biopharmaceutic classification system, BCS)中, Ⅱ类药物具有低溶解度高渗透性的特点, 其在体内的吸收受限于药物的溶出速率, 进而影响药物的生物利用度和治疗效果。BCSⅡ类药物通常以稳定的晶型存在, 由于晶格能的束缚, 溶解度较差。通过破坏晶格结构, 使药物从晶型态转变成无定型态, 可显著提高药物溶解度和溶出速率。但无定型分子处于高能状态, 容易转变为稳定的晶型物质, 影响药物的体外溶出和体内吸收性质[1, 2]。为了维持无定型药物的稳定, 可借助多孔材料的多孔特性装载药物分子, 利用孔道的空间位阻效应限制药物分子的空间取向, 抑制药物重结晶所需的分子间作用力, 致使无定型药物难以转变为晶态, 维持较高的溶解性。因此, 多孔材料可作为难溶性药物的载体, 有效提高药物溶解度和溶出速率[3, 4]。
金属有机骨架材料(metal-organic frameworks, mofs)是由金属离子和有机配体通过配位键连接而成的有机-无机杂化多孔材料, 具有规则的孔道结构和较大的孔隙率。与传统无机或有机多孔材料相比, 具有更好的孔道可调控性和可修饰性[5]。γ-环糊精金属有机骨架材料(γ-cyclodextrin metal-organic framework, CD-MOF)由钾离子与γ-环糊精通过配位键自组装形成, 不同于其他金属有机骨架材料, CD-MOF的合成过程避免了苯二甲酸和均苯三甲酸等有潜在毒性有机配体的使用, 具有良好的生物相容性[6]。CD-MOF具有多孔道体心结构, 每个晶胞单元内部有一个1.7 nm球形空腔, 晶胞单元之间有柱形孔道, 直径为0.78 nm, 且形成CD-MOF的有机配体γ-环糊精具有桶状疏水空腔。CD-MOF的多种孔道结构适于大多数客体分子的装载。目前, CD-MOF主要用于气体存储和分离[7-10], 以及药物递送[11-13]等领域。
作为药物递送载体, 已有相关研究表明CD-MOF能显著增强难溶性药物布洛芬[12]和阿齐沙坦[14]的溶解度, 但尚未有不同粒径CD-MOF增加难溶性药物溶解度差异比较。本研究选用难溶性药物二氟尼柳(diflunisal, DIF)为模型药, 采用浸渍法促使药物装载入CD-MOF孔道中。通过扫描电镜、粉末X-射线衍射和傅里叶红外光谱等方法表征载药前后的载体形貌和晶格结构变化, 并探究载体的体外释药性能和细胞毒性, 验证CD-MOF作为难溶性药物增溶载体的应用潜力。
材料与方法仪器 粉末X-射线衍射仪(D2 Phaser)、傅里叶红外光谱仪(EQUINOX 55) (德国Bruker公司); 马尔文激光粒度分析仪(Zetasizer Nano ZS和Mastersizer 2000, 英国马尔文公司); 扫描电镜(EVO MA10, 卡尔蔡司公司); 同步热分析仪(STA 449 F3 Jupiter®, 德国耐驰仪器制造有限公司); 全自动快速比表面与孔隙度分析仪[ASAP2460, 麦克默瑞提克(上海)仪器有限公司]; 酶联免疫检测仪(ELX800, 美国伯腾仪器有限公司)。
药品和试剂 DIF原料药(批号: 120502, 质量分数99.42%, 中国巨化集团公司); γ-环糊精(γ-cyclodextrin, γ-CD, 广州泰龙生化科技有限公司); 氢氧化钾(potassium hydroxide, KOH, 麦克林试剂公司); 十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide, CTAB, 西格玛试剂公司); 甲醇、异丙醇(天津大茂化学试剂厂, 分析纯)。
CD-MOF的制备 根据文献报道方法[15]制备不同粒径的CD-MOF (图 1), 按比例称取γ-CD与KOH (1:8, mol/mol)加入适量去离子水中, 待溶解完全后采用0.45 μm滤膜过滤。加入适量甲醇溶液, 充分振摇, 将反应瓶转移至50 ℃水浴加热6 h。取出反应瓶, 加入适量CTAB, 振摇均匀后室温静置过夜, 制得微米级CD-MOF (CD-MOF-Micro)。加CTAB的同时额外加入适量体积甲醇溶液, 可调节产物粒径, 制得纳米级CD-MOF (CD-MOF-Nano)。最后, 沉淀物用异丙醇洗涤, 离心干燥, 制得CD-MOF。

|
Figure 1 The fabrication process of γ-cyclodextrin metal-organic framework by solvent thermal method |
二氟尼柳装载 将DIF完全溶解于无水乙醇, 加入适量的空白载体, 室温低速搅拌过夜。样品离心, 用乙醇洗涤, 真空干燥24 h, 得到载药的γ-环糊精金属有机骨架材料(DIF-MOF)。
二氟尼柳包合物制备 称取适量γ-CD和DIF (1:1, mol/mol)分别完全溶解于定量去离子水和无水乙醇。将γ-CD溶液转移至70 ℃水浴锅搅拌加热, 滴加DIF乙醇溶液, 反应4 h后, 取出反应瓶冷却至室温, 转移至4 ℃冰箱放置24 h。沉淀物用无水乙醇洗涤, 离心干燥, 制得DIF包合物(DIF-CD)。
样品表征 扫描电镜:样品粉末分散在样品板上, 喷金处理, 实验加速电压为20~30 kV; 粉末X-射线衍射:扫描范围为5°~40°, 扫描速度为0.1 s, 检测温度为室温; 氮气吸附-解吸附:实验样品先于60 ℃下脱气6 h, 测定温度为77 K, 由Brunauer Emmett Teller方程计算比表面积; 傅里叶红外光谱: KBr压片法制备样品, 扫描范围为400~4 000 cm-1; 热重分析:氮气速率为40 mL·min-1, 升温速度为10 ℃·min-1, 温度范围为30~400 ℃。
标准曲线的建立 准确称取DIF适量, 用甲醇溶解, 转移至50 mL量瓶, 定容得DIF母液。母液依次用甲醇稀释成质量浓度为998、479.04、191.62、76.65、30.66、12.26、4.91、1.96、0.78和0.31 μg·mL-1 DIF标准溶液, 用高效液相色谱测定含量。以标准溶液浓度(C)为横坐标, 对应峰面积(A)为纵坐标, 进行回归分析, 绘制DIF溶液标准曲线。得到的回归方程为A = 3.36×107C-27 007, r = 0.999 9, 线性范围为0.31~479.04 μg·mL-1。
色谱条件:色谱柱为Gemini-NX·5u C18柱(250 mm×4.60 mm, 5 μm); 流动相为5%醋酸溶液-甲醇(26:74, v/v); 检测波长为253 nm; 流速为1 mL·min-1; 柱温为35 ℃; 进样量为10 μL。
载药量测定 精密称取DIF-MOF和DIF-CD各1 mg, 分别溶解于1 mL超纯水, 0.22 μm滤膜过滤, 按照建立的高效液相方法测定载药量, 平行3份。
饱和溶解度测定 加适量超纯水溶液于离心管中, 分别加入过量DIF-MOF-Nano、DIF-MOF-Micro、DIF-CD和DIF, 将离心管放置气浴恒温振荡器(37 ℃, 100 r·min-1) 24 h, 取上清液, 0.22 μm滤膜过滤, 按照建立的液相方法测定各样品的饱和溶解度, 平行3份。
药物体外释放 以超纯水为释放介质, 控制溶出介质温度为37 ℃, 用透析袋法进行药物释放实验。精密称取含1 mg DIF的DIF-MOF、DIF-CD和DIF 1 mg分别装于提前活化处理的透析袋中, 扎紧袋口。将装有样品的透析袋置于释放介质中, 每隔一段时间取样1 mL并补加1 mL新鲜介质, 样液用0.22 μm微孔滤膜过滤, 按照建立的高效液相方法在253 nm处测定不同时间点药物释放量, 平行3份。
采用FDA推荐的相似因子ƒ2对DIF-MOF-Nano、DIF-MOF-Micro、DIF-CD和DIF 4组体外释放曲线相似程度进行检验, 相似因子计算公式如(1)所示, 若受试与参比制剂的溶出曲线间的ƒ2值不小于50, 则认为两者相似, ƒ2值越大两曲线间差异越小, 释药曲线完全相同时, ƒ2=100;当小于50时, 则表明两释药曲线有显著性差异。
| $ {f_2} = 50\log \left\{ {{{\left[ {1 + \frac{1}{n}\sum\limits_{t = 1}^n {{{\left( {{R_t} - {T_t}} \right)}^2}} } \right]}^{ - 0.5}}} \right\} \times 100 $ | (1) |
式中, Rt和Tt分别表示参比制剂和受试制剂于第t时间点的累积药物释放量; n代表选取计算时间点数(n=3~5且R > 85%的点不超过1个)。
细胞毒性研究 用含10%胎牛血清、1%双抗的DMEM培养液培养RAW264.7巨噬细胞, 轻轻吹打使细胞脱落, 离心沉淀, 弃去上清液。加入适量培养液吹打制得细胞悬液, 控制细胞数为1×105个/mL, 接种至96孔培养板中(每孔100 μL, 含1×104个细胞, 设置6个复孔)。将接种细胞的培养板转移至细胞培养箱培养过夜, 24 h后按照实验设置加入不同浓度的含药培养液, 放在培养箱中继续培养24 h, 每孔加CCK-8试剂10 μL, 用酶联免疫检测仪测定450 nm处吸光度值, 根据公式(2)计算巨噬细胞存活率(CL)。
| $ {\rm{CL}} = [({A_{\rm{s}}} - {A_{\rm{b}}})/({A_{\rm{c}}} - {A_{\rm{b}}})] \times 100\% $ | (2) |
其中, As表示实验组吸光度, Ac表示对照组吸光度, Ab表示仅含培养基的空白组吸光度。
结果与讨论 1 扫描电镜借助扫描电镜对载体形貌进行表征。图 2a和b分别是CD-MOF-Nano和CD-MOF-Micro的扫描电镜结果。从图中可见, 合成的CD-MOF呈立方体形貌, 大小均一且不同粒径级别之间尺寸差异明显。马尔文激光粒度分析仪测定CD-MOF-Nano平均粒径为530 nm, 而CD-MOF-Micro平均粒径为6.085 μm, 与扫描电镜图尺寸大致一致。合成初始阶段, 钾离子和环糊精在甲醇水溶液中充分接触, 加热促使钾离子与环糊精配位形成立方体晶胞单位, 不同晶胞单位之间由于环糊精次面上羟基与钾离子的配位作用产生堆积效应, 晶体持续生长, 形成CD-MOF-Micro。在晶体生长阶段, 额外的甲醇溶剂加入反应瓶中, 可降低晶核接触几率, 晶体生长速率受限, 从而控制合成CD-MOF-Nano[16]。

|
Figure 2 The SEM images of nano size γ-cyclodextrin metal- organic framework (CD-MOF-Nano) (a) and micro size γ-cyclodextrin metal-organic framework (CD-MOF-Micro) (b) |
基于晶体物质晶胞中原子、离子或分子数目和位置的特异性, 利用粉末X-射线衍射技术确定药物晶型和结构, 区分晶态与非晶态物质, 同时通过对比特征峰的峰型和位置可推知晶型结构是否发生改变。图 3a是不同尺寸CD-MOF的粉末X-射线衍射结果, CD-MOF-Nano和CD-MOF-Micro特征峰均在2θ=16°左右, 峰型无明显差异, 表明CD-MOF粒径大小对于载体晶型和结构影响甚微。图 3b是载药后载体的粉末X-射线衍射结果, 载体特征峰位置与峰型均无明显变化, 与晶型药物DIF的特征峰显著不同, 表明DIF以无定型形态完全装载于孔道中, 且装载过程不会破坏载体的晶格结构。
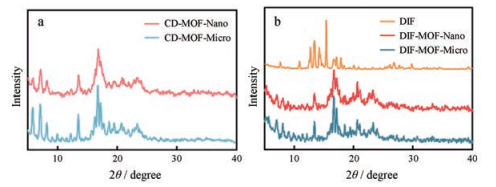
|
Figure 3 The powder X-ray diffraction patterns of CD-MOF-Nano and CD-MOF-Micro (a). The powder X-ray diffraction patterns of diflunisal (DIF) and DIF loaded CD-MOF (DIF-MOF) (b) |
N2吸附-解吸附可用于表征CD-MOF载体的孔径分布和比表面积。图 4为不同尺寸CD-MOF载药前后的N2吸附-解吸附等温线。结果表明, 不论是纳米级还是微米级载体的等温线, 均属于Ⅰ类N2吸附-脱附等温线, 即Langmuir型等温线, 表明其孔组织结构为微孔型, 测得平均孔径均为1.20 nm。CD-MOF-Nano比表面积略高于CD-MOF-Micro, 分别为522.47和488.30 m2·g-1, 载药后对应的比表面积值均不同程度下降, 表明DIF装载于CD-MOF孔道中。而两种粒径的DIF-MOF吸附等温线与脱附等温线在低压处均不重合, 可能是因为孔道中的DIF原料药对N2的吸附作用过强, 进而影响N2解吸附过程。
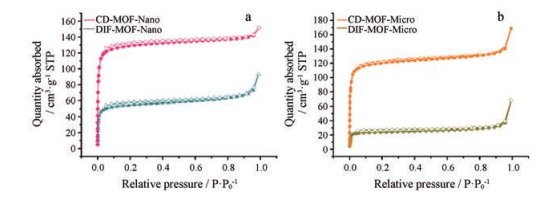
|
Figure 4 Nitrogen adsorption and desorption isotherms of CD-MOF-Nano and DIF-MOF-Nano (a) and CD-MOF-Micro and DIF-MOF-Micro (b) |
傅里叶红外光谱可探究分子结构及DIF与金属有机骨架之间的作用力, 进一步确证DIF成功装载于MOF孔道中。图 5a和b分别为CD-MOF-Nano和CD-MOF-Micro载药前后, 以及与原料药物理混合物的红外光谱结果。DIF在3 123和1 687 cm-1的吸收峰分别对应苯环游离羟基和羧酸羰基的特征峰, 1 223和1 198 cm-1的吸收峰均为C-F键的伸缩振动峰。CD-MOF空白载体在3 361 cm-1处有游离羟基的伸缩振动峰。而DIF-MOF的红外光谱中未观察到DIF原料药的特征吸收峰, 仅观察到DIF峰强减弱的C=C键伸缩振动峰和C-H弯曲振动峰, 表明DIF完全装载进CD-MOF孔道中, 而非游离于载体表面。与空白载体相比, DIF-MOF的羟基吸收峰增强, 可能是因为DIF羰基与载体羟基之间存在氢键作用。此外, DIF羰基与钾离子间存在的强静电作用也有利于药物的装载过程。由此分析可知, DIF装载于CD-MOF孔道中是多种作用力的综合作用。
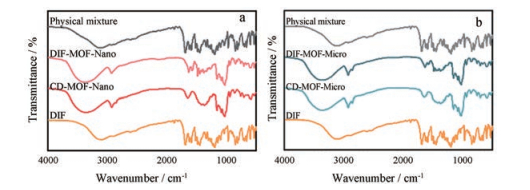
|
Figure 5 The Fourier infrared spectrometer results of DIF, CD-MOF-Nano, DIF-MOF-Nano and the physical mixture of DIF and CD-MOF-Nano (a) and DIF, CD-MOF-Micro, DIF-MOF-Micro and the physical mixture of DIF and CD-MOF-Micro (b) |
借助同步热分析仪分别对γ-CD、DIF、CD-MOF-Nano、CD-MOF-Micro及载药载体DIF-MOF进行表征。随着温度的升高, 物质的物理化学性质发生改变, 进而分析物质成分。图 6是6组样品热重分析结果。6组样品在100 ℃均有重量损失, 这是因为吸附在样品表面或孔道中的水分受热蒸发, 其中CD-MOF-Nano重量变化最明显。环糊精在320~340 ℃降解产生失重阶梯, 这一降解现象也体现在CD-MOF中, 但是降解温度前移至250~320 ℃, 与环糊精相比, CD-MOF热稳定性降低。模型药DIF在220 ℃开始降解, 而CD-MOF孔道中DIF降解起始温度后移至300 ℃, 表明药物全部装载于孔道中, 而非游离于载体表面, 并且由于纳米孔道的毛细管作用力限制熔融DIF汽化失重[17, 18], 药物降解温度升高, 热稳定性增强。

|
Figure 6 The thermal gravity analysis curves of γ-CD, DIF, CD-MOF-Nano, CD-MOF-Micro, DIF-MOF-Nano and DIF-MOF-Micro |
借助高效液相色谱法和标准曲线换算, 测得CD-MOF-Nano载药量为17%, 而CD-MOF-Micro载药量为15%。同等质量的载体, 尺寸越小, 比表面积越大, 与药物分子的接触面更大, 有利于药物装载。因此, CD- MOF-Nano有更高的载药量。此外, DIF-CD的载药量仅为3.6%, 小于CD-MOF的载药量, 可能是CD-MOF结构中球形空腔和柱形通道为药物装载提供更大的空间, 以及钾离子的静电作用有利于药物的吸附。
实验测得DIF原料药的饱和溶解度为0.043 mg·mL-1, DIF-CD饱和溶解度为0.155 mg·mL-1, 与原料药相比, 溶解度提高了3.6倍。将DIF装载于CD-MOF中, 溶解度得以进一步提高, CD-MOF-Nano和CD-MOF-Micro的饱和溶解度分别为4.594和1.289 mg·mL-1, 与原料药相比, 溶解度提高了约100倍和30倍, 增溶能力均强于环糊精。
模型药DIF是pH依赖型难溶性药物, 其溶解度和溶出速率受pH影响, 故本研究选择超纯水作为体外溶出介质, 以透析袋法考察药物的体外释放能力, 实验结果如图 7所示。结果表明, 装载于CD-MOF的DIF在1 h内释放量达到90%以上, 而原料药的释放量不足20%, 表明CD-MOF能显著提高药物溶解速率和溶解度。CD-MOF结构中不仅有环糊精的疏水空腔, 还有晶胞内部球形空腔和晶胞单位间柱形通道, DIF通过疏水作用, 氢键等分子间相互作用力可装载于CD-MOF孔道中, 键能较低, 有利于难溶性药物分子的释放。其次, 由于晶态药物DIF以无定型态吸附于CD-MOF孔道中, 并且孔道的空间位阻作用能够维持高能不稳定的无定型态, 自由能大且没有晶格结构束缚, DIF溶出速率较晶态原料药显著提高。此外, CD-MOF外表面富含羟基, 呈亲水性, 有利于水分子与孔道中的药物接触, 促进溶解。而对比不同粒径DIF-MOF的释放行为可发现微米级DIF-MOF药物释放比纳米级快, 可能是因为CD-MOF-Nano表面能级大, 分子之间易于团聚, 减弱了与水分子之间的作用, 进而影响药物释放。

|
Figure 7 The cumulative release percentage of DIF from different sizes of CD-MOF (n = 3, x±s) |
为探究不同制剂的释放差异, 本研究以DIF原料药为参比制剂, DIF-CD、纳米级和微米级DIF-MOF为受试制剂, 选取的时间点分别为15、30、45 min和1、2、3、4和5 h。3种受试制剂相似因子ƒ2计算结果如表 1所示, ƒ2值均小于50, 可知3条释放曲线与DIF释放曲线相比均有显著性差异, 用γ-CD或CD-MOF包载难溶性药物能显著提升其溶出速率, 且CD-MOF的增溶能力更强。
| Table 1 The ƒ2 values of diflunisal inclusion compound (DIF-CD), DIF-MOF-Nano and DIF-MOF-Micro |
采用CCK-8法探究空白载体对巨噬细胞生存率的影响, 进一步评价CD-MOF的生物相容性, 实验结果如图 8所示。环糊精是天然的葡萄糖环状低聚物, 生物相容性好, 无细胞毒性, 随着实验剂量的增高, 巨噬细胞RAW264.7的存活率无显著下降趋势。以环糊精为原料制备的不同尺寸CD-MOF空白载体, 细胞存活率有明显区别。在CD-MOF-Micro最高质量浓度100 µg·mL-1作用下, 巨噬细胞存活率保持在90%以上, 无明显抑制细胞增殖作用, 生物相容性与环糊精相当。相比而言, CD-MOF-Nano对细胞抑制作用较强, 同等浓度范围内细胞存活率均低于环糊精组和CD-MOF-Micro组, 这可能是因为合成过程中引入的分子调节剂CTAB残留在团聚的纳米粒内部, 简单的离心洗涤较难清除完全, 进而对细胞产生抑制作用, 后续研究可通过改变CTAB去除方法以减少残留。
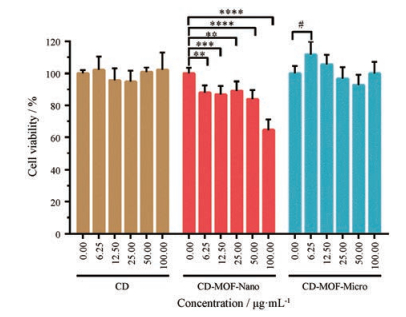
|
Figure 8 In vitro cytotoxicity of different concentrations of CD, CD-MOF-Nano and CD-MOF-Micro in Raw 264.7 cells (n = 6, x±s).**P < 0.01, ***P < 0.001, ****P < 0.000 1; #P < 0.05 |
本文采用溶剂热法合成不同粒径的CD-MOF, 制得CD-MOF-Nano和CD-MOF-Micro均呈立方体形貌, 具有明显晶格结构, 比表面积大, 孔道多样。进一步采用浸渍法将药物装载于CD-MOF的内部孔道, 粉末X-射线衍射、N2吸附-解吸附及傅里叶红外光谱等表征结果显示难溶性药物与载体之间通过多种作用力实现装载, 且药物负载后CD-MOF的形貌和晶格结构均无显著性变化。载药体系的溶出速率和溶解度较原料药显著提高, 有利于改善难溶性药物的生物利用度。实验结果表明, 空白载体细胞毒性低, 生物相容性好, 进一步表明CD-MOF有望成为难溶性药物的增溶载体, 并具有良好的体内应用前景。
| [1] | Ying J, Lü Y, Du GH. Progress in the research of amorphous pharmaceuticals[J]. Acta Pharm Sin (药学学报), 2009, 44: 443–448. |
| [2] | Mishima O, Calvert LD, Whalley E. An apparently first-order transition between two amorphous phases of ice induced by pressure[J]. Nature, 1985, 314: 76–78. DOI:10.1038/314076a0 |
| [3] | Quan GL, Wu QL, Zhang XX, et al. Enhancing in vitro dissolution and in vivo bioavailability of fenofibrate by solid self-emulsifying matrix combined with SBA-15 mesoporous silica[J]. Colloids Surf B Biointerfaces, 2016, 141: 476–482. DOI:10.1016/j.colsurfb.2016.02.013 |
| [4] | Quan GL, Chen B, Wang ZH, et al. Improving the dissolution rate of poorly water-soluble resveratrol by the ordered mesoporous silica[J]. Acta Pharm Sin (药学学报), 2012, 47: 239–243. |
| [5] | Ren H, Zhu GS. Porous organic frameworks:synthetic strategy and their applications[J]. Acta Chim Sin (化学学报), 2015, 73: 587–599. DOI:10.6023/A15010071 |
| [6] | Wu MX, Yang YW. Metal-organic framework (MOF)-based drug/cargo delivery and cancer therapy[J]. Adv Mater, 2017. DOI:10.1002/adma.201606134 |
| [7] | Forgan RS, Smaldone RA, Gassensmith JJ, et al. Nanoporous carbohydrate metal-organic frameworks[J]. J Am Chem Soc, 2012, 134: 406–417. DOI:10.1021/ja208224f |
| [8] | Hartlieb KJ, Holcroft JM, Moghadam PZ, et al. CD-MOF:a versatile separation medium[J]. J Am Chem Soc, 2016, 138: 2292–2301. DOI:10.1021/jacs.5b12860 |
| [9] | Eddaoudi M, Kim J, Rosi N, et al. Systematic design of pore size and functionality in isoreticular MOFs and their application in methane storage[J]. Science, 2002, 295: 469–472. DOI:10.1126/science.1067208 |
| [10] | Gassensmith JJ, Furukawa H, Smaldone RA, et al. Strong and reversible binding of carbon dioxide in a green metal-organic framework[J]. J Am Chem Soc, 2011, 133: 15312–15315. DOI:10.1021/ja206525x |
| [11] | Li HY, Lv NN, Li X, et al. Composite CD-MOF nanocrystals-containing microspheres for sustained drug delivery[J]. Nanoscale, 2017, 9: 7454–7463. DOI:10.1039/C6NR07593B |
| [12] | Hartlieb KJ, Ferris DP, Holcroft JM, et al. Encapsulation of ibuprofen in CD-MOF and related bioavailability studies[J]. Mol Pharm, 2017, 14: 1831–1839. DOI:10.1021/acs.molpharmaceut.7b00168 |
| [13] | Abucafy MP, Caetano BL, Chiari-Andreo BG, et al. Supramole-cular cyclodextrin-based metal-organic frameworks as efficient carrier for anti-inflammatory drugs[J]. Eur J Pharm Biopharm, 2018, 127: 112–119. DOI:10.1016/j.ejpb.2018.02.009 |
| [14] | He YZ, Zhang W, Guo T, et al. Drug nanoclusters formed in confined nano-cages of CD-MOF:dramatic enhancement of solubility and bioavailability of azilsartan[J]. Acta Pharm Sin B, 2018. DOI:10.1016/j.apsb.2018.09.003 |
| [15] | Singh V, Guo T, Xu HT, et al. Moisture resistant and biofriendly CD-MOF nanoparticles obtained via cholesterol shielding[J]. Chem Commun, 2017, 53: 9246–9249. DOI:10.1039/C7CC03471G |
| [16] | Wang SZ, McGuirk CM, d'Aquino A, et al. Metal-organic framework nanoparticles[J]. Adv Mater, 2018. DOI:10.1002/adma.201800202 |
| [17] | Zhang P, Forsgren J, Strømme M. Stabilisation of amorphous ibuprofen in upsalite, a mesoporous magnesium carbonate, as an approach to increasing the aqueous solubility of poorly soluble drugs[J]. Int J Pharm, 2014, 472: 185–191. DOI:10.1016/j.ijpharm.2014.06.025 |
| [18] | Abd-Elrahman AA, El Nabarawi MA, Hassan DH, et al. Ketoprofen mesoporous silica nanoparticles SBA-15 hard gelatin capsules:preparation and in vitro/in vivo characterization[J]. Drug Deliv, 2016, 23: 3387–3398. DOI:10.1080/10717544.2016.1186251 |
 2019, Vol. 54
2019, Vol. 54


