2. 中国食品药品检定研究院包装材料与药用辅料检定所, 北京 100050
2. Institute of Packaging Materials and Pharmaceutical Excipients, National Institutes for Food and Drug Control, Beijing 100050, China
随着组合化学和高通量筛选技术的发展, 新化学实体的数目不断增加, 但50%以上的新化学实体溶解性低, 口服生物利用度差[1]。改善难溶性药物的溶解度一直是药剂学工作者研究和探讨的重点。多种制剂技术曾用于提高难溶性药物的溶解度[2], 其中, 通过溶剂法制备固体分散体技术是提高难溶性药物水溶性的一种有效技术策略[3, 4]。相比于其他方法, 溶剂法具有许多优势[5-10]:适用于热不稳定的药物和高熔点或高玻璃态转化温度的载体材料; 操作简单易行; 可工业化程度高。
螺内酯(spironolactone)是一种利尿药[11], 作用于远曲小管和集合管皮质段, 拮抗醛固酮对上述部位的排钾保钠作用, 临床上常与强效利尿剂呋塞米联用, 主要用于伴有醛固酮升高的顽固性水肿, 如肾病综合症、肝硬化腹水及充血性心力衰竭[12]。但是, 螺内酯属于生物药剂学分类系统第Ⅱ类药物, 水溶性低, 生物利用度差, 应用受限。提高水溶解性是提高其口服吸收和疗效的关键。因此, 本研究拟采用固体分散体技术提高螺内酯的水溶解性: ①以溶解度参数法为依据, 对常用的固体分散体辅料进行初筛; ②采用溶剂法制备固体分散体; ③对螺内酯固体分散体进行全面的理化性质表征, 比较不同辅料对螺内酯的增溶作用, 研究药物与辅料之间的相互作用对水溶解性的影响; ④通过影响因素试验, 确定螺内酯固体分散体的最优处方, 明确影响其稳定性的关键因素。
材料与方法仪器 HITACHI Chromaster高效液相色谱仪(5110泵, 5210自动进样器, 5310柱温箱, 5410紫外检测器, 日本日立公司); RC806D溶出试验仪(天津天大天发科技有限公司); UV-1102Ⅱ型紫外-可见分光光度计(上海天美科学仪器有限公司); DSC1差示扫描量热分析仪(瑞士梅特勒-托利多公司); D8 discover X射线衍射仪(德国布鲁克AXS有限公司); ZFS 55红外光谱仪(德国布鲁克光谱仪器公司)。
药品与试剂 螺内酯原料药(浙江朗华制药有限公司, 纯度 > 99.47%, 批号OT00N101015);螺内酯对照品(中国食品药品检定研究院, 纯度 > 99.7%, 批号100193-201102);乙腈(色谱纯, 天津市康科德科技有限公司); 冰醋酸(色谱纯, 天津市科密欧化学试剂有限公司); 四氢呋喃(色谱纯, 赛默飞世尔科技中国有限公司); 氢氧化钠(色谱纯)、盐酸(分析纯)、30%过氧化氢(分析纯) (天津市博迪化工有限公司); 水为重蒸水; 1号明胶胶囊壳(苏州胶囊有限公司); 聚乙烯己内酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物(polyvinylcaprolactame-polyvinyl acetate-polyethylene glycol graft copolymer, Soluplus)、共聚维酮(vinyl pyrrolidone/ vinyl acetate copolymer, PVP VA64) (德国巴斯夫公司); 羟丙基甲基纤维素E5 (hydroxypropyl methylcellulose E5, HPMC-E5, 上海卡乐康包衣技术有限公司); 羟丙基甲基纤维素琥珀酸酯LF (hydroxypropyl methyl cellulose succinate LF, HPMCAS LF, 日本信越化学工业株式会社); 聚氧乙烯(polyethylene oxide, PEO, 上海优道奥巴化工有限公司)。
溶解度参数法 螺内酯的化学结构如图 1所示, 文献报道[13-16]的各个基团的内聚能贡献值如表 1所示, 采用基团贡献法[17, 18]计算螺内酯、Soluplus、PVP VA64、HPMC-E5、HPMCAS和PEO的溶解度参数并计算螺内酯与5种辅料的溶解度参数之差(△δ), 确定5种载体材料与螺内酯的相容性。

|
Figure 1 Chemical structure of spironolactone |
| Table 1 Solubility parameter calculation for spironolactone using the group contribution method. N: The number of repeating units; Fd and Fp: Molar attraction constants due to dispersion and polar components; Eh: Hydrogen bonding energy; Vm: Molar volume |
载体种类的筛选 分别称取2.5 g的PVP VA64、Soluplus、PEO、HPMC-E5和HPMCAS, 与500 mg螺内酯置于250 mL茄形瓶中, 加入二氯甲烷100 mL或二氯甲烷100 mL与无水乙醇(HPMC-E5不溶于纯二氯甲烷) 50 mL, 超声, 使螺内酯与载体完全溶解且分散均匀。将茄形瓶置于40 ℃水浴中, 旋转蒸发除去有机溶剂, 得到螺内酯固体分散体, 置于干燥器中存放24 h, 进一步除去残留的有机溶剂。干燥后将其粉碎, 过80目筛, 置于干燥器中备用。
体外溶出 分别考察螺内酯原料药、物理混合物和固体分散体的体外溶出。称取样品适量(相当于螺内酯约50 mg), 灌装于1号明胶胶囊壳中。按照《中华人民共和国药典》2015年版通则0931溶出度测定法, 以纯水1 000 mL为溶出介质, 温度为(37 ± 0.5) ℃, 转速为75 r·min-1。依法操作, 分别在5、10、15、20、30、45和60 min时, 取样10 mL, 同时补加相同温度、相同体积的纯水。将样品用纯水定量稀释, 摇匀, 按照《中华人民共和国药典》2015年版通则0401, 采用紫外-可见分光光度法, 在242 nm波长处测定吸光度; 另取螺内酯对照品适量, 精密称定, 加乙腈20 mL溶解, 用溶出介质定量稀释, 摇匀, 制成质量浓度约为100 mg·L-1溶液, 精密量取1 mL至10 mL量瓶中, 用溶出介质稀释至刻度, 摇匀, 同法测定, 计算螺内酯的累积溶出量。
差示扫描量热法(differential scanning calorimetry, DSC) 分别对螺内酯原料药、HPMC-E5、螺内酯-HPMC- E5物理混合物(1:5, w/w)、螺内酯-HPMC-E5固体分散体(1:5, w/w)、Soluplus、螺内酯-Soluplus物理混合物(1:5, w/w)和螺内酯-Soluplus固体分散体(1:5, w/w)进行差示扫描量热分析。精密称取样品约3~5 mg, 置于铝坩埚中, 坩埚盖上留一针孔, 坩埚压盖密封, 以氧化铝为参比。测定条件: N2流速40 mL·min-1, 温度范围20~220 ℃, 升温速率10 ℃·min-1。记录各个样品的差示扫描量热曲线。
X射线衍射法(X-ray diffraction, XRD) 对上述样品进行X射线衍射分析。测定条件: Cu靶, 高压40 kV, 单流30 mA, 扫描2θ角度3°~50°, 扫描速度6°·min-1。记录样品X射线衍射曲线。
傅里叶转换红外光谱法(Fourier transform infrared spectroscopy, FT-IR) 本研究采用溴化钾压片法, 对上述样品进行傅里叶转换红外光谱分析。测定条件如下:扫描波长范围400~4 000 cm-1, 分辨率2 cm-1。
影响因素试验 高温试验:称取螺内酯固体分散体粉末适量, 置于铝塑包装袋中, 密封。将样品分别放置于40 ℃和60 ℃烘箱中, 于第5、10天取样。高湿试验:称取螺内酯固体分散体粉末适量, 均匀平铺于表面皿中, 然后敞口放置于相对湿度(relative humidity, RH) 75%和92.5%的环境下(分别由饱和氯化钠溶液和饱和硝酸钾溶液提供), 于第5、10天取样。高温和高湿试验取出的样品分别采用差示扫描量热法、X射线衍射法、傅里叶转换红外光谱法和体外溶出法来确定药物在载体中的分散状态, 进而得出不同载体对药物物理稳定性的影响。
结果 1 溶解度参数法筛选载体材料采用基团贡献法计算螺内酯的溶解度参数为22.5 MPal/2。Soluplus、PVP VA64、HPMC-E5、HPMCAS和PEO的溶解度参数[13]以及与螺内酯的溶解度参数之差△δ见表 2[13-16]。由表中数据可知, Soluplus、PVP VA64、HPMC-E5、HPMCAS、PEO与螺内酯溶解度参数之差△δ均小于7 MPa1/2, 说明载体与螺内酯相容性良好, 均可用于螺内酯固体分散体的制备。
| Table 2 Solubility parameters of drug and carrier materials. δ: Solubility parameter; △δ: Solubility parameter differences; PVP: Vinyl pyrrolidone/vinyl acetate copolymer; HPMC: Hydroxypropyl methylcellulose; HPMCAS: Hydroxypropyl methyl cellulose succinate; PEO: Polyethylene oxide |
采用溶剂法制备螺内酯固体分散体, 并考察固体分散体的体外溶出行为, 结果如图 2所示。与螺内酯原料药和药物-载体的物理混合物相比, 以PVP VA64、PEO和HPMCAS为载体的螺内酯固体分散体在水中的溶出速率及溶出度未得到显著提高, 而以Soluplus和HPMC-E5为载体的螺内酯固体分散体在水中的溶出速率及溶出度明显提高, 60 min时, 螺内酯的累积溶出量达到90%以上。因此, 选择Soluplus和HPMC-E5为载体进行下一步研究。

|
Figure 2 Dissolution profiles of bulk SP, SP-carrier materials physical mixture and SP-carrier materials solid dispersions. SP: Spironolactone; PM: Physical mixture; SD: Solid dispersion. A: Bulk SP and SP-carrier materials physical mixture; B: Bulk SP, SP-carrier solid dispersions |
差示扫描量热实验结果如图 3所示。由图可知, 螺内酯原料药在其熔点处有一晶体熔融吸热峰; HPMC-E5和Soluplus不存在熔融吸热峰; 而物理混合物的DSC曲线中仍存在一个熔融吸热峰, 说明药物仍以晶体形式存在, 但是, 其峰变宽、变钝, 且熔点降低, 这很可能是载体的存在而引起的熔点抑制现象; 而两种固体分散体的DSC曲线中, 与螺内酯熔点相对应的吸热峰均消失, 说明螺内酯可能以无定型状态分散于载体中。

|
Figure 3 Differential scanning calorimetry (DSC) curves of SP-HPMC-E5 solid dispersion, SP-Soluplus solid dispersion, SP-HPMC-E5 physical mixture, SP-Soluplus physical mixture, HPMC-E5, Soluplus and bulk SP |
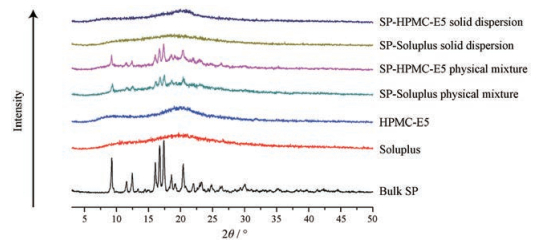
X射线衍射实验结果如图 4所示。由图可知, 螺内酯原料药在9.26°、11.47°、12.39°、15.99°、16.85°、17.35°和20.25°处可以检测到明显的特征衍射峰; 而HPMC-E5和Soluplus不存在这些特征峰; 物理混合物中, 尽管螺内酯的某些特征衍射峰被掩盖, 但在9.24°、11.41°、12.36°、15.99°、16.62°、17.24°和20.22°处仍然能够检测到其特征衍射峰, 说明螺内酯仍以晶体形式存在于物理混合物中; 而制备成固体分散体后, 螺内酯的特征衍射峰完全消失, 说明螺内酯可能以无定型状态分散于载体中。
|
Figure 4 X-ray diffraction (XRD) patterns of SP-HPMC-E5 solid dispersion, SP-Soluplus solid dispersion, SP-HPMC-E5 physical mixture, SP-Soluplus physical mixture, HPMC-E5, Soluplus and bulk SP |
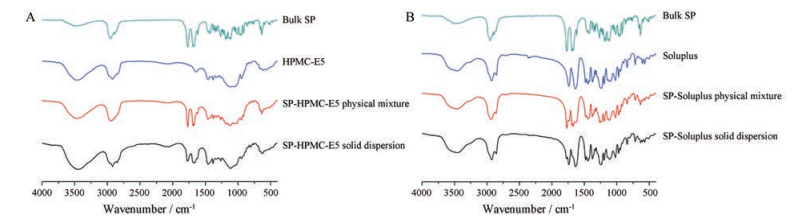
傅里叶转换红外光谱结果如图 5所示。结合化学结构及样品的红外吸收图谱可知, 螺内酯原料药中存在O=C-O-、O=C-S-和O=C-C=C-的羰基伸缩振动特征峰, 分别位于1 768.7、1 691.4和1 673.7 cm-1; HPMC-E5中存在-OH峰, 位于3 468.9 cm-1; 螺内酯-HPMC-E5物理混合物的红外吸收图谱中存在螺内酯的羰基伸缩振动特征峰, 分别位于1 769.2、1 690.9和1 672.8 cm-1, 说明简单的物理混合基本不影响螺内酯3个羰基的红外吸收的峰位及强度; 而螺内酯-HPMC-E5固体分散体的红外吸收图谱中, HPMC-E5的羟基峰向低波数移动, 位于3 448.2 cm-1, 螺内酯O=C-O-峰位基本不变, 但O=C-S-和O=C-C=C-羰基的伸缩振动峰信号减弱, 且向低波数移动, 并合并为一个宽、钝的峰, 位于1 662.7cm-1。说明螺内酯的O=C-S-和O=C-C=C-的羰基很可能与载体HPMC-E5的-OH形成了氢键。载体Soluplus中存在-OH、O=C-O-和O=C-NH-羰基的伸缩振动特征峰, 分别位于3 455.0、1 740.5和1 638.3 cm-1; 螺内酯-Soluplus物理混合物的红外吸收图谱中, 能够检测到螺内酯和Soluplus相应的特征吸收峰, 且峰位基本不变; 而制备成螺内酯-Soluplus固体分散体后, Soluplus羟基峰向低波数移动, 由3 455.0 cm-1变为3 443.7cm-1, 螺内酯与Soluplus O=C-O-羰基的红外吸收峰位基本不变, 分别位于1 773.9和1 738.6 cm-1, 而螺内酯O=C-S-和O=C-C=C-羰基的红外信号减弱向低波数移动, 并与Soluplus的O=C-NH-羰基合并为一个宽、钝的吸收峰, 位于1 638.5 cm-1。综合分析各个样品的红外吸收图谱, 推测螺内酯的O=C-S-和O=C-C=C-羰基可能与Soluplus的-O-形成了氢键。
|
Figure 5 Fourier transform infrared spectroscopy (FT-IR) spectra of bulk SP, HPMC-E5, SP-HPMC-E5 physical mixture, and SP-HPMC-E5 solid dispersion(A) and bulk SP, Soluplus, SP-Soluplus physical mixture, and SP-Soluplus solid dispersion (B) |
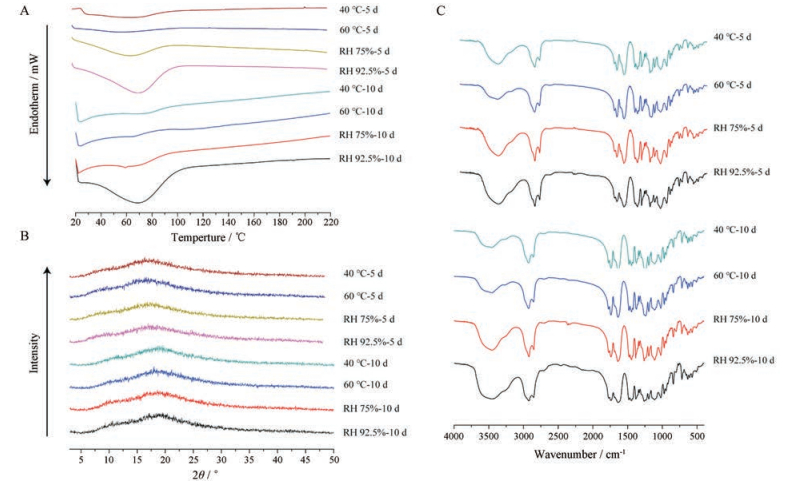
螺内酯-Soluplus固体分散体在高温和高湿条件下放置, DSC和XRD曲线(图 6A, B)中均未出现螺内酯的特征峰。螺内酯-Soluplus固体分散体中存在3个羰基特征吸收峰(图 6C), 0天时分别位于1 773.9、1 738.6和1 638.5 cm-1; 高温和高湿条件下放置后, 红外吸收图谱与0天相比无明显变化, 说明螺内酯与Soluplus之间的氢键未被破坏。
|
Figure 6 DSC curves (A), XRD patterns (B) FT-IR spectra (C) of solid dispersions prepared with Soluplus after storage under various conditions for 5 and 10 days |
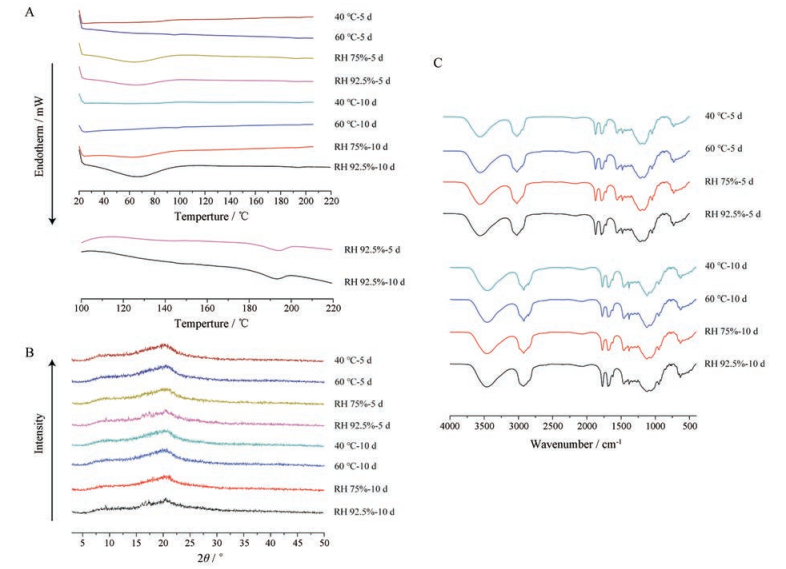
螺内酯-HPMC-E5固体分散体在RH 92.5%条件下放置, DSC和XRD曲线(图 7A, B)中均可以找出螺内酯的特征峰, 说明有药物晶体析出。螺内酯-HPMC-E5固体分散体在40 ℃、60 ℃、和RH 75%的条件下放置5和10天后, 红外吸收图谱(图 7C)中羟基向高波数移动, 由3 448.2 cm-1 (0天)分别变为3 464.8 cm-1 (40 ℃ 5天)、3 462.7 cm-1 (60 ℃ 5天)、3 463.1 cm-1 (RH 75% 5天)、3 451.1 cm-1 (40 ℃ 10天)、3 454.0 cm-1 (60 ℃ 10天)和3 460.9 cm-1 (RH 75% 10天); 螺内酯O=C-O-羰基峰位基本保持不变; 0天时位于1 662.7 cm-1吸收峰向高波数移动, 分别位于1 690.7 cm-1 (40 ℃ 5天)、1 691.0 cm-1 (60 ℃ 5天)、1 690.5 cm-1 (RH 75% 5天)、1 690.5 cm-1 (40 ℃ 10天)、1 689.8 cm-1 (60 ℃ 10天)和1 691.4 cm-1 (RH 75% 10天), 与螺内酯原料药的O=C-S-羰基吸收峰位相同, 说明螺内酯O=C-S-羰基与HPMC-E的-OH之间的氢键被破坏, 但螺内酯的O=C-C=C-羰基与HPMC-E5的-OH之间的氢键不受影响。在RH 92.5%条件下放置5天和10天时, 红外吸收图谱中同时出现螺内酯O=C-S-和O=C-C=C-羰基吸收峰, 分别位于1 691.0 cm-1 (5天)、1 675.8 cm-1 (5天)、1 691.4 cm-1 (10天)和1 676.2 cm-1 (10天), 说明螺内酯的O=C-S-、O=C-C=C-羰基与HPMC-E5羟基之间的氢键作用消失。
|
Figure 7 DSC curves (A), XRD patterns (B), and FT-IR spectra (C) of solid dispersions prepared with HPMC-E5 after storage under various conditions for 5 and 10 days |
在高温、高湿环境下放置后, 螺内酯-Soluplus固体分散体在水中的溶出无变化。在高温条件下放置5和10天后, 螺内酯-HPMC-E5固体分散体的溶出基本不变, 但在RH 75%条件下放置5和10天后, 螺内酯-HPMC-E5固体分散体在水中的溶出速率及溶出度降低, 在RH 92.5%环境下放置5和10天后, 螺内酯-HPMC-E5固体分散体的溶出显著降低, 60 min内累积溶出量仅约为60%。结果见图 8。

|
Figure 8 Dissolution curves of solid dispersions prepared with Soluplus or HPMC-E5 after storage under various conditions for 5 and 10 days |
螺内酯溶解度较差, 疏水性强, 在水中溶出时药物漂浮于溶出介质表面, 导致体外溶出较低。与螺内酯原料药相比, 药物-载体物理混合物在水中的溶出均有一定程度提高, 这是由于药物在物理混合物中分散后, 附着在药物表面的载体降低了药物与溶出介质之间的表面张力。另外, 对于溶剂法制备的固体分散体而言, 亲水性载体增加了药物的润湿性, 并且药物在载体中的分散度大大提高, 更重要的是, 药物由晶体状态转化为分子或无定型状态, 溶出时无需克服晶格能。因此, 通过选择合适的载体来制备螺内酯固体分散体是提高螺内酯体外溶出的有效方法。
溶解度参数法可以有效地筛选与药物相容性良好的载体, 研究表明, 若两种物质的溶解度参数之差△δ (△δ=|δ1-δ2}) < 7 MPa1/2, 则相容性良好; 若△δ≥10 MPa1/2, 则两种物质不相容。由表 2可知, Soluplus和HPMC-E5与螺内酯△δ仅为0.9和0.1 MPa1/2, 相比于PVP VA64、HPMCAS、PEO更小, 与药物之间的互溶性更好, 得到的固体分散体更加均一, 水溶性更好, 这与螺内酯-Solupus固体分散体和螺内酯-HPMC-E5固体分散体的体外溶出结果是一致的。
采用Soluplus和HPMC-E5为载体的固体分散体均可以显著提高螺内酯在水中的的溶出速率和溶出度, 在60 min内的累积溶出量达到90%以上。实验表明, 这是由于药物和载体形成了氢键, 使药物以无定型的形式分散于载体中, 提高了药物的溶出速率和溶出度。但影响因素试验结果表明, 螺内酯-HPMC-E5固体分散体的稳定性不如螺内酯-Soluplus固体分散体, 这是由于在储存过程中, 环境中的水分会竞争性地与药物或载体结合, 破坏了药物和载体之间的氢键相互作用。HPMC-E5与药物之间的氢键结合力较Soluplus弱, 所以在储存过程中会造成制剂的老化进而导致药物的溶出速率和溶出度下降。由此可以得出结论, 以Soluplus制备的固体分散体稳定性更好, 既能够提高药物的溶出, 也可以提高药物在储存过程中的稳定性。
| [1] | Kerns EH. High throughput physicochemical profiling for drug discovery[J]. J Pharm Sci, 2001, 90: 1838–1858. DOI:10.1002/jps.1134 |
| [2] | Yue PF, Liu Y, Xie J, et al. Review and prospect on preparation technology of drug nanocrystals in the past thirty years[J]. Acta Pharm Sin (药学学报), 2018, 53: 529–537. |
| [3] | Vasconcelos T, Sarmento B, Costa P. Solid dispersions as strategy to improve oral bioavailability of poor water soluble drugs[J]. Drug Discov Today, 2007, 12: 1068–1075. DOI:10.1016/j.drudis.2007.09.005 |
| [4] | Chiou WL, Riegelman S. Pharmaceutical applications of solid dispersion systems[J]. J Pharm Sci, 1971, 60: 1281–1302. DOI:10.1002/jps.2600600902 |
| [5] | Chen MW, Chen WR, Chen TK, et al. Application research of hot-melt extrusion in preparation of solid dispersion[J]. Acta Pharm Sin (药学学报), 2012, 47: 163–167. |
| [6] | Kim EJ, Chun MK, Jang JS, et al. Preparation of a solid dispersion of felodipine using a solvent wetting method[J]. Eur J Pharm Biopharm, 2006, 64: 200–205. DOI:10.1016/j.ejpb.2006.04.001 |
| [7] | Wu JX, Yang M, van den Berg F, et al. Influence of solvent evaporation rate and formulation factors on solid dispersion physical stability[J]. Eur J Pharm Sci, 2011, 44: 610–620. DOI:10.1016/j.ejps.2011.10.008 |
| [8] | Sethia S, Squillante E. Solid dispersion of carbamazepine in PVP K30 by conventional solvent evaporation and supercritical methods[J]. Int J Pharm, 2004, 272: 1–10. DOI:10.1016/j.ijpharm.2003.11.025 |
| [9] | Munjal M, Stodghill SP, ElSohly MA, et al. Polymeric systems for amorphous Δ9-tetrahydrocannabinol produced by a hot-melt method. Part Ⅰ:Chemical and thermal stability during processing[J]. J Pharm Sci, 2006, 95: 1841–1853. DOI:10.1002/jps.20667 |
| [10] | Shah S, Maddineni S, Lu J, et al. Melt extrusion with poorly soluble drugs[J]. Int J Pharm, 2013, 453: 233–252. DOI:10.1016/j.ijpharm.2012.11.001 |
| [11] | Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure[J]. New Engl J Med, 1999, 341: 709–717. DOI:10.1056/NEJM199909023411001 |
| [12] | Lula I, Gomes MF, Piló-Veloso D, et al. Spironolactone and its complexes with β-cyclodextrin:modern NMR characterization and structural DFTB-SCC calculations[J]. J Incl Phenom Macrocycl Chem, 2006, 56: 293–302. DOI:10.1007/s10847-005-9030-9 |
| [13] | Zhu L, Yang M, Zhang Q, et al. Preparation of posaconazole solid dispersion via hot-melt extrusion and preliminary evaluation in vitro[J]. J China Pharm Univ (中国药科大学学报), 2015, 46: 309–315. |
| [14] | Yun F, Kang A, Shan J, et al. Preparation of osthole-polymer solid dispersions by hot-melt extrusion for dissolution and bioavailability enhancement[J]. Int J Pharm, 2014, 465: 436–443. DOI:10.1016/j.ijpharm.2014.02.040 |
| [15] | Sarode AL, Sandhu H, Shah N, et al. Hot melt extrusion (HME) for amorphous solid dispersions:predictive tools for processing and impact of drug-polymer interactions on supersaturation[J]. Eur J Pharm Sci, 2013, 48: 371–384. DOI:10.1016/j.ejps.2012.12.012 |
| [16] | Crowley MM, Fredersdorf A, Schroeder B, et al. The influence of guaifenesin and ketoprofen on the properties of hot-melt extruded polyethylene oxide films[J]. Eur J Pharm Sci, 2004, 22: 409–418. DOI:10.1016/j.ejps.2004.04.005 |
| [17] | Xiang WJ, Guo XR, Han J. Application of solubility parameters in solid dispersions[J]. Pharm Today (今日药学), 2010, 20: 5–8. |
| [18] | Just S, Sievert F, Thommes M, et al. Improved group contribution parameter set for the application of solubility parameters to melt extrusion[J]. Eur J Pharm Biopharm, 2013, 85: 1191–1199. DOI:10.1016/j.ejpb.2013.04.006 |
 2019, Vol. 54
2019, Vol. 54


