2. 中国医学科学院北京协和医学院药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
番荔枝内酯(ACGs), 又称番荔素, 是由番荔枝科植物中分离的抗肿瘤有效部位, 由一系列结构类似的化合物组成[1]。这些化合物在结构上通常含有35~37个碳原子的长链脂肪族酸、1个α, β不饱和链、0~3个四氢呋喃环和γ-内酯环[2-4]。番荔枝内酯及从中分离得到的单一化合物对多种癌细胞均表现出强烈的抗肿瘤活性[5]。泡番荔枝辛(bullatacin)是活性最强的番荔枝内酯化合物之一。从ED50看, 对A549和MCF-7的生长抑制作用是多柔比星的1×104~1×105倍[6], 对人白血病细胞HL-60的杀伤作用是一线抗癌药紫杉醇的300倍[7]。ACGs还能逆转许多肿瘤细胞系的多重耐药性(multidrug resistance, MDR)[8]。然而, ACGs的溶解性差(小于1 μg·mL-1)和较窄的治疗窗口限制了药物递送和体内抗肿瘤研究[9, 10]此外, ACGs是植物来源的有效部位, 是一系列具有类似结构的天然成分的混合物, 给制剂的制备也带来一些困难。目前报道的ACGs的制剂有乳剂[11]、滴丸剂[12]和固体分散剂[13]等, 在体内研究中还有使用ACGs的油溶液[14], 但这4种剂型载药量都很低。ACGs本身是脂溶性长脂肪链内酯类成分, 乳剂中大量油相的存在给ACGs的含量测定带来很大困难。且滴丸、固体分散体和油溶液只能口服, 无法静脉注射给药。
纳米混悬剂是一种以少量辅料将难溶性药物制备成的纳米大小的颗粒, 具有极高的载药量, 可高效递送难溶药物[15, 16], 同时可兼顾口服和静脉注射等多种给药途径[17]。本课题组先后以PCL-mPEG和TPGS等为主要辅料, 报道了ACGs纳米混悬剂的制备, 显示其在解决ACGs溶解性的同时, 既能口服给药, 也能静脉注射, 显著提高了其体内外抗肿瘤作用[18, 19]。但这些辅料缺乏药用规格, 所制备的ACGs载药纳米粒在临床上暂时还不具备应用的可能性。为此, 本研究采用FDA批准可用于静脉注射, 且在国内能通过商业途径获得药用规格的辅料为载体, 尝试制备ACGs纳米粒, 考察是否具有较好的稳定性和能否显著提高体内抗肿瘤药效, 以便为ACGs走向临床应用奠定基础[20]。
材料与方法仪器和材料 Zetasizer Nano ZS 90型粒度仪/电位仪(英国Malvern Instruments公司); Ultimate 3000高效液相色谱仪(美国Dionex公司); Venusil C18 Plus色谱柱(250 mm × 4.6 mm, 5 μm); Tecan Infinite M1000 PRO全波长多功能酶标仪(瑞士TECAN公司); JSM-IT500扫描电子显微镜(日本电子珠式会社); KM-200DE超声仪(昆山市美美超声仪器有限公司); PLPHR 2-4 LD Plus低温冻干机(德国CHRIST有限公司); JN-3000温控型高压均质机(广州聚能仪器有限公司); RYJ-12B药物透皮扩散仪(上海黄海药检有限公司); MCO-18AC二氧化碳培养箱(日本Sanyo公司); 番荔枝总内酯(批号20180112)、番荔枝内酯K19由药用植物研究所黄文华研究员实验室提供; 泊洛沙姆(P-188, 批号P-7000)、泊洛沙姆P407 (批号P2443-250G) (美国Sigma公司); 卵磷脂(SPC, 批号A4140170, 广州汉方中药研发有限公司); 人血清白蛋白(HSA, 批号70024-90-7, 北京诺其雅盛生物科技有限公司); 葡萄糖(批号170228, 北京化工厂); 紫杉醇注射剂(PTX, 批号170903, 北京协和药厂)。
动物及细胞培养 Balb/c小鼠, 雌性, 体重17~18 g; 昆明小鼠, 雌雄各半, 体重19~21 g, 北京华阜康动物技术有限公司提供, SPF级, 合格证号: 11401300078017, 许可证编号: SCXK (京) 2014-004; 4T1鼠乳腺癌细胞株、HeLa宫颈癌细胞株、HepG2肝癌细胞株、MCF-7人乳腺癌细胞株(北京协和医学院细胞中心); RPMI 1640培养基、高糖DMEM培养基、胎牛血清、青链霉素双抗(美国Gibco公司); 96孔无菌培养板(美国Corning公司)。
番荔枝内酯纳米混悬剂的制备及条件筛选
载体种类筛选 精密称量药物载体P188、P407、SPC和HSA (0.1%含量的载体, m/v)各5 mg, 分别溶于5 mL纯水中; 另称量ACGs 5 mg, 用200 μL的有机溶剂(甲醇、无水乙醇或丙酮)溶解, 室温和超声(250 W)条件下将有机溶液缓慢滴入5 mL水相中, 形成带有乳光的液体, 即番荔枝内酯纳米混悬剂(ACGs-NSps), 37 ℃减压旋转蒸发除去有机溶剂, 调整水相体积至5 mL, 测定其粒径、电位和多分散指数(polydispersity index, PDI)值, 筛选出最合适的载体。
药载比筛选 精密称取ACGs各5 mg, 按照ACGs和P188的重量比(药载比)为1:1、5:1和1:5称取相应的辅料, 按上述方法制备ACGs-NSps并测定, 筛选出合适的药载比。
超声功率筛选 精密称取ACGs 10 mg, 用无水乙醇0.5 mL溶解, 室温下分别在100、150、200和250 W的功率下, 超声滴注到10 mL水相中(含2 mg·mL-1 P188), 按上述方法制备ACGs-NSps并测定, 筛选出合适的超声功率。
制备温度筛选 精密称取ACGs 10 mg, 0.5 mL无水乙醇溶解, 250 W的超声功率下, 分别在温度为4、25、37和45 ℃下滴注到10 mL水相中(含2 mg·mL-1 P188), 按上述方法制备ACGs-NSps并测定, 筛选出合适的制备温度。
采用最优制备工艺, 平行3次制备ACGs-NSps, 测其粒径和表面电位。
ACGs-NSps粒径和形态 用双纯水将ACGs-NSps稀释至100 μg·mL-1, 取5 μL滴在300目的铜网上, 5 min后吸去多余液体, 自然晾干, 用2% (w/v)乙酸铀染色, 晾干3 h, 使用JEM-1400电子显微镜观察药物颗粒的形态。
ACGs的HPLC含量测定 参照文献[6]建立番荔枝内酯HPLC色谱条件, 由于番荔枝内酯是混合物, 其成分中K19 (squamocin)含量最多, 因此将K19作为成分指标, 绘制标准曲线。精密称取ACGs 10 mg用甲醇溶解后转移到10 mL棕色量瓶中, 摇匀定容至刻度, 得到1 mg·mL-1的母液, 用色谱甲醇依次稀释, 得到质量浓度分别为5、10、25、50、75和100 μg·mL-1的标准溶液, 各取样品20 μL于HPLC进行分析, 测得的色谱峰面积(Y)对ACGs标准溶液浓度(X)进行线性回归得出标准曲线方程。
载药量测定 精密吸取ACGs-NSps 5 mL冻干称重, 即为ACGs-NSps的总质量(W1); 加入甲醇5 mL溶解并释放出ACGs, 甲醇定容到25 mL, 稀释到检测范围内, 取200 μL进行HPLC测定, 计算5 mL ACGs-NSps中药物质量(W2)。所有样品均平行3份, 通过下式计算载药量(drug loading, DL):
| $ {\rm{DL }} = {W_2}/{W_1} \times {\rm{ }}100\% $ |
ACGs-NSps室温放置的粒径稳定性 将制备的ACGs-NSps在室温下放置, 在第0、1、3、5、7和15天中, 取样品1 mL测定粒径及其分布, 并观察是否有肉眼可见的混浊、沉淀或悬浮物。每个样品均平行3份。
生理介质中ACGs-NSps的粒径稳定性 用1 mol·L-1 HCl和1.0%胃蛋白酶配制人工胃液, 1.0%胰酶和pH 6.8的磷酸二氢钾溶液配制人工肠液, 与ACGs-NSps (1 mg·mL-1)按照4:1体积比混合, 37 ℃孵育, 在0、2、4、6和8 h, 测定指标同上。
将ACGs-NSps (1 mg·mL-1)与8% NaCl、10% Glu溶液和2×pH 7.4磷酸盐缓冲液(PBS)按照体积比1:1混合, 测定指标同上。
体外血浆稳定性实验研究 观察血浆成分(血清白蛋白和酶)是否与ACGs-NSps相互作用并诱导聚集, 将ACGs-NSps (1 mg·mL-1)与小鼠血浆(1:4, v/v)混合, 测定指标同上。
溶血性测定 前期研究中发现ACGs具有较强的溶血性, 故使用健康的小鼠红细胞进行溶血实验, 考察以P188为载体的ACGs-NSps是否能够静脉注射给药。将新鲜小鼠血液5 000 r·min-1离心10 min, 沉淀的红细胞用0.9% NaCl多次离心洗涤至上清无血色, 稀释成4% (v/v)的红细胞悬液。取获得的红细胞悬浮液0.5 mL分别与0.5 mL去离子水(阳性对照)、0.5 mL的0.9% NaCl (阴性对照)和0.5 mL不同质量浓度的ACGs-NSps (0.25、0.5、1.5、2和2.5 mg·mL-1, 以生理盐水为分散介质)混合, 37 ℃孵育4 h, 5 000 r·min-1离心5 min, 在540 nm处测定上清液的吸光度(A)值。另取0.5 mL不同质量浓度的ACGs-NSps (0.25、0.5、1.5、2和2.5 mg·mL-1, 以生理盐水为分散介质), 加入生理盐水0.5 mL, 同样条件下测定A值, 作为样品对照。根据以下公式计算溶血百分比(hemolytic rate, HR):
| $ {\rm{HR = }}\left( {{A_{样品}} - {A_{阴性对照}}} \right)\left( {{A_{阳性对照}} - {A_{阴性对照}}} \right) \times 100\% $ |
药物体外释放 采用透析袋扩散法考察ACGs-NSps的体外释放。将ACGs-NSps (4 mL, 1 mg·mL-1)置于截留相对分子质量8 000~14 000的透析袋内并浸入2 L PBS (pH 7.4, 0.1 mol·L-1)中, 在37 ℃和100 r·min-1条件下搅拌。在特定时间间隔内, 从透析袋中精密吸取样品50 μL, 加入450 μL甲醇中破坏和溶解ACGs-NSps, 释放出游离药物, 13 000 r·min-1离心10 min, 采用HPLC分析含量。这种方法实测的是透析袋内剩余的药物含量, 通过与透析袋内原有的药物对比, 以减量法计算ACGs的累积释放度。释放介质每24 h更换1次。所有样品平行3份进行测定。
ACGs-NSps冻干复溶 取ACGs-NSps 2 mL直接冻干, 剩余ACGs-NSps平均分成3组, 每组平行3份(每份5 mL), 以0.5%葡萄糖、1.5%葡萄糖、0.5%葡萄糖+ 2% P188作为冻干保护剂, -20 ℃预冻6 h, 冷冻干燥, 加入去离子水5 mL复溶, 观察状态, 测其粒径及其分布。
ACGs-NSps对肿瘤细胞的体外抗肿瘤作用研究 使用4T1、HeLa、MCF-7和HepG2细胞系通过MTT法测定ACGs-NSps的细胞毒性。取消化后的细胞150 μL接种于96孔板(每孔1.0×104个细胞)于培养箱温育过夜。加入不同浓度的ACGs-NSps或游离ACGs的DMSO溶液, 孵育48 h后, 取MTT溶液(5 mg·mL-1) 20 μL加入细胞后孵育4 h。除去培养基, 每孔加入200 μL DMSO以溶解结晶, 在摇床上震荡10 min后, 通过酶标仪在570 nm波长下检测最大A值, 计算细胞抑制率(cell inhibitory rate, CIR):
| $ {\rm{CIR = }}\left( {1 - {A_{实验组}}/{A_{空白对照组}}} \right) \times 100\% $ |
ACGs-NSps对4T1荷瘤小鼠的体内抗肿瘤药效研究 将密度长到80%~90%的小鼠4T1细胞悬浮于培养基(每毫升1.0×107细胞)中, 并在无菌条件下皮下注射0.2 mL到小鼠的右腋下。当肿瘤达到100 mm3时, 将小鼠随机分成5组(每组10只): 0.5 mg·kg-1 ACGs-NSps静脉注射组; 3 mg·kg-1 ACGs-NSps灌胃组; 3 mg·kg-1 ACGs油溶液(原药溶于大豆油)灌胃组; 静脉注射6 mg·kg-1 PTX作为阳性对照组; 静脉注射0.9%生理盐水作为阴性对照组。静脉注射组每两天给药1次, 灌胃组每天给药, 共给药14天。每两天监测体重和肿瘤体积。停药后解剖处理小鼠, 称量肿瘤和肝脾的重量, 计算体内肿瘤抑制率(tumor inhibition rate, TIR)和肝脾指数(liver index, LI; spleen index, SI):
| $ \begin{array}{l} {\rm{TIR}} = \left( {1 - {W_t}/{W_n}} \right) \times 100\% \\ {\rm{LI}} = {W_L}/{W_M}\\ {\rm{SI}} = {W_S}/{W_M} \end{array} $ |
其中, Wn为阴性对照组的平均肿瘤重量, Wt为实验组的平均肿瘤重量, WL为肝的重量, WS为脾的重量, WM为小鼠的体重。
统计学分析 使用SPSS软件的单因素方差分析来检验实验组之间的统计分析, *P < 0.05被认为具有统计学意义。
结果 1 ACGs-NSps的制备及条件筛选 1.1 载体种类的筛选由表 1可以看出, 在各种载体中, 当用P188为ACGs载体时粒径相对最小, 平均粒径为163.2 nm, PDI值为0.080, zeta电位为-26.4 mV。因此, ACGs-NSps的制备选用P188作为载体。
| Table 1 Particle size, polydispersity index (PDI) value and zeta potential of annonaceous acetogenins nanosuspensions (ACGs-NSps) with different stabilizer. SPC: Soya lecithin; HAS: Human serum albumin. n = 3, x±s |
由图 1A可见, 3种药载比的ACGs-NSps的粒径都不大, 但ACGs和P188的药载比例为1:1时粒径较小, 粒径分布也较好。因此, 使用药载比1:1的ACGs-NSps。

|
Figure 1 Particle size and PDI of ACGs-NSps with different drug-stabilizer ratios (A). The impact of ultrasonic intensity on ACGs-NSps (B). The impact of different preparation temperature on particle size of Quercetin-NSps (C). n = 3, x±s. Particle size, distribution and image of ACGs-NSps (D) |
由图 1B可见, 粒径随功率大小的变化, 当超声功率逐渐增强, 制备的粒径也不断变小。功率为200 W和250 W时粒径接近, 为便于后续研究, 选择250 W作为ACGs-NSps的制备功率。
1.4 制备温度筛选由图 1C可见, 随着制备温度升高, 所得纳米粒的粒径也随之增大。温度为4 ℃和25 ℃时粒径接近。从制备方便考虑, 选择25 ℃作为ACGs-NSps的最适制备温度。
综上, 以P188为载体制备ACGs-NSps的最优方案:药载比1:1, 将ACGs的乙醇溶液在25 ℃和250 W超声滴注到水相, 减压旋转蒸发除去有机溶剂。按照最优方案制备的ACGs-NSps实物照片和粒径分布如图 1D所示, 平均粒径约160 nm左右, 粒径分布均匀。
2 ACGs-NSps的表征 2.1 ACGs的标准曲线的建立通过标准曲线方法建立得到ACGs标准曲线方程Y = 0.097 5 X - 0.038 5, R2 = 0.999 9, 检测范围为5~100 μg·mL-1。药物浓度和峰面积符合线性关系, 精密度、准确度和最低检测限均良好, 符合测定要求。
2.2 ACGs-NSps的形态和载药量电镜下ACGs-NSps呈圆整的球形(图 2), 实测载药量为48.18%, 与理论值比较接近。

|
Figure 2 Transmission electron microscope images of ACGs-NSps |
ACGs-NSps在室温下连续放置15天, 期间测定6次粒径, 发现粒径尺寸变化不大(图 3A), 溶液未见沉淀浑浊现象, 说明ACGs-NSps可在此时间内稳定存放。
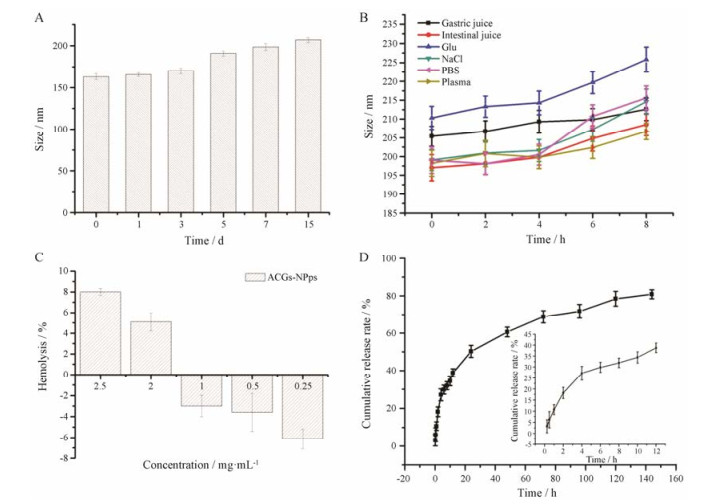
|
Figure 3 The characterization of ACGs-NSps. The placement stability of ACGs-NSps (A). The particle size change of ACGs-NSps in different media (B). Hemolysis rate of ACGs-NSps in different concentrations (C). Cumulative ACGs release from ACGs-NSps in PBS at 37℃ with in 144 h (D). n = 3, x±s |
制备的ACGs-NSps与生理盐水、PBS或5%葡萄糖在37 ℃孵育4 h后, 粒径略有增加(图 3B); 孵育8 h时, 粒径增加不到30 nm, 说明以P188为稳定剂制备的ACGs-NSps具有较好的生理介质稳定性。与人工胃液或人工肠液孵育8 h后也是如此, 同时未见有肉眼可见的颗粒物出现。
血浆含有各种血清白蛋白和酶, 可能吸附在纳米粒的表面并改变其表面性质。这些变化可能导致粒径增大甚至形成大颗粒聚集, 带来堵塞血管等潜在的安全隐患。为此, 将1 mg·mL-1 ACGs-NSps与小鼠血浆于37 ℃温育, 定时测定粒径尺寸和PDI值。结果孵育8 h内, ACGs-NSps粒径略有增加, 但未见大颗粒出现。
纳米粒系统在静脉内给药时不应该有溶血现象。ACGs自身具有强烈的溶血作用, 但制备成纳米混悬剂后发现, 当药物稀释到2.5 mg·mL-1时溶血率低于10%; 1 mg·mL-1及更低浓度时, 完全不溶血(图 3C)。
综上, 制备的ACGs-NSps在生理盐水、PBS、5%葡萄糖和血浆中粒径没有明显变化, 同时质量浓度低于1 mg·mL-1时完全不溶血, 从而满足静脉注射给药的基本要求, 可以静脉给药。
2.5 药物体外释放ACGs-NSps的体外释放大体有两个阶段: 0~12 h释放相对较快和12~144 h释放缓慢, 共累积释放了80.82% (图 3D), 其释放基本符合一级动力学方程(表 2)。ACGs-NSps在前4 h大约释放27%, 这可能是因为吸附在纳米混悬剂表面或分布于纳米混悬剂浅表层的ACGs快速释放的结果。
| Table 2 The fit curves of drug release from ACGs-NSps in phosphate buffered saline |
本文分别选用0.5%葡萄糖、1.5%葡萄糖和0.5%葡萄糖/2% P188作为冻干保护剂复溶, 结果如表 3。直接冻干的ACGs-NSps复溶振荡后有细小悬浮物, 超声后粒径尺寸显著增大。当用0.5%葡萄糖/2% P188联合作为冻干保护剂时, 冻干的粉末加水后快速分散且平均粒径最小, 为189.5 nm。因而, 初步选用0.5%葡萄糖/2% P188为联合冻干保护剂, 对ACGs-NSps进行冻干。
| Table 3 The particle size of ACGs-NSps reconstituted after lyophilization using different lyoprotectants. n = 3, x±s |
由图 4可知, ACGs-NSps在绝大多数浓度下, 对4T1、HeLa、MCF-7和HepG2细胞株的生长抑制作用均显著强于ACGs游离药物(P < 0.05、P < 0.01或P < 0.001)。由IC50值(表 4)显示, ACGs-NSps对4种细胞株的体外抗肿瘤也均显著优于ACGs游离药物(P < 0.05或P < 0.01), 原因是纳米粒与细胞的非特异性相互作用及随后的入胞增加了细胞对载药纳米粒的摄取, 同时说明ACGs-NSps提高了ACGs的抗肿瘤活性。从敏感性程度看, MCF-7对游离的ACGs和ACGs-NSps最为敏感, HepG2最不敏感。
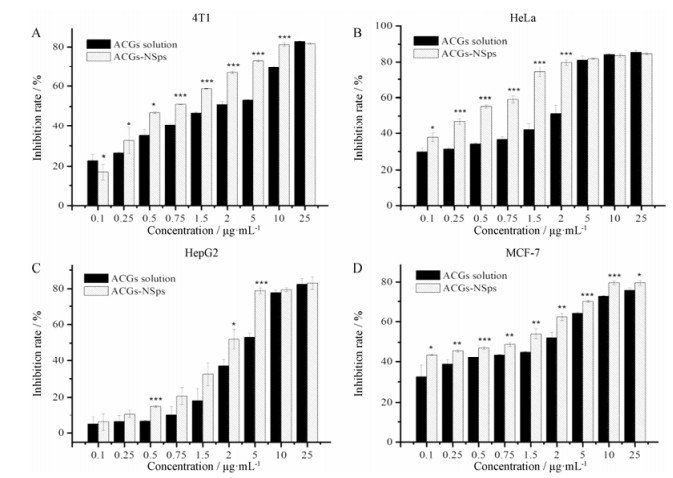
|
Figure 4 The growth inhibition rate of ACGs-NSps and ACGs solution against 4T1 cells (A), HeLa cells (B), HepG2 cells (C) and MCF-7 cells (D). n = 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs ACGs solutio |
| Table 4 IC50 values of ACGs-NSps and ACGs solution against 4T1, HeLa, HepG2 and MCF-7 cell lines. n = 3, x±s. *P < 0.05, **P < 0.01 vs ACGs solution |
用4T1荷瘤鼠对ACGs-NSps的体内抗肿瘤药效进行评估。由各组小鼠肿瘤体积随时间变化曲线(图 5A)可知, 阴性对照组的肿瘤体积快速增长, 实验终点时远大于各实验组(P < 0.001); 3 mg·kg-1剂量下灌胃给药的油溶液和ACGs-NSps肿瘤体积变化曲线比较接近; 0.5 mg·kg-1剂量下隔天注射给药的ACGs-NSps肿瘤体积增长最为缓慢, 与8 mg·kg-1 PTX注射液效果相似并略好。
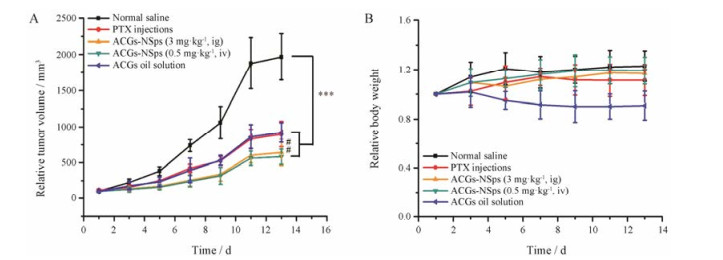
|
Figure 5 The change of tumor volume of 4T1 tumor-bearing mice after administration of ACGs-NSps, PTX injections, normal saline and ACGs oil solution (A). n = 10, x±s. ***P < 0.001; ##P < 0.01. The body weight change of 4T1 tumor-bearing mice after administration of ACGs-NSps, PTX injections, normal saline and ACGs oil solution (B) n = 8, x±s |
由表 5可知, 阳性药PTX注射液(8 mg·kg-1, iv)抑瘤率为55.08%, ACGs油溶液(3 mg·kg-1)抑瘤率为53.11%;而ACGs-NSps灌胃(3 mg·kg-1)和静脉注射(0.5 mg·kg-1)抑瘤率分别为67.23%和70.34%, 均高于阳性对照药, 提示ACGs是比PTX抗肿瘤活性更强的药物。相同剂量下, 灌胃给药ACGs-NSps的抑瘤率高于ACGs油溶液(分别67.23%和53.11%), 显示纳米混悬剂比油溶液具有更好的口服生物利用度。虽然在肝脾指数上, ACGs-NSps与油溶液比较没有显著不同(表 5), 但实验中其他各组小鼠的体重都有所增长, 只有给予油溶液的小鼠体重明显下降(图 5B), 提示油溶液具有较强的毒副作用。实验过程中也观察到油溶液组小鼠出现静卧和蜷缩等现象, 而其他各组小鼠未见异常行为。这些结果提示, 与油溶液相比, ACGs-NSps灌胃同时具有增效和减毒两方面的作用。ACGs-NSps静脉注射, 在隔天给药和0.5 mg·kg-1的低剂量下, 比灌胃给药(3 mg·kg-1)具有更高的抑瘤率(分别为70.34%和67.23%), 除了静脉注射具有完全的生物利用度外, 主要的原因可能在于ACGs-NSps静脉注射改变了ACGs的组织分布, 如由于EPR效应在肿瘤组织有更高的蓄积[6]。
| Table 5 The in vivo antitumor inhibition rate of ACGs-NSps, paclitaxel (PTX) injections and ACGs oil solution in 4T1 tumor-bearing mice and the index of liver and spleen. n = 8, x±s. ***P < 0.001 vs normal saline group; #P < 0.05 vs ACGs oil solution |
从可用于静脉注射的辅料中, 筛选出P188制备ACGs-NSps, 其平均粒径169.4 nm, PDI值为0.130, zeta电位-19.8 mV, 载药量高达48.18%, 室温放置15天, 粒径未见显著变化, 以0.5%葡萄糖和2% P188为联合保护剂进行冻干, 加水分散后粒径相似。ACGs-NSps既可静脉注射, 也可口服给药, 成功解决了ACGs的难溶和难给药问题。纳米混悬剂通过内吞作用显著提高了ACGs对3种肿瘤细胞的体外抗肿瘤作用。
在4T1荷瘤鼠模型上, 肿瘤体积变化曲线终点时显示的肿瘤抑制情况(图 5A)与以瘤重为基础计算的肿瘤抑制率略有不同, 这种情况下通常以瘤重抑瘤率为准。这是因为小鼠肿瘤形状多不规则, 不同测量者的手法和把握尺度松紧也有不同, 这些都会带来一些误差, 而实验结束后剖取肿瘤称重比较客观和准确, 据此计算出来的肿瘤抑制率也更为可靠。本研究中, ACGs-NSps有效提高了ACGs的肿瘤治疗效果。
对于细胞毒药物来说, 灌胃给药应关注对胃肠刺激性。本研究药效实验结束后, 对ACGs-NSps灌胃给药组与阴性对照组的胃、小肠和大肠外观进行了检查, 结果未发现有肉眼可见的异常。这可能与ACGs-NSps具有较好的缓释作用、药物局部浓度不高有关。抗肿瘤药物通常需要在较长时间内连续用药, 多次给药对胃肠的反复刺激是否会带来不良反应需要在以后的工作中继续探索。
综上, 以P188为稳定剂制备的ACGs-NSps口服给药有望发展成为一种可在临床上应用的有效抗肿瘤药物。
| [1] | Ye JB, Wen JJ, Lin YQ, et al. Inhibition of annonaceous acetogenins on cell activities of human gastric cancer cells in vitro[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 2895–2901. |
| [2] | Yuan F, Bai GG, Miao JJ, et al. Effects of annonaceous acetogenins against multidrug resistant human breast cancer cell line MCF-7/ADR in vitro[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 2815–2819. |
| [3] | Li NG, Shi ZH, Tang YP, et al. Progress in total synthesis of annonaceous acetogenins from Annonaceae[J]. Chin J Organ Chem (有机化学), 2009, 29: 350–364. |
| [4] | Wang Y, Qiu HL, Chen JW, et al. Study on acute and cumulative toxicity of total annonaceous acetogenins[J]. Chin J New Drugs Clin Rem (中国新药与临床杂志), 2013, 32: 712–715. |
| [5] | Xu ZF, Wei XY, Xie HH, et al. Inhibition of oxygen consumption by annonaceous acetogenins in liver cell respiration and their structure-activity relationship[J]. Acta Pharm Sin (药学学报), 2002, 37: 818–820. |
| [6] | Hong J, Li Y, Xiao Y, et al. Annonaceous acetogenins (ACGs) nanosuspensions based on a self-assembly stabilizer and the significantly improved anti-tumor efficacy[J]. Colloids Surf B Biointerfaces, 2016, 145: 319–327. DOI:10.1016/j.colsurfb.2016.05.012 |
| [7] | Yu YL, Su KJ, Chen CJ, et al. Synergistic anti-tumor activity of isochaihulactone and paclitaxel on human lung cancer cells[J]. J Cell Physiol, 2012, 227: 213–222. DOI:10.1002/jcp.22719 |
| [8] | Pinto NCC, Silva JB, Menegati LM, et al. Cytotoxicity and bacterial membrane destabilization induced by Annona squamosa L. extracts[J]. An Acad Bras Cienc, 2017, 89: 2053–2073. DOI:10.1590/0001-3765201720150702 |
| [9] | Miao YJ, Shi YY, Xu XF, et al. Three cytotoxic annonaceous acetogenins from the seeds of Annona squamosa[J]. Phytochem Lett, 2016, 16: 92–96. DOI:10.1016/j.phytol.2016.03.006 |
| [10] | Chen YJ, Jin S, Xi J, et al. New cytotoxic annonaceous acetogenin mimetics having a nitrogen-heterocyclic terminal and their application to cell imaging[J]. Tetrahedron, 2014, 70: 4921–4928. DOI:10.1016/j.tet.2014.05.047 |
| [11] | Pan XP, Wu P, Lin LD. Determination of the total content of annonaceous acetogenins in Anuoning emulsion injection by colorimetry[J]. Chin Tradit Herb Drugs (中草药), 2007, 27: 1658–1659. |
| [12] | Dang YJ, Feng HZ, Zhang L, et al. In situ absorption in rat intestinal tract of solid dispersion of annonaceous acetogenins[J]. Gastroenterol Res Pract, 2012, 8: 879–812. |
| [13] | Xu SS, Li X, Chen JW, et al. Preparation technology and determination of annonaceous acetogenins dripping pill[J]. Exp Tradit Med Formul (中国实验方剂学杂志), 2012, 10: 16–19. |
| [14] | Chen Y, Xu SS, Chen JW, et al. Anti-tumor activity of Annona squamosal seeds extract containing annonaceous acetogenin compounds[J]. J Ethnopharmacol, 2012, 142: 462–466. DOI:10.1016/j.jep.2012.05.019 |
| [15] | Dang QL, Kim WK, Nguyen CM, et al. Nematicidal and antifungal activities of annonaceous acetogenins from Annona squamosa against various plant pathogens[J]. J Agric Food Chem, 2011, 59: 11160–11167. DOI:10.1021/jf203017f |
| [16] | Liaw CC, Wu TY, Chang FR, et al. Historic perspectives on annonaceous acetogenins from the chemical bench to preclinical trials[J]. Planta Med, 2010, 76: 1390–1404. DOI:10.1055/s-0030-1250006 |
| [17] | Tietze R, Zaloga J, Unterweger H, et al. Magnetic nanoparticle-based drug delivery for cancer therapy[J]. Biochem Biophys Res Commun, 2015, 468: 463–470. DOI:10.1016/j.bbrc.2015.08.022 |
| [18] | Gao HL, Jiang XG. The development of novel tumor targeting delivery strategy[J]. Acta Pharm Sin (药学学报), 2016, 51: 272–280. |
| [19] | Sun WJ, Xiao Y, Zhang MZ, et al. Preparation of annonaceous acetogenins nanosuspensions and their antitumor effect[J]. Drug Eva Res (药物评价研究), 2016, 39: 966–972. |
| [20] | Hong JY, Sun ZH, Li YJ, et al. Folate modified annonaceous acetogenins (ACGs) nanosuspensions and their improved anti-tumor efficacy[J]. Int J Nanomed, 2017, 12: 5053–5067. DOI:10.2147/IJN |
 2018, Vol. 53
2018, Vol. 53


