据报道, 全球每年约有820万人死于癌症。国家癌症中心发布的数据显示, 我国癌症患者人数呈现上升趋势, 每年癌症死亡人数达250万人, 其中以肺癌患者居多[1]。目前癌症的治疗方法包括手术、化疗和放疗等[2]。然而, 当前大部分抗肿瘤药物都有选择性较差、毒副作用大等缺点[3]。例如广谱抗肿瘤药物多柔比星(doxorubicin, DOX)可用于治疗乳腺癌、卵巢癌、甲状腺癌和非小细胞型肺癌等多种癌症, 其作用机制是嵌入DNA从而抑制核酸的合成[4], 但DOX·HCl具有明显的不良反应尤其是心脏毒性, 极大地限制了临床应用。
相比于传统化疗药物, 纳米给药系统具有诸多优势, 包括可以增加难溶性药物溶解度, 延长体内半衰期等而倍受重视, 尤其是粒径位于20~200 nm纳米粒(nanoparticles, NPs)可通过增强渗透滞留(enhanced permeability and retention, EPR)效应实现肿瘤组织的被动靶向[5]; 此外, 通过对NPs进行靶向配体的修饰, 可进一步赋予其主动靶向特征, 利用受配体相互作用使更多NPs蓄积于靶部位, 实现增效减毒的功效。如以聚L-赖氨酸(poly-L-lysine, PLL)为基础的载体材料, 易与带负电荷的细胞膜相互作用而被摄取, 且具较高的基因转染效率, 可以作为DNA和RNA的特异性递送载体[6, 7]。但由于正电荷的NPs易与血清蛋白结合发生非特异性反应, 血液稳定性差, 易被网状内皮吞噬系统捕捉并快速清除; 同时其生物相容性差, 具有一定的细胞毒性, 使其应用受到限制。透明质酸(hyaluronic acid, HA)是一种天然聚阴离子线性多糖, 具有良好的生物相容性和生物可降解性; HA在中性pH条件下呈负电荷, 可包覆在阳离子NPs的表面以屏蔽其正电荷; 同时, HA自身也是主动靶向配体, 可被非小细胞肺癌(如A549)等恶性肿瘤细胞表面过表达的CD44受体特异性识别[8], 可用于药物与基因的主动靶向递送。此外, 肿瘤细胞外酸性基质中广泛分布的透明质酸酶(hyaluronidase, HAase)可降解NPs表面修饰的HA, 以暴露NPs正电内核[9], 促进细胞摄取, 为环境敏感型递送系统的构建提供了可能。
近年来, 以siRNA为代表的RNA干扰技术为肿瘤的精确治疗提供了新的思路。当siRNA进入细胞后, 可特异性地与相关mRNA结合, 下调特定的蛋白表达[10], 如通过siRNA下调肿瘤细胞VEGF表达可抑制肿瘤新生血管生成[11]。但siRNA在体内呈负电荷并且易被酶解, 需要安全高效的基因载体运载, 而基因载体(如PLL)等有着血液稳定性差、安全性不佳等缺点[12]。因此, 设计一种安全、高效的递送体系尤为重要, 可为基因与药物联合增效应用提供参考, 对肿瘤治疗具有一定的指导意义, 期望在新型纳米剂型技术的理论、方法和技术等方面取得一定进展。
因此, 本研究以PLL接枝还原敏感性材料硫辛酸(lipoic acid, LA), 合成两亲性聚合物PLA, 以LA作为还原性疏水嵌段包载DOX, 同时利用PLL的阳离子吸附带负电荷的siRNA[13], 制得共载DOX/siRNA的NPs, 再通过静电吸附作用将HA包覆于NPs表面, 得到具有主动靶向效应的还原敏感型NPs, 即HA-PLA/DOX-siRNA-NPs。该NPs的体内靶向递送历经了3个过程: ①通过EPR效应实现肿瘤组织被动靶向蓄积; ② HA介导的主动靶向作用与HAase降解HA暴露的正电荷增强细胞摄取; ③胞内实现内涵体逃逸后[14], NPs进入胞浆, 在胞浆中NPs内部的二硫键响应谷胱甘肽(glutathione, GSH)而断裂, NPs结构改变而解体, 释放DOX和siRNA, 分别作用于细胞核和mRNA, 同时发挥诱导细胞凋亡和下调相应目的蛋白表达的作用, 从而抑制肿瘤增殖与转移, 实现药物与基因的联合抗肿瘤疗效[15] (图 1)。
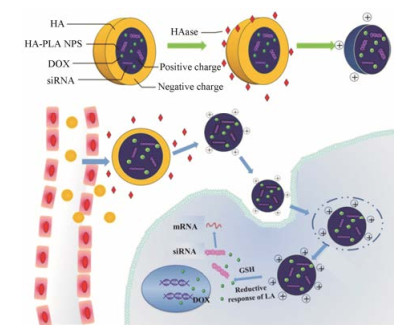
|
Figure 1 Co-delivery of doxorubicin (DOX) and siRNA via reduction-responsive nanoparticles (NPs) modified with hyaluronic acid (HA) |
主要仪器 全波长多功能微孔板检测仪(Infinite M1000 Pro, 瑞士Tacan公司); Unity Inova 400超导核磁共振谱仪(美国瓦里安公司); HPP 5001激光粒度分析仪(英国Malvern公司); H-600透射电子显微镜(日本日立公司); 凝胶成像仪(美国Bio-rad公司); LSM 710共聚焦激光扫描显微镜(德国Zeiss公司); Elx808酶联免疫检测仪(英国Bio-Tek公司)。
试药 DOX·HCl (99.97%, 大连美仑生物试剂有限公司); PLL (上海麦克林生化科技有限公司); LA、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride, EDC·HCl]、N-羟基丁二酰亚胺(N-hydroxysuccinimide, NHS) (阿达玛斯试剂有限公司); HA (华熙福瑞达生物医药有限公司); GSH (上海源叶生物科技有限公司); 透明质酸酶(HAase, 西格玛奥德里奇上海贸易有限公司); 细胞胎牛血清(FBS, 浙江天杭生物科技有限公司); RPMI-1640培养基(Hyclone生物科技有限公司); siRNAFAM、Lysotraker- red (Beyotime生物技术有限公司); Hochest 33258 (美国Sigma公司); 其他试剂均为分析纯。
非小细胞肺癌细胞A459的培养 非小细胞肺癌细胞株A549由苏州大学药理学教研室提供。A549细胞培养条件为RPMI-1640培养基(含10% FBS和1%青霉素-链霉素溶液), 置于37 ℃、5% CO2细胞培养箱中培养。
PLA聚合物的合成 称取LA 250 mg, 以N, N-二甲基甲酰胺(N, N-dimethylformamide, DMF) 30 mL溶解后, 加入EDC·HCl 233 mg和NHS 139 mg, 在50 ℃搅拌条件下反应45 min, 以活化LA的羧基[16]。称取PLL 500 mg, 用30 mL去离子水溶解, 在搅拌条件下将PLL溶液缓慢滴加至LA溶液中, 混合均匀后在50 ℃下反应24 h。将溶液装入透析袋(MWCO 3 500 Da)中, 去离子水透析48 h, 用0.45 μm滤膜滤过, 冷冻干燥后得到白色粉末。
聚合物的结构表征 取适量PLL和PLA分别置于两只核磁管中, 以0.55 mL D2O完全溶解; 取适量LA至核磁管中, 加入0.6 mL CDCl3完全溶解。用核磁共振氢谱仪测得LA、PLL和PLA化合物的1H NMR图。
PLA/DOX-NPs的制备 称取PLA 20 mg溶于去离子水中, 搅拌至其完全溶解, 配成2 mg·mL-1溶液, 加入DOX·HCl (10 mg·mL-1) 1 mL和三乙胺500 μL, 磁力搅拌5 min后加至透析袋(MWCO 3 500 Da)中, 去离子水透析, 以除去三乙胺和未包入的DOX, 再用0.45 μm微孔滤膜过滤, 得到PLA/DOX-NPs[17]。
PLA/DOX-siRNA-NPs的制备及优化 通过静电吸附作用包载siRNA制备PLA/DOX-siRNA-NPs。取siRNA (100 nmol, DEPC水溶解)溶液与PLA/DOX-NPs溶液以不同N/P比(0、2、4、6、8和10)混合搅拌15 min后, 静置即得PLA/DOX-siRNA- NPs[18]。通过琼脂糖凝胶电泳[19]来考察包载siRNA最佳N/P比。具体过程如下:配制浓度为3%琼脂糖凝胶, 加热使完全溶解, 待溶液冷却到50~60 ℃时, 加入适量GelRed并充分混匀, 倒入胶板中, 插入上样梳, 室温下待其冷却凝固; 取不同N/P比PLA/DOX- siRNA-NPs溶液与上样缓冲液混匀, 电泳并通过凝胶成像仪观察凝胶条带的亮度及位置, 从而确定包载siRNA的最佳N/P比。
HA-PLA/DOX-siRNA-NPs的制备及处方优化 称取适量HA, 以去离子水完全溶解, 使其质量终浓度为2 mg·mL-1; 振荡条件下将PLA/DOX-siRNA-NPs溶液按照PLA/HA为1:1、1:2、1:3和1:4的质量比逐滴加入HA溶液中, 得到HA-PLA/DOX-siRNA- NPs, 并以粒径和zeta电位为指标对其进行处方筛选。
HA-PLA/DOX-NPs的质量评价 以包封率(encapsulation efficiency, EE)和载药量(drug loading, DL)为参数, 对载DOX NPs进行质量评价。取适量HA-PLA/DOX-NPs溶液用乙醇破乳并稀释, 通过全波长酶标仪测定其荧光强度(Ex = 480 nm, Em = 590 nm), 计算溶液中的总药物浓度。另取适量HA-PLA/DOX-NPs溶液, 4 ℃下以25 000 ×g高速离心30 min, 测定上清液的荧光强度, 得到溶液中的游离药物浓度[20]。同法测定PLA/DOX-NPs的EE和DL。按式(1)和(2)计算载DOX NPs溶液EE和DL。
| $ {\rm{EE}} = {W_0}/{W_1} \times 100\% $ | (1) |
| $ {\rm{DL}} = {W_0}/W \times 100\% $ | (2) |
式中, W0代表纳米粒中包封的药量, W1代表纳米粒溶液中总药物量, W代表载药纳米粒总质量。
HA-PLA/DOX-NPs的体外释药特性 采用透析袋法考察HA-PLA/DOX-NPs和PLA/DOX-NPs在不同pH和还原环境下的释放情况[21]。将3 mL PLA/DOX-NPs和HA-PLA/DOX-NPs分别装入透析袋(MWCO 3 500 Da)中, 置于装有100 mL不同条件透析外液(pH 7.4、pH 7.4 + 10 mmol·L-1 GSH、pH 5.3、pH 5.3 + 10 mmol·L-1 GSH)的广口瓶中(模拟血液循环和肿瘤细胞内环境), 放入(37 ± 1) ℃恒温箱中以100 r·min-1振荡, 在0.5、1、2、4、6、8、12和24 h时间点分别吸取透析外液1 mL, 同时分别补充等体积、等温度下的相应新鲜释放介质。采用多功能酶标仪测定不同时间点释放外液的DOX浓度, 按照公式(3)计算相应时间下的累积释放率(cumulative release, CR)并绘制时间-累积释放百分数曲线。
| $ {\rm{CR}} = {C_t} \times n/C \times 100\% $ | (3) |
式中, Ct代表t时间所测得的释放外液的DOX浓度, n为稀释倍数, C代表纳米粒溶液中总药物浓度。
HA-PLA/DOX-siRNA-NPs的环境响应性验证 取HA-PLA/DOX-siRNA-NPs溶液分为3组: ①不作处理; ②加入HAase (4 mg·mL-1, pH 6.5 PBS); ③加入GSH (10 mmol·L-1)。摇匀并孵育2 h, 用马尔文粒径测定仪检测3组NPs的粒径和zeta电位。另取后两组溶液1~2滴置碳支持膜上, 干燥, 透射电镜(transmission electron microscope, TEM)观察NPs的形态。
细胞摄取实验 将A549细胞以1×104个/孔接种于6孔板中, 培养24 h。分别加入DOX终质量浓度均为5 μg·mL-1 PLA/DOX-siRNAFAM-NPs、HA-PLA/ DOX-siRNAFAM-NPs和HA-PLA/DOX-siRNAFAM-NPs (HAase)各1 mL。孵育2 h后分别吸去药物, 以pH 7.4 PBS洗涤3次, 加入4%多聚甲醛溶液1 mL固定细胞, PBS清洗3次后, 再加入Hoechst 33258 (10 μg·mL-1) 1 mL, 孵育15 min, 对细胞核进行染色。借助共聚焦显微镜(confocal laser scanning microscope, CLSM)考察细胞对HA-PLA/DOX-siRNAFAM-NPs (HAase +/-)和PLA/DOX-siRNAFAM-NPs的摄取情况。
为证明PLA及单独HA的包覆增强PLA/DOX-NPs和HA-PLA/DOX-NPs细胞摄取的作用, 通过酶标仪对其细胞摄取进行了定量分析。收集对数生长期的4T1细胞, 胰蛋白酶消化后, 离心5 min并以培养基稀释成每毫升3×105个细胞混悬液, 吹打使细胞分散成单个状态, 置于细胞培养箱中培养24 h。分别加入DOX终质量浓度均为10 μg·mL-1 DOX·HCl、PLA/DOX-NPs和HA-PLA/DOX-NPs, 孵育2 h后吸去药物, 以pH 7.4 PBS洗涤3次, 胰蛋白酶消化、计数并超声粉碎, 为避免干扰, 以乙醇和甲醇(5:1, v/v)萃取DOX并离心, 通过酶标仪测定上清液中DOX的荧光强度(激发波长为480 nm, 发射波长为590 nm), 得到2 h的药物摄取量。
siRNAFAM细胞内分布 以上述方法接种A549细胞于6孔板中, 与HA-PLA/siRNAFAM-NPs共孵育2或6 h后, 吸去培养基, PBS清洗3次, 加入Lysotracker Red溶液1 mL对溶酶体进行染色; 45 min后, PBS清洗3次, 用4%多聚甲醛固定细胞; PBS清洗2次后, 再加入Hoechst 33258 (10 μg·mL-1) 1 mL孵育15 min, 对细胞核进行染色。通过CLSM考察不同时间点siRNAFAM的胞内分布情况。
统计学分析 实验数据采用方差分析和t-检验进行统计学分析。计量资料数据用x±s表示, 组间计量资料的比较采用单因素方差分析, 以P < 0.05为差异有统计学意义。
结果 1 PLA聚合物的合成与表征PLA聚合物的合成见合成路线图 1。在EDC/NHS的催化条件下, 通过酰胺化反应将LA接枝于PLL上, 合成载体材料PLA聚合物。由图 2中1H NMR表征结果可得, 与PLL相比, PLA在δ 1.75、1.51、1.36、2.45、2.36和3.75处出现特征峰, 分别为LA结构中C-b、C-c、C-d、C-e、C-f和C-g的氢质子特征峰, 说明载体材料PLA已成功合成。以1H NMR图中特征峰积分面积计算LA的接枝率为25.1%。

|
Scheme 1 Synthetic route of poly-L-lysine-lipoic acid (PLA) via amidation reaction |
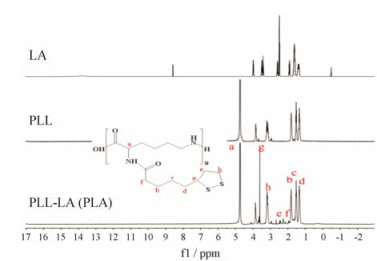
|
Figure 2 1H NMR spectra of lipoic acid (LA), poly-L-lysine (PLL) and poly-L-lysine-lipoic acid (PLA) in D2O |
通过琼脂糖凝胶电泳来研究包载siRNA的最佳N/P比, 凝胶成像结果(图 3)显示, 裸露的siRNA可随电泳跑出, 随着N/P比例增大, 跑出的电泳条带亮度逐渐减弱。N/P比高于6:1后, siRNA主要位于上样孔, 几乎没有泄露, 说明siRNA已被完全包载。因此, 后续体外实验将N/P设为6:1。
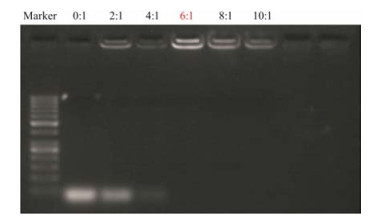
|
Figure 3 The result of optimal N/P ratio via agarose gel electrophoresis |
以PLA为载体材料, 分别通过透析法和静电吸附法包载DOX与siRNA, 得到PLA/DOX-siRNA- NPs; 以一定比例的HA对其进行包覆得到HA-PLA/DOX-siRNA-NPs。如图 4所示, 通过对NPs粒径与zeta电位的测定, 发现当PLA与HA的质量比为1:3 (w/w)时, NPs的粒径最小, 为(167.3 ± 9.9) nm, 并且zeta电位呈负值, 为(-15.5 ± 1.4) mV, 说明HA已完全包覆住NPs。因此, 确定最佳处方为PLA/HA为1:3比例时制备的NPs。
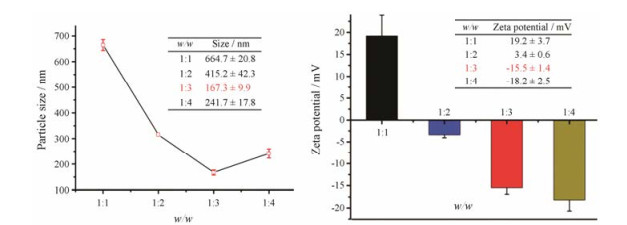
|
Figure 4 Optimization of HA-PLA/DOX-siRNA-NPs formulations. Particle size of HA-PLA/DOX-siRNA-NPs (left); zeta potential of HA-PLA/DOX-siRNA-NPs (right). w/w: Mass ratio of PLA and HA |
通过荧光法测定NPs中DOX总浓度及游离药物浓度并计算载药NPs的EE和DL, 得到PLA/DOX-NPs分别为(90.04 ± 9.13) %和(14.82 ± 2.72) %; HA-PLA/DOX-NPs分别为(86.93 ± 8.91) %和(4.17 ± 0.68) %。包覆前后NPs的EE无明显变化, 说明在HA对NPs的包覆过程中不会导致药物的泄露。
通过透析袋法考察HA-PLA/DOX-NPs和PLA/DOX-NPs中DOX在不同条件下的释放情况, 结果见图 5。从图中可见, HA-PLA/DOX-NPs在pH 7.4条件下释药缓慢, 累积释放率最低, 24 h时累积释放率约为17%, 这将有助于减少DOX在体液循环中的释放, 降低其系统毒性; HA-PLA/DOX-NPs在pH 7.4下的累积释放率略低于PLA/DOX-NPs, 说明HA包覆能进一步减少NPs在血液循环中DOX泄露。而在10 mmol·L-1 GSH条件下, PLA/DOX-NPs和HA-PLA/ DOX-NPs在pH 5.3和7.4下均能实现快速释放, 24 h累积释放率超过70%, 说明两组NPs在肿瘤细胞内还原环境下能够实现药物的快速释放, 有利于提高细胞内药物浓度, 增强疗效。
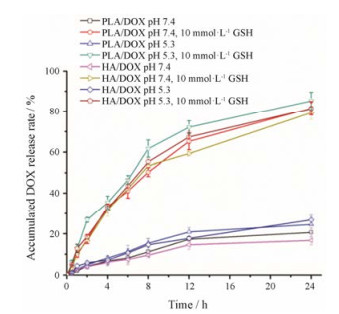
|
Figure 5 Release of DOX from HA-PLA/DOX-NPs or PLA/DOX-NPs under different conditions in vitro. GSH: Glutathione |
通过测定粒径与zeta电位对HA-PLA/DOX- siRNA-NPs的肿瘤微环境响应性进行考察。图 6为HA-PLA-NPs在正常条件下和HAase存在条件下的zeta电位。图 7为HA-PLA-NPs在正常条件下和10 mmol·L-1 GSH条件下的粒径分布与TEM图。从图 6可以看出, HA-PLA/DOX-siRNA-NPs在生理pH下zeta电位为负值, 但在HAase的作用下, NPs发生电荷翻转, zeta电位由负转为正, 说明在酶的作用下NPs带负电荷的HA外壳部分降解, 暴露出正电内核。从图 7中可以看到, HA-PLA/DOX-siRNA-NPs的粒径呈单峰, 且分布均匀, 粒径约为167.3 nm; 加入GSH后, 粒径分布散乱, 呈多峰; 在TEM图中也能看出GSH处理后NPs形态明显改变, 出现聚集现象, 推测可能是HA-PLA/DOX-siRNA-NPs中的二硫键响应高浓度GSH而断裂, 致使NPs结构改变从而解体。
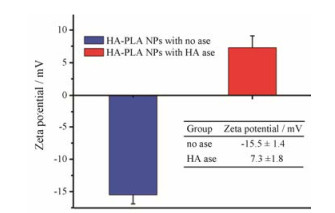
|
Figure 6 Zeta potential of HA-PLA-NPs (HA-PLA/DOX-siRNA-NPs) with or without HAase |
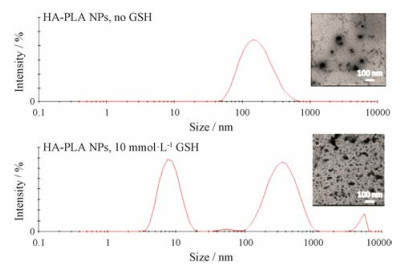
|
Figure 7 Particle size distribution and transmission electron microscope (TEM) of HA-PLA-NPs (HA-PLA/DOX-siRNA-NPs) with or without GSH |
通过CLSM考察A549细胞对HA-PLA/DOX-siRNAFAM-NPs (HAase +/-)和PLA/DOX-siRNAFAM-NPs的摄取情况, 结果见图 8。由图可见, 3组NPs的摄取均呈时间依赖性, 随着共孵育时间延长, 红色DOX荧光与绿色siRNA均有所增强, 提示其细胞摄取量增加; PLA/DOX-siRNAFAM-NPs组的摄取略高于HA-PLA/DOX-siRNAFAM-NPs组, 推测可能是由于HA-PLA/DOX-siRNAFAM-NPs在生理pH条件呈负电荷, 而PLA/DOX-siRNAFAM-NPs呈正电荷, 且HA受体介导的细胞摄取弱于正负电荷介导的细胞摄取; HA-PLA/DOX-siRNAFAM-NPs (HAase)的摄取在2和6 h均高于HA-PLA/DOX-siRNAFAM-NPs组和PLA/ DOX-siRNAFAM-NPs组, 推测可能是由于酶降解部分HA外壳而暴露正电荷内核, 加之未被降解的HA介导的受配体结合增强摄取, 联合作用使得摄取量增加。
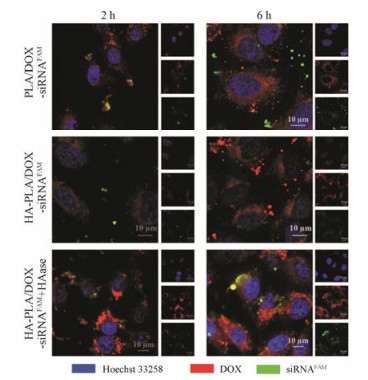
|
Figure 8 Confocal laser scanning microscope (CLSM) images of A549 cells treated with co-loaded NPs at different time points |
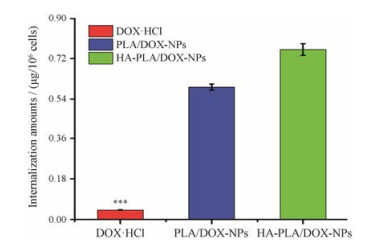
为进一步考察HA及PLA包覆的NPs对A549细胞的体外靶向性, 通过酶标仪定量分析A549细胞对HA-PLA/DOX-NPs组和PLA/DOX-NPs组的细胞摄取情况。结果见图 9。由图可见, PLA/DOX-NPs和HA-PLA/DOX-NPs两组被细胞摄取的量都明显高于DOX·HCl组, 提示PLA及HA的包覆提高了NPs的靶向性及细胞亲和性, 从而增强了A549细胞对NPs的摄取, 这可能是由于PLA/DOX-NPs通过正负电荷介导增强HA-PLA/DOX-NPs与A549细胞表面高表达的CD44+受体结合所致, 而DOX·HCl由于不具有靶向性因而摄取量较低, 摄取效率不佳。NPs摄取量的增加有望充分发挥DOX在A549细胞中的作用从而增强细胞毒性。
|
Figure 9 Quantitative analysis of cellular uptake on A549 cells treated with DOX-loaded NPs for 2 h using a full wavelength microplate reader. n = 3, x±s. ***P < 0.001 vs PLA/DOX-NPs group or HA-PLA/DOX-NPs group |
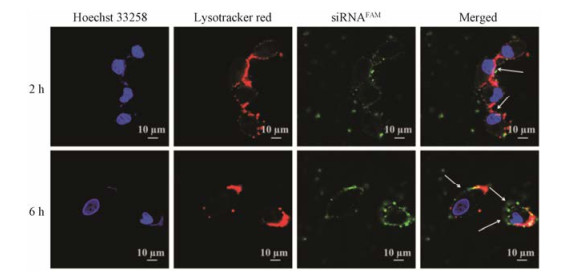
将A549细胞与HA-PLA/siRNAFAM-NPs共孵育2或6 h后, 通过CLSM观察不同时间点siRNAFAM的胞内分布情况, 结果见图 10。由图可见, HA-PLA/siRNAFAM-NPs的摄取呈时间依赖性, 随着共孵育时间延长, 绿色荧光强度增强, 提示摄取量增加; 2 h时, HA-PLA/siRNAFAM-NPs的siRNAFAM绿色荧光与溶酶体的红色荧光呈强共定位, 而孵育时间延长至6 h时, siRNAFAM的绿色荧光与溶酶体的红色荧光几乎不呈共定位, 说明载体材料能有效帮助siRNAFAM实现内涵体逃逸, 避免其被溶酶体酶降解, 提高细胞内基因的浓度, 以增强疗效。
|
Figure 10 Endosomal escape of siRNAFAM in A549 cells treated with HA-PLA/siRNAFAM-NPs at different time points |
肿瘤细胞有不同于正常细胞的特殊环境。肿瘤组织内由于血管丰富、血管壁间隙较宽和结构完整性差, 淋巴回流缺失, 因而20~200 nm的NPs可通过EPR效应实现肿瘤组织的被动靶向; 其次, 肿瘤细胞表面高表达某些特异性受体, 如非小细胞肺癌表面高表达CD44受体, 因此以HA作为主动靶向配体对NPs进行修饰, 可进一步赋予其主动靶向特征, 通过受体-配体相互作用使更多NPs被肿瘤细胞摄取。此外, 肿瘤细胞内呈还原环境, 胞浆中GSH的浓度(约为2~10 mmol·L-1)是细胞外的浓度(约为2~20 μmol·L-1)的10~1 000倍[22]。肿瘤细胞外基质中具有丰富的HAase, 远远高于正常组织, 这些都为环境敏感性载体的设计提供了良好条件[23]。
因此, 基于肿瘤内部特殊的微环境, 以PLL为基础接枝LA, 成功合成了具还原敏感性的两亲性载体材料PLA, 以LA作为还原敏感材料接枝于PLL具有以下优势: ① LA是人体天然存在的天然氧化剂, 生物相容性好, 毒性小; ② LA分子中有1个含二硫键的五元环, 可在GSH作用下开环, 形成线状结构; ③具有一定的疏水性, 能够作为还原性疏水内核包载DOX; ④在体内循环稳定, 能很好地抑制药物泄露; 在胞内可响应GSH, 二硫键被打开后疏水性下降, 因而能够快速释放药物, 产生高抗肿瘤活性[24]。因此, 合成的PLA一方面可作为DOX的储库, 另一方面表面氨基带来的正电荷可有效吸附siRNA, 从而构建了一种共载DOX和siRNA的还原敏感性PLA/DOX-siRNA-NPs。此外, 为增强肿瘤靶向作用, 并降低PLA的强正电荷性带来的不良反应, 通过静电作用以HA对PLA/DOX-siRNA-NPs表面进行修饰, 构建了HA-PLA/DOX-siRNA-NPs, 用特异性配体和还原敏感嵌段特性从而实现其主动靶向及环境响应性的递送模式, 达到增加细胞摄取和细胞内药物有效释放的效果。
通过粒径和电位测定对不同包覆质量比(PLA:HA分别为1:1、1:2、1:3和1:4)的HA-PLA/DOX-siRNA-NPs进行处方优化, 发现在包覆比为1:1时, 粒径最大, 为(664.7 ± 20.8) nm, 可能会导致NPs的聚集, 且电位为正电荷, 不利于其稳定性和其体内循环。随着HA比例增加, NPs的粒径逐渐减小, 电位下降, 在PLA:HA为1:3 (w/w)时, NPs的粒径最小, 为(167.3 ± 9.9) nm, 可能是由于HA和PLL之间的电荷吸引力增大而使NPs内部变得紧凑[25], 并且zeta电位呈负值, 为(-15.5 ± 1.4) mV, 说明HA已完全包覆了NPs, 因此通过此包覆比例合成的载体材料更有利于NPs稳定性, 且zeta电位结果表明HA修饰后得到的HA-PLA/DOX-siRNA-NPs (PLA:HA为1:3)相比于PLA/DOX-siRNA-NPs表面呈负电荷, 这有助于减少在血液循环中对血浆蛋白的非特异性吸附, 提高其血液稳定性[26]。通过对HAase的响应, HA-PLA/DOX-siRNA-NPs发生电荷反转, 由负转正, 但zeta电位低于PLA/DOX-siRNA-NPs, 推测有部分HA被HAase降解。细胞摄取实验也表明, 在生理条件下HA-PLA/DOX-NPs摄取较低, 有助于降低其对正常细胞的毒性; 而在HAase存在的条件下, HA- PLA/siRNAFAM-NPs的细胞摄取明显增强, 这可能是HA-PLA/siRNAFAM-NPs在此条件下暴露正电荷内核及剩余HA的主动靶向联合作用所致。酶标仪定量结果表明, PLA及HA包覆的NPs相比于DOX·HCl的细胞摄取量显著增加, 提示这两种材料的包覆可增加NPs的细胞亲和性及靶向性。因此, 这种具有HAase响应及CD44主动靶向的NPs有望增强体内肿瘤靶向作用。
通过对粒径的考察, 可知HA-PLA/DOX-siRNA- NPs在生理条件下呈较为适宜的粒径且分布窄。经GSH刺激后, HA-PLA/DOX-siRNA-NPs粒径显著变大, 分布变宽, 且出现双峰。推测这种粒径的变化来源于PLA结构中LA片段的二硫键可在GSH作用下还原成巯基, 亲水性上升, 导致PLA聚合物整体亲疏水性平衡打破, NPs发生解聚, 将有助于胞内还原条件下药物的释放。通过模拟血液及肿瘤细胞内环境, 考察HA-PLA/DOX-NPs的体外释放情况, 可知HA-PLA/DOX-NPs在生理条件下释药缓慢, 有助于避免或减少血液循环中DOX释放; 而在10 mmol·L-1 GSH存在的条件下, 则迅速且彻底地释放包载的DOX, 利于胞内药物释放[27]。这种肿瘤微环境刺激下的药物释放特征有利于NPs在增强肿瘤细胞毒性的同时, 降低DOX的系统毒副作用。细胞内siRNA和DOX分布的结果也显示, 随着孵育时间的延长, DOX可有效释放且逐渐扩散至细胞核, 而siRNA则主要位于细胞浆中。鉴于DOX与siRNA的最终作用靶点分别是细胞核与mRNA, 这种胞内分布特征有助于两者药效的发挥。
siRNA可被溶酶体中的酶降解, 因此作为siRNA的载体材料, 需要具备内涵体逃逸功能。通过对内涵体/溶酶体染色发现, HA-PLA/siRNAFAM-NPs经过6 h孵育后, 与溶酶体几乎不呈共定位, 提示其已经从内涵体逃逸, 这将有利于提高siRNA转染效率。一般而言, PEI或PLL等富含氨基的载体材料在内涵体弱酸性条件下可发生质子化, 引起H+、Cl-及H2O内流, 将内涵体胀破, 即通过“质子海绵效应”实现内涵体逃逸[28]。
综上, HA-PLA/DOX-siRNA-NPs能有效改善PLL阳离子聚合物作为递送载体的缺陷, 提高共递送体系在血液循环中的稳定性; 同时, 通过HA的主动靶向作用及HAase刺激下的电荷反转, 增强细胞摄取; 摄取后可成功实现内涵体逃逸并响应胞浆中还原环境, 迅速释放包载的药物, 为更好地发挥药物与基因协同抑制肿瘤增殖和转移的能力提供基础条件, 可作为潜在的靶向非小细胞肺癌的药物递送系统。
| [1] | Ye X, Fan W, Wang H, et al. Expert consensus for thermal ablation of primary and metastatic lung tumors (2017 Edition)[J]. Chin J Lung Cancer (中国肺癌杂志), 2017, 20: 433–445. |
| [2] | Gu JR, Cao XT. Conceptual consideration of cancer, challenges and opportunities for cancer biotherapy[J]. Chin J Cancer Biotherapy (中国肿瘤生物治疗杂志), 2008, 15: 2–7. |
| [3] | Omelyanenko V, Kopečková P, Gentry C, et al. Targetable HPMA copolymer-adriamycin conjugates. Recognition, internalization, and subcellular fate[J]. J Control Release, 1998, 53.: 25–37. DOI:10.1016/S0168-3659(97)00235-6 |
| [4] | Mizutani H, Oikawa S, Hiraku Y, et al. Distinct mechanisms of site-specific oxidative DNA damage by doxorubicin in the presence of copper (Ⅱ) and NADPH-cytochrome P450 reductase[J]. Cancer Sci, 2003, 94: 686–691. DOI:10.1111/cas.2003.94.issue-8 |
| [5] | Mitra S, Gaur U, Ghosh PC, et al. Tumour targeted delivery of encapsulated dextran-doxorubicin conjugate using chitosan nanoparticles as carrier[J]. J Control Release, 2001, 74: 317–323. DOI:10.1016/S0168-3659(01)00342-X |
| [6] | Itaka K, Yamauchi K, Harada A, et al. Polyion complex micelles from plasmid DNA and poly(ethylene glycol)-poly(L-lysine) block copolymer as serum-tolerable polyplex system:physicochemical properties of micelles relevant to gene transfection efficiency[J]. Biomaterials, 2003, 24: 4495–4506. DOI:10.1016/S0142-9612(03)00347-8 |
| [7] | Patil ML, Zhang M, Minko T. Multifunctional triblock nanocarrier (PAMAM-PEG-PLL) for the efficient intracellular siRNA delivery and gene silencing[J]. ACS Nano, 2011, 5: 1877–1887. DOI:10.1021/nn102711d |
| [8] | Ohashi R, Takahashi F, Cui R, et al. Interaction between CD44 and hyaluronate induces chemoresistance in non-small cell lung cancer cell[J]. Cancer Lett, 2007, 252: 225–234. DOI:10.1016/j.canlet.2006.12.025 |
| [9] | Zhang W, Yan C. Hyaluronic acid and its derivatives as drug carriers[J]. Prog Chem (化学进展), 2006, 18: 1684–1690. |
| [10] | Steichen SD, Caldorera-Moore M, Peppas NA. A review of current nanoparticle and targeting moieties for the delivery of cancer therapeutics[J]. Eur J Pharm Sci, 2013, 48: 416–427. DOI:10.1016/j.ejps.2012.12.006 |
| [11] | Yang ZZ, Li JQ, Wang ZZ, et al. Tumor-targeting dual peptides-modified cationic liposomes for delivery of siRNA and docetaxel to gliomas[J]. Biomaterials, 2014, 35: 5226–5239. DOI:10.1016/j.biomaterials.2014.03.017 |
| [12] | Gaucher G, Dufresne MH, Sant VP, et al. Block copolymer micelles:preparation, characterization and application in drug delivery[J]. J Control Release, 2005, 109: 169–188. DOI:10.1016/j.jconrel.2005.09.034 |
| [13] | Qi R, Hu X, Yan L, et al. Synthesis of biodegradable cationic triblock copolymer mPEG-PCL-PLL for siRNA delivery[J]. J Control Release, 2011, 152: e167–e168. DOI:10.1016/j.jconrel.2011.08.067 |
| [14] | Liu P, Sun Y, Wang Q, et al. Intracellular trafficking and cellular uptake mechanism of mPEG-PLGA-PLL and mPEG-PLGA-PLL-Gal nanoparticles for targeted delivery to hepatomas[J]. Biomaterials, 2014, 35: 760–770. DOI:10.1016/j.biomaterials.2013.10.020 |
| [15] | Ryoo NK, Lee J, Lee H, et al. Therapeutic effects of a novel siRNA-based anti-VEGF (siVEGF) nanoball for the treatment of choroidal neovascularization[J]. Nanoscale, 2017, 9: 15461–15469. DOI:10.1039/C7NR03142D |
| [16] | Leijten J, Rouwkema J, Zhang YS, et al. Advancing tissue engineering:a tale of nano-, micro-, and macroscale integration[J]. Small, 2016, 12: 2130–2145. DOI:10.1002/smll.v12.16 |
| [17] | Du YZ, Wang L, Yuan H, et al. Preparation and characteristics of linoleic acid-grafted chitosan oligosaccharide micelles as a carrier for doxorubicin[J]. Colloids Surf B Biointerfaces, 2009, 69: 257–263. DOI:10.1016/j.colsurfb.2008.11.030 |
| [18] | Cun D, Foged C, Yang M, et al. Preparation and characterization of poly(DL-lactide-co-glycolide) nanoparticles for siRNA delivery[J]. Int J Pharm, 2010, 390: 70–75. DOI:10.1016/j.ijpharm.2009.10.023 |
| [19] | Wang HY, Cai B, Cui CB, et al. Vitexicarpin, a flavonoid from Vitex trifolia L., induces apoptosis in K562 cells via mitochondria-controlled apoptotic pathway[J]. Acta Pharm Sin (药学学报), 2005, 40: 27–31. |
| [20] | Tam YT, To KK, Chow AH. Fabrication of doxorubicin nanoparticles by controlled antisolvent precipitation for enhanced intracellular delivery[J]. Colloids Surf B Biointerfaces, 2016, 139: 249–258. DOI:10.1016/j.colsurfb.2015.12.026 |
| [21] | Ko H, Son S, Jeon J, et al. Tumor microenvironment-specific nanoparticles activatable by stepwise transformation[J]. J Control Release, 2016, 234: 68–78. DOI:10.1016/j.jconrel.2016.05.009 |
| [22] | Fan D, Yu JM, Huang H, et al. Research progress of environment-responsive delivery system in the application of co-delivery gene and drug[J]. Acta Pharm Sin (药学学报), 2017, 52: 713–721. |
| [23] | Teo PY, Cheng W, Hedrick JL, et al. Co-delivery of drugs and plasmid DNA for cancer therapy[J]. Adv Drug Deliv Rev, 2016, 98: 41–63. DOI:10.1016/j.addr.2015.10.014 |
| [24] | Deng C, Meng FH, Cheng R, et al. Multifunctional biodegradable polymeric nanocarriers:design, synthesis, and applications in targeted tumor therapy[J]. Chin Sci Bull (科学通报), 2015, 60: 1339–1351. DOI:10.1360/N972015-00141 |
| [25] | Chan MW, Wong CY, Cheng AS, et al. Targeted inhibition of COX-2 expression by RNA interference suppresses tumor growth and potentiates chemosensitivity to cisplatin in human gastric cancer cells[J]. Oncol Rep, 2007, 18: 1557–1562. |
| [26] | Shen Y, Wang J, Li Y, et al. Co-delivery of siRNA and paclitaxel into cancer cells by hyaluronic acid modified redox-sensitive disulfide-crosslinked PLGA-PEI nanoparticles[J]. RSC Adv, 2015, 5: 46464–46479. DOI:10.1039/C5RA03085D |
| [27] | Zhong Y, Zhang J, Cheng R, et al. Reversibly crosslinked hyaluronic acid nanoparticles for active targeting and intelligent delivery of doxorubicin to drug resistant CD44+ human breast tumor xenografts[J]. J Control Release, 2015, 205: 144–154. DOI:10.1016/j.jconrel.2015.01.012 |
| [28] | Deng J, Gao N, Wang Y, et al. Self-assembled cationic micelles based on PEG-PLL-PLLeu hybrid polypeptides as highly effective gene vectors[J]. Biomacromolecules, 2012, 13: 3795–3804. DOI:10.1021/bm3012538 |
 2018, Vol. 53
2018, Vol. 53


