2. 成都康弘药业集团股份有限公司, 四川 成都 610000
2. Chengdu Kanghong Pharmaceutical Group, Chengdu 610000, China
康柏西普(conbercept)是一种重组人血管内皮生长因子受体-抗体融合蛋白, 于2013年12月被国家食品药品监督管理总局(CFDA)批准上市, 用于治疗湿性年龄相关性黄斑变性[1, 2]。2016年10月康柏西普获得美国食品和药品监督管理局(FDA)准许在美国直接开展Ⅲ期临床试验。针对康柏西普的质量控制, 其非还原SDS-PAGE纯度测定最初直接采用了《中国药典》中的相应方法, 以该方法检测产品纯度相对偏低。为了确定康柏西普产品是纯度问题还是方法学评价的客观性问题, 进一步有效控制和评价康柏西普产品相关杂质, 结合康柏西普蛋白的特点发现原方法在产品主成分饱和的情况下过高估计了杂质的含量, 同时也优化了R250染色的非还原SDS-PAGE纯度检测方法, 相应药学资料经过方法学验证后提交给FDA, 促进了康柏西普在美国直接进入临床Ⅲ期。本文针对凝胶的筛选、凝胶成像系统的比较、主带灰度值线性范围、主要杂质灰度值线性范围以及脱色条件开展研究, 确定了康柏西普非还原SDS-PAGE纯度测定方法的实验条件。希望本文能够对新药研发人员具有一定的借鉴作用。
材料与方法药品和试剂 康柏西普蛋白样品, 成都康弘生物科技有限公司生产。10%预制聚丙烯酰胺凝胶, Bio-Rad公司, 货号456-1033; 4%~15%预制聚丙烯酰胺凝胶, Bio-Rad公司, 货号456-1083; 10×Tris/ Glycine/SDS Buffer, Bio-Rad公司, 货号161-0732; 4×上样缓冲液, Bio-Rad公司, 货号161-0747;蛋白Marker, Bio-Rad公司, 货号161-0373;碘乙酰胺, Sigma公司, 货号L1149-5G;考马斯亮蓝R250染色液, Beyotime公司, 货号P0017A-1;脱色液, Beyotime公司, 货号P0017A-2。
仪器 PowerpacTM Universal型电泳仪, Bio-Rad公司; XRS+型高分辨率凝胶成像系统, Bio-Rad公司; EZ型低分辨率凝胶成像系统, Bio-Rad公司。
凝胶的选择 康柏西普样品分别以10%固定浓度预制胶、4%~15%梯度浓度预制胶进行非还原SDS-PAGE电泳, 每块胶以10 μg、3 μg各上样1孔并有一泳道为蛋白Marker。两种凝胶同槽电泳, 染色脱色条件相同, 比较两种凝胶对蛋白的分离效果。除特别说明外, 非还原SDS-PAGE实验条件为(下同):上样体系加入3.6 % (W/V)碘乙酰胺1 μL (抑制自由巯基重排)[1, 2], 70 ℃水浴10 min, 80 V电泳30 min后再120 V电泳60 min, 考马斯亮蓝R250染色60 min后再脱色。
凝胶成像系统的选择 使用4%~15%梯度浓度预制胶, 康柏西普样品上样3 μg进行非还原SDS- PAGE电泳, 染色脱色后, 同一块凝胶分别在高分辨率和低分辨率的两种凝胶系统上采集数据, 使用ImageLab软件分析数据。比较两种不同分辨率的凝胶成像系统采集数据的差异。
主带线性范围及上样量的确定 使用4%~15%梯度浓度预制胶电泳, 高分辨率凝胶成像系统采集数据, 以康柏西普样品在0.125~20 μg内进行10个梯度上样量的检测, 分别为0.125、0.25、0.5、1、1.5、2、3、4、10和20 μg, 重复3次, 各1板凝胶。复孔样品单独稀释和前处理, 计算不同上样量主带灰度值的3次重复平均值。以上样量对主带平均灰度值作图, 考察主带上样量的线性; 计算各上样量对应的纯度, 考察不同上样量纯度的精密度。
脱色条件的影响 同一康柏西普样品经前处理后混匀上样体系, 于两板凝胶上各点样4孔, 以考马斯亮蓝R250同盘染色60 min后, 两板凝胶各置一脱色盘脱色, 每次加入脱色液100 mL。胶1加入脱色液开始脱色后, 每脱色30 min后更换一次新鲜脱色液, 总脱色时间为3 h。胶2加入脱色液开始脱色后, 每脱色60 min后更换一次新鲜脱色液, 总脱色时间为3 h时采集一次数据, 胶2加入脱色液继续脱色至5 h, 采集数据。通过背景脱色效果和纯度结果比较3个脱色条件的影响。
主要杂带的线性范围 电泳与主带线性范围实验相同, 二者共享实验数据。计算各上样量主要杂质条带灰度值的3次重复平均值。以上样量对主要杂质带平均灰度值作图, 考察杂带灰度值的线性。
结果 1 凝胶的选择10%固定浓度预制胶、4%~15%梯度浓度预制胶以相同实验条件电泳并染色脱色后, 电泳结果见图 1。

|
Figure 1 Separation results of conbercept with 4%-15% gradient gel (A) and 10% gel (B) |
电泳图 1显示, 康柏西普样品主带下方出现3条杂带, 杂带1、杂带2位于100 kD与主带之间, 所占比例较低; 杂带3略低于75 kD, 所占比例明显高于杂带1、杂带2。10%固定浓度胶, 杂带1、杂带2与主带未完全分离, 带型较弥散, 康柏西普条带两边上翘。4%~15%梯度浓度胶, 杂带1、杂带2与主带完全分离, 且分离效果好, 带型平整。另外, 分子量Marker显示, 对于高分子量区域, 4%~15%梯度浓度胶分离效果优于10%固定浓度胶, 相反, 对于低分子量区域, 10%固定浓度胶分离效果优于4%~15%梯度浓度胶。
2 凝胶成像系统的选择康柏西普样品电泳后, 如图 2所示, 同一凝胶以两种凝胶成像系统采集数据, 分别为EZ型(低分辨率型)和XRS+型(高分辨率型)。其中低分辨率型设备较简易, 专用于SDS-PAGE, 图片分辨率140万像素, 动态范围3.0 OD, 像素密度为212, 即饱和度为4 096, 输出图像清晰度300 dpi; 高分辨率型则具有多功能性, 可用于SDS-PAGE、DNA凝胶等, 图片分辨率400万像素, 动态范围4.0 OD, 像素密度为216, 即饱和度为65 536。输出图片清晰度300~600 dpi。

|
Figure 2 Comparison of data acquired from gel imaging systems with low resolution (A) and high resolution (B) |
对于康柏西普样品, 主带下方有3条杂质带, 杂带1、杂带2含量较低且离主带较近, 杂带3为主要的杂质且离主带较远。凝胶系统采集数据并经Image Lab软件分析, 低分辨率凝胶系统无法使杂带1、杂带2与主带基线分离, 无法准确进行积分计算; 高分辨率凝胶系统能使杂带1、杂带2与主带基线分离。
3 主带线性范围及上样量的确定康柏西普样品在0.125~20 μg内进行10个梯度上样量, 重复3次, 上样量与主带平均灰度值的线性关系见图 3A。
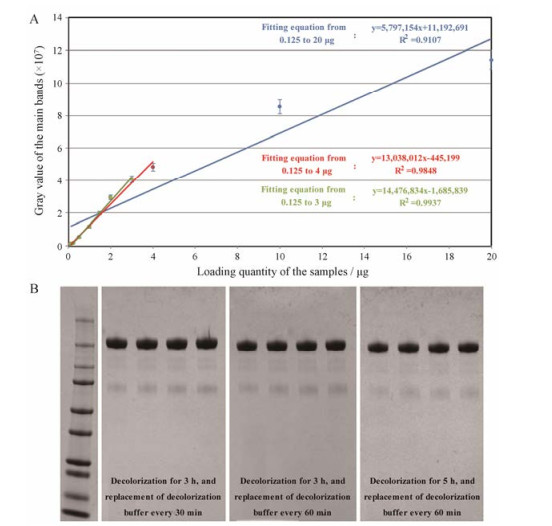
|
Figure 3 The linear relationship between the loading amounts of the samples and the average gray values of the main band (A) and electrophoregrams with three destaining conditions as indicated (B) |
上样量≤3 μg时, 主带灰度值线性相关系数R2 = 0.993 7;上样量≤4 μg时, 主带灰度值线性相关系数R2 = 0.984 8;上样量≤10 μg时, 主带灰度值线性相关系数R2 = 0.944 1;上样量≤20 μg时, 主带灰度值线性相关系数R2 = 0.910 7。表明上样量≤3 μg时, 主带灰度值线性好, 上样量超过3 μg时, 主带灰度值线性相关系数逐渐下降。1.5~4 μg内不同上样量的纯度CV% = 0.96%, 1.5~10 μg内不同上样量的纯度CV% = 2.68%, 10 μg上样量纯度明显偏低。
鉴于上样量≤3 μg时, 主带灰度值线性相关系数R2 = 0.993 7, 且CV值较低, 故非还原SDS-PAGE检测康柏西普纯度的方法采用3 μg作为样品检测的上样量。
4 脱色条件的影响3种脱色条件为不同的脱色液更换频率和脱色时间, 电泳图见图 3B, 3种脱色条件所对应主带的纯度分别为89.9% ± 1.33%、90.2% ± 1.27%和94.4% ± 0.68%。
60 min更换一次脱色液, 脱色3 h后, 凝胶脱色干净, 背景清晰。总脱色时间3 h内, 30 min与60 min的换液频率主带平均纯度无明显差异; 脱色时间延长至5 h, 杂带变浅, 主带纯度由90.2%提高至94.5%, 表明3 h后继续脱色对纯度有明显影响。
5 主要杂质的线性范围康柏西普杂带占比以杂带3为主。电泳与主带线性范围实验相同, 计算不同上样量(0.5~20 μg)对应杂带3的平均灰度值。可以计算得到, 第3条杂质带的上样量(0.5~20 μg)与杂带3的平均灰度值的线性相关系数R2 = 0.990 0, 线性关系较好。结合主带线性范围的结果, 以3 μg作为非还原SDS-PAGE纯度方法的上样量时, 主带及主要杂质的灰度值均在线性范围内。
讨论固定浓度胶和梯度浓度胶对不同分子量区域的蛋白尤其糖蛋白的分离效果存在差异[3]。康柏西普样品主带下方出现3条杂带, 4%~15%梯度浓度胶的分离效果和带型均明显优于10%固定浓度胶, 所以康柏西普非还原SDS-PAGE纯度测定方法选用4%~15%梯度浓度胶进行电泳。作为纯度测定方法, 应尽量保证泳道分离组分的完整性, 本研究的两种凝胶电泳条件相同, 溴酚蓝刚迁移至凝胶底部时结束电泳, 若10%固定浓度胶增加电泳时间, 主带与杂带也可能实现完全分离, 但过度的迁移将导致条带两边上翘加重且会丢失泳道的部分信息。
康柏西普应使用高分辨率的凝胶成像系统采集凝胶数据。由于康柏西普有两条100 kD以上的杂质带且所占比例很低。低分辨率的凝胶成像系统无法实现响应峰的基线分离, 将导致杂质条带占比显著高于真实值。
确定康柏西普的非还原SDS-PAGE纯度方法上样量为3 μg。当SDS-PAGE作为定量方法时, 应结合主带、杂带的线性范围合理确定上样量。康柏西普上样量 > 3 μg时, 随上样量的增加, 主带灰度值逐渐趋于饱和, 而杂质条带的响应值却线性增加, 将导致计算的主带纯度结果低于真实值。康柏西普3 μg上样量对应主带灰度值为线性范围的上限, 且对应的主要杂质条带灰度值也在线性范围内, 所以3 μg是康柏西普的非还原SDS-PAGE纯度方法的合理上样量。
本研究之前的实验表明, 脱色2~2.5 h, 有时背景不能完全脱色干净, 故本研究对3 h及3 h以上的脱色时间进行了比较。结果表明, 脱色3 h内, 保证背景脱色干净的前提下, 更高的换液频率(30 min更换一次脱色液)对纯度结果没有影响, 而进一步增加脱色时间将导致杂质条带过度脱色, 使主带纯度结果高于真实值。由于脱色过程对纯度结果有影响, 实际应用中, 应结合脱色液用量、摇床转速、换液频率等确定合理的脱色时间。
值得注意的是, 虽然现行版《中国药典》Ⅲ部中很多治疗类生物制品各论的SDS-PAGE方法要求加样量不低于10 μg[4], 但是对于新药研发应根据产品特点进行方法学验证以确定适宜的加样量。在本文研究中, 10 μg的上样量已经严重脱离其灰度值及上样量之间的线性关系, 所计算的康柏西普非还原SDS- PAGE纯度远低于其实际值。此外, 取高上样量时杂带的灰度值、低上样量时的主带的灰度值, 以保证二者均位于上样量与灰度值的良好线性范围内, 并综合考虑上样量之间的倍数关系, 所计算出的样品纯度能够更客观地反映其实际值。虽然SDS-PAGE是相对成熟的传统纯度测定方法, 但是其中对于实际产品的检测, 仍然需要谨慎的优化和验证, 这样才能真实地反映产品纯度。本文中应用了碘乙酰胺, 可以在非还原电泳中有效减少杂带的含量[5, 6]。综上所述, 利用本文中优化的非还原SDS-PAGE方法重新对康柏西普纯度进行方法学验证和评估, 实测值及结合多批次所制定的质量标准获得FDA同行专家的认可, 也为重组融合蛋白类制品纯度的质量控制提供了参考。
| [1] | Nguyen TT, Guymer R. Conbercept (KH-902) for the treatment of neovascular age-related macular degeneration[J]. Expert Rev Clin Pharmacol, 2015, 8: 541–548. DOI:10.1586/17512433.2015.1075879 |
| [2] | Lu X, Sun X. Profile of conbercept in the treatment of neovascular age-related macular degeneration[J]. Drug Des Devel Ther, 2015, 9: 2311–2320. |
| [3] | Walker JM. Gradient SDS polyacrylamide gel electrophoresis[J]. Methods Mol Biol, 1984, 1: 57–61. |
| [4] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Vol 4. Beijing: China Medical Science Press, 2015. |
| [5] | Taylor FR, Prentice HL, Garber EA, et al. Suppression of sodium dodecyl sulfate-polyacrylamide gel electrophoresis sample preparation artifacts for analysis of IgG4 half-antibody[J]. Anal Biochem, 2006, 353: 204–208. |
| [6] | Vasilyeva E, Woodard J, Taylor FR, et al. Development of a chipbased capillary gel electrophoresis method for quantification of a half-antibody in IgG4 samples[J]. Electrophoresis, 2004, 25: 3890–3896. DOI:10.1002/(ISSN)1522-2683 |
 2018, Vol. 53
2018, Vol. 53


