齐墩果酸(oleanolic acid, OA)是一种以游离和/与糖结合形式广泛存在于夏枯草、怀牛漆、油橄榄、连翘、青叶胆和女贞子等植物中的五环三萜类化合物[1, 2]。齐墩果酸具有多种重要的药理活性, 如抗病毒、降血糖、抗糖尿病、抗HBV和抗肿瘤[3-6]等。本课题组自2000年以来, 开展了五环三萜类似物的设计合成及抗肿瘤活性研究, 主要集中在乳香酸、熊果酸、积雪草酸的结构修饰及体外抗肿瘤活性评价[7-10]。此外, 通过计算机辅助设计, 在模拟解析化合物与蛋白靶点结合的基础上, 指导齐墩果酸、积雪草酸等五环三萜化合物的结构改造, 取得一定的进展[11, 12]。
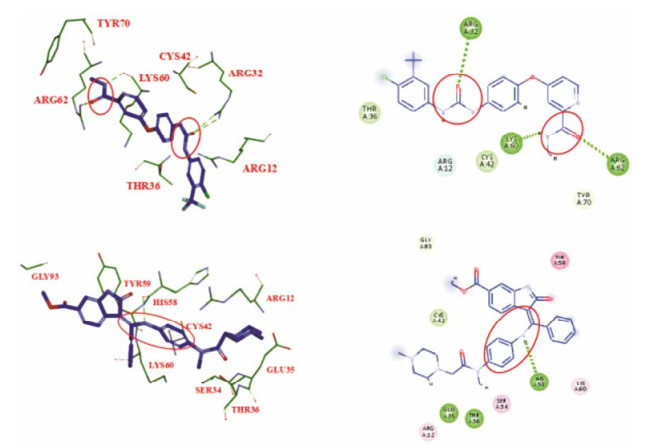
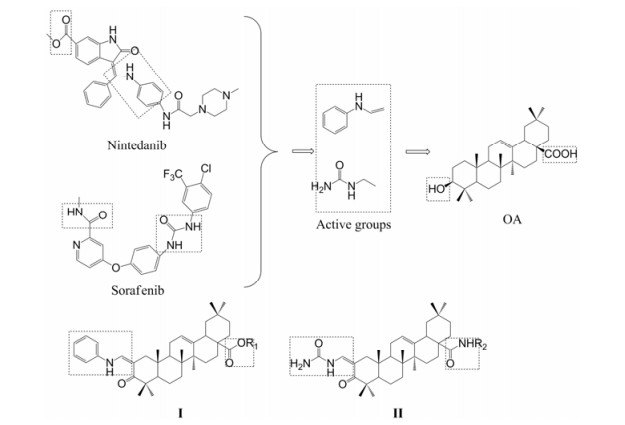
PDGF受体属于受体酪氨酸激酶跨膜糖蛋白二聚体分子[13], 其自分泌生长方式和肿瘤组织细胞内的高表达, 在PDGF受体阳性细胞恶性转化及其侵袭转移中起到重要作用[14, 15]。目前, 通过抑制PDGF受体的酪氨酸蛋白激酶活性及信号传导, 从而抑制肿瘤新生血管生成, 去寻找新的抗肿瘤药物已成为肿瘤治疗中的热点[16]。FDA“快通道”审批的多靶点、多激酶抑制剂索拉菲尼, 具有脲基结构, 高效作用于PDGF受体、VEGF受体等靶点, 通过抑制酪氨酸激酶的磷酸化, 阻止其与底物蛋白分子结合, 从而达到阻断细胞内信号转导通路的目的[17, 18]。乙磺酸尼达尼布具有苯胺亚甲基结构, 可以竞争性地结合于受体激酶结构域上的三磷酸腺苷结合位点, 阻滞胞内信号传导[19, 20]。结合PDB数据库中PDGF受体的三维晶体结构(PDB: 1SHA), 运用分子模拟对接方法分析了已知PDGF受体小分子抑制剂与靶酶的相互作用, 解析靶蛋白发挥活性作用的关键氨基酸残基片段, 确定能够和关键位点结合的活性基团(图 1), 并将部分抑制剂结构中的活性基团片段创新性地引入到五环三萜母体中, 主要结构改造集中在2位引入相应活性基团(图 2)。设计合成了10个新型齐墩果酸类似物, 并进行了体外抗肿瘤活性测试和PDGF受体抑制活性测试。
|
Figure 1 Analysis of the interaction of nintedanib esylate and sorafenib with 1SHA, the key amino acids: ARG32, HIS58 |
|
Figure 2 The analytical active groups introduce oleanolic acid and design new derivatives |
本文通过计算机模拟分析出已上市的两种抗肿瘤药物的关键活性结构(图 1), 并将其与前期Meng's课题组对五环三萜化合物的结构修饰相结合, 将活性基团引入齐墩果酸2位。通过计算机分子对接模拟分析Ⅰ3、Ⅱ5与PDGF靶蛋白的结合方式, 均显示出较为紧密的结合能力。通过体外抗肿瘤活性测试, 结果表明化合物Ⅰ3、Ⅱ5在抗SGC-7901和A549细胞上比阳性对照物吉非替尼具有更为突出的抗肿瘤活性, 与多柔比星相当。通过PDGF受体抑制活性测试, 结果表明化合物Ⅱ5与PDGF受体有较好的结合能力。
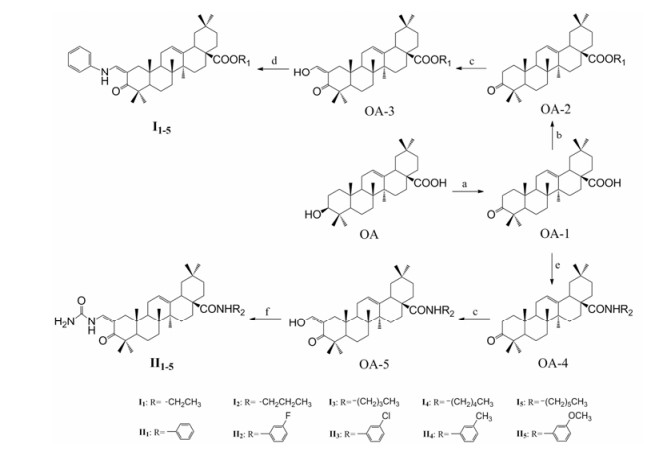
结果与讨论 1 化学合成以OA为原料, 设计并合成了两类共10个化合物, 其结构经NMR、MS确认, 数据见表 1和表 2。首先采用Jones'试剂将齐墩果酸3位羟基氧化成酮, 得到OA-1, 在此基础上, 将28位的羧基成酰胺或酯, 得到化合物OA-2或OA-4, 然后与甲酸乙酯反应, 在碱性条件下反应12 h得到化合物OA-3和OA-5, 进一步在2位上引入苯胺和脲基, 形成2-苯胺亚甲基- 3-羰基-齐墩果烷-12-烯-28-羧酸酯类化合物Ⅰ1~Ⅰ5和2-脲亚甲基-3-羰基-齐墩果烷-12-烯-28-羧酸酰胺类Ⅱ1~Ⅱ5, 目标化合物的合成见合成路线1。

|
| Table 1 The NMR date of target compounds Ⅰ1-5, Ⅱ1-5 |
| Table 2 The MS and elemental analysis date of target compounds Ⅰ1-5, Ⅱ1-5 |
以吉非替尼和多柔比星为阳性对照物, 采用四甲基偶氮唑盐法(MTT比色法)对合成的化合物进行初步的体外抗肿瘤活性测试, 实验结果见表 3。
| Table 3 Inhibitory activity of the target compounds on the SGC7901 and A549 cells proliferation. Inhibitory percentage of cells treated with each compound at a concentration of 10 μmol·L-1 for 72 h |
通过分子对接模拟显示齐墩果酸衍生物Ⅰ1-5、Ⅱ1-5与PDGF受体(PDB编号: 1SHA)的结合都具有较强的亲和能力。Molegro virtual docker (MVD)软件能够预测和计算蛋白质与大分子的配体相互作用和能量, 通过函数打分将结果通过数值直观表达, 分数表示为结合自由能(Escore kcal·mol-1), (MloDock Score, Escore=Einter+Eintra, Einter表示配体-蛋白质相互作用能量, Eintra表示配体内部能量)。MVD评估1SHA与分子之间的连接情况。能量分数(kcal·mol-1)的绝对值越大, 结合亲和力越强。使用MVD6.0, 结合分数显示化合物Ⅰ3: -105.036, 化合物Ⅱ5: -114.987, 自身小分子配体(-100.450)。
|
Scheme 1 The synthesis routes of target compounds Reagents and conditions: (a) Jones, acetone, r.t., 2.5 h; (b) DMF, K2CO3, R1Br, 5 h; (c) Toluene, tBuOK, r.t., 12 h; (d) EtOH, aniline, reflux, 4 h; (e) DCM, (COCl)2, r.t., 4 h; amins, DCM, r.t., 24 h; (f) EtOH, urea, reflux, 4 h. |
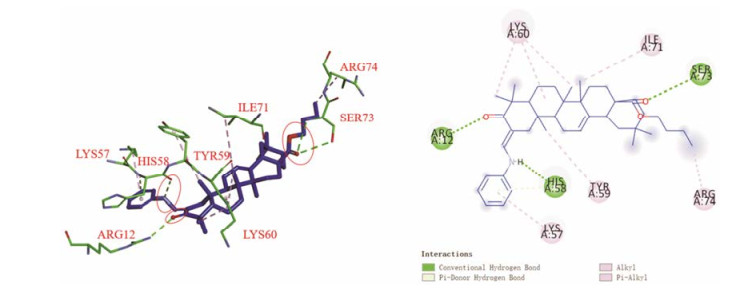
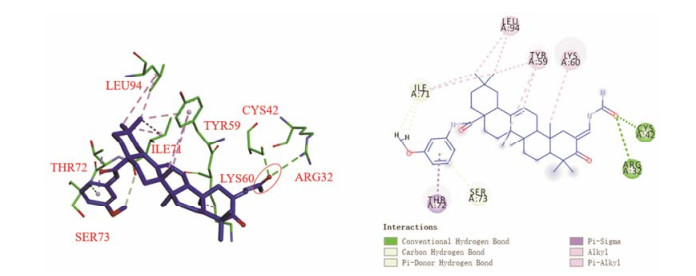
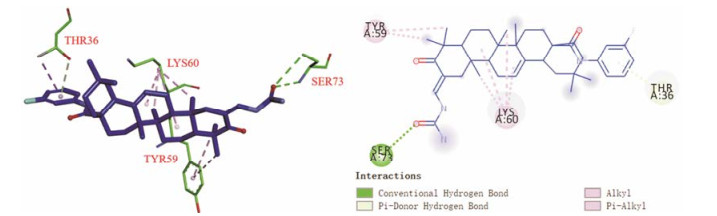
通过Discovery Studio 4.0直观分析对化合物和靶点的结合情况, 发现所设计的齐墩果酸类似物能够插入到PDGF受体靶标中并与周围一些氨基酸紧密连接(图 3和图 4), 化合物Ⅰ3和Ⅱ5牢固地嵌入了靶点的活性口袋中, 它们通过疏水键和H-键与氨基酸相互作用(与之相互作用的氨基酸残基分别为Ⅰ3: ARG12、LYS60、ILE71、SER73、ARG74、TYB59、HIS58、LYS57; Ⅱ5: ILE71、CEU94、TYR59、LYS60、CYS42、ARG32、SER73、THR72)。如图 5和图 6, 化合物Ⅰ1和Ⅱ2也可与活性口袋中的氨基酸残基相互作用(与之相互作用的氨基酸残基分别为Ⅰ1: LYS60、CYS42、TYR70、ARG12; Ⅱ2: TYR59、LYS60、THR36、SER73), 但相互作用的氨基酸数量明显减少, 可能导致化合物与PDGF受体的相互作用减弱, 影响其抗肿瘤活性。所有化合物的MolDock评分如表 4所示。
|
Figure 3 Binding of compound Ⅰ3 to the active site of PDGFR, it exhibited 1 H-bond with HIS58, the hydrogen bonds formed colored in green |
|
Figure 4 Binding of compound Ⅱ5to the active site of PDGFR, it exhibited 1 H-bond with ARG32 and 1 H-bond with CYS42, the hydrogen bonds formed colored in green |

|
Figure 5 Binding of compound Ⅰ1 to the active site of PDGFR |
|
Figure 6 Binding of compound Ⅱ2 to the active site of PDGFR |
| Table 4 Comparison of energy scores for different compounds with PDGFR |
采用荧光偏振免疫法(FPIA), 对通过计算机辅助设计模拟结合力较好且体外生物活性较好的化合物Ⅰ3和Ⅱ5进行PDGF受体抑制活性测试, 通过GraphPad Prism 5计算得Ⅰ3和Ⅱ5在10 μg·mL-1时的IC50分别为3.10 μmol·L-1和2.57 μmol·L-1。
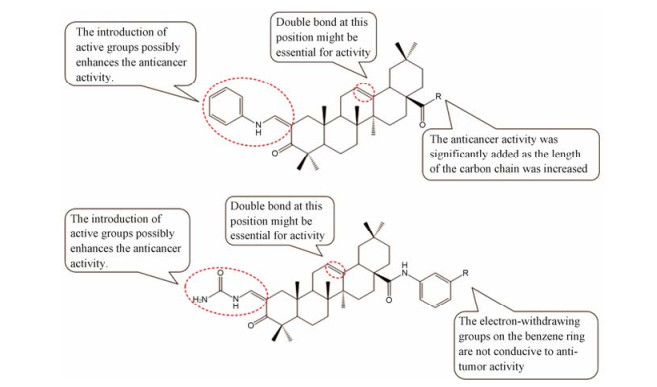
5 小结运用计算机辅助药物设计方法, 分析已知抗肿瘤靶点PDGF受体和抑制剂相互作用, 设计拟合成化合物, 经母体(OA)结构优化后得到10个新的OA衍生物, 目标化合物结构经NMR和MS确认, 将其与PDGF受体进行对接, 并通过Molegro Virtual Docker计算预测合成的所有化合物与PDGF受体的结合情况, 结果表明合成的化合物与PDGF受体均具有良好的结合能力。同时, 体外药理实验表明所合成的化合物对人胃癌细胞(SGC-7901)和人肺癌细胞(A549)均具有抑制活性。初步构效关系表明在齐墩果酸的2位引入苯胺亚甲基和脲亚甲基均可增强活性, C-28位酰胺化也具有一定的增强活性的作用, 且苯环上的吸电子基团不利于抗肿瘤活性(Ⅱ5 > Ⅱ4 > Ⅱ1 > Ⅱ3 > Ⅱ2), 将C-28位羧基成酯并改变酯链长度, 随着链长度的增加抗肿瘤活性随之增加, 但碳链过长不利于抗肿瘤活性(Ⅰ3 > Ⅰ4 > Ⅰ5 > Ⅰ2 > Ⅰ1), 如图 7, 其中Ⅰ3和Ⅱ5对肿瘤细胞显示出较强的抑制作用, SGC-7901细胞(IC50 = 4.46 μmol·L-1, IC50 = 4.01 μmol·L-1)和A549细胞(IC50 = 5.77 μmol·L-1, IC50 = 4.49 μmol·L-1)。PDGF受体蛋白抑制实验表明化合物Ⅱ5对PDGF受体表现出较强的抑制活性。本研究结果对进一步优化设计齐墩果酸衍生物作为PDGF受体抑制剂的研究具有参考价值。
|
Figure 7 Summarized structure-activity relationships of novel compounds with regard to cancer inhibition |
Büchi B-540熔点测定仪; BrukerARX-600型核磁共振分析仪, CDCl3为溶剂, TMS为内标; 热电-菲尼根LCQ型质谱仪; SPECTRA MAX plus型酶标仪; XDS-1B倒置显微镜; TGL-16B低速台式离心机。齐墩果酸(质量分数 > 98%)购于陕西森弗生物技术有限公司; 柱色谱用200~300目硅胶、薄层色谱硅胶GF254, 购于深圳市宇恒硅橡胶制品有限公司; 显色剂为10%硫酸乙醇溶液(实验室自制); 活性测试所用的RPMI-1640培养基(含10%胎牛血清, 100 u·mL-1青霉素, 100 μg·mL-1链霉素)、四甲基偶氮唑盐(MTT)、胰蛋白酶(Trypsin)和标准胎牛血清(FBS), 购于上海图赫实业有限公司; 活性测试所用SGC-7901和A549细胞均由沈阳药科大学药理教研室提供。阳性对照物阿霉素和吉非替尼, 购于阿斯利康制药有限公司。所有试剂均为分析纯或化学纯。
1 目标化合物合成 1.1 3-羰基-齐墩果烷型-12-烯-28-羧酸(OA-1)的制备取OA (0.500 g, 1.10 mmol)充分溶解于50 mL丙酮中, 在冰浴条件下缓慢滴加新配制的Jones'试剂0.64 mL (5.78 mmol), 10 min后将温度升为室温反应2.5 h, TLC跟踪检测终点[展开剂:石油醚-丙酮5:1 (V/V)], 显色剂为10%硫酸乙醇溶液, 反应结束后, 加入异丙醇20 mL淬灭, 室温搅拌45 min。待反应完毕后, 加入适量饱和食盐水和乙酸乙酯, 萃取3次, 合并有机相。无水MgSO4干燥过夜, 过滤, 减压蒸馏浓缩得粗品, 粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯10:1 (V/V)], 得0.486 g白色粉末状固体OA-1, 产率97.2%, mp 221.1~222.5 ℃。
1.2 3-羰基-齐墩果烷型-12-烯-28-羧酸乙酯(OA-2)的制备取中间体OA-1 (0.500 g, 1.10 mmol)充分溶于10 mL N, N-二甲基甲酰胺中, 加入无水碳酸钾0.30 g, 冰浴下缓慢滴加溴乙烷0.24 mL (5.02 mmol), TLC检测反应终点[展开剂:石油醚-乙酸乙酯5:1 (V/V)]。反应结束后, 加入饱和食盐水和乙酸乙酯, 萃取3次, 合并有机相。用无水MgSO4干燥过夜, 过滤, 粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得0.445 g白色片状固体OA-2, 产率89.0%, mp 208.3~209.5 ℃。
1.3 2-羟亚甲基-3-羰基-齐墩果烷-12-烯-28-羧酸乙酯(OA-3)的制备取上一步中间体OA-2 (0.400 g, 0.8 mmol), 溶于10 mL无水甲苯溶液中, 在冰浴条件下加入叔丁醇钾0.30 g, 并缓慢滴加甲酸乙酯1 mL, 20 min后将温度升为室温反应12 h, TLC检测反应终点[展开剂:石油醚-乙酸乙酯5:1 (V/V)]。反应结束后, 减压蒸发除去溶剂, 得淡黄色油状固体, 产物经稀盐酸洗涤后, 加入饱和食盐水和乙酸乙酯, 萃取3次, 合并有机相。用无水MgSO4干燥过夜, 过滤, 粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得0.305 g淡黄色片状固体OA-3, 产率76.25%, mp 195.5~197.6 ℃。
1.4 3-羰基-齐墩果烷型-12-烯-28-酰-苯胺(OA-4)的制备取中间体OA-1 (0.500 g, 1.10 mmol), 加入干燥的二氯甲烷(DCM) 25 mL, 室温下搅拌, 待中间体完全溶解后, 加入草酰氯(1.20 mmol), 加热回流, 4 h后反应完毕, 生成3-羰基-12-烯-齐墩果烷-28-酰氯, 旋蒸除去反应溶剂和未反应的草酰氯, 残余物加入环己烷10 mL, 随后减压蒸除环己烷, 反复操作3次。酰氯中加入DCM 15 mL, 并加三乙胺调pH为9~10, 搅拌5 min后, 加入苯胺(2.2 mmol), 室温下反应6 h, 以TLC检测反应终点。反应结束后, 向反应液中加入15 mL食盐水, 以2 mol·L-1稀盐酸调至pH 3~4, 静止分层, 分离有机相, 向水中再加入20 mL DCM, 萃取3次, 合并有机相, 加入无水MgSO4干燥。减压蒸馏, 得白色固体。粗品经硅胶柱色谱分离纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得目标产物0.346 g淡黄色晶体OA-4, 产率69.2%, mp 124.4~126.7 ℃。
1.5 2-羟亚甲基-3-羰基-齐墩果烷型-12-烯-28-酰-苯胺(OA-5)的制备按照OA-3的制备方法, 由OA-4 (0.8 mmol)与甲酸乙酯12 mmol反应。最后粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得0.294 g淡黄色片状固体OA-3, 产率73.50%, mp 113.5~114.6 ℃。
1.6 2-苯胺亚甲基-3-羰基-齐墩果烷-12-烯-28-羧酸乙酯(Ⅰ1)的制备取上一步中间体OA-3 (0.400 g, 0.78 mmol), 溶解于15 mL无水乙醇中, 并加入苯胺(0.87 g, 9.34 mmol) 0.80 mL溶液, 加热至回流, TLC检测反应终点[展开剂:石油醚-乙酸乙酯5:1 (V/V)], 4 h反应结束。减压蒸出溶剂, 加入饱和食盐水和乙酸乙酯萃取3次, 合并有机相。用无水MgSO4干燥过夜, 过滤, 粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得0.284 g淡黄色粉末状固体Ⅰ1, 产率71.0%, mp 200.9~203.3 ℃。
按照Ⅰ1的制备方法, 由中间体OA-1 (1.10 mmol)与溴丙烷(4.95 mmol)反应。最终粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得到0.279 g白色粉末状固体Ⅰ2, 产率69.8%, mp 212.3~213.9 ℃。
按照Ⅰ1的制备方法, 由中间体OA-1 (1.10 mmol)与溴丁烷(4.95 mmol)反应。最终粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得到0.261 g白色粉末状固体Ⅰ3, 产率65.3%, mp 221.4~224.0 ℃。
按照Ⅰ1的制备方法, 由中间体OA-1 (1.10 mmol)与溴戊烷(4.95 mmol)反应。最终粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得到0.277 g白色粉末状固体Ⅰ4, 产率69.3%, mp 231.0~232.8 ℃。
按照Ⅰ1的制备方法, 由中间体OA-1 (1.10 mmol)与溴己烷(4.95 mmol)反应。最终粗品经硅胶柱色谱纯化[洗脱剂:石油醚-乙酸乙酯20:1 (V/V)], 得到0.250 g白色粉末状固体Ⅰ5, 产率62.5%, mp 239.2~240.8 ℃。
1.7 2-脲亚甲基-3-羰基-齐墩果烷型-12-烯-28-酰-苯胺(Ⅱ1)的制备取中间体OA-5 (0.400 g, 0.67 mmol), 溶解于15 mL无水乙醇中, 并加入尿素(0.30 g, 5.03 mmol)溶液, 加热至回流, TLC检测反应终点[展开剂:石油醚-丙酮2:1 (V/V)], 4 h反应结束。减压蒸出溶剂, 加入饱和食盐水和二氯甲烷萃取3次, 合并有机相。用无水MgSO4干燥过夜, 过滤, 粗品经硅胶柱色谱纯化[洗脱剂:二氯甲烷-甲醇50:1 (V/V)], 得0.261 g淡黄色粉末状固体Ⅱ1, 产率65.3%, mp 113.5~114.6 ℃。
按照Ⅱ1的制备方法, 由中间体OA-1 (1.10 mmol)与间氟苯胺(2.20 mmol)反应。最终粗品经硅胶柱色谱纯化[洗脱剂:二氯甲烷-甲醇50:1 (V/V)], 得到0.250 g淡黄色粉末状固体IⅠ2, 产率50.0%, mp 101.5~102.2 ℃。
按照Ⅱ1的制备方法, 由中间体OA-1 (1.10 mmol)与间氯苯胺(2.20 mmol)反应。最终粗品经硅胶柱色谱纯化[洗脱剂:二氯甲烷-甲醇50:1 (V/V)], 得到0.248 g淡黄色粉末状固体IⅠ3, 产率49.6%, mp 93.8~94.7 ℃。
按照Ⅱ1的制备方法, 由中间体OA-1 (1.10 mmol)与间甲基苯胺(2.20 mmol)反应。最终粗品经硅胶柱色谱纯化[洗脱剂:二氯甲烷-甲醇50:1 (V/V)], 得到0.251 g淡黄色粉末状固体Ⅱ4, 产率50.2%, mp 104.1~105.7 ℃。
按照Ⅱ1的制备方法, 由中间体OA-1 (1.10 mmol)与间甲氧基苯胺(2.20 mmol)反应。最终粗品经硅胶柱色谱纯化[洗脱剂:二氯甲烷-甲醇50:1 (V/V)], 得到0.247 g淡黄色粉末状固体Ⅱ5, 产率49.4%, mp 115.3~1116.7 ℃。
2 初步体外活性测试选择人肺癌A549细胞和人胃癌SGC7901细胞为靶细胞, 用吉非替尼和多柔比星为阳性对照, 采用MTT比色法对合成的齐墩果酸衍生物进行体外抗肿瘤活性测试。取0.25%胰蛋白酶消化单层培养的细胞, 用含10%小牛血RPML1640培养液调整细胞数为每毫升2×104~4×104的单细胞悬液, 接种于96孔培养板内。将培养板放入CO2培养箱, 在37 ℃、5% CO2及饱和湿度条件下培养, 待培养细胞贴壁后, 给药组加入含有不同浓度(将起始浓度为1 mg·mL-1药品依次稀释成500、50、5、0.5、0.05 μg·mL-1)的测试物, 至少3个平行孔, 实验的空白对照组继续放入CO2培养箱, 在37 ℃、5% CO2及饱和湿度条件下培养72 h。培养72 h后, 每孔加入MTT溶液50 μL, 37 ℃继续培养4 h, 离心弃去上清液, 每孔加入150 μL DMSO溶解甲臜颗粒, 振荡溶解。在酶联免疫检测仪波长为490 nm条件下测定光密度值(OD), 计算所测化合物对细胞的抑制率和IC50值。
3 PDGF受体抑制实验采用荧光偏振免疫分析法对合成的齐墩果酸衍生物Ⅰ3和Ⅱ5进行PDGF受体抑制活性测试。在384孔板依次加入PDGFR-β蛋白30 μL和被稀释成不同浓度的化合物(将起始浓度为10 μg·mL-1药品依次稀释成5、2.5、2、1、0. 5 μg·mL-1), 以不加PDGFR-β蛋白为阳性对照, 在25 ℃、140 r·min-1振荡条件下培养1 h。1 h后向每孔加入FILC溶液30 μL, 继续避光振荡培养15 min, 用酶标仪检测不同浓度的两个样品的偏振值, 计算所测化合物对靶蛋白的抑制率和IC50值。
| [1] | Mo WB, Su CH, Huang JY, et al. Synthesis of acyl oleanolic acid-uracil conjugates and their anti-tumor activity[J]. Chem Central J, 2016, 10: 69. DOI:10.1186/s13065-016-0217-5 |
| [2] | Cheng KG, Su CH, Huang JY, et al. Synthesis and cytotoxic evaluation of several oleanolic acid-uracil/thymine conjugates[J]. Medchemcomm, 2016, 7: 972–981. DOI:10.1039/C6MD00061D |
| [3] | Tian T, Liu XY, Lee ES, et al. Synthesis of novel oleanolic acid and ursolic acid in C-28 position derivatives as potential anticancer agents[J]. Arch Pharm Res, 2017, 40: 458–468. DOI:10.1007/s12272-016-0868-8 |
| [4] | Silva FS, Oliveira PJ, Duarte MF. Oleanolic, ursolic and betulinic acids as food supplements or pharmaceutical agents for type 2 diabetes-promise or illusion[J]. J Agric Food Chem, 2016, 64: 2991–3008. DOI:10.1021/acs.jafc.5b06021 |
| [5] | Nkeh-Chungag BN, Oyedeji OO, Oyedeji AO, et al. Anti-inflammatory and membrane-stabilizing properties of two semisynthetic derivatives of oleanolic acid[J]. Inflammation, 2015, 38: 61–69. DOI:10.1007/s10753-014-0007-y |
| [6] | Tsao SM, Yin MC. Antioxidative and anti-inflammatory activities of asiatic acid, glycyrrhizic acid, and oleanolic acid in human bronchial epithelial cells[J]. J Agric Food Chem, 2015, 63: 3196–3204. DOI:10.1021/acs.jafc.5b00102 |
| [7] | Meng YQ, Zhang LF, Liu DY, et al. Synthesis and antitumor activity evaluation of novel ursolic acid derivatives[J]. J Asian Nat Prod Res, 2016, 18: 280–288. DOI:10.1080/10286020.2015.1070830 |
| [8] | Meng YQ, Zhao YW, Kuai ZY, et al. Synthesis and antitumor activity evaluation of novel oleanolic acid derivatives[J]. J Asian Nat Prod Res, 2017, 19: 1000–1010. DOI:10.1080/10286020.2017.1283310 |
| [9] | Meng YQ, Cui HB, Zhang WC, et al. Synthesis and antitumor activity evaluation of asiatic acid derivatives as survivin inhibitor[J]. J Asian Nat Prod Res, 2018, 20: 1–12. DOI:10.1080/10286020.2017.1381089 |
| [10] | Meng YQ, Xing W, Kuai ZY, et al. Synthesis and anti-tumor activities of ring A derived analogues of oleanolic acid[J]. Chin J Org Chem (有机化学), 2017, 37: 1417–1425. DOI:10.6023/cjoc201610033 |
| [11] | Niu G, Sun L, Pei Y, et al. Oleanolic acid inhibits colorectal cancer angiogenesis by blocking the VEGFR2 signaling pathway[J]. Anticancer Agents Med Chem, 2018, 18: 583–590. DOI:10.2174/1871520617666171020124916 |
| [12] | Maneesai P, Bunbupha S, Kukongviriyapan U, et al. Effect of asiatic acid on the Ang Ⅱ-AT1R-NADPH oxidase-NF-κB pathway in renovascular hypertensive rats[J]. Naunyn Schmiedebergs Arch Pharmacol, 2017, 390: 1073–1083. DOI:10.1007/s00210-017-1408-x |
| [13] | Singh J, Sharma K, Pillai P, et al. PDGFR inhibition mediated intracellular signalling in C6 glioma growth and migration:role of ERK and ROCK pathway[J]. Cytotechnology, 2018, 70: 465–477. DOI:10.1007/s10616-017-0163-7 |
| [14] | Kurahara H, Maemura K, Mataki Y, et al. Impact of p53 and PDGFR-β expression on metastasis and prognosis of patients with pancreatic cancer[J]. World J Surg, 2016, 40: 1977–1984. DOI:10.1007/s00268-016-3477-2 |
| [15] | Jeibmann A, Halama K, Witte HT, et al. Involvement of CD9 and PDGFR in migration is evolutionarily conserved from Drosophila glia to human glioma[J]. J Neurooncol, 2015, 124: 373–383. DOI:10.1007/s11060-015-1864-4 |
| [16] | Moawad EY. Predicting effectiveness of imatinib mesylate in tumors expressing platelet-derived growth factors (PDGF-AA, PDGF-BB), stem cell factor ligands and their respective receptors (PDGFR-α, PDGFR-β, and c-kit)[J]. J Gastrointest Cancer, 2015, 46: 272–283. DOI:10.1007/s12029-015-9721-4 |
| [17] | Chu JS, Ge FJ, Zhang B, et al. Expression and prognostic value of VEGFR-2, PDGFR and c-Met in advanced hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2013, 32: 1–8. DOI:10.1186/1756-9966-32-1 |
| [18] | Wang ZH, Hu PC, Fang T, et al. HDAC6-mediated EGFR stabilization and activation restrict cell response to sorafenib in non-small cell lung cancer cells[J]. Med Oncol, 2016, 33: 1–9. DOI:10.1007/s12032-015-0714-8 |
| [19] | Rossi A, Latiano TP, Parente P, et al. The potential role of nintedanib in treating colorectal cancer[J]. Expert Opin Pharmacother, 2017, 18: 1153–1162. DOI:10.1080/14656566.2017.1346086 |
| [20] | Steinemann G, Jacobsen C, Gerwing M, et al. Activity of nintedanib in germ cell tumors[J]. Anti-Cancer Drugs, 2016, 27: 89–98. DOI:10.1097/CAD.0000000000000305 |
 2018, Vol. 53
2018, Vol. 53


