2. 山西省动物疫病预防控制中心, 山西 太原 030027;
3. 内蒙古农业大学兽医学院, 农业农村部动物疾病临床诊疗技术重点实验室, 内蒙古 呼和浩特 010018
2. Shanxi Animal Disease Control Center, Taiyuan 030027, China;
3. Key Laboratory of Clinical Diagnosis and Treatment Techniques for Animal Disease, Ministry of Agriculture and Rual, College of Veterinary Medicine, Inner Mongolia Agricultural University, Hohhot 010018, China
胆汁, 性味苦寒, 具有清热解毒、清肝明目、清肺止咳、滋阴润肺之功效, 为我国传统动物来源中药, 应用历史悠久, 因其来源广泛, 疗效确切, 备受关注[1]。早在《神农本草经》中就有关于牛胆的记载, 后来的《唐本草》中还记载了熊胆汁的应用, 《本草纲目》与《中华本草》中更是分别收录了31和44种动物胆汁[2], 上千年的用药历史证明了胆汁的确切疗效。
现代药理学研究发现, 动物胆汁在治疗呼吸系统疾病(如急慢性气管炎、咳嗽等)、肝胆疾病(如胆固醇性结石)、消化系统疾病(如小儿单纯性消化不良)等方面具有显著作用[3, 4], 此外, 动物胆汁还具有解热镇痛[5]、抑菌、抗炎[6, 7]、免疫调节[8]等多方面的药理作用。不同动物胆汁组成成分略有差异, 但均主要包含胆汁酸、胆色素、脂类、蛋白、微量元素等成分, 其中胆汁酸被认为是胆汁发挥功效的物质基础。按照来源可将胆汁酸分为初级和次级胆汁酸, 前者由胆固醇经多次酶促反应在肝脏合成, 后者主要由前者在肠道细菌水解后经7-位脱羟基作用而产生; 按照化学结构可将胆汁酸分为游离型和结合型胆汁酸。
在各类型胆汁酸中, 牛磺鹅去氧胆酸(taurochenodeoxycholic acid, TCDCA, 图 1)作为结合型胆汁酸主要存在于多种动物(如鸡、鸭、鹅、蛇等)胆汁中, 不同动物胆汁中TCDCA含量有一定差异, 其中以鸡、鸭、鹅等家禽胆汁含量较高, 均超过38%[9]。课题组前期研究中发现, TCDCA对多种原因引起的急慢性炎症反应均具有良好的抑制作用[10], 但其确切作用机制尚未阐明, 本研究拟通过网络药理学分析TCDCA抗炎作用机制, 为深入揭示TCDCA的药理作用提供支持。
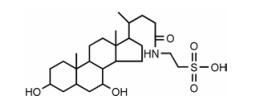
|
Figure 1 The chemical structure of taurochenodeoxycholic acid (TCDCA) |
TCDCA作用靶点的获取 登录PubChem服务器, 查询并下载TCDCA的3D分子结构式, 储存为SDFile (*.sdf)格式。然后将TCDCA.sdf文件输入PharmMapper服务器[11], 获得TCDCA作用靶点。利用UniProt数据库的Retrieve/ID Mapping功能[12], 将靶点的UniProt ID转换为Gene Symbol。
炎症相关靶点的筛选 在GeneCards服务器输入inflammation和anti-inflammation搜索已报道的炎症相关基因[13], 去除重复基因, 与PharmMapper返回的TCDCA靶点进行匹配, 得到TCDCA抗炎作用靶点。
蛋白相互作用网络构建分析 将TCDCA抗炎作用靶点信息导入STRING数据库(https://string-db.org/, Version 10.5)[14], 设定物种为人, 可获得靶点蛋白相互作用关系, 从结果中提取node1、node2及combine score等相关信息导入Cytoscape程序构建靶点蛋白网络[15], 并对网络进行分析, 保存分析结果, 设置结点颜色和大小以反映degree的大小, 设置边的粗细反映combine score的大小, 建立靶点蛋白相互作用网络。
生物功能与通路分析 将TCDCA作用靶点信息输入STRING数据库, 进行GO富集分析和KEGG通路注释分析, 保存结果, 设定阈值为P < 0.05, 筛选生物过程或通路。
分子对接验证 选择KEGG通路中富集的靶点, 查找其PDB ID, 输入Systems Dock Web Site (http://systemsdock.unit.oist.jp, Version 2.0)与TCDCA进行分子对接[16], 保存对接结果, 对其对接打分进行分析, 用以评价TCDCA与各靶点间的结合活性。
靶点类型归属 将能够与TCDCA发生对接的靶点信息输入DisGeNET数据库[17], 获取靶点类型相关信息。
结果 1 靶点预测将TCDCA在PharmMapper服务器返回的前100个潜在作用靶点依据fit score进行排序, 通过UniProt数据库将UniProt ID转换为Gene Symbol, 然后与GeneCards中炎症相关基因进行比对, 筛选出89个TCDCA抗炎的潜在作用靶点, 详见表 1。
| Table 1 Information of potential targets from TCDCA |
将上述靶点蛋白信息导入STRING数据库, 获得靶点蛋白相互作用关系, 利用Cytoscape程序对靶点蛋白相互作用网络进行可视化处理(图 2)。图中的节点表示靶点蛋白分子, 边表示各靶点间的相互关系, 共包含85个节点, 356条边(其中HRSP12、RORA、CRAT和ISG20与其他靶点蛋白不存在相互作用, 故不在网络中体现)。图中节点颜色和大小反映了靶点蛋白degree的值, 颜色由绿变红、节点越大表示该靶点蛋白的degree值越大, 反之表示degree值越小。边的粗细程度表示靶点蛋白间的combine score值, 线条越粗, 表示该值越大。
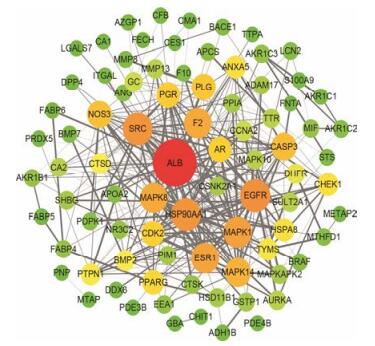
|
Figure 2 Target protein interaction network of TCDCA |
通过STRING数据库分析了TCDCA抗炎靶点的生物学过程、分子功能和细胞成分, 结果表明, 这些靶点被富集到68个生物学过程中(表 2), 其中排名前5的生物学过程主要包括:对刺激的反应(response to stimulus)、多细胞生物过程(multicellular organismal process)、单细胞生物过程(single-multicellular organism process)、对化学刺激的反应(response to chemical)及对有机物的反应(response to organic substance)等。分子功能GO分析表明(表 3), TCDCA的靶点主要富集于蛋白结合(protein binding)、脂质结合(lipid binding)、受体结合(receptor binding)、脂肪酸结合(fatty acid binding)、受体信号蛋白丝氨酸/苏氨酸激酶活性(receptor signaling protein serine/threonine kinase activity)及MAPK蛋白激酶活性(MAP kinase activity)等6方面。在细胞组分方面(表 4), 这些靶点主要为细胞质(cytoplasmic part、cytosol)、细胞外成分(extracellular region)、膜结合囊泡(membrane-bounded vesicle)、囊泡(vesicle)、外泌体(extracellular exosome)与内涵体(endosome)等。
| Table 2 Gene ontology terms for biological process of TCDCA |
| Table 3 Gene ontology terms for molecular functions of TCDCA |
| Table 4 Gene ontology terms for cellular components of TCDCA |
TCDCA所有潜在抗炎靶点中共有44个靶点富集到51条信号通路(表 5), 排名靠前的通路包括癌症相关通路(pathways in cancer)、孕酮介导的卵母细胞成熟(progesterone-mediated oocyte maturation)、MAPK信号通路(MAPK signaling pathway)、蛋白多糖在癌症中的作用(proteoglycans in cancer)等。此外, 如胰岛素信号通路(insulin signaling pathway)、FoxO信号通路(FoxO signaling pathway)、雌激素信号通路(estrogen signaling pathway)、PPAR信号通路(PPAR signaling pathway)、NOD样信号通路(NOD- like receptor signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)及血管内皮生长因子受体信号通路(VEGF signaling pathway)等均与炎症反应密切相关, 体现了TCDCA多途径的作用特点。
| Table 5 Enriched KEGG pathways of potential targets of TCDCA |
将上述富集到51条通路中的44个靶点的PDB ID输入到System Dock Web Site服务器中, 采用分子对接的方式进一步确认这些靶点与TCDCA的结合活性, 研究发现只有24个分子可以与TCDCA发生结合, 其中docking score大于7.0的有18个靶点, TCDCA与其中5个靶点的打分甚至超过8.0 (表 6, 图 3), 介于5.0~7.0之间的有6个靶点。该对接程序认为docking score大于4.25表示药物分子与靶蛋白间存在结合能力, 大于5.0时表示结合活性较强, 大于7.0时表示结合能力极强[18]。分子对接结果表明, TCDCA与预测靶点的结合能力均较强, 体现了TCDCA多靶点的作用特点。
| Table 6 Molecular docking of TCDCA |
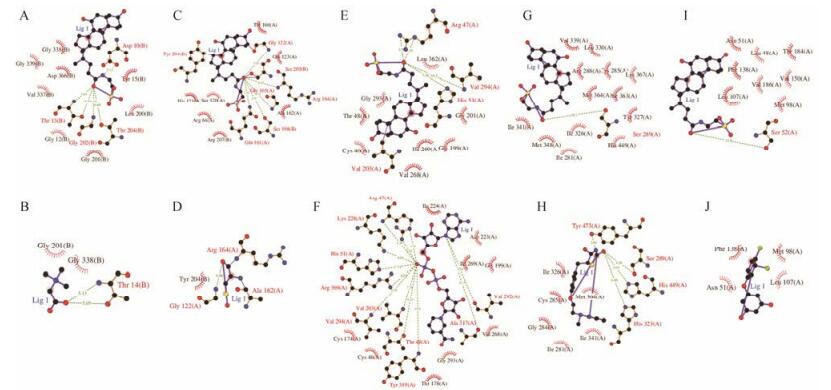
|
Figure 3 Results of molecular docking. A, C, E, G, I: Molecular docking results for TCDCA with HSPA8, CASP3, ADH1B, PPARG and HSP90AA1 respectively; B, D, F, H, J: Positive control |
将上述可与TCDCA结合的24个靶点信息输入DisGeNET数据库查找各靶点作用类型(protein class, 表 7), 发现这些靶点多数为蛋白激酶、氧化还原酶、转录因子、受体等, 表明TCDCA可作为信号分子与这些靶点发生结合, 调控相关靶点的生物学功能, 这与近年来对于胆汁酸生理功能的研究结果相吻合[19, 20]。
| Table 7 The protein class of potential anti-inflammation targets of TCDCA |
胆汁酸具有乳化脂肪、增强脂肪酶活性, 促进脂肪及脂溶性维生素的消化与吸收, 促进胆汁分泌防止胆石生成等作用[21, 22]。近年来发现, 胆汁酸可作为信号分子, 激活细胞内信号转导通路发挥抗炎、免疫调节等药理作用[19, 20]。研究发现, TCDCA具有显著的抗炎、免疫调节作用, 对物理、化学、细菌等原因引起的炎症反应均具有显著的抑制作用[10], 随着研究深入, 本课题组以佐剂性关节炎(adjuvant arthritis, AA)模型为研究对象探讨了TCDCA对糖皮质激素受体(glucocorticoid receptor, GR)介导的信号通路的影响, 结果表明TCDCA可激活GR, 显著抑制AA大鼠足跖肿胀, 改善AA大鼠骨骼关节变形等情况, 表现出明显的抗炎作用[23], TCDCA对AA的治疗作用与其抑制AA大鼠滑膜组织与细胞中核因子-κB (nuclear factor-κB, NF-κB)转录活性, 进而抑制肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、白细胞介素(interleukin, IL)-1β、IL-6等细胞因子及细胞间黏附分子-1的表达[23, 24], 以及诱导AA大鼠成纤维样滑膜细胞凋亡有关[25], 但同时研究也发现, 阻断GR信号通路并不能完全拮抗TCDCA的抗炎作用, 这表明还存在其他通路参与了TCDCA抗炎作用。因此, 通过网络药理学的方式深入挖掘TCDCA的作用靶点对于揭示其作用机制具有重要意义。
本研究通过PharmMapper服务器与GeneCards数据库预测到TCDCA的潜在抗炎作用靶点共89个。接着通过STRING数据库分析发现, 在这些靶点中, 共有85个蛋白存在相互作用关系, 这表明TCDCA抗炎作用并非依靠作用于单一靶点起效, 而是多靶点彼此协同作用。随后利用STRING数据库对这些靶点进行了GO分析, 结果表明, 这些靶点主要分布于细胞外、细胞质、膜结合囊泡、外泌体、内涵体等部位, 具有与蛋白、脂质、受体、脂肪酸结合的功能, 还具有蛋白激酶的活性, 可参与机体对多种物质刺激的反应过程, 参与蛋白、脂质代谢, 调控细胞增殖、免疫应答, 调控多种蛋白激酶活性等作用, 这表明TCDCA的抗炎作用可通过多层次、多途径实现。
对上述靶点进行KEGG通路分析发现, 共有44个靶点可富集到51条信号通路中, 其中24个靶点可与TCDCA发生结合, 它们主要为酶类(包括蛋白酶、蛋白激酶、氧化还原酶、转移酶、水解酶等)、受体、转录因子、转运蛋白、钙结合蛋白、伴侣分子、细胞骨架蛋白等。进一步分析发现, 这些靶点中MAPK1 (41)、MAPK8 (31)、MAPK10 (31)、MAPK14 (26)、BRAF (19)、EGFR (18)、SRC (15)、CASP3 (12)、PDPK1 (11)等均参与了10条以上信号通路(表 6), 以上靶点可能对TCDCA的抗炎作用具有重要的影响。
上述靶点中, MAPK1、MAPK8、MAPK10、MAPK14均为丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族成员, 它们是一组在真核生物中高度保守的蛋白激酶, 其介导的信号转导通路在调节细胞增殖、分化、凋亡过程中发挥重要作用, 此外, MAPK通路还参与了机体对外界环境应激的适应、炎症反应等多种生理、病理过程, 是多种抗炎药物作用的共同通路[26]。Dong等[27]发现低浓度胆汁酸能够促进大鼠肝细胞JNK蛋白表达, Alpini等[28]研究发现, TCDCA的差向异构体牛磺熊去氧胆酸可通过MAPK通路抑制胆管上皮癌细胞系Mz-ChA-1细胞的增殖, Ko等[29]报道证实, 熊去氧胆酸(ursodeoxycholic acid, UDCA)能够调控MAPK和NF-κB通路抑制脂多糖(lipopolysaccharide, LPS)诱导RAW 264.7巨噬细胞中IL-1β、TNF-α、IL-6等细胞因子的表达, 同时还能促进抗炎细胞因子IL-10的表达, 以上研究表明胆汁酸可以调控不同细胞中的MAPK通路。Wang等[30]报道了TCDCA可以通过PKC/JNK通路诱导NR8383细胞凋亡, 这与本研究网络药理学的预测基本一致, 表明MAPK通路可能是TCDCA发挥抗炎作用的重要途径。
BRAF作为一种蛋白激酶参与了促有丝分裂信号从细胞膜到细胞核的传递, 能够磷酸化MAP2K1激活MAPK/ERK信号通路。在类风湿性关节炎等炎症疾病中, BRAF-MAPK/ERK信号通路被激活, 促进成纤维样滑膜细胞增殖, 可加重关节炎症反应[31], Zhang[32]发现白芍药苷可抑制该通路显著缓解类风湿性关节炎。课题组前期研究发现, TCDCA可促进细胞凋亡, 抑制成纤维样滑膜细胞过度增殖[25], 在这一过程中TCDCA对BRAF-MAPK/ERK通路的影响尚不清楚。
表皮生长因子受体(epidermal growth factor receptor, EGFR)是一种糖蛋白, 位于细胞膜表面, 属于酪氨酸激酶受体, 与其配体结合后形成二聚体, 并发生磷酸化激活, 活化的EGFR可进一步激活下游的RAS-RAF-MEK-ERK、PI3K-AKT、PLC-PKC、STATs与NF-κB等信号通路, 而这些信号通路都与炎症反应密切相关。Im等[33]发现, UDCA可以通过调控EGFR/Raf-1/ERK通路抑制脱氧胆酸诱导的结肠癌细胞凋亡, 表明胆汁酸可通过调控EGFR相关通路发挥生物学效应[34]。Rust等[35]报道, TCDCA可以激活EGFR下游PI3K/PKC通路, 但对于PI3K下游另一重要蛋白AKT无影响; TCDCA还可以抑制NF-κB的转录活性[36], 但由于NF-κB与多条信号通路均存在密切联系, TCDCA是否能够抑制EGFR进而抑制NF-κB还需进行实验验证。
蛋白激酶SRC广泛分布于组织细胞内, 可与多条信号通路中的关键分子发生相互作用而参与调控细胞代谢、生长、发育和分化等过程。SRC可直接激活MAPK通路上游活化蛋白RAS, 活化的RAS可依次激活RAF、MEK、MAPK/ERK引发一系列生物学效应[37]; SRC还与EGFR通路密切相关, EGFR的活性常随着SRC活性升高而升高[38];在LPS诱导的巨噬细胞炎症反应中, 抑制SRC活性可阻断诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、环氧合酶(cyclooxygenase, COX)-2及TNF-α的表达产生抗炎作用[39, 40]。TCDCA对LPS诱导的大鼠腹腔巨噬细胞中iNOS、COX-2及TNF-α的表达均有抑制作用[23, 36], 提示TCDCA也可能通过抑制SRC活性而产生抗炎作用。
PDPK1在磷脂酰肌醇-3, 4, 5-三磷酸存在的条件下可快速磷酸化AKT激活PI3K/AKT信号通路及下游NF-κB通路[41, 42], PDPK1的高表达间接促进了NF-κB通路的活化[43], 然而也有研究发现, 在巨噬细胞中PDPK1可以负反馈抑制Toll样受体介导的NF-κB通路[44], 因此, PDPK1对于炎症的影响可能是双重的。尽管PDPK1在PI3K/AKT及NF-κB信号通路中发挥重要作用, 胆汁酸也可以通过调控这两条通路产生相关生物学效应, 但目前胆汁酸对PDPK1有何影响尚不明确。
除了上述参与多条通路的靶点外, HSPA8、CASP3、ADH1B、PPARG、HSP90AA1等靶点在与TCDCA的分子对接中得分较高, 可能对TCDCA的抗炎作用也具有重要作用。这些靶点中, HSPA8、HSP90AA均与LPS诱导细胞分泌TNF-α有关, TCDCA已被证实在多种情况下均可抑制TNF-α表达[45, 46];前期研究证实TCDCA可通过活化CASP3诱导佐剂性关节炎模型大鼠成纤维样滑膜细胞凋亡[25]; ADH1B与PPARG可调控体内物质代谢, 前者参与体内乙醇的代谢, 而PPARG主要与脂质代谢有关, 同时, PPARG在调控机体炎症反应方面也显示出重要作用, 但目前对于TCDCA与这两个靶点的研究尚未见相关报道。
综合以上信息不难发现, TCDCA的上述靶点主要集中于调控RAS-RAF-MAPK、PI3K-AKT、NF-κB等信号通路, 这些通路均与炎症反应密切相关, 其中部分靶点在TCDCA抗炎效果中的作用已有相关文献报道, 在一定程度上确证了本研究有关网络药理学预测的准确性, 其余靶点的作用尚需进一步确证。本研究证明了TCDCA的抗炎作用是通过多靶点、多途径、多通路实现的, 为今后更加深入地阐明TCDCA的抗炎机制提供了新方向, 也为以胆汁酸为基础的创新抗炎药物研制奠定了基础。
| [1] | Yuan S, Zhao W, Wang J. Research progress on pharmacological activities and clinical application of Sus scrofa domestica Brisson bile[J]. Acta Chin Med Pharmacol (中医药学报), 2014, 42: 166–168. |
| [2] | Zhao W, Wang Y, Lu Y, et al. Medicinal research on animal bile[J]. Inform Tradit Chin Med (中医药信息), 1999, 16: 14–15. |
| [3] | Jiang J, Yang P, Shi X, et al. Research progress on components and pharmacological activities of animal bile[J]. Food Drug (食品与药品), 2017, 19: 227–231. |
| [4] | Hu X, Shi C. Comparison of tauro conjugated bile acids with the corresponding free bile acids in antitussive, expectorant and anti-inflammatory effects[J]. Chin J Clin Pharm (中国临床药学杂志), 2001, 10: 85–88. |
| [5] | Li P, Guan H, Baiyin J. Studies on antipyretic and analgesic effects of taurine and cholic acid in mice and rats[J]. J Tradit Chin Veter Med (中兽医医药杂志), 2003, 22: 3–5. |
| [6] | Hasi S, Li P, Cao J, et al. Studies on antibacterial effects of taurine and cholic[J]. J Tradit Chin Veter Med (中兽医医药杂志), 2001, 20: 3–6. |
| [7] | Li P, Guan H, Hasi S, et al. Studies on anti-inflammatory effects of taurine and cholic[J]. J Tradit Chin Veter Med (中兽医医药杂志), 2002, 21: 7–10. |
| [8] | He X, Li P, Guan H, et al. Effect of taurochenodeoxycholic acid on immune function in mice[J]. J Chin Med Mater (中药材), 2005, 28: 1089–1092. |
| [9] | Li F. Study on the Matrix Selection for Cultivating Bear Bile Powder Analogue in vitro Based on Compositions Similarity (基于物质成分相似性的体外培育拟天然熊胆粉的基质选择研究)[D]. Chongqing: Chongqing University (重庆大学), 2015. |
| [10] | Li PF, He XL, Guan H, et al. Taurochenodeoxycholic acid (TCDCA) anti-inflammatory mechanism[J]. Chin J Veter Sci (中国兽医学报), 2008, 28: 1317–1320. |
| [11] | Wang X, Shen Y, Wang S, et al. PharmMapper 2017 update:a web server for potential drug target identification with a comprehensive target pharmacophore database[J]. Nucleic Acids Res, 2017, 45: W356–W360. DOI:10.1093/nar/gkx374 |
| [12] | Chen C, Huang H, Wu CH. Protein bioinformatics databases and resources[J]. Methods Mol Biol, 2017, 1558: 3–39. DOI:10.1007/978-1-4939-6783-4 |
| [13] | Rebhan M, Chalifa-Caspi V, Prilusky J, et al. GeneCards:integrating information about genes, proteins and diseases[J]. Trends Genet, 1997, 13: 163. DOI:10.1016/S0168-9525(97)01103-7 |
| [14] | Szklarczyk D, Morris JH, Cook H, et al. The STRING database in 2017:quality-controlled protein-protein association networks, made broadly accessible[J]. Nucleic Acids Res, 2017, 45: D362–D368. DOI:10.1093/nar/gkw937 |
| [15] | Shannon P, Markiel A, Ozier O, et al. Cytoscape:a software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13: 2498–2504. DOI:10.1101/gr.1239303 |
| [16] | Hsin KY, Matsuoka Y, Asai Y, et al. SystemsDock:a web server for network pharmacology-based prediction and analysis[J]. Nucleic Acids Res, 2016, 44: W507–W513. DOI:10.1093/nar/gkw335 |
| [17] | Pinero J, Bravo A, Queralt-Rosinach N, et al. DisGeNET:a comprehensive platform integrating information on human disease-associated genes and variants[J]. Nucleic Acids Res, 2017, 45: D833–D839. DOI:10.1093/nar/gkw943 |
| [18] | Wu D, Gao Y, Xiang H, et al. Exploration into mechanism of antidepressant of Bupleuri radix based on network pharmacology[J]. Acta Pharma Sin (药学学报), 2018, 53: 210–219. |
| [19] | Zhou H, Hylemon PB. Bile acids are nutrient signaling hormones[J]. Steroids, 2014, 86: 62–68. DOI:10.1016/j.steroids.2014.04.016 |
| [20] | Guo C, Xie S, Chi Z, et al. Bile acids control inflammation and metabolic disorder through inhibition of NLRP3 inflammasome[J]. Immunity, 2016, 45: 802–816. DOI:10.1016/j.immuni.2016.09.008 |
| [21] | de Aguiar VT, Tarling EJ, Edwards PA. Pleiotropic roles of bile acids in metabolism[J]. Cell Metab, 2013, 17: 657–669. DOI:10.1016/j.cmet.2013.03.013 |
| [22] | Fiorucci S, Distrutti E. Bile acid-activated receptors, intestinal microbiota, and the treatment of metabolic disorders[J]. Trends Mol Med, 2015, 21: 702–714. DOI:10.1016/j.molmed.2015.09.001 |
| [23] | Liu M, Mao W, Guan H, et al. Effects of taurochenodeoxycholic acid on adjuvant arthritis in rats[J]. Int Immunopharmacol, 2011, 11: 2150–2158. DOI:10.1016/j.intimp.2011.09.011 |
| [24] | Li L, Liu C, Li P. Effect of taurochenodeoxycholic acid on the expression of ICAM-1 in fibroblast-like synoviocytes of adjuvant arthritis in rats[J]. Chin J Veter Sci (中国兽医学报), 2017, 37: 1144–1148. |
| [25] | Li L, Liu C, Liu M, et al. Taurochenodeoxycholic acid induces apoptosis of fibroblast-like synoviocytes[J]. Eur J Pharmacol, 2013, 706: 36–40. DOI:10.1016/j.ejphar.2013.02.051 |
| [26] | Plotnikov A, Zehorai E, Procaccia S, et al. The MAPK cascades:signaling components, nuclear roles and mechanisms of nuclear translocation[J]. Biochim Biophys Acta, 2011, 1813: 1619–1633. DOI:10.1016/j.bbamcr.2010.12.012 |
| [27] | Dong X, Zhao H, Ma X. Low concentration of cholic acid up-regulates JNK protein expression:can it promote synthesis of liver cell DNA?[J]. J Clin Rehab Tiss Engin Res (中国组织工程研究与临床康复), 2010, 14: 5818–5822. |
| [28] | Alpini G, Kanno N, Phinizy JL, et al. Tauroursodeoxycholate inhibits human cholangiocarcinoma growth via Ca2+-, PKC-, and MAPK-dependent pathways[J]. Am J Physiol Gastrointest Liver Physiol, 2004, 286: G973–G982. DOI:10.1152/ajpgi.00270.2003 |
| [29] | Ko WK, Lee SH, Kim SJ, et al. Anti-inflammatory effects of ursodeoxycholic acid by lipopolysaccharide-stimulated inflammatory responses in RAW 264.7 macrophages[J]. PLoS One, 2017: e180673. |
| [30] | Wang X, Zhang Z, He X, et al. Taurochenodeoxycholic acid induces NR8383 cells apoptosis via PKC/JNK-dependent pathway[J]. Eur J Pharmacol, 2016, 786: 109. DOI:10.1016/j.ejphar.2016.06.007 |
| [31] | Zhang LL, Wei W, Wang QT, et al. Cross-talk between MEK1/2-ERK1/2 signaling and G protein-couple signaling in synoviocytes of collagen-induced arthritis rats[J]. Chin Med J, 2008, 121: 2278–2283. |
| [32] | Zhang L. The Cross Talk between G Protein-AC-cAMP Signaling and Ras-Raf-MEK-ERK Signaling in Fibroblasts Like Synoviocytes of Rat with Collagen-induced Arthritis and Regulation of Paeoniflorin (胶原性关节炎大鼠成纤维样滑膜细胞G蛋白-AC-cAMP与Ras-Raf-MEK-ERK信号转导的交叉对话及芍药苷的调节作用)[D]. Hefei: Anhui Medical University (安徽医科大学), 2008. |
| [33] | Im E, Martinez JD. Ursodeoxycholic acid (UDCA) can inhibit deoxycholic acid (DCA)-induced apoptosis via modulation of EGFR/Raf-1/ERK signaling in human colon cancer cells[J]. J Nutr, 2004, 134: 483–486. DOI:10.1093/jn/134.2.483 |
| [34] | Feldman R, Martinez JD. Growth suppression by ursodeoxycholic acid involves caveolin-1 enhanced degradation of EGFR[J]. Biochim Biophys Acta, 2009, 1793: 1387–1394. DOI:10.1016/j.bbamcr.2009.05.003 |
| [35] | Rust C, Karnitz LM, Paya CV, et al. The bile acid taurochenodeoxycholate activates a phosphatidylinositol 3-kinase-dependent survival signaling cascade[J]. J Biol Chem, 2000, 275: 20210–20216. DOI:10.1074/jbc.M909992199 |
| [36] | Liu MQ. Studies on The Therapeutic Action and Mechanism of TCDCA in Adjuvant-induced Arthritis Rats (TCDCA对佐剂性关节炎模型大鼠的治疗作用及其作用机制研究)[D]. Hohhot: Inner Mongolia Agricultural University (内蒙古农业大学), 2012. |
| [37] | Kline CL, Olson TL, Irby RB. Src activity alters alpha3 integrin expression in colon tumor cells[J]. Clin Exp Metastasis, 2009, 26: 77–87. DOI:10.1007/s10585-008-9215-x |
| [38] | Hiscox S, Morgan L, Green TP, et al. Elevated Src activity promotes cellular invasion and motility in tamoxifen resistant breast cancer cells[J]. Breast Cancer Res Treat, 2006, 97: 263–274. DOI:10.1007/s10549-005-9120-9 |
| [39] | Lee YG, Lee WM, Kim JY, et al. Src kinase-targeted anti-inflammatory activity of davallialactone from Inonotus xeranticus in lipopolysaccharide-activated RAW264.7 cells[J]. Br J Pharmacol, 2008, 154: 852–863. |
| [40] | Yu T, Lee S, Yang WS, et al. The ability of an ethanol extract of Cinnamomum cassia to inhibit Src and spleen tyrosine kinase activity contributes to its anti-inflammatory action[J]. J Ethnopharmacol, 2012, 139: 566–573. DOI:10.1016/j.jep.2011.11.051 |
| [41] | Dieterle AM, Bohler P, Keppeler H, et al. PDK1 controls upstream PI3K expression and PIP3 generation[J]. Oncogene, 2014, 33: 3043–3053. DOI:10.1038/onc.2013.266 |
| [42] | Wu N, He C, Zhu B, et al. 3-Phosphoinositide dependent protein kinase-1(PDK-1) promotes migration and invasion in gastric cancer cells through activating the NF-κB pathway[J]. Oncol Res, 2017, 25: 1153–1159. DOI:10.3727/096504017X14845839228545 |
| [43] | Du L, Xie Y, Liu M. Expression and significance of PDK1 and NF-κB in the middle ear cholesteatoma[J]. J Clin Otorhinolaryngol Head Neck Surg (临床耳鼻咽喉头颈外科杂志), 2016, 33: 770–773. |
| [44] | Chaurasia B, Mauer J, Koch L, et al. Phosphoinositide-dependent kinase 1 provides negative feedback inhibition to Toll-like receptor-mediated NF-κB activation in macrophages[J]. Mol Cell Biol, 2010, 30: 4354–4366. DOI:10.1128/MCB.00069-10 |
| [45] | He X, Li P, Guan H, et al. Effect of TCDCA on the contents of IL-1β, IL-6, TNF-α and IgG in AA rat serum[J]. Prog Veter Med (动物医学进展), 2010, 31: 49–51. |
| [46] | Wang X, Zhang Z, Li P. Effects of taurochenodeoxycholic acid on the production of tumor necrosis factor-α induced by TGR5 in NR8383[J]. Chin J Veter Sci (中国兽医学报), 2016, 36: 108–111. |
 2018, Vol. 53
2018, Vol. 53


