阿尔兹海默病(AD)是一种以进行性认知功能障碍和行为损害为特征的脑退行性疾病[1]。目前对AD病因和发病机制的研究仍未完全清楚, 临床上极度缺乏预防及治疗AD的有效药物。传统观点认为脑内淀粉肽Aβ沉积是AD病理的始发及核心因素, 淀粉样蛋白假说主导阿尔茨海默病研究20多年, 但是在反复的临床试验中, 通过干扰Aβ产生, 或减少Aβ沉积都并没有得到好的临床试验效果。近年来一系列报道提出, 引起AD疾病的病因不仅是胆碱能神经元的损失或Aβ产生过多, 还包括着脑血管功能障碍导致的慢性脑灌注不足[2]。AD血管因素概念是基于AD病理过程中代谢降低, 记忆功能障碍和神经退行性等一系列的异常病变所提出的[3]。血管性损伤不仅在AD疾病中存在, 甚至更早于传统意义上的AD病理损伤[4, 5]。目前这个假说在分子水平和细胞水平研究较少且未有明确的机制, 但脑血管系统的变化确实可能会造成认知能力下降, 同时增加Aβ在脑和脑血管中的累积, 从而影响慢性神经退行性疾病的病理发展。
同源盒MEOX2基因又称为GAX基因, 主要在心血管系统中高表达, 对血管的分化和血管的生成起多方面作用[6]。目前在国内外未见以血管性因素的角度探讨MEOX2基因在AD动物模型中作用的报道。本文拟从AD疾病中微血管系统损伤的角度, 研究MEOX2基因在AD疾病中的作用及其可能机制, 为AD疾病的治疗寻找新的思路。
材料与方法实验动物 SPF级SD大鼠, 雄性, 体重300~330 g, 购自于四川省中医药科学院中医研究所, 合格证号: SYXK (川) 2008-057。常规饲养, 饲养环境温度维持在(25 ± 1) ℃, 相对湿度50%~70%, 12 h/ 12 h昼夜节律, 自由摄食饮水。实验动物饲养及处理均符合中国实验动物伦理学要求,相关操作均符合四川大学动物研究委员会标准。
材料与试剂 淀粉肽Aβ1-42 (Sigma公司); 一氧化氮(NO)试剂盒(南京建成生物工程研究所); 大鼠内皮素(ET-1)、Aβ1-42、Aβ1-40 ELISA试剂盒(武汉华美生物工程有限公司); Revert First Synthesis Kit (Thermo Scientific公司); Ssofast EvaGreen SuperMix (Bio-Rad公司); SDS-PAGE蛋白上样缓冲液、SDS- PAGE凝胶配制试剂盒、BCA蛋白浓度测定试剂盒(碧云天生物科技有限公司)。
Aβ1-42单体聚化 用无菌生理盐水将Aβ1-42粉末状单体配制为溶液, 终质量浓度1 g·L-1。置于37 ℃孵育72 h后存放于4 ℃备用。
实验动物分组及AD模型建立 实验大鼠随机分为两组, 对照组和模型组, 每组12只。将大鼠麻醉后固定于大鼠脑立体定位仪进行注射定位(前囟后0.8 mm, 中线左右旁开1.5 mm, 硬膜下3.5 mm), 钻开颅骨使用微量注射器注射。模型组每侧注射Aβ1-42寡聚体(质量浓度1 g·L-1) 5 μL; 对照组每侧注射生理盐水5 μL。注射完毕后留针5 min后缓慢退针, 骨蜡封闭, 局部消毒后缝合头皮, 术后保温至动物清醒, 常规饲养。
Morris水迷宫实验 在术后1周进行Morris水迷宫行为学实验。实验分为隐匿平台实验和空间探索实验。隐匿平台实验:将大鼠随机从不同象限面壁置入池内, 每只动物每天4个不同方位各训练1次, 记录大鼠找到平台的时间即为潜伏期, 最长记录时间为120 s, 用以评价大鼠的空间学习能力。空间探索实验:在第4天隐匿平台实验结束后的2 h, 撤去平台进行空间探索实验, 将大鼠从平台所在象限的对侧象限入水, 计时120 s, 记录大鼠在靶象限(原平台所在象限)活动时间[7], 用以评价大鼠的空间记忆能力。
标本采集 动物行为学测试结束后, 麻醉大鼠, 每组取8只用预冷的生理盐水灌流, 取出大脑用液氮急冻, 置于-80 ℃保存, 用于Western blot及试剂盒的测定。每组其余4只用预冷的生理盐水灌流后, 再用4%多聚甲醛溶液灌流, 取出大脑, 用4%甲醛固定24~48 h, 从大脑前囟前2 mm到前囟后3 mm的冠状脑组织, 石蜡包埋, 制作厚度约5 μm的脑部冠状切片, 用于免疫组化染色。
免疫组化染色 采用SABC法对动物脑组织切片进行免疫组化显色。每组4只动物, 每只动物取3张切片。所用一抗浓度见表 1。染色结束后, 用显微图像采集系统进行图像采集, 并采用图象处理与分析系统对阳性表达进行累积光密度(IOD)分析, 每张切片同一区域中, 随机选取3个视野, 检测面积相同, 取其平均值作为该切片目标区域的IOD值。
| Table 1 Primary antibodies. NSE: Neuron specific enolase; SYN: Synaptophysin; GFAP: Glial fibrillary acidic protein; AIF1: Allograft inflammatory factor 1; VEGF: Vascular endothelial growth factor; eNOS: Endothelial nitric oxide synthase; LRP-1: Low density lipoprotein receptor-related protein 1; RAGE: Receptor for advanced glycation end products |
比色法与ELISA法测定 按照试剂盒说明书操作方法进行动物脑组织匀浆液NO、ET-1浓度及血清中Aβ1-42、Aβ1-40含量的检测。Aβtotal为Aβ1-42、Aβ1-40两者之和[8]。
Real-time PCR检测 用Trizol从大鼠脑组织中分离总RNA, 并逆转录为cDNA, 随后进行qPCR反应。特异性引物序列见表 2。MEOX2、低密度脂蛋白受体相关蛋白1 (LRP-1)、晚期糖基化末端产物受体(RAGE)水平归一化为GAPDH。结果表示为使用2-ΔΔCt方法相对于空白对照组的阈循环(Ct)值的倍数变化。
| Table 2 The primer sequence of real time-PCR |
Western blot检测 常规提取动物脑组织蛋白, BCA法测定蛋白浓度, 定量后进行聚丙烯酰胺凝胶电泳, 采用相关抗体进行Western blot检测。所用一抗浓度见表 1。使用ECL化学发光试剂盒进行显影分析, 并用Gel Pro Analyzer 6.0测定每条带的OD值。对免疫印迹结果进行定量分析, 并表示为各组相对于对照组的比值。
统计学分析 实验数据以x±s表示, 实验结果用SPSS 16.0软件进行统计分析, 水迷宫实验潜伏期采用two-way ANOVA分析, 其余组间比较采用成对t检验分析的方法进行, 显著性结果以P < 0.05和P < 0.01表示。
结果 1 AD大鼠认知功能障碍水迷宫实验是检测动物学习记忆功能的经典实验[9], 实验可分为隐匿平台实验和探索实验两个阶段。如图 1所示, Aβ诱导的AD大鼠模型具有明显的认知功能障碍, 表现为在隐匿平台实验阶段, 对照组和模型组动物找到平台的时间随着训练天数的增加都有所减低。在训练期的前两天两组间没有显著差异, 到第3天观察到两组之间具有显著性差异(P < 0.05, 图 1A)。在空间探索阶段, 与对照组相比, 模型组穿越平台的次数较少, 无显著性差异(P > 0.05, 图 1B), 但在靶象限活动的时间明显降低(P < 0.05, 图 1C)。结果说明, 模型组动物出现了明显的行为学障碍, 模型建立成功。

|
Figure 1 Cognitive impairment showed in Alzheimer's disease (AD) rat model induced by bilateral intracerebroventricular injections of Aβ1-42. The mean latency time (A) during the hidden-platform test and the number of crossing the platform (B) and the time spent in the target quadrant (C) during the probe test are shown. n = 12, x±s. *P < 0.05 vs Sham-operated group |
脑中淀粉肽蛋白的异常沉积是AD疾病的典型病理特征, 被认为是AD病理机制的中心环节。异常沉积的Aβ淀粉肽诱发包括氧化、炎症、细胞凋亡等在内的级联反应, 从而促进疾病的发生发展。如图 2所示, 与对照组相比, 模型组大鼠脑皮层中Aβ1-42阳性表达明显增加(P < 0.01) (图 2A、B), 可见Aβ沉积形成的斑块; 且模型组大鼠血清中Aβ1-40、Aβ1-42及Aβtotal均明显增加(P < 0.05, P < 0.01) (图 2C)。模型组动物脑内淀粉肽蛋白的异常沉积, 与行为学功能的障碍结果一致。
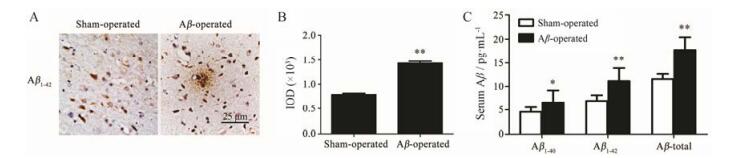
|
Figure 2 Accumulation of Aβ burden in brain showed in AD rat model induced by bilateral intracerebroventricular injections of Aβ1-42. A: Representative immunostaining of Aβ1-42 and NSE staining in the cerebral cortex areas (×400 magnification); B: Quantification of the immunohistochemical analysis based on the IOD of the protein immunostaining per field using Image Pro Plus 6.0; C: Aβ (Aβ40, Aβ42 and Aβtotal) levels in the serum were assayed by ELISA. n = 8, x±s (exception of n = 4 in A and B). *P < 0.05, **P < 0.01 vs Sham-operated group |
AD疾病中神经元细胞的损伤和胶质细胞的异常活化均为疾病的病理特征。神经元细胞的损伤与学习记忆功能的障碍关系密切; 胶质细胞的活化引起炎症介质的释放, 导致炎症反应的发生。如图 3所示, 与对照组相比, 模型组大鼠出现了明显的神经元损伤刺激的胶质细胞活化以及突触功能障碍, 表现为脑内皮质区特异性神经元烯醇酶(NSE)明显降低(P < 0.05) (图 3A、C), 脑内星形胶质细胞标记物胶质纤维酸性蛋白(GFAP)和小胶质细胞标记物同种异体炎性因子1 (AIF1)显著增加(P < 0.05) (图 3A、D), 海马区突触素(SYN)明显降低(P < 0.01) (图 3B、E)。以上结果说明, 脑部定位注射淀粉肽蛋白造成模型组动物神经元细胞的损伤并诱导胶质细胞引起的炎症反应。

|
Figure 3 Neuropathological changes showed in AD rat model induced by bilateral intracerebroventricular injections of Aβ1-42. A: Representative immunostaining of NSE, GFAP and AIF1 staining in the cerebral cortex areas (×400 magnification); B: Representative immunostaining of SYN staining in the hippocampus areas (×40 magnification); C-E: Quantification of the immunohistochemical analysis based on the IOD of the protein immunostaining per field using Image Pro Plus 6.0. n = 4, x±s. *P < 0.05, **P < 0.01 vs Sham-operated group |
近年来的研究指出, 引起AD疾病的病因不仅只是Aβ异常沉积, 还包括脑血管功能障碍导致的慢性脑灌注不足。如图 4所示, 与对照组相比, 模型组大鼠出现了明显的脑内血管内皮稳态失衡, 毛细血管密度降低, 血管功能异常, 表现为模型组大鼠脑皮层中CD34、血管内皮生长因子(VEGF)表达明显降低(P < 0.05), 内皮一氧化氮合酶(eNOS)表达明显增加(P < 0.01), 脑组织中内皮素(ET)含量明显增加(P < 0.05), 一氧化氮(NO)含量明显降低(P < 0.05)。说明在AD疾病过程中, 血管性损伤包括新生血管生成以及血管内皮功能障碍的存在。
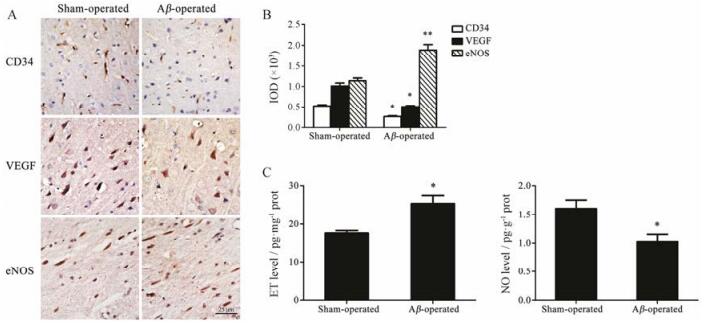
|
Figure 4 Cerebrovascular dysfunction showed in AD rat model induced by bilateral intracerebroventricular injections of Aβ1-42. A: Representative immunostaining of CD34, VEGF and eNOS staining in the cerebral cortex areas (×400 magnification); B: Quantification of the immunohistochemical analysis based on the IOD of the protein immunostaining per field using Image Pro Plus 6.0; C: ET level in brain tissues were assayed by ELISA and NO level were obtained by biochemical analysis. n = 8, x±s (exception of n = 4 in A and B). *P < 0.05, **P < 0.01 vs Sham-operated group |
为研究MEOX2基因与AD疾病发生的相关性, 本研究检测了动物脑部MEOX2的水平以及Aβ转运受体LRP-1和RAGE的表达。如图 5所示, 免疫印迹和实时PCR分析结果显示, 与对照组相比, 模型组大鼠脑内MEOX2和LRP-1表达减少(P < 0.01, P < 0.05), RAGE表达增加(P < 0.05)。上述结果表明, Aβ1-42诱导的AD大鼠模型动物脑部MEOX2基因水平降低, Aβ转运受体LRP-1升高而RAGE降低, 这两者之间可能具有相关性, 其中的机制需要进一步深入研究。
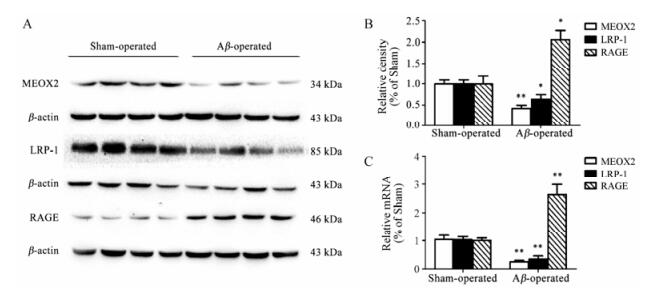
|
Figure 5 Decreased MEOX2 mRNA and protein expression induced by bilateral intracerebroventricular injections of Aβ1-42 may correlated to LRP-1 inhibition and RAGE upregulation. A: Representative Western blot of the expression of MEOX2, LRP-1 and RAGE; B: Quantitative analysis of the expression of MEOX2, LRP-1 and RAGE; C: Quantitative analysis of the mRNA levels of MEOX2, LRP-1 and RAGE. The results were normalized to the corresponding reporter gene β-actin and presented as fold change relative to the Sham-operated group. n = 4, x±s. *P < 0.05, **P < 0.01 vs Sham-operated group |
AD疾病脑部病变包括:神经胶质细胞异常活化, 神经元细胞损伤丢失增加, 突触素减少, 内皮功能障碍, Aβ累积增加等, 从而表现为一系列神经功能性损伤。在AD中, 血管功能障碍和微脉管/内皮的血脑屏障障碍是评估Aβ累积及其斑块形成的重要的参数[2, 3]。已有研究表明, NO和ET分子对于维持脑内血管稳态具有非常重要的作用[10], 且NO和ET表达失衡早于淀粉样沉积[11]。并且, 在AD脑内会出现毛细血管异常[12, 13], 包括内皮细胞的产生和崩解[14], 表明在AD病理进程中血管新生的能力降低。作用于血管的蛋白eNOS和VEGF影响血管通透性[15], CD34、VEGF和eNOS表达水平可以表明毛细血管的密度及血管的功能[16, 17], 因此它们可能参与血管淀粉样蛋白的累积。VEGF水平降低和eNOS增加导致脑血管生成的损伤, 可能引起BBB渗透性降低, 从而影响Aβ清除。在本研究中, AD模型大鼠中确实存在NO和ET表达的失常、毛细血管密度降低和血管功能障碍。已有研究表明, MEOX2具有影响血管生成和血管功能的作用[18], AD大鼠模型中血管方面的异常可能与MEOX2表达降低有关。
根据AD神经血管假说, BBB损伤导致中枢神经系统中Aβ累积增加。在AD中血脑屏障上主要转运Aβ蛋白的两个受体是LRP-1和RAGE[19]。LRP-1介导脑内Aβ经血脑屏障途径转运出脑, RAGE介导Aβ经血脑屏障途径转运进脑, LRP-1和RAGE的表达可能是反向耦合的。对于AD中MEOX2、LRP-1、RAGE的变化研究很少, 有一项在人脑内皮细胞的体外实验中发现, 沉默MEOX2基因表达, LRP-1表达会降低。同时他们也观察到在敲除MEOX2的转基因小鼠中LRP-1表达减少[20]。在本实验研究中表明, AD大鼠模型中LRP-1的下调和RAGE的上调可能与MEOX2基因表达的降低具有一定的相关性, LRP-1和RAGE表达的失常影响了脑内Aβ的清除。
综上所述, 推测AD大鼠模型中的神经血管功能的障碍与MEOX2基因水平的降低有关。并且, MEOX2基因的作用可能与Aβ转运受体LRP-1和RAGE有一定的相关性。这些结果表明, MEOX2可能是治疗AD的一个新靶点, 而MEOX2在AD疾病中具体的作用机制, 以及MEOX2基因与Aβ沉积之间的因果关系还需进一步深入研究。
| [1] | de la Monte SM. Brain insulin resistance and defciency as therapeutic targets in Alzheimer's disease[J]. Curr Alzheimer Res, 2012, 9: 35–66. DOI:10.2174/156720512799015037 |
| [2] | Ambrose CT. Neuroangiogenesis:a vascular basis for Alzheimer's disease and cognitive decline during aging[J]. J Alzheimers Dis, 2012, 32: 773–788. DOI:10.3233/JAD-2012-120067 |
| [3] | Drachman DA. The amyloid hypothesis, time to move on:amyloid is the downstream result, not cause, of Alzheimer's disease[J]. Alzheimers Dement, 2014, 10: 372–380. DOI:10.1016/j.jalz.2013.11.003 |
| [4] | Zlokovic BV. Neurovascular pathways to neurodegeneration in Alzheimer's disease and other disorders[J]. Nat Rev Neurosci, 2011, 12: 723–738. DOI:10.1038/nrn3114 |
| [5] | Zlokovic BV. Neurodegeneration and the neurovascular unit[J]. Nat Med, 2010, 16: 1370–1371. DOI:10.1038/nm1210-1370 |
| [6] | Shen XZ, Liu SK, Lin JJ. MEOX2 and cardiovascular[J]. Dis Chin Heart J (心脏杂志), 2009, 21: 875–877. |
| [7] | Wang Y, Zhao XY, Li XY, et al. Militarine alleviates white matter damage and cognitive impairment in rats with chronic cerebral hypoperfusion[J]. Acta Pharm Sin (药学学报), 2016, 51: 738–742. |
| [8] | Dean RA, Demattos R, Gelfanova V, et al. ELISA-based measurement of plasma total Aβ1-40 and Aβ1-42, and CSF total and free Aβ1-40 and Aβ1-42 in the presence of solanezumab, a mid-domain anti-Aβ antibody[J]. Alzheimers Dement, 2009, 5: 133. DOI:10.1016/j.jalz.2009.01.006 |
| [9] | Morris RGM. Spatial localization does not require the presence of local cues[J]. Learn Motiv, 1981, 12: 239. DOI:10.1016/0023-9690(81)90020-5 |
| [10] | Gates PE, Strain WD, Shore AC. Human endothelial function and microvascular ageing[J]. Exp Physiol, 2009, 94: 311–316. DOI:10.1113/expphysiol.2008.043349 |
| [11] | Tong XK, Hamel E. Simvastatin restored vascular reactivity, endothelial function and reduced string vessel pathology in a mouse model of cerebrovascular disease[J]. J Cereb Blood Flow Metab, 2015, 35: 512–520. DOI:10.1038/jcbfm.2014.226 |
| [12] | Fisher VW, Siddiqi A, Yusufaly Y. Altered angioarchitecture in selected areas of brains with Alzheimer's disease[J]. Acta Neuropathol, 1990, 79: 672–679. DOI:10.1007/BF00294246 |
| [13] | Buee L, Hof PR, Delacourte A. Brain microvascular changes in Alzheimer's disease and other dementiasa[J]. Ann N Y Acad Sci, 1997, 826: 7–24. DOI:10.1111/nyas.1997.826.issue-1 |
| [14] | Kalaria RN, Hedera H. Differential degeneration of the cerebral microvasculature in Alzheimer's disease[J]. Neuroreport, 1995, 6: 477–480. DOI:10.1097/00001756-199502000-00018 |
| [15] | Jeynes B, Provias J. The case for blood-brain barrier dysfunction in the pathogenesis of Alzheimer's disease[J]. J Neurosci Res, 2011, 89: 22–28. DOI:10.1002/jnr.v89:1 |
| [16] | Wang P, Xie ZH, Guo YJ, et al. VEGF-induced angiogenesis ameliorates the memory impairment in APP transgenic mouse model of Alzheimer's disease[J]. Biochem Biophys Res Commun, 2011, 411: 620–626. DOI:10.1016/j.bbrc.2011.07.003 |
| [17] | Provias J, Jeynes B. The role of the blood-brain barrier in the pathogenesis of senile plaques in Alzheimer's disease[J]. Int J Alzheimers Dis, 2014, 2014: 191863. |
| [18] | Liu P, Zhang C, Zhao YX, et al. Gax gene transfer inhibits vascular remodeling induced by adventitial inflammation in rabbits[J]. Atherosclerosis, 2010, 212: 398–405. DOI:10.1016/j.atherosclerosis.2010.06.001 |
| [19] | Deane R, Bell RD, Sagare A, et al. Clearance of amyloid-beta peptide across the blood-brain barrier:implication for therapies in Alzheimer's disease[J]. CNS Neurol Disord Drug Targets, 2009, 8: 16–30. DOI:10.2174/187152709787601867 |
| [20] | Zlokovic BV, Wu Z, Guo H, et al. Role of the MEOX2 homeobox gene in neurovascular dysfunction in Alzheimer disease[J]. Nat Med, 2005, 11: 959–965. DOI:10.1038/nm1287 |
 2018, Vol. 53
2018, Vol. 53


