2. 武汉大学药学院, 组合生物合成与新药发现教育部重点实验室, 湖北 武汉 430071
2. Key Laboratory of Combinatorial Biosynthesis and Drug Discovery, Wuhan University School of Pharmaceutical Sciences, Wuhan 430071, China
紫草为我国常用传统中药, 始载于《神农本草经》[1]。《本草纲目》谓本品“治斑疹痘毒, 活血凉血, 利大肠”。《滇南本草》亦载有“紫草”, 别称“滇紫草”。据考证, 历代本草记载的紫草来源于紫草科紫草属(Lithospermum)、软紫草属(Arnebia)以及滇紫草属(Onosma)植物[2]。现版《中国药典》规定紫草为新疆紫草[Arnebia euchroma (Royle) Johns]或内蒙紫草(A. guttata Bunge)的干燥根[3]。滇紫草属于现版药典成方制剂中出现但“未收载”的药材, 虽不是药典正式品种, 却为地方习用, 并在一些地方中药材标准中收载[4−6]。紫草应用广泛, 仅现版药典记载含有紫草的成方制剂就有15种。
研究表明, 紫草含有多种活性成分, 主要包括萘醌类、苯醌及单萜苯酚类、黄酮类、酚酸类、三萜酸类及多糖类成分等[7−10]。其中报道较多的是以紫草素(shikonin)或其对映异构体阿卡宁(alkannin)为代表的萘醌类化合物, 其生物活性多样, 如抑制炎症、调节免疫, 治疗肝炎、炎性肠病和类风湿关节炎以及促进伤口愈合、抗肿瘤等, 且与紫草的传统功效相关联[11−13]。与此同时, 紫草素类成分的生物合成途径也一直是人们关注的焦点, 基于紫草转录组的生物信息学研究促进了对其合成关键酶基因(如对羟基苯甲酸香叶基转移酶, p-hydroxybenzoate geranyltransferases, PGT)功能和特性的了解[14]。以萘醌类成分作为质量标志物对紫草进行定性定量表征无疑是必要和可行的[15]。而对于化学及药理活性, 以多种萘醌类成分进行紫草的整体质量控制和评价研究尚不够深入, 因而成为当前紫草研究的一个重要方向[16]。本文就近年来以紫草素为代表的紫草萘醌类成分药理作用及其定量分析方法的最新研究进展做一综述, 以期为进一步开展紫草资源品质评价和质量标准研究提供参考。
1 紫草萘醌类成分的药理作用据报道, 紫草素类(shikonins)化合物(图 1)具有抗炎、抗肿瘤、抗氧化、免疫调节、抗病原微生物以及促伤口愈合等药理药效作用[11]。我国历代本草也有将紫草用于烧烫伤、溃疡或痔疮等的记载[1, 12]。目前依据这些性质已开发了一系列促伤口愈合的外用软膏制剂, 如在希腊上市的Histoplastin Red®和Helixderm®等[12]。从国内外文献调研来看, 紫草素的研究最为多见, 以下主要围绕紫草素进行阐述。
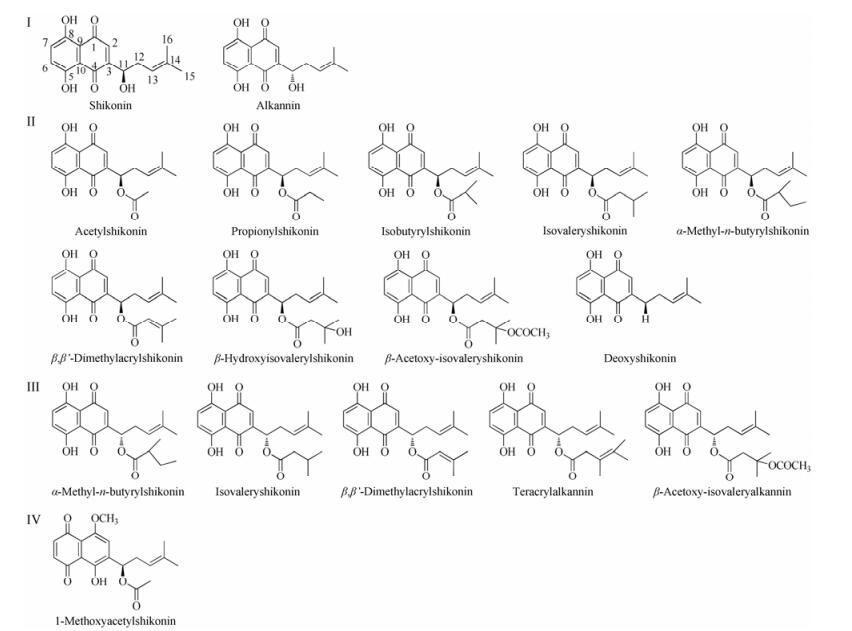
|
Figure 1 The core structures of naphthoquinones and some common derivatives found in Zicao. Ⅰ: Two core structures (shikonin and alkannin) of naphthoquinones with R/S configuration at C11, respectively; Ⅱ: Some representative derivatives of shikonin; Ⅲ: Some representative derivatives of alkannin; Ⅳ: A representative compound of other types of shikonins |
紫草素类成分的抗炎作用已被许多研究所证实[11, 12]。这些研究有赖于大量炎症动物模型的应用, 例如:经典抗炎小鼠模型(如角叉菜或十四烷酰佛波乙酸酯致耳肿胀模型、二甲苯致耳廓肿胀模型等)、自身免疫性炎症模型(如胶原致关节炎小鼠模型、右旋糖酐硫酸钠盐(dextran sodium sulfate, DSS)致Balb/C小鼠急性溃疡性结肠炎模型、哮喘小鼠模型和NZB/W F1小鼠系统性红斑狼疮模型等)以及雨蛙肽诱导急性胰腺炎模型和脂多糖(lipopolysaccharides, LPS)诱导急性肺损伤模型等, 其作用的机制包括:抑制白三烯B4生物合成、肥大细胞脱颗粒和中性粒细胞呼吸爆发, 以及改变磷脂酰肌醇介导的信号通路、阻滞趋化因子与CCR-1受体结合和抑制环氧化酶(COX)等[11]。进一步研究还表明, 这些作用涉及多条分子信号通路的参与, 且主要与核因子κB (NF-κB)和促分裂原活化蛋白激酶(MAPK)等的通路抑制有关(图 2)。相关的炎症因子或分子靶点包括:细胞因子(TNF-α、IL-12、IL-6、IL-1β、IL-2及IFN-γ)、MAPK信号分子(ERK1/2和JNK)、促炎症因子相关酶(COX-2、IκBα、iNOS和蛋白酶等)、转录因子(NF-κB、T-bet和STAT3)以及其他调节因子(一氧化氮、细胞黏附分子)等[11, 17]。

|
Figure 2 Potential molecular targets and signaling pathways involved in inflammatory diseases that are inhibited by shikonins. Four pathways as well as molecular targets for shikonins in inflammation are illustrated, that is, ① NF-κB and relative signalings (e.g. TLR4/NF-κB); ② MAPK and relative signaling; ③ PI3K/Akt/NF-κB signaling pathway; ④ JAK/STAT signaling pathway. LPS: Bacterial lipopolysaccharide (endotoxin); ConA: Concanavalin A; D-GalN: D-galactosamine; TNF: Tumor necrosis factor; TNFR1: TNFα receptor 1; RIPK1: Receptor interacting protein kinase 1; TRADD: TNFR associated death domain; TRAF: TNFR associated factor; cIAP1/2: Cellular inhibitor of apoptosis proteins-1 and-2; TLR4: Toll-like receptor 4; IRAK: IL-1 receptor-associated kinase; MAPK: Mitogen-activated protein kinase; NEMO: NF-κB essential modulator; IKK: IκB kinase; IκB: Member of the IκB family of inhibitor proteins; JNK: c-Jun N-terminal kinase; JAK: Janus kinase; STAT: Signal transducer and activator of transcription; SOCS: Suppressor of cytokine signaling |
研究还发现紫草素对防治炎症性皮肤病(如银屑病)可能有效。在HaCaT角质细胞中, 紫草素能够显著地抑制白细胞介素17 (IL-17)诱导的血管内皮生长因子(vascular endothelial growth factor, VEGF)的mRNA和蛋白表达, 抑制IL-17诱导的IL-17受体、磷酸化JAK2和STAT3的表达, 并且上调细胞中细胞因子信号抑制物(SOCS1)的水平; 在体内实验中, 紫草素同样可以有效地抑制IL-17激发的小鼠皮肤VEGF的表达, 并抑制VEGF诱导的人脐静脉内皮细胞血管样小管形成和CD34抗原的表达, 推测其作用机制与阻断JAK2/STAT3信号通路有关[18]。该研究组进一步发现紫草素可显著抑制IFN-γ诱导的HaCaT细胞中K17蛋白(一种细胞支架角蛋白)过表达, 其机制可能与干预了STAT3信号通路有关[19]。在最近一些研究中, 紫草素可以通过调节MAPK信号通路抑制炎症性细胞因子的激活。Liu等[20]研究了紫草素对伴刀豆凝集素A (ConA)致Balb/C小鼠急性肝炎的保护作用及其机制, 发现给予紫草素后相关炎症因子(IL-1β、TNF-α和IFN-γ)的mRNA水平及蛋白表达均显著下降, 并呈一定的剂量依赖性, 肝损伤也得到了明显改善; 其机制在于紫草素抑制了IL-1β/ JNK/p-JNK信号通路, 并由此抑制了肝细胞凋亡和自噬。同样, Tian等[21]研究发现紫草素对LPS/D-GalN (D-半乳糖胺)诱导C57BL/6小鼠产生的急性肝损伤具有保护作用, 结果表明, 紫草素可显著降低炎症因子如TNF-α、IL-1β、IL-6和IFN-γ的水平, 因而具有抗炎活性, 其机制在于抑制了JNK1/2、ERK1/2、p38和NF-κB磷酸化以及IκBα的磷酸化降解而导致MAPK与NF-κB信号通路阻滞。
研究还发现紫草素对兼具促炎性和成瘤性的突发性肺纤维化(idiopathic pulmonary fibrosis, IPF)有治疗作用[22]。实验表明, 紫草素可抑制C57BL/6小鼠肺成纤维细胞的生长、迁移, 增强其凋亡以及细胞G1和G2/M期阻滞, 同时, 紫草素降低了TGF-β诱导的α-平滑肌动蛋白(α-SMA)、纤粘蛋白及胶原蛋白Ⅰ/Ⅲ的产生, 这些均为组成IPF组织重构细胞外基质的重要成分。信号通路分析表明, 紫草素抑制了Akt的磷酸化, 提升了p53以及细胞周期抑制蛋白p21/p27的转录水平, 同时降低了TGF-β诱导的p38和Akt的磷酸化。由此说明, 紫草素一方面通过抑制PI3K/Akt活化通路及激活p53促进细胞凋亡, 另一方面通过调节p38 MAPK和Akt活性而抑制TGF-β诱导的IPF组织细胞重构。本研究组近期也初步研究了紫草素对LPS诱导巨噬细胞炎性反应的拮抗机制, 并通过5% DSS诱发的炎症性肠病(inflammatory bowel disease, IBD)小鼠模型证实其抗炎作用, 结果表明紫草素可能通过抑制巨噬细胞炎症信号通路Toll样受体4 (toll-like receptor 4, TLR4)/NF-κB的活化, 抑制炎症因子TNF-α、IL-1β和IL-6的表达, 提升抑炎因子IL-10水平等发挥抗炎作用[23]。
另有研究表明, 在弗氏佐剂和牛Ⅱ型胶原诱导的关节炎模型中, 从新疆紫草中得到的一种羟基萘醌类提取物具有明显的抗关节炎作用, 无论采取预防性还是治疗性给药均可抑制足趾肿胀和炎症发展、降低TNF-α及IL-1β水平以及保护软骨和骨骼组织, 这些作用甚至优于一些上市药物如醋酸强的松和依那西普(etanercept), 且无直接的不良反应。同时, 该提取物还具有较强的镇痛效果[24]。Rajapaksha等[25]研究还表明, 异丁酰紫草素(isobutyrylshikonin)能显著降低BV2小胶质细胞中LPS诱导产生的一氧化氮(NO)和前列腺素E2分泌, 其机制在于通过阻滞磷脂酰肌醇-3-激酶/蛋白激酶B (PI3K/Akt)介导的NF-κB通路而抑制诱导型一氧化氮合酶(iNOS)和COX-2的表达。
许多研究已表明, LPS能激活人单核细胞内多种信号通路, 如IKK-NF-κB及3个主要MAPK通路(ERK1/2、JNK和p38)等, 从而刺激细胞产生大量的炎症因子, 如TNF-α等。而这些因子特别如TNF对NF-κB和JNK的调控具有直接影响[26, 27]。从以上研究不难看出, 紫草素具有明显对抗LPS或其他刺激剂诱发的炎症作用, 其抑制的潜在分子靶点及信号通路如图 2所示, 至少包含了以下4个方面: ① NF-κB及其相关通路(如TLR4/NF-κB等); ② MAPK及相关信号通路; ③ PI3K/Akt/NF-κB信号通路; ④ JAK/STAT信号通路。然而, 紫草素发挥作用的抗炎靶点还有许多, 不同分子靶点及其信号通路之间亦多存在交互作用(crosstalk), 因此, 紫草素类成分在其中的作用及对抗炎作用的影响还有待进一步研究。
1.2 抗肿瘤作用紫草素及其衍生物的抗肿瘤活性研究已有多年[11, 28−31]。早期实验表明, 紫草素对多种人癌细胞株具有细胞毒作用, 如人胶质瘤细胞(U87、U251)、人肺腺癌细胞(A549)、人结肠癌细胞(Hct116)、人乳腺癌细胞(MDA-MB-231)、人宫颈癌细胞(HeLa)、人肝细胞癌细胞(Hep3B)、黑色素瘤细胞(SBcl2)、人急性早幼粒白血病细胞(HL-60)及人急性淋巴白血病细胞(CCRF-CEM)等[11]。近几年来有关研究有增无减, 一方面拓展了紫草素的抗瘤谱, 另一方面对机制的研究更为深入。就前者而言, 对紫草素敏感的肿瘤细胞还有人鳞状细胞癌细胞(A431)[32]、人乳腺癌细胞(MCF-7)[33]、人胃癌细胞(AGS)[34]、人胰腺癌细胞(BXPC-3)[35]、人前列腺癌细胞(DU-145和PC-3)[36]、人非小细胞肺癌(吉非替尼耐药)[37]和EGFR突变型肺癌细胞(HCC827, c-Met高表达)[38]等。这些作用的分子机制涉及了与细胞生长、生存和死亡相关的多种信号通路, 如细胞凋亡(apoptosis)、程序性细胞坏死(necroptosis)和自噬(autophagy)等, 以及这些信号通路上下游相关因子的调控, 如诱导ROS形成、抑制蛋白酶体活性、抑制肿瘤特异性丙酮酸激酶M2、抑制整合素β1表达或下调NF-κB调控基因产物[如基质金属蛋白酶9 (matrix metalloproteinase-9, MMP-9)]表达等, 表现出一定程度的多样性。这些作用机制有赖于肿瘤细胞类型和给药剂量或方式, 详细的阐述可参见近期相关综述[28−31]。
1.3 抗氧化作用紫草萘醌类成分基本结构单元为羟基萘醌(naphthazarin)。Kourounakis等[11, 39]研究认为这是该类成分发挥自由基清除及抗氧化作用的结构基础, 同时也是以上抗炎活性不可或缺的结构特征之一。Parray等[40]采用多种体外抗氧化体系, 如DPPH自由基清除、羟基自由基清除、超氧阴离子自由基清除、硫氰酸铁(FTC)和β-硫代巴比妥酸(TBA)实验法以及脂质过氧化实验法, 以及体外抗DNA损伤实验考察了软紫草属植物A. benthamii (Wall. ex G. Don) Johnston乙酸乙酯提取部位及所含紫草素的活性, 结果显示该乙酸乙酯提取物和紫草素均有良好的抗氧化活性, 并可通过抑制羟自由基对DNA损伤产生保护作用。Huang等[41]研究了紫草素的抗动脉粥样硬化作用, 发现该作用主要与其抗氧化机制有关。结果显示, 紫草素通过活化PI3K/Akt/ Nrf2 (转录因子NF-E2相关因子2)信号通路促进了许多抗氧化酶的表达, 如血红素加氧酶-1 (HO-1)、谷氨酸半胱氨酸连接酶(GCL)调节单元、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px) 1以及谷胱甘肽还原酶(GSR), 并提高了还原型谷胱甘肽(GSH)含量; 同时, 抑制了氧化低密度脂蛋白(oxLDL)诱导的活性氧(ROS)产生、抗氧化反应元件报告活性、NF-κB核转位以及细胞间黏附因子-1 (ICAM-1)和内皮细胞选择素(E-selectin)的表达, 并抑制单核细胞黏附内皮细胞的增加。由此说明紫草素通过上调PI3K/Akt/Nrf2通路依赖型抗氧化酶的表达, 抑制了ROS/NF-κB介导的ICAM-1及E-selectin表达, 从而对oxLDL诱导的内皮损伤产生保护作用。还有研究提示紫草素对缺血/再灌注引起的小鼠脑组织损伤具有保护作用, 亦与其抗氧化性质有关[42]。该实验采用局灶性脑缺血/再灌注小鼠模型考察了3种剂量(12.5、25和50 mg·kg−1)紫草素的治疗作用, 结果与模型组相比, 紫草素可明显降低脑缺血/再灌注小鼠的神经功能缺损评分、脑梗死体积、丙二醛(MDA)含量、蛋白质羰基含量及线粒体中活性氧水平, 减少了神经元损伤, 并且提高了SOD、CAT、GSH-Px活性以及GSH与氧化型谷胱甘肽(GSSG)的比率。这些作用均呈剂量依赖性, 且在高剂量(50 mg·kg−1)下最为明显。在对LPS/ D-GalN诱发急性肝损伤的保护研究中, 紫草素还可以显著增加SOD和GSH的产生, 同时降低了ROS水平, 其机制在于上调了Nrf2/HO-1信号通路及相关蛋白(如醌氧化还原酶NQO1、谷氨酰半胱氨酸连接酶亚型Gclc和Gclm)的表达[21]。
1.4 抗病原微生物作用紫草萘醌类化合物具有广谱的抗微生物作用, 如抗细菌、抗真菌、抗寄生虫和抗病毒等。一般认为, 紫草素及其衍生物具有抗革兰阳性菌(如金葡菌、粪肠球菌和枯草芽孢杆菌等)活性, 其最小抑菌浓度(MICs)范围为0.30~6.25 mg·L−1, 但对革兰阴性菌(如大肠杆菌、铜绿假单胞菌和藤黄微球菌等)无效[11]。但也有研究发现紫草素在浓度为200 μmol·L−1 (57.6 mg·L−1)时可抑制铜绿假单胞菌(Pseudomonas aeruginosa)和嗜麦芽黄单胞菌(Stenotrophomonas maltophilia)的生物膜形成[43]。Vegara等[44]也发现紫草素对大肠杆菌(E. coli CECT 515)和金葡菌(S. aureus CECT 59)均有良好的抑制活性, MIC50分别为(15 ± 0.4) mg·L−1 (或约53 μmol·L−1)和(1.9 ± 0.4) mg·L−1 (或约6.5 μmol·L−1), 对大肠杆菌菌株CECT 515的最小杀菌浓度(MBC)为47 mg·L−1; 采用间歇式灭菌的胡萝卜汤(一种粗加工食品模型)培养, 在MBC浓度下紫草素可致大肠杆菌数生长减少6.5个对数循环, 而在浓度45 mg·L−1时可致金葡菌生长减少3.1个对数循环。Li等[45]从新疆紫草中分离出紫草素(结构可能为阿卡宁)等化合物并筛选了其抗菌活性, 结果发现紫草素对金葡菌有较弱的抑制作用, MIC为0.125 mg·mL−1 (阳性对照为庆大霉素, MIC≤0.25 μg·mL−1)。Kim等[46]从硬紫草(来源于紫草Lithospermum erythrorhizon Sieb. et Zucc.的根)中分离得到紫草素等6种紫草萘醌类化合物和shikonofuran C等3种紫草呋喃类化合物, 体外GH33细菌唾液酸酶抑制实验证明这些化合物对产气荚膜梭状芽胞杆菌(Clostridium perfringens)源的GH33唾液酸酶均有较强的抑制作用。相比而言, 紫草呋喃类的抑制作用强于萘醌类化合物, 其中, shikonofuran E的活性表现最强, 其IC50值为0.24 μmol·L−1。动力学分析显示这些化合物均为竞争性的和简单可逆的慢结合型抑制剂。
紫草素等的抗病毒作用也逐渐受到关注。早期研究显示新疆紫草醇提物具有抗HCV的作用[47], 后来Li等[45]研究发现紫草素具有较强的抗HCV作用, 其EC50值为0.025 μg·mL−1, 细胞毒活性CC50值为1.089 μg·mL−1, 选择性指数即为43.56, 远高于阳性对照药利巴韦林的7.89 (实验测得利巴韦林的EC50值为2.553 μg·mL−1, CC50值为20.14 μg·mL−1)。神经氨酸酶(NA)抑制剂是治疗甲型流感的有效药物, Zhang等[48]采用HPLC/ESI-TOF-MS分析结合半制备HPLC分离并鉴定了(硬)紫草中的抗NA成分, 结果发现其中阿卡宁、乙酰阿卡宁、异丁酰阿卡宁、β, β '-二甲基丙烯酰阿卡宁、异戊酰阿卡宁具有明显的神经氨酸酶抑制活性, 其IC50值分别为218.00、164.12、558.68、160.48和163.45 μmol·L−1, 其中以乙酰阿卡宁作用最强。除抗菌作用外, Kim等[46]还考察了6种紫草萘醌类化合物和3种紫草呋喃类化合物的体外抗病毒作用, 结果萘醌类化合物均能抑制重组甲型流感病毒H1N1中GH34唾液酸酶活性, 其IC50值均为40 μmol·L−1; 而紫草呋喃类化合物无明显作用。动力学分析显示萘醌类化合物的作用机制主要为非竞争性抑制。在抗HIV活性方面, 紫草素表现了较好的体外抗HIV-1活性, 即在纳摩尔水平抑制在不同趋化因子作用下的单核细胞趋化性和钙离子流, 其作用机制与下调巨噬细胞表面一个主要的HIV-1共受体CCR5 (细胞因子受体5)的表达有关; 紫草素还可抑制人外周血单核细胞中HIV多药耐药株及儿科临床分离株的复制, 其半数有效浓度(IC50)在96~366 nmol·L−1之间[49]。由此推知, 作为一种天然的小分子泛趋化因子受体抑制剂, 紫草素具有开发抗HIV药物的潜力。
1.5 抗肥胖作用Gwon等[50]对高脂肪饮食的C57BL/6J小鼠同时给药紫草素8周, 结果发现紫草素能减少高脂肪饮食引起的体重增加, 且能减少白色脂肪组织含量、血清甘油三酯和总胆固醇水平; 血浆胰岛素及瘦素的水平也有显著下降。紫草素还能降低白色脂肪组织中蛋白含量与脂肪细胞发生相关基因的mRNA表达以及肝脏中脂肪形成基因的mRNA表达与脂质含量。此外, 紫草素能提高肝脏和骨骼肌中过氧化物酶增殖激活的受体(PPAR-α)、辅助激活因子-1α (PGC-1α)和酯酰辅酶A氧化酶1 (ACOX1)的表达, 促进脂肪酸β-氧化。该研究认为紫草素通过调节脂肪细胞发生、脂肪形成和脂肪酸氧化防止小鼠高脂肪饮食所致肥胖, 故可能对肥胖病有一定的治疗作用。在另一项研究中, 高脂肪饮食的大鼠分别灌服100、300和900 mg·kg−1剂量的乙酰紫草素(acetylshikonin) 6周, 结果表明给药组的大鼠体重、白色脂肪组织含量、肝重、血清甘油三酯和游离脂肪酸水平较模型组均有不同程度的下降, 高剂量组有显著性差异; 同时, 乙酰紫草素抑制了脂肪分化转录因子的表达, 减少了脂肪细胞特异性蛋白HSL和脂肪甘油三酯脂酶ATGL的表达。不仅如此, 乙酰紫草素还可以诱导脂解作用, 释放甘油和增加蛋白激酶PKA与激素敏感性脂肪酶HSL的磷酸化水平。这些结果提示乙酰紫草素具有抗肥胖作用, 可用于人的减肥治疗[51]。该研究组[52]还以自发型肥胖db/db小鼠为模型, 以每日540 mg·kg−1剂量灌胃给予乙酰紫草素8周, 结果显示乙酰紫草素给药组小鼠表现出体重、食物功效比、血清甘油三酯及游离脂肪酸水平的明显降低, 同时, 肝脏ALT、AST和促炎因子水平均显著下降。进一步考察发现乙酰紫草素能明显提升脂肪组织中脂质代谢酶ATGL和HSL的表达水平, 还可显著下调肝脏脂质合成相关蛋白, 如固醇调节元件结合蛋白-1 (SREBP-1)、脂肪酸合成酶(FAS)和羟甲基戊二酰辅酶A还原酶(HMGCR)的表达。这些作用表明了乙酰紫草素具有抗肥胖和非酒精性脂肪肝的作用, 其作用机制与调节脂肪代谢及抗炎作用有关。
1.6 其他作用有研究表明乙酰紫草素具有抗生育的作用[53]。高剂量(1 080 mg·kg−1)的乙酰紫草素可使SD大鼠的怀孕率显著下降(45.5% vs对照组81.8%), 并发现乙酰紫草素可抑制促性腺激素(GTH)分泌, 使大鼠垂体中血清促卵泡激素(FSH)和黄体激素(LH)水平明显下降, 该作用可能通过影响促性腺激素的胞吐作用发生。但是撤除乙酰紫草素一个月后大鼠可恢复怀孕率, 说明此作用是可逆的。
从以上文献的调研可知, 以紫草素为代表的紫草萘醌类成分具有广泛的药理作用, 尤其是抗炎、抗肿瘤和抗病毒等活性, 已成为学者们研究的热点。与此同时, 紫草及其萘醌类成分因具有抗炎、促皮肤伤口愈合等作用在临床上得到广泛应用[11, 12]。作用机制的研究表明, 对于某一种药理效应或病症(如肝损伤)紫草素可能通过多条信号通路的调节发挥作用。以紫草素的抗炎效应为例, 除了与TLR4/NF-κB信号通路阻滞有关, 许多其他信号通路关键分子(如MAPK通路蛋白、转录因子T-bet等)也可能参与其中[11, 20−23]。这些信号分子及其转导通路以及各信号通路间的交互作用对紫草素药理作用的影响亟需阐明。其次, 尽管研究已经发现了不少紫草素药理作用的潜在分子靶点, 但针对不同疾病及病理类型的特异性关键靶点还有待揭示。需要指出的是, 紫草素广泛且较强的药理作用有可能使其缺乏选择性, 而其较强的脂溶性、化学及代谢不稳定性也可能大大降低其生物利用度及有效性[11]。因此, 还需要在紫草素类成分的结构改造与构效关系、体内药代动力学及药物递送系统等方面开展深入研究。
2 紫草萘醌类成分的定量分析方法中药化学成分具有多样性和复杂性, 故对某单一成分定量很难达到对中药质量控制的目的, 为更好地控制中药质量保证用药的安全、可靠, 现多采用多组分含量测定进行定量。2010版《中国药典》中, 用梯度洗脱测定多指标成分含量的品种共31个, 收录的成方制剂中有258个品种测定两种及以上成分的含量[54]。2015版药典明显增加了多味药、多组分的测定方法, 且更注重在同一HPLC条件下测定[55]。为解决对照品紧缺和检测成本高的困难, 2010版《中国药典》首次将“一测多评” (multi-components by single-marker, QAMS)法纳入, 作为多组分测定的替代方法[56]。该法或可弥补指纹图谱在实际应用中过于“模糊”的难题[57]。
纵观紫草萘醌类成分的药理活性、临床功效及其生物合成途径, 将此类成分作为紫草的质量标志物具有内在的合理性, 因此, 从药典标准到产品质量控制, 无一不将紫草素类成分作为定性定量指标的首选。在现版中国药典中, 紫草的含量测定方法为采用HPLC法、以乙腈−水−甲酸(70:30:0.05)为流动相, 测定β, β '-二甲基丙烯酰阿卡宁(β, β '-dimethylacrylalkannin)的含量, 以UV-Vis法测定紫草羟基萘醌总色素含量[3]。早期的质量研究多以单一成分的测定为主, 如Zhang等[58]采用HPLC方法, 以乙腈− 0.1%磷酸(75:25)为流动相建立了滇紫草及其两个近缘品种(密花滇紫草和昆明滇紫草)中乙酰紫草素的含量测定方法, 发现两个近缘品种中乙酰紫草素的含量比滇紫草低。本研究组[59]曾采用HPLC法测定8批不同来源紫草药材(新疆紫草、滇紫草、进口紫草)中β, β '-二甲基丙烯酰基紫草素(β, β '-dimethylacrylshikonin)的含量, 结果表明, 不同来源的紫草药材质量差异较大。目前仍有少量对单一成分含量测定研究的报道, 如Zhu等[60]采用乙腈−水(80:20)系统对不同产地紫草中去氧紫草素(deoxyshikonin)含量进行了测定, 结果方法快速、准确, 重现性好。这些研究采用的流动相系统均比较简单, 如前两者分别采用了乙腈−0.1%磷酸和乙腈−水−甲酸系统, 因而能有效分离的萘醌类成分数量比较有限。由于药典控制的β, β '-二甲基丙烯酰阿卡宁在不同来源紫草中的含量参差不齐, 甚至出现混伪品含量较高的现象[59, 61], 因此, 采用单一成分定量已不能满足对药材整体质量控制和评价的要求, 建立多组分的定量方法则成为提高和完善紫草药材质量标准的必然途径。
目前对紫草类药材中多种萘醌类成分同时测定已有不少报道(表 1)。大多数研究是在药典方法基础上进行的多组分定量分析[61−68]。例如, Zan等[65]采用乙腈−0.05%甲酸(70:30)为流动相建立了新疆紫草的特征图谱, 并同时测定紫草科不同属植物(新疆紫草AE、内蒙紫草AG、硬紫草LE、滇紫草OP和长花滇紫草OHL)中左旋紫草素(即阿卡宁)等6种萘醌类成分的含量, 通过定性定量分析, 不同基原药材中萘醌类成分的数目及含量有显著差异, 如以6种成分计总萘醌的含量或范围分别为3.3~92.5 mg·g−1 (AE, 19批次)、25.0~60.4 mg·g−1 (AG, 2批次)、8.4~9.9 mg·g−1 (LE, 2批次)、4.1 mg·g−1 (OP, 1批次)、6.9~31.6 mg·g−1 (OHL, 3批次)。该作者[66]还采用相同的流动相系统对新疆紫草不同部位中阿卡宁、β-羟基异戊酰紫草素(β-hydroxyisovalerylshikonin)、乙酰紫草素、β-乙酰氧基异戊酰阿卡宁(β- acetoxy-isovaleryalkannin)、去氧紫草素、异丁酰紫草素、β, β '-二甲基丙烯酰阿卡宁和异戊酰紫草素(isovaleryshikonin)等8种羟基萘醌类成分进行了分析和含量测定, 结果表明新疆紫草各部位中主要成分含量差异较大, 从高到低依次为根皮、根、茎残基、根木质部和地上部。该流动相系统还被应用于测定新疆北部10个产地硬萼软紫草(A. decumbens)根中乙酰紫草素、去氧紫草素、异丁酰紫草素和α-甲基丁酰紫草素(α-methyl-n-butyrylshikonin)的含量, 该药材不含β, β '-二甲基丙烯酰阿卡宁和左旋紫草素, 其中乙酰紫草素和α-甲基丁酰紫草素为主要成分且4种成分在不同产地药材中含量存在差异, 其总量在4~20 mg·g−1之间[67]。Aga等[68]采用HPLC-DAD方法, 以乙腈−水为流动相梯度洗脱, 同时测定了藏紫草(细花滇紫草Onosma hookerii C. B. Clarke和长花滇紫草O. hookerii Clarke var. longiflorum Duthie)中紫草素、乙酰紫草素与β, β '-二甲基丙烯酰紫草素的含量, 结合HPLC指纹图谱研究, 对西藏地区不同来源的7批藏紫草药材的质量进行初步比较和评价, 结果显示市售藏紫草药材来源混杂、质量差异较大, 3种成分的总量约为0.08~5.0 mg·g−1。此系统还被应用于建立细花滇紫草及其变种药材药材指纹图谱, 如Jiang等[69]采用乙腈−水溶剂系统梯度洗脱对27批次不同产地的细花滇紫草及其变种药材样品建立了指纹图谱, 结果表明不同产地细花滇紫草及其变种药材指纹图谱共有峰有12个, 相似度为0.92~0.99。近期还有Sun等[70]采用乙腈−0.1%甲酸(80:20)等度洗脱系统对新疆紫草中的紫草素、乙酰紫草素和β, β '-二甲基丙烯酰紫草素三种成分进行了测定。
| Table 1 The analytical methods for multi-components determination of naphthoquinones in crude materials of Zicao. aAB: Arnebia benthamii (Wall. ex G. Don) Johnston; ADC: Arnebia decumbens (Vent.) Coss. et Kral.; ADL: Arnebia densiflora (Nordm.) Ledeb.; AE: Arnebia euchroma (Royle) Johnston; AG: Arnebia guttata Bunge; LE: Lithospermum erythrorhizon Sieb. et Zucc.; OC: Onosma confertum W. W. Smith; OE: Onosma exsertum Hemsl.; OH: Onosma hookerii C. B. Clarke; OHL: Onosma hookerii Clarke var. longiflorum Duthie; OP: Onosma paniculatum Bur. et Franch.; OW: Onosma waltonii Duthie. bIn the citations with no column information, the reverse parking material C18 is used. cSee Figure 1 for structures |
另有一些研究对药典流动相系统进行了改进, 以实现更多萘醌类成分的分离。例如, Han等[71]采用反相HPLC法, 以同含0.5%冰醋酸及0.3%三乙胺的乙腈溶液和水溶液为流动相, 梯度洗脱, 建立了同时测定硬紫草中紫草素、异丁酰紫草素和β, β '-二甲基丙烯酰紫草素的方法, 其流动相加入了冰醋酸和三乙胺使得拖尾现象有了很大改善, 提高了分离度。Bozan等[72]曾对分布于土耳其安纳托利亚半岛的药用植物A. densiflora中4种阿卡宁类成分进行分析, 总含量约为30.8 mg·g−1; 该方法用甲醇替换乙腈作为流动相(表 1), 然而, α-甲基丁酰阿卡宁和异戊酰阿卡宁在此条件下重合, 故对其采用混合定量的方法进行测定。以上方法尽管实现了紫草萘醌的多组分含量测定, 但仍不能对所有组分实现完全分离, 如α-甲基丁酰阿卡宁(紫草素)和异戊酰阿卡宁(紫草素)。对此也有学者进行了探究, 如Hu等[73]曾报道使用C8柱, 以甲醇(含5%四氢呋喃)和水(含0.2%甲酸)组成流动相梯度淋洗, 对9种紫草科不同属植物中紫草素等8个萘醌类成分进行定量研究, 该方法可使α-甲基丁酰紫草素和异戊酰紫草素完全分离(分离度达1.51)。本研究组近期也对滇紫草含量测定方法进行了研究, 建立了四氢呋喃−乙腈−水−甲酸流动相系统对其中多种萘醌类成分实现了完全分离并定量(数据待发表)。与之类似, Li等[74]采用四氢呋喃−乙腈−水(含0.17%甲酸)三元混合溶剂等度洗脱体系(43:8:49)为流动相, 对10批新疆紫草的羟基萘醌指纹图谱进行了实验, 确定了其相似度应大于0.990。
最近, 一些研究采用了不同于紫外的检测方法进行定性定量分析。例如, Liao等[75, 76]利用超高效液相色谱−高分辨电喷雾飞行时间质谱法研究了紫草素类化合物电喷雾质谱裂解规律, 进而应用液质联用及多反应监测(MRM)技术, 同时测定了紫草(包括14批新疆紫草、6批硬紫草和2批内蒙紫草)中9个萘醌类和4个紫草呋喃类化合物, 结果显示不同种属及来源的样品中紫草萘醌类及呋喃类成分含量差异较大。Tao等[77]应用高效液相色谱−电化学法(HPLC-ECD)测定了紫草中紫草素、乙酰紫草素、去氧紫草素、异丁酰紫草素、β, β '-二甲基丙烯酰紫草素的含量, 结果显示该法准确度与紫外法相当, 而其灵敏度远高于紫外法。
基于HPLC法的一测多评法在紫草质量评价中也开始得到应用。Zhao等[61]以廉价、易得的β, β '-二甲基丙烯酰阿卡宁为内参物, 建立了乙酰紫草素、β-乙酰氧基异戊酰阿卡宁、异丁酰紫草素和α-甲基丁酰紫草素的相对校正因子, 并测定其含量, 结果与外标法测得结果基本一致, 实现了紫草中5种萘醌类成分的一测多评。同时, 研究还发现不同来源的新疆紫草萘醌含量差异较大, 其中α-甲基丁酰紫草素与总萘醌的含量呈正相关, 可在一定程度上反映药材总萘醌的含量。
除了HPLC方法, 还有研究应用薄层扫描法对紫草中紫草素类成分进行定量分析。例如, Katoch等[78]建立了正相高效薄层层析法(NP-HPTLC), 以正己烷−乙酸乙酯−甲醇(40:7.5:2.5)为展开系统, 测定了印度喜马偕尔邦产药用植物A. benthamii根的甲醇提取物中紫草素和β, β '-二甲基丙烯酰紫草素的含量。另外, 还有采用毛细管电泳技术、红外光谱和近红外光谱法对紫草类药材的指纹图谱进行的研究[79−81], 结果稳定、可靠, 可为紫草类药材的鉴别提供参考。
从以上文献整理可见, 不同种属紫草类药材之间萘醌类成分的种类及其比例有一定的差异, 同一基原的紫草萘醌类成分含量在不同文献中报道也有不同(表 1);而造成差异的原因除了原植物的区别, 还可能与药材产地、生长环境、采收期、采集部位、初加工及贮藏条件等多种因素有关[66−68]。由于药典基原的紫草野生资源逐渐匮乏[82], 一些地方品种或习用品, 包括如云南、贵州、四川等地习用的滇紫草[59, 83], 新疆地区习用的硬萼软紫草、天山软紫草(A. tschimganicum B. Fedtsch.)和帕米尔紫草(A. thomsonii C. B. Clarke)[84], 西藏地区习用的藏紫草[68], 甚至还有巴基斯坦、阿富汗等国流入我国境内的非药典品[75]等, 可能混入药材的流通环节, 甚至成为紫草的主要来源; 而其质量优劣不均且不及新疆紫草(AE)。本研究组[83]研究也发现市售滇紫草药材与确定基原的药材在萘醌类成分的种类及含量上存在较大差异, 一些批次的滇紫草药材混杂了其他种类药材或为混伪品等。值得注意的是, 一些混伪品按照《中国药典》总萘醌测定方法仍可测出一定含量, 有的甚至高于药典的最低要求(即不少于0.80%)[3], 但HPLC分析均未发现任何萘醌类成分, 提示仅根据总萘醌含量进行紫草药材的质量评价可能不准确, 甚至导致误判; 再则, 由于紫草药材中紫草素或阿卡宁的含量普遍较低, 以该化合物的吸收系数(E1% 1cm = 242)计算总萘醌含量均低于以含量较高者如β, β '-二甲基丙烯酰紫草素为标准定量的结果, 提示现有方法有可能低估紫草样品中总萘醌的实际含量, 此结果也与文献相吻合[85]。这些现象都说明现阶段对紫草类药材进行质量控制与评价研究的必要性和紧迫性, 而多组分含量测定及一测多评能在一定程度上同时满足对药材质量控制整体性和精准性的要求。另外, 紫草素及其衍生物一般都有一个手性碳(C-11, 图 1), 依此可分为R-型的紫草素类(shikonins)和S-型的阿卡宁类(alkannins)[86]。如按基原区分, 软紫草属来源的新疆紫草主要含阿卡宁类, 而紫草属及滇紫草属来源的紫草萘醌主要为紫草素类, 而两者须采用手性色谱进行分析[86, 87]。不难看出, 许多研究采用的对照品为购买得到, 其名称与来源混淆不清(既有“紫草素”也有“阿卡宁”), 实际上多未考虑手性异构的问题。因此, 要真正实现紫草类药材质量的精准控制和评价还需从对照品的“正本清源”开始。
3 结语与展望紫草类生药主要来源于紫草属、软紫草属和滇紫草属植物。萘醌类成分是该类生药中一类重要的脂溶性色素成分, 其药理活性多样, 包括抗炎、抗肿瘤以及促进伤口愈合等, 是紫草应用于临床不可忽视的药效物质基础。紫草素的抗炎和促进伤口愈合作用已被充分用于各种制剂, 其作用机制也得到了广泛关注和研究。另一方面, 紫草类生药在食品、化妆品及医药等行业的应用逐步加大, 而其药材供不应求, 尤其是药典收载品种如新疆紫草和内蒙紫草野生资源已近匮乏, 使得药材价格居高不下, 同时导致市场流通的药材来源混杂, 出现不同种属药材之间替代甚至掺伪等现象, 质量良莠不齐。从文献整理还看到, 紫草的品质评价从基础研究到药典标准无一不将萘醌类成分作为其质量控制或评价指标。这反映了萘醌类成分不仅是紫草固有存在的化学物质, 可以作为一般性的指标成分, 而且是与其功能密切相关的标志性成分。值得注意的是, 目前紫草的药典标准采用单一的萘醌成分—β, β '-二甲基丙烯酰阿卡宁及总萘醌作为药材含量测定指标, 已无法满足对紫草药材的整体质量控制和准确评价的要求。采用多种萘醌类成分对不同来源的紫草质量进行评价并建立其标准, 可以更好地了解和控制紫草药材及其产品的质量, 选择更优质或可替代的紫草药材, 从而保证临床应用的安全有效。尽管近些年来对紫草萘醌多组分含量测定、指纹图谱以及一测多评的研究逐渐增多, 但分析方法仍有不足, 有关对照品的来源、类型及数量尚不明确, 对紫草素及其衍生物的药理活性、作用机制以及成药性等的了解还不够深入等, 这些都有待于进一步研究。
| [1] | Chinese Herbals Editor Board, the State Administrative Bureau of Chinese Medicine of China. Chinese Herbals (中华本草)[M]. Shanghai: Shanghai Science and Technology Press, 1999: 525-544. |
| [2] | Wu D, Li CY. Textual research on Arnebia[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2008, 19: 2042–2043. |
| [3] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol I. 2015 Ed. Beijing: China Medicinal Science Press, 2015: 340. |
| [4] | The Editor Board of Yunnan Food and Drug Administration Bureau. Yun Nan Chinese Materia Medica Standards (Volume 6 for Yi Nationality Medicine (Ⅲ)) (云南省中药材标准2005年版第六册·彝族药(Ⅲ))[S]. Kunming: Yunnan Science and Technology Press, 2010: 99, 485. |
| [5] | The Editor Board of Sichuan Food and Drug Administration Bureau. Si Chuan Chinese Materia Medica Standards (2010 Edition) (四川省中药材标准2010年版)[S]. Chengdu: Sichuan Science and Technology Press, 2011: 608-609. |
| [6] | Jiang B. A medicinal plant of Bai Nationality-Onosma paniculatum Bur. et Franch[J]. J Dali Univ (大理大学学报), 2016, 1: 102. |
| [7] | Zhan Z, Hu J, Liu T, et al. Advances in studies on chemical compositions and pharmacological activities of Arnebiae Radix[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4127–4135. |
| [8] | Zhao X, Li N, Song Y, et al. Chemical constituents of Arnebiae Radix[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2016, 22: 47–50. |
| [9] | Liao M, Yao Y, Chen F, et al. Studies on chemical constituents from Arnebia guttata Bunge[J]. J South-Cent Univ Natly (Nat Sci Ed) (中南民族大学学报·自然科学版), 2018, 37: 58–60. |
| [10] | Zhang B, Xie Y. Protective effect of Lithospermum erythrorhizon polysaccharide on CCl4-induced acute liver injury in mice and its underlying mechanisms[J]. Curr Immunol (现代免疫学), 2018, 38: 135–139. |
| [11] | Andújar I, Ríos JL, Giner RM, et al. Pharmacological properties of shikonin-a review of literature since 2002[J]. Planta Med, 2013, 79: 1685–1697. DOI:10.1055/s-00000058 |
| [12] | Papageorgiou VP, Assimopoulou AN, Ballis AC. Alkannins and shikonins:a new class of wound healing agents[J]. Curr Med Chem, 2008, 15: 3248–3267. DOI:10.2174/092986708786848532 |
| [13] | Gao XM. Chinese Medicines (中药学)[M]. Beijing: People's Medical Publishing House, 2000: 445-452. |
| [14] | Liu T, Lv C, Wang S, et al. Transcriptome-based gene mining and bioinformatics analysis of p-hydroxybenzoate geranyltransferase genes in Arnebia euchroma[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 1422–1429. |
| [15] | Liu C, Chen S, Xiao X, et al. A new concept on quality marker of Chinese materia medica:quality control for Chinese medicinal products[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1443–1457. |
| [16] | Cheng M, Mo Q, Xu Y, et al. Quality evaluation of Arnebiae Radix using multiple qualitative and quantitative methods coupled with multivariate statistical analysis[J]. Curr Pharm Anal, 2013, 9: 217–225. DOI:10.2174/1573412911309020013 |
| [17] | Andujar I, Rios JL, Giner RM, et al. Beneficial effect of shikonin on experimental colitis induced by dextran sulfate sodium in BALB/c mice[J]. Evid Based Complement Alternat Med, 2012, 2012: 271606. |
| [18] | Xu YY, Xu YG, Gao XG, et al. Shikonin suppresses IL-17-induced VEGF expression via blockage of JAK2/STAT3 pathway[J]. Int Immunopharmacol, 2014, 19: 327–333. DOI:10.1016/j.intimp.2014.01.027 |
| [19] | Liu L, Wu Y, Cao K, et al. Shikonin inhibits IFN-g-induced K17 over-expression of HaCaT cells by interfering with STAT3 signaling[J]. Int J Clin Exp Pathol, 2015, 8: 9202–9207. |
| [20] | Liu T, Xia Y, Li J, et al. Shikonin attenuates concanavalin A-induced acute liver injury in mice via inhibition of the JNK pathway[J]. Mediat Inflamm, 2016, 2016: 2748367. |
| [21] | Tian Y, Li Z, Shen B, et al. The protective effects of shikonin on lipopolysaccharide/D-galactosamine-induced acute liver injury via inhibiting MAPK and NF-κB and activating Nrf2/HO-1 signaling pathways[J]. Rsc Adv, 2017, 7: 34846–34856. DOI:10.1039/C7RA03291A |
| [22] | Nie Y, Yang Y, Zhang J, et al. Shikonin suppresses pulmonary fibroblasts proliferation and activation by regulating Akt and p38 MAPK signaling pathways[J]. Biomed Pharmacother, 2017, 95: 1119–1128. DOI:10.1016/j.biopha.2017.09.023 |
| [23] | Li YJ. Anti-inflammatory Effects of Shikonin by TLR4/NF-κB Pathway in Macrophage (紫草素通过TLR4/NF-kB信号通路在巨噬细胞中发挥抗炎作用的研究)[D]. Wuhan: Wuhan University, 2018. |
| [24] | Fan HY, Yang MY, Che X, et al. Activity study of a hydroxynaphthoquinone fraction from Arnebia euchroma in experimental arthritis[J]. Fitoterapia, 2012, 83: 1226–1237. DOI:10.1016/j.fitote.2012.06.011 |
| [25] | Rajapaksha GP, Kyoung TL, Chang HK, et al. Isobutyrylshikonin inhibits lipopolysaccharide-induced nitric oxide and prostaglandin E2 production in BV2 microglial cells by suppressing the PI3K/Akt-mediated nuclear transcription factor-κB pathway[J]. Nutr Res, 2014, 34: 1111–1119. DOI:10.1016/j.nutres.2014.10.002 |
| [26] | Guha M, Mackman N. LPS induction of gene expression in human monocytes[J]. Cell Signal, 2001, 13: 85–94. DOI:10.1016/S0898-6568(00)00149-2 |
| [27] | Blaser H, Dostert C, Mak TW, et al. TNF and ROS crosstalk in inflammation[J]. Trends Cell Biol, 2016, 26: 249–261. DOI:10.1016/j.tcb.2015.12.002 |
| [28] | Qiu HY, Wang PF, Lin HY, et al. Naphthoquinones:a continuing source for discovery of therapeutic antineoplastic agents[J]. Chem Biol Drug Des, 2018, 91: 681–690. DOI:10.1111/cbdd.2018.91.issue-3 |
| [29] | Andújar I, Recio MC, Giner RM, et al. Traditional Chinese medicine remedy to jury:the pharmacological basis for the use of shikonin as an anticancer therapy[J]. Curr Med Chem, 2013, 20: 2892–2898. DOI:10.2174/09298673113209990008 |
| [30] | Zhu M, Wang R, Zhou W, et al. Antitumor effect research progress of shikonin and its derivatives[J]. Acta Pharm Sin (药学学报), 2012, 47: 588–593. |
| [31] | Yang WB, Luo XL, Hu J, et al. Research progress on anti-tumor components and mechanism of Arnebiae Radix[J]. Pharm J Chin PLA (解放军药学学报), 2017, 33: 359–362. |
| [32] | Tian R, Li Y, Gao M. Shikonin causes cell-cycle arrest and induces apoptosis by regulating the EGFR-NF-κB signalling pathway in human epidermoid carcinoma A431 cells[J]. Biosci Rep, 2015, 35: e00189. |
| [33] | Jang SY, Hong D, Jeong SY, et al. Shikonin causes apoptosis by up-regulating p73 and down-regulating ICBP90 in human cancer cells[J]. Biochem Biophys Res Commun, 2015, 465: 71–76. DOI:10.1016/j.bbrc.2015.07.131 |
| [34] | Lee MJ, Kao SH, Hunag JE, et al. Shikonin time-dependently induced necrosis or apoptosis in gastric cancer cells via generation of reactive oxygen species[J]. Chem Biol Interact, 2014, 211: 44–53. DOI:10.1016/j.cbi.2014.01.008 |
| [35] | Shi SQ, Cao HM. Shikonin promotes autophagy in BXPC-3 human pancreatic cancer cells through the PI3K/Akt signaling pathway[J]. Oncol Lett, 2014, 8: 1087–1089. DOI:10.3892/ol.2014.2293 |
| [36] | Kuo LJ, Huang CY, Cheng WL, et al. Glucose-regulated protein 78 mediates the anticancer efficacy of shikonin in hormone-refractory prostate cancer cells[J]. Tumor Biol, 2015, 36: 5063–5070. DOI:10.1007/s13277-015-3157-0 |
| [37] | Li X, Fan XX, Jiang ZB, et al. Shikonin inhibits gefitinib-resistant non-small cell lung cancer by inhibiting TRXR and activating the EGFR proteasomal degradation pathway[J]. Pharmacol Res, 2017, 115: 45–55. DOI:10.1016/j.phrs.2016.11.011 |
| [38] | Hsieh YS, Liao CH, Chen WS, et al. Shikonin inhibited migration and invasion of human lung cancer cells via suppression of c-met-mediated epithelial-to-mesenchymal transition[J]. J Cell Biochem, 2017, 118: 4639–4651. DOI:10.1002/jcb.v118.12 |
| [39] | Kourounakis AP, Assimopoulou AN, Papageorgiou VP, et al. Alkannin and shikonin:effect on free radical processes and on inflammation-a preliminary pharmacochemical investigation[J]. Arch Pharm (Weinheim), 2002, 335: 262–266. DOI:10.1002/1521-4184(200208)335:6<262::AID-ARDP262>3.0.CO;2-Y |
| [40] | Parray JA, Hamid R, Kamili AN, et al. Biological efficacy and radical scavenging potential of shikonin in Arnebia benthamii (Wall ex. G Don) Johnston[J]. Ind Crop Prod, 2015, 74: 434–439. DOI:10.1016/j.indcrop.2015.04.040 |
| [41] | Huang CS, Lin AH, Yang TC, et al. Shikonin inhibits oxidized LDL-induced monocyte adhesion by suppressing NF-κB activation via up-regulation of PI3K/Akt/Nrf2-dependent antioxidation in EA.hy926 endothelial cells[J]. Biochem Pharmacol, 2015, 93: 352–361. DOI:10.1016/j.bcp.2014.12.005 |
| [42] | Wang ZH, Liu T, Gan L, et al. Shikonin protects mouse brain against cerebral ischemia/reperfusion injury through its antioxidant activity[J]. Eur J Pharmacol, 2010, 643: 211–217. DOI:10.1016/j.ejphar.2010.06.027 |
| [43] | Ding X, Yin B, Qian L, et al. Screening for novel quorum-sensing inhibitors to interfere with the formation of Pseudomonas aeruginosa biofilm[J]. J Med Microbiol, 2011, 60: 1827–1834. DOI:10.1099/jmm.0.024166-0 |
| [44] | Vegara S, Funes L, Martí N, et al. Bactericidal activities against pathogenic bacteria by selected constituents of plant extracts in carrot broth[J]. Food Chem, 2011, 128: 872–877. DOI:10.1016/j.foodchem.2011.03.109 |
| [45] | Li HM, Tang YL, Zhang ZH, et al. Compounds from Arnebia euchroma and their related anti-HCV and antibacterial activeties[J]. Planta Med, 2012, 78: 39–45. DOI:10.1055/s-0031-1280266 |
| [46] | Kim JY, Jeong HJ, Park JY, et al. Selective and slow-binding inhibition of shikonin derivatives isolated from Lithospermum erythrorhizon on glycosyl hydrolase 33 and 34 sialidases[J]. Bioorg Med Chem, 2012, 20: 1740–1748. DOI:10.1016/j.bmc.2012.01.011 |
| [47] | Ho TY, Wu SL, Lai IL, et al. An in vitro system combined with an in-house quantitation assay for screening hepatitis C virus inhibitors[J]. Antivir Res, 2003, 58: 199–208. DOI:10.1016/S0166-3542(03)00004-4 |
| [48] | Zhang MM, Zhao HQ, Zhao ZG, et al. Rapid screening, identification, and purification of neuraminidase inhibitors from Lithospermum erythrorhizon Sieb.et Zucc. by ultrafiltration with HPLC-ESI-TOF-MS combined with semipreparative HPLC[J]. J Sep Sci, 2016, 39: 2097–2104. DOI:10.1002/jssc.201600087 |
| [49] | Chen X, Yang L, Zhang N, et al. Shikonin, a component of Chinese herbal medicine, inhibits chemokine receptor function and suppresses human immunodeficiency virus type 1[J]. Antimicrob Agents Chemother, 2003, 47: 2810–2816. DOI:10.1128/AAC.47.9.2810-2816.2003 |
| [50] | Gwon SY, Choi WH, Lee DH, et al. Shikonin protects against obesity through the modulation of adipogenesis, lipogenesis, and β-oxidation in vivo[J]. J Funct Foods, 2015, 16: 484–493. DOI:10.1016/j.jff.2015.04.040 |
| [51] | Su ML, Huang WD, Zhu BH, et al. Acetylshikonin from Zicao prevents obesity in rats on a high-fat diet by inhibiting lipid accumulation and inducing lipolysis[J]. PLoS One, 2016, 11: e0146884. DOI:10.1371/journal.pone.0146884 |
| [52] | Su ML, He Y, Li QS, et al. Efficacy of acetylshikonin in preventing obesity and hepatic steatosis in db/db mice[J]. Molecules, 2016, 21: 976. DOI:10.3390/molecules21080976 |
| [53] | He Y, Li QS, Su ML, et al. Acetylshikonin from Zicao exerts antifertility effects at high dose in rats by suppressing the secretion of GTH[J]. Biochem Biophys Res Commun, 2016, 476: 560–565. DOI:10.1016/j.bbrc.2016.05.162 |
| [54] | Zhang L, Feng L, Nie J. A survey on the standards and characteristics of Chinese patent medicines in 2010 edition of Chinese Pharmacopoeia[J]. Chin Pharm J (中国药学杂志), 2010, 45: 1284–1286. |
| [55] | Zhang L. Elementary analysis of quality standards of traditional Chinese patent medicines in the Chinese Pharmacopoeia 2015 Edition[J]. Chin Pharm J (中国药学杂志), 2015, 50: 1754–1756. |
| [56] | Wang Z, Qian Z, Zhang Q, et al. A technical guideline for the establishment of methodology of quantitative analysis of multi-components by single marker (QAMS)[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 657–658. |
| [57] | Wang J, Zhang L, Guo Q, et al. Quantitative analysis of seven phenolic acids in eight Yinqiao Jiedu serial preparations by quantitative analysis of multi-components with single-marker[J]. Acta Pharm Sin (药学学报), 2015, 50: 480–485. |
| [58] | Zhang C, He B, Chen S, et al. Content determination of acetylshikonin in Onosma paniculatum and its two closely related species by HPLC[J]. J Yunnan Univ Tradit Chin Med (云南中医学院学报), 2014, 37: 17–22. |
| [59] | Cheng M, Mo Q, Tang J, et al. Determination of β, β'-dimethylacrylalkannin in Arnebiae Radix from different sources and quality evaluation[J]. China Pharm (中国药师), 2013, 16: 798–801. |
| [60] | Zhu Y, Dong N, Qu X, et al. Content determination of deoxyshikonin of Arnebia Radix in different producing areas by HPLC[J]. J Taishan Med Coll (泰山医学院学报), 2017, 38: 1229–1231. |
| [61] | Zhao W, Wu Z, Wu X, et al. Determination of five naphthaquinones in Arnebia euchroma by quantitative analysis multi-components with single-marker[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 3792–3797. |
| [62] | Liu Y. Simultaneous determination of shikonin and its derivatives in Arnebia euchroma (Royle) Johnst by HPLC[J]. China Brew (中国酿造), 2011, 1: 173–176. |
| [63] | Wang XY, Gao SQ, Zhang R, et al. Determination of the active constituents in Arnebia euchroma (Royle) Johnst. by ionic liquid-based ultrasonic-assisted extraction high-performance liquid chromatography[J]. J Chromatogr B, 2011, 879: 1833–1838. DOI:10.1016/j.jchromb.2011.05.009 |
| [64] | Hao H, Li P, Ye H, et al. Simultaneous determination of seven naphthoquinones in crude extract of Arnebia euchroma[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 108–112. |
| [65] | Zan K, Su R, Teng A, et al. HPLC specific chromatogram of Arnebia euchroma and determination of six naphthoquinones in Boraginaceous herbs[J]. Chin J Pharm Anal (药物分析杂志), 2016, 36: 1526–1535. |
| [66] | Zan K, Zheng H, Liu J, et al. Simultaneous determination of eight hydroxyl naphthoquinones in different parts of Arnebia euchroma by HPLC[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 2532–2537. |
| [67] | Ding W, Li J, Yan X, et al. Determination of four naphthaquinones in roots of Arnebia decumbens from different origin by HPLC[J]. Nat Prod Res Dev (天然产物研究与开发), 2017, 29: 2075–2080. |
| [68] | Aga E, Nie L, Dongzhi Z, et al. Multi-component quantitative analysis combined with chromatographic fingerprint for quality assessment of Onosma hookeri[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4442–4445. |
| [69] | Jiang L, Aga E, Wang J, et al. Study on fingerprint of Onosma hookeri and its variants[J]. J Tibet U (Nat Sci Ed) (西藏大学学报·自然科学版), 2017, 32: 38–44. |
| [70] | Sun J, Wen X, Cai D, et al. Simultaneous determination of shikonin, acetylshikonin and β, β'-dimethylacrylshikonin in Arnebia euchroma by RP-HPLC[J]. China Pharm (中国药房), 2018, 29: 455–457. |
| [71] | Han J, Zhu L, Weng X, et al. RP-HPLC determination of shikonin, isobutylshikonin and β, β'-dimethylacrylshikonin in Lithospermum erythrorhizon Sieb.et Zucc.[J]. Chin J Pharm Anal (药物分析杂志), 2008, 28: 6–8. |
| [72] | Bozan B, Baser KHC, Kara S. Quantitative determination of naphthaquinones of Arnebia densiflora (Nordm.) Ledeb. by an improved high-performance liquid chromatographic method[J]. J Chromatogr A, 1997, 782: 133–136. DOI:10.1016/S0021-9673(97)00460-3 |
| [73] | Hu YN, Jiang ZH, Leung Y, et al. Simultaneous determination of naphthoquinone derivatives in Boraginaceous herbs by high-performance liquid chromatography[J]. Anal Chim Acta, 2006, 577: 26–31. DOI:10.1016/j.aca.2006.06.031 |
| [74] | Li F, Cao X, Hao S. Established HPLC fingerprint of Arnebia euchroma (Royle) Johnst.[J]. J Yantai Univ (Nat Sci Eng Ed) (烟台大学学报·自然科学与工程版), 2016, 29: 187–192. |
| [75] | Liao M, Jiang H. Simultaneous determination of 13 shikonins and shikonofurans in medicinal Arnebia plants by HPLC-MS[J]. Chin Pharm J (中国药学杂志), 2016, 51: 1212–1218. |
| [76] | Liao M, Li A, Chen C, et al. Systematic identification of shikonins and shikonofurans in medicinal Zicao species using ultra-high performance liquid chromatography quadrupole time of flight tandem mass spectrometry combined with a data mining strategy[J]. J Chromatogr A, 2015, 1425: 158–172. DOI:10.1016/j.chroma.2015.11.028 |
| [77] | Tao K, Liu L, Guo S, et al. Determination of five naphthaquinones derivatives in Arnebia euchroma by reversed-phase high-performance liquid chromatography with electrochemical detection[J]. J Yangzhou U (Nat Sci Ed) (扬州大学学报·自然科学版), 2017, 20: 33–37. |
| [78] | Katoch P, Rana S, Kumar D, et al. Concurrent NP-HPTLC determination of shikonin and β, β'-dimethylacryl shikonin in Arnebia benthamii[J]. J Chromatogr Sci, 2016, 54: 1421–1427. DOI:10.1093/chromsci/bmw096 |
| [79] | Zhang L, Zhang A, Wang M, et al. Capillary electrophoresis fingerprint of Arnebia euchroma (Royle) Johnst[J]. Chin J Anal Chem (分析化学), 2017, 45: 1727–1733. |
| [80] | Jiang L. Study on the Quality Control of Onosma hookeri Using High Performance Liquid Chromatography and Infrared Spectroscopy (高效液相色谱法和近红外光谱法在藏紫草质量控制中的应用)[D]. Tibet: Tibet University, 2017. |
| [81] | Lin JY. Application Research of Infrared Fingerprint Identification in Tibetan Medicine (红外指纹图谱在藏药鉴别中的应用研究)[D]. Lanzhou: Lanzhou University, 2013. |
| [82] | Wang S, Li X, Zhou LY, et al. Breeding biology and artificial cultivation of Arnebia euchroma[J]. Mod Chin Med (中国现代中药), 2011, 13: 18–22. |
| [83] | Li SS. Studies on Naphthoquinones Determination in Onosmae Radix et Cortex (滇紫草萘醌类成分含量测定研究)[D]. Wuhan: Wuhan University, 2017. |
| [84] | Li GY, Maierdan M. Distribution of the medicinal Zicao species in Xinjiang and research progress[J]. J Xinjiang Med Univ (新疆医科大学学报), 2009, 32: 386–388. |
| [85] | Liu Y. Study on chromatographic detection method for hydroxynaphthoquinone pigments in Arnebia euchroma (Royle) Johnst[J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 1140–1145. |
| [86] | Zhou W, Jiang HG, Peng Y, et al. Comparative study on enantiomeric excess of main akannin/shikonin derivatives isolated from the roots of three endemic Boraginaceae plants in China[J]. Biomed Chromatogr, 2011, 25: 1067–1075. DOI:10.1002/bmc.v25.10 |
| [87] | Papadoyannis IN, Samanidou VF, Assimopoulou AN, et al. Analytical methods for the determination of alkannins and shikonins[J]. Curr Org Chem, 2006, 10: 583–622. DOI:10.2174/138527206776055277 |
 2018, Vol. 53
2018, Vol. 53


