抑郁症是一种较为常见的、精神科自杀率最高的疾病, 主要表现为情绪低、焦虑、失眠、食欲不振、精力不集中等。全球约有3.5亿人患有抑郁症。世界卫生组织预计, 到2020年, 抑郁症将成为仅次于心脑血管病的第二大疾病。世界卫生组织对中国大陆地区的抑郁症患病率推测为7%~8%[1]。目前抑郁症的发病机制尚不清楚, 存在多种假说:单胺类神经递质假说、细胞因子假说(炎性细胞因子、神经营养因子等)、神经损伤与神经元细胞凋亡假说、下丘脑−垂体−肾上腺皮质轴(hypothalamic-pituitary-adrenal cortex axis, HPA)假说等[2−5]。现有抗抑郁药物由于治愈效率低, 停药后容易复发, 长期服用不良反应多等缺点, 给患者带来了巨大的经济压力和精神痛苦。因此, 从天然药物中寻找毒性低、疗效高、价格合理的理想抗抑郁新药, 正日益被人们重视。
在传统医学上, 小檗碱(berberine, BBR, 图 1)及含有小檗碱成分的天然药物被广泛应用, 在印度、伊朗和中国有3 000年的药用史[6]。小檗碱是黄连、刺檗、白毛茛等中草药的根茎和皮中的重要成分之一, 具有抑菌、抗炎、抗病毒等药理作用, 对肿瘤、糖尿病、心血管疾病、消化道疾病具有较好的治疗作用[7−10]。国内外多项研究表明小檗碱可以显著降低大、小鼠强迫游泳实验的不动时间, 说明小檗碱有一定的抗抑郁活性, 本文就小檗碱的抗抑郁作用展开综述, 拟为今后抗抑郁药物的研究提供方向和思路。
|
Figure 1 Structure of berberine |
抑郁症的病因与大脑内神经元、胶质细胞、单胺类神经递质的异常变化密切相关, 小檗碱能否穿越血脑屏障在大脑中分布至关重要。有研究证明, 大鼠给予小檗碱48 h内在组织中广泛分布并且大脑中的含量明显高于血浆[11]。另有课题组对黄连提取物股静脉给药后大鼠的海马组织和血浆中小檗碱的动力学差异进行研究, 证实了小檗碱可以通过血脑屏障进入海马组织发挥作用, 为小檗碱的临床治疗和学术研究提供了参考[12] (图 2)。
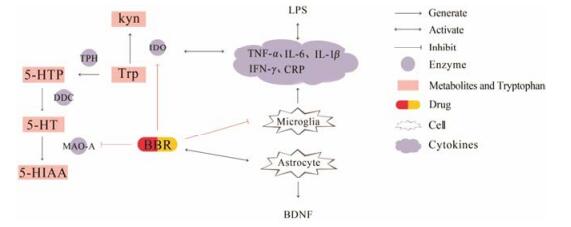
|
Figure 2 Pathogenesis of depression and berberine target. BBR: Berberine; Trp: Tryptophan; Kyn: Kynurenine; TPH: Tryptophan hydroxylase; IDO: Indoleamine 2, 3-dioxygenase; 5-HTP: 5-Hydroxytryptophan; DDC: Dopamine decarboxylase; 5-HT: Serotonin; MAO-A: Monoamine oxidase-A; 5-HIAA: 5-Hydroxyindoleacetic acid; TNF-α: Tumor necrosis factor-α; IL-6: Interleukin-6; IL-1β: Interleukin-1β; IFN-γ: Interferon-γ; CRP: C-reaction protein; BDNF: Brain-derived neurotrophic factor; LPS: Lipopolysaccharides |
五羟色胺(serotonin, 5-HT)假说认为抑郁症是由于中枢神经系统中5-HT释放减少, 突触间隙含量下降所致。大量研究进一步证实, 5-HT在抑郁症的病理生理以及抗抑郁药物机制中具有重要的作用。多巴胺(dopamine, DA)能神经系统在快感与行为动机方面起着极其重要的作用, 因此其含量或功能异常以及其代谢产物异常可能引发抑郁症。Ressler等[13]认为焦虑、抑郁的发生可能是由于复杂的去甲肾上腺素(noradrenaline, NE)功能变化包括蓝斑核的改变、NE的利用及突触前、突触后的受体异常导致的。选择性五羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor, SSRIs)和去甲肾上腺素再摄取抑制剂(selective noradrenaline reuptake inhibitor, SNRIs)是两类临床上使用多年的抗抑郁药物, 足以证明单胺类神经递质参与了抑郁症的发病机制。
有研究表明, 小檗碱可以通过提高小鼠全脑中NE、5-HT及DA含量和调节其他生物胺来逆转利血平引起的小鼠绝望行为, 根据全脑中生物胺的变化推测小檗碱调节小鼠各种行为的机制可能是通过调节大脑内生物胺(NE、5-HT、DA)、L-精氨酸、一氧化氮、环鸟苷单磷酸、sigma受体等途径发挥抗抑郁作用[14]。另一项研究表明, 小檗碱还能影响精神病候选基因之一五羟色胺转运体(serotonin transporter, 5-HTT)不同等位基因间mRNA和蛋白质的表达来发挥抗抑郁作用[15]。
2.2 5-HT、NE、DA转运体、受体及相关酶现行的临床常用抗抑郁药物主要是通过阻断大脑中5-HT和NE的高亲和性转运体对二者的转运来发挥药理作用。有机阳离子转运体2 (organic cation transporter 2, OCT2)作为高亲和性转运体的一个补充体系而受到关注。OCT2对单胺神经递质亲和力虽然低但摄取容量大, 是突触后膜上生物胺能神经紧张的重要决定因素之一, 能够调节与情绪相关的一系列行为[16]。实验证明, 小檗碱能够抑制OCT2和OCT3介导对NE和5-HT的摄取, 该抑制作用将有助于增加脑中NE和5-HT浓度从而发挥抗抑郁作用[17]。
单胺氧化酶(monoamine oxidases, MAOs)是调节大脑和外周组织中单胺水平的关键代谢酶。单胺氧化酶A (monoamine oxidase-A, MAO-A)抑制剂和单胺氧化酶B (monoamine oxidases-B, MAO-B)抑制剂目前临床上用作三线抗抑郁药, 但由于单胺氧化酶在调节突触功能和单胺代谢方面的关键作用, 这一领域的研究在不断的增加。Peng等[18]通过强迫游泳实验(forced swimming test, FST)和悬尾试验(tail suspension test, TST)发现小檗碱可以降低抑郁大鼠在FST和TST中的不动时间, 推测其机制是通过抑制MAO-A对单胺类神经递质的降解来提高海马组织和额叶皮质层中5-HT的浓度发挥抗抑郁作用。
3 炎性因子近年来, 炎性假说在抑郁症的病因中日益凸显。已有多项研究指出, 抑郁症患者血清中白细胞介素-6 (interleukin-6, IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、核转录因子(nuclear factor kappa- light-chain-enhancer of activated B cells, NF-κB)等炎性因子与健康对照组相比明显升高。抑郁症患者尸检样本中也发现, 促炎症细胞因子相关基因的表达明显升高。因此, 神经炎性与炎性细胞因子可能与抑郁症的发病相关, 抗炎药物可能会改善抑郁症患者的抑郁症状[19, 20]。
炎性因子可以直接损伤神经元、抑制星形胶质细胞释放神经营养因子, 进而导致海马、杏仁核、前额皮质、前扣带回和基底核等脑区受损, 脑细胞减少、脑容量降低[21]。干扰素γ (interferon-γ, IFN-γ)、IL-6、TNF-α、脂多糖(lipopolysaccharides, LPS)和氧化应激均可激活吲哚胺2, 3-双加氧酶(indoleamine 2, 3-dioxygenase, IDO), 活化的IDO会使色氨酸更多地向犬尿氨酸代谢导致合成5-HT的原料减少, 5-HT含量降低[22]。有研究证明, 在小鼠慢性不可预见温和应激(chronic unpredictable mild stress model, CUMS)模型中, 小檗碱可通过抑制神经炎性来抗抑郁。小檗碱口服给药后会增加小鼠在糖水偏好实验(sucrose preference test, SPT)中对糖水的摄取, 减少FST中小鼠的不动时间, 但不影响正常组动物的行为。同时小檗碱给药后降低了海马组织中白细胞介素-1β (interleukin-1β, IL-1β)、IL-6、TNF-α水平, 抑制小胶质细胞活性; 抑制了海马区NF-κB信号通路中NF-κB、IκB激酶α (IκB kinase α, IKKα)、IKKβ蛋白的磷酸化和NF-κB下游靶点诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的活化[23]。
据文献报道, 小檗碱可以降低基础状态下小鼠胚胎成纤维细胞3T3-L1中TNF-α、IL-6的分泌并且降低IKK-β的磷酸化。实时定量PCR检测发现TNF-α作用3T3-L1细胞会增加细胞内TNF-α、IL-6、急性反应蛋白(C-reaction protein, CRP)、单核细胞趋化因子蛋白1 (monocyte chemoattractant protein-1, MCP-1) mRNA的表达, 而小檗碱干预后可以使这些炎症因子表达显著下降[24]。NLRP3 (NLR family, pyrin domain- containing 3)炎症小体被认为是潜在的抑郁症炎性标志物之一。Zhang等[25]在动物模型的研究结果也支持这一理论。他们发现NLRP3炎症小体的各组分表达增加或炎症小体的活性增强均可使血清IL-1β水平升高。
4 氧化应激大量研究表明, 抑郁症伴随着神经细胞的程序性凋亡、神经退行性改变和神经元可塑性改变。提高抗氧化物的浓度和抑制氧化应激反应有助于改善抑郁症的程度[26], 因此如何抑制氧化应激反应、减少神经元的破坏成为治疗抑郁症的关键。
Ostadhadi等[27]证明一氧化氮合酶(nitric oxide synthase, NOS)抑制剂具有剂量依赖性和立体选择性抗抑郁剂性质, 并且用一氧化氮(nitric oxide, NO)前体L-精氨酸预处理小鼠, 能够阻断抗抑郁药的抗抑郁作用。此外, 另一项研究表明, 在慢性温和应激(chronicmild stress model, CMS)诱导的小鼠抑郁模型中发现, 丙二醛(malonaldehyde, MDA)等脂质过氧化物作用增强, 诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)水平升高, 超氧化物歧化酶(superoxide dismutase, SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)等抗氧化防御酶活性降低[28]。提示抑制NOS、MDA等脂质过氧化物活性或提高抗氧化防御酶活性可能是治疗抑郁症的新方向。
据文献报道, 小檗碱可以降低巨噬细胞和内皮细胞中因炎性刺激物刺激产生的活性氧(reactive oxygen species, ROS), 间接阻滞了由ROS损伤细胞而引起的炎症。另一方面, 在内皮细胞中, 小檗碱也可以减弱由ROS诱导的低密度脂蛋白(low-density lipoprotein, LDL)氧化, 减少了线粒体跨膜电位的崩溃、染色体皱缩、细胞色素C释放和半胱氨酸天冬氨酸特异性蛋白酶3 (cysteine aspartic acid specific protease, caspase-3)活化, 从而减少细胞凋亡的发生[29]。
小檗碱通过激活腺苷单磷酸激活的蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)信号级联激活内皮细胞和血管, 增强内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)磷酸化, 减少高糖诱导产生的促红细胞生成素(OS), 抑制细胞凋亡、NF-κB活化和黏附分子表达从而发挥保护神经细胞的作用。小檗碱可以抑制脂多糖诱导的抑郁样小鼠海马、前额叶皮质层和杏仁核中iNOS和环氧合酶-2 (cyclooxygenase-2, COX-2)的过度表达[30]。研究表明, 小檗碱可通过激活AMPK通路缓解代谢紊乱, 如肥胖、2型糖尿病和血脂异常。然而, 小檗碱对巨噬细胞促炎症反应的影响知之甚少。在肥胖小鼠的脂肪组织研究中发现, 小檗碱给药后可显著下调促炎性基因TNF-α、IL-1、IL-6、单核细胞趋化蛋白-1 (monocyte chemoattractant protein 1, MCP-1)、iNOS和COX-2的表达。小檗碱抑制脂多糖诱导的腹腔巨噬细胞和RAW 264.7细胞炎性基因的表达, 包括IL-1、IL-6、iNOS、MCP-1、COX-2和基质金属蛋白酶-9。在脂多糖、游离脂肪酸和过氧化氢等多种促炎症信号途径中, 小檗碱可以抑制有丝分裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)的磷酸化, 例如抑制p38、细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)的磷酸化以及降低巨噬细胞中活性氧的表达水平。此外, 通过AMPK抑制剂或失活的AMPK可以阻断小檗碱的抗炎作用, 这意味着小檗碱会通过刺激AMPK抑制巨噬细胞中的炎症反应[31]。小檗碱还可以通过激活AMPK促进GSH-Px和SOD在小鼠肝脏内活化, 减少ROS的产生并增加细胞中GSH-Px和SOD的表达[32]。
5 神经元脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是神经营养因子家族中的重要成员之一, 它可以提高神经干细胞分化成神经元的比率, 还可以刺激新生神经元突起的生长, 对新生神经元的进一步发育和成熟起着重要的作用和意义。大量研究发现BDNF与抑郁症的发生密切相关。是否具有神经元保护作用, 是否能够促进神经元再生对抗抑郁药物研究来讲具有重要的意义。此外, 促进神经元再生也是抗抑郁药作用机制之一, 而经典抗精神病药氯丙嗪和抗焦虑药安定无此作用, 因此提出了抑郁症的“应激性神经元损伤−再生障碍”理论。应激性海马神经元损伤和神经元再生障碍共同导致海马区神经元数量减少是抑郁症研究的关键环节[33]。
Duman等[34]发现抑郁症会导致海马、前额叶与杏仁核等脑边缘区的神经元萎缩和细胞丢失, 并且导致BDNF表达下降。研究表明, 小檗碱促进海马体的存活和神经元细胞的分化。在艾托酸注射引起的记忆受损大鼠模型中, 小檗碱给药大大增加了海马锥体细胞和粒状细胞的存活率。小檗碱促进SH-SY5Y神经元细胞系中的神经突生长和大鼠外周神经系统(PNS)中的轴突再生。小檗碱给药后能增强SH-SY5Y细胞的神经突延伸。另一项在大鼠坐骨神经损伤模型研究中, 通过免疫组化实验证实了小檗碱对髓鞘轴突具有再生作用。小檗碱给药也可以使髓鞘再生的轴突在损伤部位有一定程度的改善。综上所述, 小檗碱能够促进PNS受损神经的轴突延伸和轴突再生[35]。
小檗碱能激活大鼠海马BDNF-eEF2 (eukaryotic elongation factor 2, eEF2)通路, 调节额叶皮质环磷腺苷效应元件结合蛋白(cAMP responsive element- binding protein, CREB)信号通路, 对去卵巢导致的大鼠抑郁行为有改善作用, 而且其作用比五羟色胺再摄取抑制剂或去甲肾上腺素再摄取抑制剂要快2~4周。小檗碱能够抑制卵巢切除后大鼠海马和额叶皮质中原癌基因c-Fos的激活[36]。此外, 小檗碱能减轻由吗啡戒断引起的大鼠的抑郁和焦虑样行为, 使下丘脑中促肾上腺皮质激素释放因子(corticotrophin-releasing factor, CRF)和蓝斑中酪氨酸羟化酶(tyrosinehydroxylase, TH)的表达降低, 提高海马组织中BDNF mRNA的表达[37]。据报道, 小檗碱可以改善由外周皮质酮注射导致的小鼠抑郁样行为。给药后, 小檗碱使小鼠的糖水消耗增多, 强迫游泳不动时间降低, 还可以增加海马组织中BDNF mRNA和蛋白的表达水平, 降低血清中皮质酮含量[38]。
6 小结与展望小檗碱可以从多个方面对抑郁症起作用, 为小檗碱的临床应用提供理论依据。目前研究多局限于细胞水平及模型动物水平, 另外不同的刺激方式也会导致模型的个体差异。小檗碱无论从中医药理论推理还是现代研究都证实了与精神类疾病有着必然的联系。希望小檗碱的研究可以在临床抑郁症患者中取得突破, 并结合现代先进的基因组学、蛋白质组学、代谢组学技术进一步筛查作用靶点, 解决有效性、靶向性等问题。还可进一步在脑内神经元、胶质细胞、信号通路、神经可塑性、生物节律、认知抉择、记忆、神经网络信息学等方面进行更加深入的研究。另外, 目前临床用于诊断抑郁症的大多是抑郁量表, 尚缺乏明确的具有代表性的生物标志物, 这些研究仍需科研工作者共同努力。
| [1] | World Health Organization. The global burden of disease: estimates for 2000-2012: report of WHO Scientific Group[R]. Geneva: WHO, 1970. |
| [2] | Liu B, Liu J, Wang M, et al. From serotonin to neuroplasticity:evolvement of theories for major depressive disorder[J]. Front Cell Neurosci, 2017, 11: 305. |
| [3] | Vogelzangs N, Duivis HE, Beekman ATF, et al. Association of depressive disorders, depression characteristics and antidepressant medication with inflammation[J]. Transl Psychiatry, 2012, 2: e79. DOI:10.1038/tp.2012.8 |
| [4] | Vreeburg SA, Hoogendijk WJG, Pelt JV, et al. Major depressive disorder and hypothalamic-pituitary-adrenal axis activity:results from a large cohort study[J]. Arch Gen Psychiatry, 2009, 66: 617–626. DOI:10.1001/archgenpsychiatry.2009.50 |
| [5] | Molendijk ML, Bus BAA, Spinhoven P, et al. Serum levels of brain-derived neurotrophic factor in major depressive disorder:state-trait issues, clinical features and pharmacological treatment[J]. Mol Psychiatry, 2011, 16: 1088–1095. DOI:10.1038/mp.2010.98 |
| [6] | Timothy CBN, Gregory S, Kelly ND, et al. Berberine:therapeutic potential of an alkaloid found in several medicinal plants[J]. Altern Med Rev, 1997, 13: 94–103. |
| [7] | Li YX, Li RH. Study on anti-inflammatory activity of berberine[J]. Practl Pharm Clinl Remed (实用药物与临床), 2013, 16: 43–44. |
| [8] | Li Z. I. Study on the Signal Pathway of Berberine Upregulating the Expression of Low Density Lipoprotein Receptor mRNA in Liver Ⅱ. Effects of Berberine Analogue Y53 on Anti-inflammatory, Anti-Oxidation and Preventing DiabeticNephropathy in Diabetic Mice (Ⅰ.小檗碱上调肝脏低密度脂蛋白受体mRNA表达的信号通路研究Ⅱ.小檗碱类似物Y53在糖尿病小鼠体内抗炎、抗氧化和预防糖尿病肾病的作用研究)[D]. Beijing: Peking Union Medical College (北京协和医学院), 2016. |
| [9] | Dong SF. Effects and Mechanisms of Berberine on Experimental Diabetic Cardiomyopathy (小檗碱治疗实验性糖尿病心肌病作用和机制研究)[D]. Beijing: Beijing University of Chinese Medicine (北京中医药大学), 2011. http://cdmd.cnki.com.cn/Article/CDMD-10026-1011117572.htm |
| [10] | Wang Y. Inhibitory Effect of Berberine on Prostate Cancer and Its Mechanism (小檗碱对前列腺癌的抑制作用及其机制研究)[D]. Ji'nan: Shandong University (山东大学), 2011. http://cdmd.cnki.com.cn/Article/CDMD-10422-1012461375.htm |
| [11] | Tan XS, Ma JY, Feng R, et al. Tissue distribution of berberine and its metabolites after oral administration in rats[J]. PLoS One, 2013, 8: e77969. DOI:10.1371/journal.pone.0077969 |
| [12] | Wang XL, Wang RF, Xing DM, et al. Kinetic difference of berberine between hippocampus and plasma in rat after intravenous administration of Coptidisrhizoma extract[J]. Life Sci, 2005, 77: 3058–3067. DOI:10.1016/j.lfs.2005.02.033 |
| [13] | Ressler KJ, Nemeroff CB. Role of serotonergic and noradrenergic systems in the pathophysiology of depression and anxiety disorders[J]. Depress Anxiety, 2000, 12 Suppl 1: 2–19. |
| [14] | Kulkarni SK, Dhir A. On the mechanism of antidepressant-like action of berberine chloride[J]. Eur J Pharmacol, 2008, 589: 163–172. DOI:10.1016/j.ejphar.2008.05.043 |
| [15] | Hu Y, Ehli EA, Hudziak JJ, et al. Berberine and evodiamine influence serotonin transporter (5-HTT) expression via the 5-HTT-linked polymorphic region[J]. Pharmacogenomics J, 2012, 12: 372–378. DOI:10.1038/tpj.2011.24 |
| [16] | Wang K. Construction of Stable Expression hOCT2 Cell Model and the Role of OCT2 in Antidepressant Mechanism (稳定表达hOCT2细胞模型的构建及OCT2在抗抑郁机制中的作用)[D]. Hangzhou: Zhejiang University (浙江大学), 2014. http://cdmd.cnki.com.cn/Article/CDMD-10335-1014359350.htm |
| [17] | Sun S, Wang K, Lei H, et al. Inhibition of organic cation transporter 2 and 3 may be involved in the mechanism of the antidepressant-like action of berberine[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2014, 49: 1–6. DOI:10.1016/j.pnpbp.2013.11.005 |
| [18] | Peng WH, Lo KL, Lee YH, et al. Berberine produces antidepressant-like effects in the forced swim test and in the tail suspension test in mice[J]. Life Sci, 2007, 81: 933–938. DOI:10.1016/j.lfs.2007.08.003 |
| [19] | Martinez P, Lien L, Zemore S, et al. Circulating cytokine levels are associated with symptoms of depression and anxiety among people with alcohol and drug use disorders[J]. J Neuroimmunol, 2018, 318: 80–86. DOI:10.1016/j.jneuroim.2018.02.011 |
| [20] | Zhu S, Li L, Li Y, et al. Macrophage related cytokine expressions in depression mouse model induced by chronic unpredictable mild stress[J]. Pak J Pharm Sci, 2017, 30: 1951–1955. |
| [21] | Song C, Wang H. Cytokines mediated inflammation and decreased neurogenesis in animal models of depression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2011, 35: 760–768. DOI:10.1016/j.pnpbp.2010.06.020 |
| [22] | Oxenkrug GF. Genetic and hormonal regulation of tryptophan kynurenine metabolism:implications for vascular cognitive impairment, major depressive disorder, and aging[J]. Ann N Y Acad Sci, 2007, 1122: 35–49. DOI:10.1196/annals.1403.003 |
| [23] | Liu YM, Niu L, Wang LL, et al. Berberine attenuates depressive-like behaviors by suppressing neuro-inflammation in stressed mice[J]. Brain Res Bull, 2017, 134: 220–227. DOI:10.1016/j.brainresbull.2017.08.008 |
| [24] | Yu XZ, Liu J, Cheng LG, et al. Effect of berberine on inflammatory cytokine secretion and inflammatory signaling pathway in 3T3-L1 adipocytes[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2010, 26: 217–219. |
| [25] | Zhang Y, Liu L, Liu YZ, et al. NLRP3 inflammasome mediates chronic mild stress-induced depression in mice via neuroinflammation[J]. Int J Neuropsychopharmacol, 2015, 18: 1–8. |
| [26] | Guo Y. Study on the Mechanism of Acupuncture Regulating Active Oxygen Species-Mitochondrial Pathway-apoptosis in Hippocampus of Rats with Depression (针剌调控抑郁模型大鼠海马活性氧-线粒体途径-凋亡机制研究)[D]. Beijing: Beijing University of Chinese Medicine (北京中医药大学), 2016. http://cdmd.cnki.com.cn/Article/CDMD-10026-1016069050.htm |
| [27] | Ostadhadi S, Norouzi-Javidan A, Nikoui V, et al. Nitric oxide involvement in additive antidepressant-like effect of agmatine and lithium in mice forced swim test[J]. Psychiatry Res, 2018, 266: 262–268. DOI:10.1016/j.psychres.2018.03.010 |
| [28] | Cheng J, Dong SQ, Yi LT, et al. Magnolol abrogates chronic mild stress-induced depressive-like behaviors by inhibiting neuroinflammation and oxidative stress in the prefrontal cortex of mice[J]. Int Immunopharmacol, 2018, 59: 61–67. DOI:10.1016/j.intimp.2018.03.031 |
| [29] | Hsieh S, Kuo WH, Lin TW, et al. Protective effects of berberine against low-density lipoprotein (LDL) oxidation and oxidized LDL-induced cytotoxicity on endothelial cells[J]. J Agric Food Chem, 2007, 55: 10437–10445. DOI:10.1021/jf071868c |
| [30] | Jiang X, Liu J, Lin Q, et al. Proanthocyanidin prevents lipopolysaccharide-induced depressive-like behavior in mice via neuroinflammatory pathway[J]. Brain Res Bull, 2017, 135: 40–46. DOI:10.1016/j.brainresbull.2017.09.010 |
| [31] | Jeong HW, Hsu KC, Lee JW, et al. Berberine suppresses proinflammatory responses through AMPK activation in macrophages[J]. Am J Physiol Endocrinol Metab, 2009, 296: E955–E964. DOI:10.1152/ajpendo.90599.2008 |
| [32] | Hsu YY, Chen CS, Wu SN, et al. Berberine activates Nrf2 nuclear translocation and protects against oxidative damage via a phosphatidylinositol 3-kinase/Akt-dependent mechanism in NSC34 motor neuron-like cells[J]. Eur J Pharm Sci, 2012, 46: 415–425. DOI:10.1016/j.ejps.2012.03.004 |
| [33] | Li YF, Luo ZP. Depression:neuronal damage and neuronal regeneration disorder[J]. Acta Pharm Sin (药学学报), 2004, 39: 949–953. |
| [34] | Duman RS, Monteggia LM. A neurotrophic model for stress-related mood disorders[J]. Biol Psychiatry, 2006, 59: 1116–1127. DOI:10.1016/j.biopsych.2006.02.013 |
| [35] | Han AM, Heo H, Kwon YK. Berberine promotes axonal regeneration in injured nerves of the peripheral nervous system[J]. J Med Food, 2012, 15: 413–417. DOI:10.1089/jmf.2011.2029 |
| [36] | Fan J, Li B, Ge T, et al. Berberine produces antidepressant-like effects in ovariectomized mice[J]. Sci Rep, 2017, 7: 1310. DOI:10.1038/s41598-017-01035-5 |
| [37] | Lee B, Sur B, Yeom M, et al. Effect of berberine on depression-and anxiety-like behaviors and activation of the noradrenergic system induced by development of morphine dependence in rats[J]. Korean J Physiol Pharmacol, 2012, 16: 379–386. DOI:10.4196/kjpp.2012.16.6.379 |
| [38] | Shen JD, Ma LG, Hu CY, et al. Berberine up-regulates the BDNF expression in hippocampus and attenuates corticosterone-induced depressive-like behavior in mice[J]. Neurosci Lett, 2016, 614: 77–82. DOI:10.1016/j.neulet.2016.01.002 |
 2018, Vol. 53
2018, Vol. 53


