2. 南京中医药大学药学院, 江苏 南京 210029;
3. 黄山学院化学化工学院, 安徽 黄山 245041
2. College of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210029, China;
3. College of Chemistry and Chemical Engineering, Huangshan University, Huangshan 245041, China
赤芍为毛茛科植物芍药Paeonia lactiflora PalL.或川赤芍Paeonia veitchii Lynch的干燥根, 具有清热凉血、散瘀镇痛之功效[1]。现代临床研究表明, 赤芍萜苷是防治心血管疾病的药效物质基础, 主要包括芍药苷(paeoniflorin)、芍药内酯苷(albiflorin)、氧化芍药苷(oxypaeoniflorin)、苯甲酰芍药苷(benzoyl paeoniflorin)、没食子酰芍药苷(galloylpaeoniflorin)、和芍药新苷(lactiflorin)等[2], 具有稳定细胞膜、减少氧化损伤和抗细胞凋亡作用[3]。赤芍萜苷组分作为制剂原料, 合理的剂型设计必然离不开中药组分的性质表征。
中药组分构成复杂, 是通过多个活性成分与生物体靶蛋白结合, 产生协同或拮抗作用发挥药效, 若将所有的活性成分都纳入到组分性质表征中, 难度大且可行性差。若能甄选出代表组分整体药效的N个成分, 则可简化中药组分的性质表征。代表性成分的确定需要依据其活性与原提取物的生物活性相似。这就需要采用一些先进分析技术如虚拟计算等[4]对主要活性成分挖掘, 经过活性评估并确认获得。分子对接技术作为一种重要的计算机辅助手段, 是基于小分子配体与目标蛋白受体之间的“钥-锁原理”, 可用于研究靶蛋白受体和小分子配体之间的亲和力以及在空间、能量上的匹配情况, 实现中药药效物质基础的高效快速挖掘[5]。LibDock为常用的分子对接工具, 根据小分子构象与受体相互作用热区(hotspot)匹配的原理将这些构象对接到受体的结合口袋中, 优势在于易操作、速度快, 适合于中药活性成分的虚拟筛选。
本研究采用UPLC-TOF/MS/MS对赤芍萜苷组分的化学成分进行定性分析, 再将各成分与心肌缺血的关键受体蛋白进行分子对接, 依据Libdockscore分值、成分含量筛选主要活性成分。建立H9c2细胞缺氧损伤模型, 遵循组分各主要成分的量比关系, 构建不同成分组合并客观评价抗缺氧活性, 以此辨识能代表赤芍萜苷组分整体药效的N个成分。在此基础上, 进一步验证其对缺氧细胞凋亡的抑制作用, 最终确定赤芍萜苷组分的代表性成分, 以期能为赤芍萜苷组分的整体性质研究提供依据。
材料与方法试剂 溴化-3-(4, 5-二甲基-2-噻唑基)-2, 5-二苯基四氮唑(MTT, 批号20161107)、DMEM高糖培养基(批号20161226)、胰酶(批号20161104)、四季青胎牛血清(批号20160716)购自江苏凯基生物技术股份有限公司; 连二亚硫酸钠(Na2S2O4, 批号20160914, 国药集团化学试剂公司); 二甲基亚砜(DMSO, 批号1601252180, 南京化学试剂股份有限公司); 芍药内酯苷(纯度≥98%, 批号JZ16080402)、苯甲酰芍药苷(纯度≥98%, 批号JZ16011602)、氧化芍药苷(纯度≥98%, 批号JZ15120601)、赤芍萜苷组分(纯度≥50%, 批号JZ16011801)均购自南京景竹生物科技有限公司; 芍药苷(纯度≥98%, 批号1523046)、甲酸(色谱级)均购自上海阿拉丁生化科技股份有限公司; 肌酸激酶(CK)测试盒(批号20170511)、乳酸脱氢酶(LDH)测定试剂盒(批号20170413)、微量丙二醛(MDA)测试盒(批号20170311)、超氧化物歧化酶(SOD)试剂盒(批号20170415)均购于南京建成生物工程研究所; 抗体cleaved caspase-3 (9664)购于CST公司; Bcl-2 (12789-1-AP)购于武汉三鹰公司; Bax (ab182734)和β-actin (ab 8227)均购于Abcam公司; 乙腈(色谱纯, 美国Fisher公司); 水为纯化水; 其余试剂均为分析纯。
主要仪器 倒置显微镜(XDS-1B, 重庆光电仪器总公司); 低速离心机(Anke TDL-40B, 上海安亭科学仪器厂); 高速冷冻离心机(美国Beckman公司); 全自动酶标仪(Spectra, max190, Molecular Devices); Triple Q-TOF 5600质谱仪(AB Sciex公司); LC-20AD型高效液相色谱仪(日本岛津公司)。
赤芍萜苷组分的成分定性分析 ①色谱条件: WelchromTM C18色谱柱(100 mm × 4.6 mm, 5 μm); 流动相0.1%甲酸(A)-乙腈(B), 梯度洗脱, 0~5 min, 2%~8% A; 5~30 min, 8%~20% A; 30~45 min, 20%~35% A; 45~60 min, 35~60% A; 60~65 min, 60%~100% A。流速0.4 mL·min-1, 柱温30 ℃[6]。②质谱条件:采用TOF MS-IDA-MS/MS模式, 负离子检测模式, 喷雾电压5 500 eV, 离子源温度(TEM) 550 ℃, 气帘气(CUR N2) 40 psi (1 psi = 6.895 kPa), 雾化气(GS1 N2) 60 psi, 辅助气(GS2 N2) 60 psi, 去簇电压(DP) 70 eV, TOF MS扫描范围m/z: 50~ 1 500。IDA条件下设置:碰撞电压(CE) 35 eV, 碰撞电压差(CES) 10 eV, 开启动态背景扣除[7]。取适量浓度的赤芍萜苷溶液, 12 000 r·min-1离心10 min, 利用UPLC-TOF/MS/MS对上清液进行分析, 以Analyst TF 1.6软件采集数据, 通过PeakView 1.2.1软件进行峰提取, 负离子模式下提取[M+HCOO]-分子离子峰, 通过离子碎片质荷比m/z解析(信号强度/总信号强度 > 0.1%, 且测定误差ppm绝对值< 10 ppm, 对色谱峰进行筛选和鉴定。
分子对接虚拟筛选赤芍萜苷组分的活性成分 ①心肌缺血相关靶基因的搜集:从CTD数据库(http://ctdbase.org/)中选择与心肌缺血(myocardial ischemia)有关的基因。利用该数据库的检索功能, 在“Diseases”中输入“myocardial ischemia”, 点击“Gene”项, 即找出与心肌缺血相关联的所有基因, 筛选“Direct Evidence”栏下标记为“M (marker/ mechanism)”和“T (therapeutic)”获得经被实验或临床证实的相关靶基因; 对“Inference Score”进行降序排列, 确定分值前5%的若干个靶基因为研究对象, 输入到Drug-Bank数据库, 筛选具有上市小分子药物的目标基因[8]。②蛋白受体晶体结构的确定:优先选择含活性配体且分辨率较高的人源蛋白晶体结构, 晶体结构通过PDB数据库(http://www.rcsb.org/pdb/home/home.do)获得, 确定研究靶蛋白, 再将靶蛋白导入Discovery Studio中, 补全不完整残基、删去配体分子和水分子、加氢和删除蛋白质变体等[9]。③蛋白受体活性位点的确定:蛋白质晶体结构含有原配体, 以该配体位置为中心再向外扩张一定的范围, 其中受体残基就是相关的活性位点[10]。④分子对接可靠性验证:在赤芍萜苷化学成分与靶蛋白受体分子对接之前, 需要对分子对接的精度及可靠性进行考察。靶蛋白含有原配体时, 先将配体删除, 再将其对接到原活性位点, 若两次配体构象的均方根偏差值(RMSD)≤2.0×10-10, 即可证实该对接方法的可靠性及对接参数的合理性[11]。⑤赤芍萜苷的分子对接:将14个候选成分与受体蛋白导入Discovery Studio 2.5中, 将小分子进行能量优化, 利用LibDock进行分子对接, 具体对接流程如下:从活性位点定义Sphere球, 修改活性部位球半径为9;在Protocols中展开Receptor-Ligand Interactions文件夹, 双击Dock Ligands (LibDock), 设置受体、配体和sphere坐标, Max Hits to Save设为“10”, 其余参数均为默认值。以14个候选成分的平均对接得分为阈值, 得分高于此阈值的化学成分被认为是赤芍萜苷治疗心肌缺血的主要活性成分[12]。
赤芍萜苷组分主要活性成分的含量测定 采用Agilent TC-C18色谱柱(250 mm × 4.6 mm, 5 μm), 以1%甲酸(A)-乙腈(B)为流动相, 梯度洗脱(0~25 min, 90%~82% A; 25~65 min, 82%~50% A, 流速1.0 mL·min-1, 柱温30 ℃, 检测波长230 nm。
基于缺氧H9c2细胞模型的代表性成分辨识 ① H9c2心肌细胞, 购于中国科学院上海细胞资源中心。H9c2细胞的培养:将快速解冻的H9c2细胞, 迅速转移至已添加5.0 mL DMEM不完全高糖培养基(含10% FBS)的15 mL离心管中, 吹打均匀后, 离心(2 000 r·min-1, 2 min), 吸除培养基, 再加DMEM不完全高糖培养基5.0 mL, 吹打均匀后转移至T-25培养瓶中, 置37 ℃、5% CO2培养箱, 隔天换培养基, 细胞长至80%~90%传代。②赤芍萜苷给药浓度的筛选:取状态良好的H9c2细胞, 加培养基吹打均匀成每毫升1×106个细胞混悬液, 以每孔100 μL接种于96孔板中, 于37 ℃、5% CO2的环境下培养24 h, 吸除培养基, 加入空白培养基或浓度为1 600、800、400、200、100、50、25、12.5和6.25 μg·mL-1的赤芍萜苷100 μL, 继续培养24 h后, 弃去培养基, 每孔加0.5 mg·mL-1 MTT溶液100 μL, 继续培养4 h, 弃去孵育液, 再加入DMSO 100 μL, 37 ℃恒温摇床振荡10 min后, 利用酶标仪570 nm处测定各孔吸光度(OD), 计算各组细胞存活率(%), 选择存活率(%) ≥95%的最高浓度, 为赤芍萜苷的给药浓度[13]。③不同的活性成分构成对H9c2细胞缺氧损伤的影响:遵循组分中各成分的比例关系, 研究各成分组合对Na2S2O4诱导H9c2细胞影响, 以此辨识与赤芍萜苷组分整体药效无统计学差异的N个成分作为代表性成分。取状态良好的H9c2细胞, 接种于6孔板中, 培养24 h后, 分成12组, 分别为空白组、模型组(4 mmol·L-1 Na2S2O4)、200 μg·mL-1赤芍萜苷组、67.6 μg·mL-1芍药苷(a)组、42.3 μg·mL-1芍药内酯苷(b)组、3.8 μg·mL-1苯甲酰芍药苷(c)组、7.0 μg·mL-1氧化芍药苷(d)组、a+b成分组、a+c成分组、b+c成分组、a+b+c成分组和a+b+c+d成分组, 继续培养24 h后, 吸弃孔内培养液, 空白组加入空白培养基2.0 mL, 其余各组加入4 mmol·L-1 Na2S2O4 2.0 mL后, 继续培养24 h, 利用倒置显微镜观察各组H9c2细胞的形态。再吸取孔内培养液, 分别收集于4 mL离心管中, 3 000 r·min-1离心10 min, 取上清液, 按试剂盒说明书测定CK、LDH、SOD活力和MDA含量。
赤芍萜苷组分代表性成分抗缺血缺氧损伤作用的验证 ①凋亡指数的测定:利用结合缓冲液吹打成每毫升1×106个细胞悬浮液, 吸取100 μL, 加入Annexin V-FITC 5 μL和碘化丙啶10 μL, 避光室温反应15 min后, 滴加结合缓冲液150 μL, 并在1 h内利用流式细胞仪进行检测(激发波长488 nm, 发射波长530 nm), 利用BD FACS软件计数, 计算各组H9c2细胞的凋亡指数。②凋亡蛋白的表达:细胞收集后, 用预冷的PBS润洗2次, 于冰浴上用RIPA裂解液提取细胞蛋白质, 13 000 r·min-1离心10 min, 收集上清液; 利用BCA蛋白测定试剂盒, 考马斯亮蓝测定蛋白浓度; 取50 μg蛋白上样SDS-PAG凝胶, 经电泳后转至PVDF膜, 5%脱脂奶粉封闭2 h后, 再分别与cleaved caspase-3、Bax和Bcl-2抗体(1:500稀释), 4 ℃孵育过夜。β-actin作为内标, TBST漂洗3次, 加二抗(辣根过氧化物酶标记抗体), 室温下孵育2 h, TBST洗涤3次, 加ECL发光试剂孵育1 min, 于暗室将膜曝光并显影洗像, 利用图像分析软件Image Pro Plus (IPP 6.0, Media Cybernetics, USA)进行灰度扫描, 计算capase-3、Bax、Bcl-2与β-actin的OD比值, 代表其各蛋白的相对表达量。③线粒体mRNA的表达:按抽提纯化方法从H9c2细胞中提取总RNA, 并测定纯度和浓度。取各组RNA 2 μg、50 μmol·L-1 OligodT(18) 2 μL, 加DEPC水至12.5 μL, 65 ℃保温5 min, 冰浴5 min, 再依次加入RNase抑制剂0.5 μL, 反应缓冲液(5×) 4.0 μL, 10 mmol·L-1 dNTPS 2.0 μL和M-MuLV 1.0 μL, 混匀, 2 000 r·min-1离心20 s, 42 ℃保温1 h, 70 ℃保温10 min, 冰浴5 min, 合成cDNA第1链后, 利用Real-Time PCR检测Ndufa4和Ndufa8。
统计学处理 实验过程中所有数据均采用SPSS 16.0进行处理, 并且各组间数据比较采用t检验, 用x± s表示。P < 0.05和P < 0.01分别表示组间有显著性差异和极显著性差异。
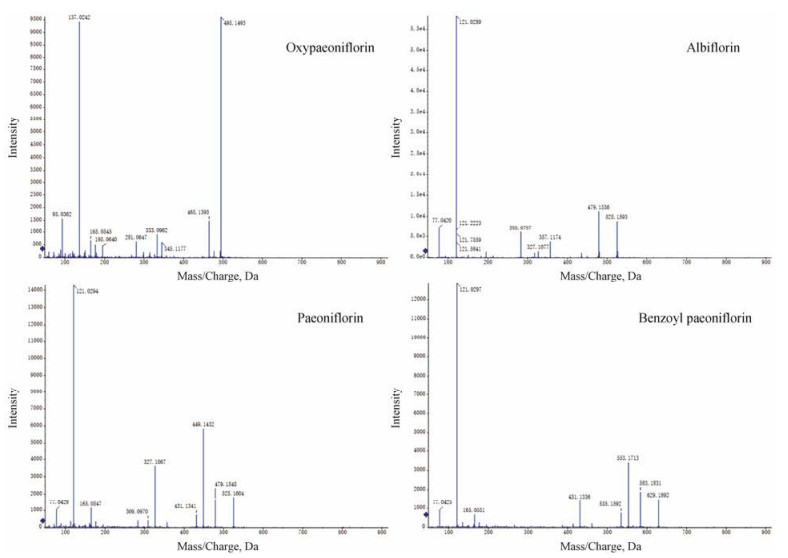
结果 1 赤芍萜苷组分的活性成分辨识赤芍萜苷的定性分析:利用UPLC-TOF-MS负离子模式, 测定分子离子峰[M+HCOO]-的质荷比m/z, 获得测定误差绝对值< 10 ppm的分子离子峰14个, 分别是芍药苷、芍药内酯苷、苯甲酰芍药苷、氧化芍药苷、芍药新苷、没食子酰基芍药苷、没食子酸乙酯(progallin A)、芍药花苷(paeonin b)、4-O-没食子酰基芍药内酯苷(4-O-galloylalbiflorin)、水杨酸(salicylic acid)、4-O-没食子酰基芍药内酯苷元(4-O-galloylalbiflorin_qt)、蔗糖(sucrose)、1-O-β-d-glucopyranosyl- 8-O-benzoylpaeonisuffrone和11α, 12α-epoxy-3β, 23- dihydroxy-30-norolean-20-en-28, 13β-olide, 详见表 1, 赤芍萜苷组分主要成分的质谱信息见图 1。
| Table 1 Composition matching results of Chishao terpene glucoside components (CSTGCS) in UPLC-TOF-MS negative ion mode |
|
Figure 1 Mass spectrogram of the main components of CSTGCS1 |
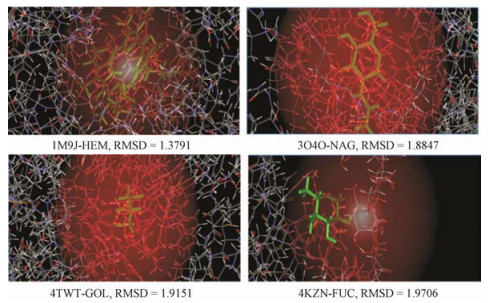
分子对接辅助辨识活性成分:选择“Inference Score”值前5%的9个靶基因TNF、IL6、AGT、NPPA、EDN1、IL1B、NOS3、NFKBIA和VEGFA, 输入到Drug-Bank数据库(http://www.drugbank.ca/)中, 筛选出4个已知上市小分子药物作用的基因, 分别为TNF、IL1B、NOS3和VEGFA。优先选择复合激动活性配体且分辨率较高的人源受体晶体结构, 确定肿瘤坏死因子(4TWT)、白介素-1β (3O4O)、血管内皮生长因子A (4KZN)和一氧化氮合成酶3 (1M9J)等4个配体-受体复合物作为研究蛋白载体。通过计算比较, 确定1M9J (HEM)、3O4O (NAG)、4TWT (GOL)和4KZN (FUC)等4个活性位点坐标(X、Y、Z轴)分别为(14.621、10.629、54.33)、(6.22、-5.265、4.546)、(-10.293、102.897、252.147)和(11.614、-3.171、21.23)。1M9J、3O4O、4TWT、4KZN的晶体结构中含有的原始配体HEM、NAG、GOL和FUC, 采用LibDock对接得到的配体构象(灰色部分)与原配体的构象(绿色部分)能够较好地重合, 两者之间RMSD值分别为1.37、1.88、1.91和1.97, 说明这4个靶点的对接方法可靠准确(图 2)。
|
Figure 2 Verification of target protein molecular docking methods |
将赤芍萜苷中的14个成分与4TWT、3O4O、4KZN和1M9J进行对接, 得分列于表 2中, 得出Libdockscore分值大于各平均值的有芍药苷、芍药内酯苷、苯甲酰芍药苷、氧化芍药苷、芍药新苷、没食子酰基芍药苷、4-O-没食子酰基芍药内酯苷和4-O-没食子酰基芍药内酯苷元, 这些是赤芍萜苷组分抗缺血缺氧损伤的活性成分。
| Table 2 Docking scores for 14 components with various target protein receptors |
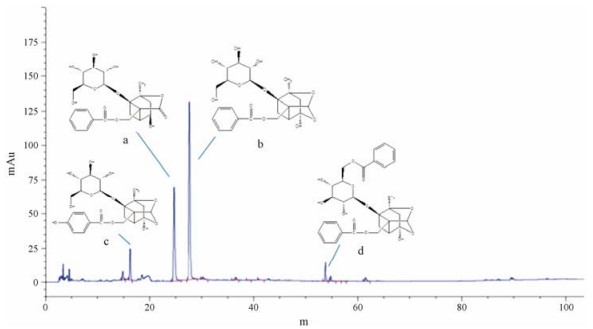
主要活性成分的含量测定:芍药苷、芍药内酯苷、苯甲酰芍药苷和氧化芍药苷的标准曲线回归方程分别为Y = 1 703.2 X - 25.742 (R2 = 0.999 4)、Y = 622.91 X - 12.323 (R2 = 0.999 5)、Y = 1 596.2 X + 2.712 2 (R2 = 0.999 9)和Y = 1 933.4 X + 7.616 (R2 = 0.999 5), 线性范围分别为0.076 2~1.219 2、0.232 0~0.696 0、0.030 5~0.305 0和0.032 6~0.521 6 μg; 芍药苷加样回收率为101.44%, RSD为2.43%;芍药内酯苷的加样回收率为100.35%, RSD为2.14%;苯甲酰芍药苷的加样回收率为101.17%, RSD为2.74 %; 氧化芍药苷的加样回收率为99.53%, RSD为2.91%。经HPLC测定(图 3), 测得赤芍萜苷组分中芍药苷含量为338.2 mg·g-1、芍药内酯苷含量为211.4 mg·g-1、苯甲酰芍药苷含量为19.12 mg·g-1和氧化芍药苷含量为35.1 mg·g-1, 芍药苷、芍药内酯苷、苯甲酰芍药苷、氧化芍药苷4个成分的量比关系为17.69/11.14/1.0/1.83, 其他成分含量都低于1.0 mg·g-1。因此, 确定芍药苷、芍药内酯苷、苯甲酰芍药苷和氧化芍药苷为主要活性成分。
|
Figure 3 HPLC chromatogram of CSTGCS. a, b, c, d respectively represent paeoniflorin, albiflorin, benzoyl glucoside and oxypaeoniflorin |
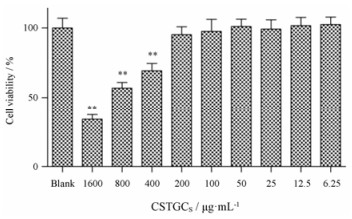
赤芍萜苷组分代表性成分辨识:与药物共孵育24 h后, 若细胞存活率大于95%时, 则认为该药物没有明显细胞毒性。H9c2细胞的赤芍萜苷给药浓度考察结果见图 4。当质量浓度为200、100、50、25、12.5和6.25 μg·mL-1时(以萜苷组分重量计), H9c2细胞存活率都高于95%;当质量浓度为400 μg·mL-1时, H9c2细胞存活率低于95%, 且随浓度增加, 细胞存活率逐渐降低, 故选择200 μg·mL-1赤芍萜苷培养液(含芍药苷67.6 μg·mL-1、芍药内酯苷42.3 μg·mL-1、苯甲酰芍药苷3.8 μg·mL-1和氧化芍药苷7.0 μg·mL-1)。
|
Figure 4 Effect of CSTGCS concentration on H9c2 cell viability. n = 3, x± s. **P < 0.01 vs blank group |
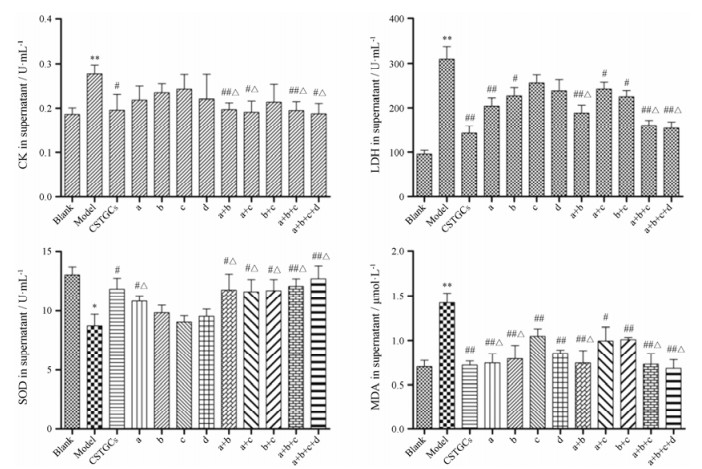
对各组H9c2细胞形态观察发现, 在空白组中, H9c2细胞贴壁生长, 细胞呈梭形, 且界限清晰、排列规整, 有少数细胞变圆现象, 可能是由于连续2天给予空白培养基, 缺少营养造成的; 当Na2S2O4刺激后, 细胞数明显减少, 且排列散乱, 说明缺氧环境对细胞损伤作用明显; 赤芍萜苷和各代表性成分组均能不同程度地缓解细胞数的降低, 减少缺氧对细胞形态的改变。不同代表性成分组合对心肌酶和过氧化物酶的测定结果见图 5, 赤芍萜苷组分及成分组合对Na2S2O4诱导H9c2细胞的过氧化物酶具有一定调节作用。被Na2S2O4刺激后, 细胞SOD活性降低, 萜苷组分、成分a、a+b、a+c、b+c、a+b+c、a+b+c+d均能显著提高SOD活力(P < 0.05, P < 0.01);与空白组相比, 模型组MDA显著增加(P < 0.01), 但给予赤芍成分或不同组合后, 各组都有极显著的降低(P < 0.05, P < 0.01);在调控CK、LDH活力方面, 模型组细胞的CK、LDH活力显著增强(P < 0.01), 用赤芍成分或组合成分干预后, 赤芍萜苷组分、a、b、a+b、a+c、b+c、a+b+c、a+b+c+d对LDH有显著的改善作用(P < 0.05, P < 0.01), 同时赤芍萜苷组分、a+b、a+c、a+b+c、a+b+c+d对CK均有明显的改善作用(P < 0.05, P < 0.01)。综上, 成分a+b+c、a+b+c+d都能很好地代表赤芍萜苷的抗缺氧损伤作用, 考虑成分的简约性, 确定成分a+b+c、即芍药苷、芍药内酯苷和苯甲酰芍药苷作为赤芍萜苷的代表性成分。
|
Figure 5 Effects of CSTGCS and different component compositions on creatine kinase (CK), lactic acid dehydrogenase (LDH), superoxide dismutase (SOD) and malondialdehyde (MDA) in H9c2 cells. n = 3, x± s. *P < 0.05, **P < 0.01 vs blank group; #P < 0.05, ##P < 0.01 vs model group; △P < 0.05 vs CSTGCS |
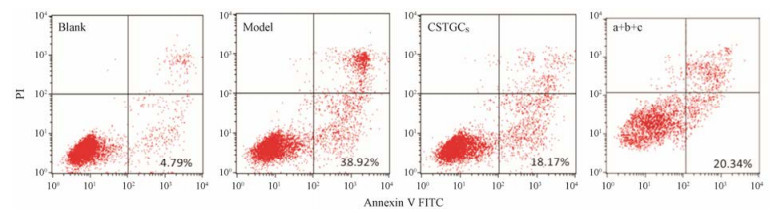
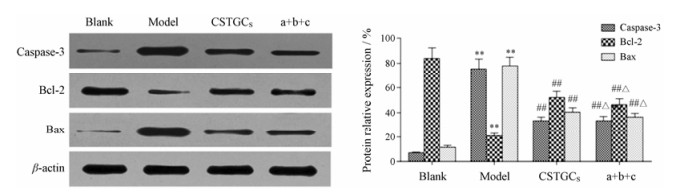
各组细胞凋亡指数结果(图 6)显示, Na2S2O4诱导能显著诱导H9c2细胞凋亡, 凋亡率从正常细胞的(4.79 ± 0.37) %升高至(38.92 ± 3.25) %, 赤芍萜苷或代表性成分a+b+c都能显著减少H9c2细胞损伤, 凋亡率分别降低至(18.17 ± 1.13) %和(20.34 ± 1.18) %, 说明赤芍萜苷和代表性成分a+b+c都能明显抑制缺氧损伤引导的细胞凋亡, 且两组对H9c2细胞凋亡的抑制作用没有显著性差异。进一步以Western blot测定与凋亡相关蛋白表达水平(图 7), 与空白组相比, 模型组中H9c2细胞中Bax和caspase-3蛋白表达显著增强(P < 0.01), 而Bcl-2蛋白表达显著降低(P < 0.01), 说明Na2S2O4促进了H9c2细胞的凋亡; 在给予赤芍萜苷和代表性成分a+b+c组, 促凋亡蛋白Bax和caspase-3表达被显著降低(P < 0.01), 而抗凋亡蛋白Bcl-2蛋白表达被显著增加(P < 0.01);重要的是, 赤芍萜苷和代表性成分a+b+c两组之间无统计学差异。
|
Figure 6 Analysis of apoptosis index of H9c2 cells in each group |
|
Figure 7 Effect of CSTGCS and representative component a+b+c on apoptotic proteins in hypoxic H9c2 cells. n = 3, x± s. **P < 0.01 vs blank group; ##P < 0.01 vs model group; △P < 0.05 vs CSTGCS |
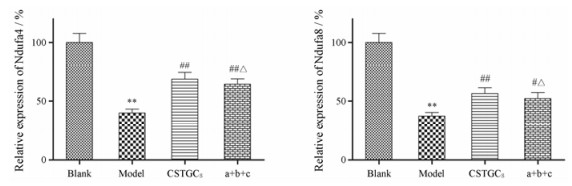
Na2S2O4模型组H9c2细胞Ndufa4、Ndufa8 mRNA表达明显下降(P < 0.01), 见图 8, 但是赤芍萜苷和代表性成分a+b+c都能显著提高Ndufa4、Ndufa8 mRNA表达水平, 且两组之间无显著性差异。结果表明, 赤芍萜苷组或代表性成分组可上调线粒体相关基因表达水平, 减轻Na2S2O4引起的氧化应激损伤。
|
Figure 8 Effect of CSTGCS and representative component a+b+c on Ndufa4 and Ndufa8 mRNA expression in H9c2 cells. n = 3, x± s. **P < 0.01 vs blank group; #P < 0.05, ##P < 0.01 vs model group; △P < 0.05 vs CSTGCS |
中药组分是一个有序整体, 研究模式是一个系统-还原-系统的过程, 分为化整为个, 化个为整的两个层面。中药组分作为具有特定结构特征的制剂原料, 是现代中药制剂研究中最常规的基本单元。科学合理的辨识体现中药组分整体特性的N个代表性成分, 或许是现代中药制剂处方前研究的关键内容。中药组分的代表性成分与刘昌孝院士提出“中药质量标志物(Q-marker)[14]”有相似的理论内涵, 都指最能代表中药组分安全性、有效性的化学成分群, 但研究落脚点存在不同, 前者落脚于中药制剂上, 后者更多体现在质量控制的范畴。因此, 对于中药组分的制剂前研究, 代表性成分的辨识是亟待解决的问题。
本文通过分子对接辅助挖掘, 得到赤芍萜苷组分的主要活性成分为芍药苷、芍药内酯苷、氧化芍药苷和苯甲酰芍药苷, 含量分别为33.82%、21.14%、1.91%和3.51%, 总质量占萜苷组分整体的60.38%, 但是否能够代表萜苷组分防治心肌缺血的整体药效呢?利用细胞实验进行了初步评价, 通过MTT法筛选赤芍萜苷质量浓度为200 μg·mL-1, 并遵循组分中各成分量比关系, 通过配伍组合, 以CK、LDH、SOD和MDA为评价指标, 辨识发现芍药苷+芍药内酯苷+苯甲酰芍药苷为赤芍萜苷组分的代表性成分。考虑细胞凋亡是心肌缺血缺氧损伤的重要机制, 继而对细胞凋亡指数、凋亡相关蛋白Bax、Bcl-2、caspase-3和线粒体功能相关Ndufa4、Ndufa8 mRNA表达进行考察, 发现成分a+b+c具有维持线粒体正常功能、抑制细胞凋亡的作用, 并且与赤芍萜苷组分的整体效果无统计学差异。
H9c2细胞缺氧后, 能量代谢发生障碍, Na+-K+- ATP酶、Mg2+-ATP酶等可将ATP催化水解, 释放能量的同时, 环境pH降低, 导致SOD活性降低; 蓄积的氧自由基与膜脂质反应产生过氧化物MDA, 进一步损伤细胞至破裂, CK和LDH等心肌酶泄露。Na2S2O4对心肌细胞线粒体结构产生严重的破坏作用, 可能与活性氧自由基失衡等因素有关, 而赤芍萜苷组分及代表性成分a+b+c的保护作用可能是通过增加SOD等过氧化物酶、减少MDA等过氧化物有关。研究结果显示, 赤芍萜苷和代表性成分a+b+c两组之间无统计学差异。由此可见, 芍药苷+芍药内酯苷+苯甲酰芍药苷可作为赤芍萜苷组分抗缺血缺氧损伤的代表性成分, 用于后续的中药组分整体生物药剂学性质表征。
| [1] | Pharmacopoeia Commission of the Ministry of Health. Chinese Pharmacopoeia[S]. Beijing: China Medical Science and Technology Press, 2015. |
| [2] | Zou ZM, Xu LZ, Yang SL. HPLC fingerprinting of total glucosides of paeony[J]. Acta Pharm Sin (药学学报), 2003, 38: 46–49. |
| [3] | Xu XY, Wang W, Wang L, et al. Intervention of paeoniflorin on isoproterenol-induced myocardial remodeling in rats[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2017, 31: 485. |
| [4] | Tumer TB, Onder FC, Ipek H, et al. Biological evaluation and molecular docking studies of nitro benzamide derivatives with respect to in vitro anti-inflammatory activity[J]. Int Immunopharmacol, 2017, 43: 129–139. DOI:10.1016/j.intimp.2016.12.009 |
| [5] | Du YF, Zhang XH, Ye XY, et al. Screening and mechanism analysis of anti-aging active ingredients based on molecular docking[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2522–2526. |
| [6] | Lian HY, Xu WYJ, Liang GD, et al. Comparison of chemical constituents between Radix Paeoniae Rubra and Radix Paeoniae Alba by UPLC-QTOF MS method[J]. J Chin Mass Spectrom Soc (质谱学报), 2014, 35: 269–278. |
| [7] | Cui XB, Shan CX, Wen HM, et al. Analysis of the material basis of bran-whitening based on UFLC/Q-TOF-MS[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 1929–1933. |
| [8] | Du YF, Zhang XH, Ye XY, et al. Screening and mechanism of anti-aging active ingredients based on molecular docking[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2522–2526. |
| [9] | Yan YW, Xu PP, Huang XA, et al. Basic research on anti-influenza substances of Radix Paeoniae Alba based on computer virtual screening[J]. Chin Med Mat (中药材), 2017, 40: 430–435. |
| [10] | Jhong CH, Riyaphan J, Lin SH, et al. Screening alpha-glucosidase and alpha-amylase inhibitors from natural compounds by molecular docking in silico[J]. Biofactors, 2015, 41: 242–251. DOI:10.1002/biof.v41.4 |
| [11] | Song XG, Zhou W, Chen C, et al. The material basis and molecular mechanism of Chuanxiong for cerebral ischemia based on molecular docking method[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 2195–2198. |
| [12] | Dash R, Uddin M, Hosen S, et al. Molecular docking analysis of known flavonoids as duel COX-2 inhibitors in the context of cancer[J]. Bioinformation, 2015, 11: 543–549. DOI:10.6026/bioinformation |
| [13] | Sun N, Xu G, Zhang F, et al. Protective effects of Sijunzi Decoction (Shengshen Shen/Red Ginseng) on H2c2 induced H9c2 cardiomyocyte apoptosis[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 1989–1993. |
| [14] | Liu CX, Chen SL, Xiao XH, et al. Q-Marker:a new concept of quality control of traditional Chinese medicine products[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1443–1457. |
 2018, Vol. 53
2018, Vol. 53


