2. 南京中医药大学, 江苏 南京 210023
2. Nanjing University of Chinese Medicine, Nanjing 210023, China
中药制剂原料前处理是中药剂型发展的重要组成部分。纵观中药制剂的发展历程, 分析中药前处理过程技术特征, 可分为直接粉碎或初步提取、粗放提取或初步除杂、精制纯化3个阶段(图 1)。在中药制剂形成过程中, 首先由于技术手段的限制, 形成了以粉碎、煎煮、浸泡为前处理的丸、散、膏、丹等第一代中药制剂, 具有粗大黑、药物分子混合释放等特点。随着中药制剂技术及提取分离技术的发展, 形成了以提取、除杂为前处理的中药片剂、颗粒剂、胶囊剂、注射剂等第二代中药制剂, 但由于中药成分的复杂性及提取、纯化、制剂技术水平的限制致使第二代中药制剂仍存在提取粗放、物质基础不明、无序释药和口服用量大等问题。膜分离技术、色谱技术等精制纯化新技术快速发展、各学科间高度融合, 分子生物学、网络药理学及各种组学技术等在中药研究领域的渗透, 使快速分离、纯化、富集、分析、表征和辨识筛选中药活性组分/成分成为可能。因此, 中药制剂前处理技术逐渐从简单的粉碎、提取向分离、纯化、精制发展, 为组分的获取提供一定的技术支撑。另外, 随着研究的不断深入, 中药物质组分逐渐清楚, 临床疗效趋向明确, 为组分制剂的发展提供坚实的基础。

|
Figure 1 Developing process for Chinese medicines preparations |
本课题组在既往中药组分相关研究的基础上, 结合自身的研究工作, 创新性地提出了“组分结构”理论, 认为通过科学化的剂型设计, 采用组分制剂技术, 可在一定程度上改善组分的生物利用度, 提高其临床疗效, 对促进中药现代化及国际化具有重要意义。考虑到中药成分的复杂性及中药药效的多样性, 尤其是中药复方、化学药物制剂所采用的研究方法不宜生搬硬套地应用到组分制剂的研究中。目前, 组分制剂的研究尚未形成一套完整的理论及技术体系, 即仍存在未解决的科学关键问题——基于组分性质的中药释药系统设计理论及其相关技术。对于基于组分性质的中药释药系统设计理论及其相关技术, 主要分为以下三点:第一, 组分制备及其表征技术; 第二, 基于组分性质的组分制剂单元设计理论与技术基础; 第三, 体现中医药整体观的结合组分性质的中药释药系统设计理论与技术基础。基于以上组分制剂的关键科学问题, 本文将着重探讨组分性质及其表征技术、组分释药单元设计、多元释药系统的构建方法及思路, 以期阐明组分制剂技术基础与关键问题, 抛砖引玉, 为相关研究者带来一定的启发及思考。
1 中药物质基础“组分结构”理论的科学内涵与中药组分自从中药组分出现以来, 涌现出众多的中药组分的新名称, 中药组分的概念呈现各说各家的多样化发展趋势, 那么中药组分的真正意义与内涵是什么呢?
“中医传药不传量”或“中医不传之秘在于量”的认识表明组成复方的各单味药之间的量及量关系是防病治病的关键, 那么组分作为中药物质基础基本单元, 组分内/组分间也必然存在着复杂的量比关系。组分内/组分间复杂的量比关系即为“组分结构”[1], 本课题组提出的“组分结构”理论[2]明确指出组分具有稳定的三维结构, 第一维是成分明确的单体; 第二维是具有相同母核结构的成分构成的组分, 组分内各成分存在一定的量比关系; 第三维是多组分按照一定的量比关系构成的整体[3]。在“组分结构”理论的基础上, 本课题组认为中药组分应是由同一类别成分按照一定的比例有机组合形成的具有完整“结构”和特异药理活性的单元, 包含几个或数十个已知或未知的化学成分, 可反映中药整体效应。
在中医药君臣佐使及辨证论治的基本思想上, 需重点开展组分间/组分内量比关系与生物效应关系的研究, 从单一成分的量-效关系丰富为可代表整个中药物质基础的多维结构的质-效关系, 从而打破传统的有效成分的定义, 为阐明中药多成分物质基础提供了可能, 有可能成为实现中药制剂现代化及国际化的突破口。
2 中药组分性质及表征组分作为第三代中药制剂的原料, 其性质(图 2)有别于传统的中药粉末及中药提取物。组分性质及表征是组分制剂技术研究的核心, 更是单元制剂技术及组分多元释药系统构建的重要基础。
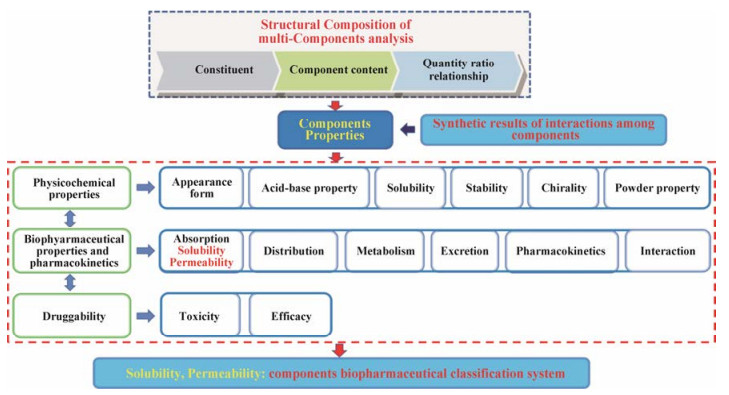
|
Figure 2 Components properties |
组分构成、组分内各要素的量及各要素间的量比关系是决定组分性质的基础, 故组分结构特征解析是组分性质及其表征的前提。在对组分结构进行解析时, 可采用高效液相、气相、液质联用及气质联用等现代分析手段, 明确组分构成, 分析组分内各要素的量及各要素间的量比关系。本课题组采用高效液相对赤芍萜苷组分进行结构解析时, 发现赤芍萜苷组分主要由芍药苷、芍药内酯苷、苯甲酰芍药苷及氧化芍药苷4种成分组成, 其中芍药苷的含量为33.8%, 芍药内酯苷含量为21.1%, 苯甲酰芍药苷含量为1.9%, 氧化芍药苷含量为3.5%, 4种成分的比例关系为17.7:11.1:1.0:1.8, 总质量占萜苷组分整体的60.38%[4]。
2.2 理化性质 2.2.1 外观性状不同的中药组分由于具有不同的化学组成, 故其形态、颜色及气味不同。中药组分是由具有相同或相似的母核结构的化学成分经精制纯化后的产物, 故组分形态是各成分在原有形态的基础上经成分间相互作用产生的综合结果, 其最终形态可能为结晶、非结晶, 亦或呈现出玻璃态、胶态及液态等不同的相态。而对于母核结构上具有较多助色团的组分则可呈现出一定的颜色, 且随着助色团的增加, 颜色逐渐加深, 如蒽醌组分由于母核上酚羟基等助色团的引入及共轭结构的存在, 使其呈现出黄、橙、棕红甚至紫红色。组分的气味主要由组分内挥发性成分产生, 是多种挥发性成分气味的叠加, 一般呈现出较为强烈的芳香气味, 如挥发油组分。
2.2.2 酸碱性对于中药组分而言, 酸碱性是部分组分固有的理化性质, 如生物碱组分主要由一系列含氮化合物组成, 具有碱性, 能与酸结合成盐类物质, 而醌类组分由一系列具有醌式结构的化合物组成, 多具有酚羟基, 具有一定的酸性。除醌类组分具有一定的酸性外, 黄酮类化合物也多具有酚羟基, 显酸性。具有不同酸碱性的中药组分, 在不同pH条件下, 解离程度不同[5], 其稳定性及其在机体的吸收、分布和排泄等过程也不同, 如不同酸碱性的组分具有不同组织分布倾向, 酸性组分常与血浆蛋白高度结合, 而亲脂碱性组分则倾向于储存在富含酸性磷脂的组织和酸性细胞器中[6]。故在组分制剂过程中应充分考虑酸碱性组分在不同pH条件下的解离程度及其组织分布特性, 合理选择制剂辅料及制剂技术。
2.2.3 溶解性组分的溶解性指组分溶解于分散介质中游离出组成成分的能力, 组分的溶解性与其介质有关, 同一组分在不同的介质中溶解性不同。对于口服给药方式而言, 组分溶解于胃肠道消化液并游离出药效成分是组分吸收的第一步, 若组分在胃肠道中的溶解性差, 则直接影响组分的吸收, 进而影响其临床疗效。组分体外溶解性考察是评价组分溶解性的主要方法, 常以水溶性及脂溶性表示, 一般认为极性较大的组分水溶性较好, 如多糖类组分、黄酮苷和蒽醌苷等苷类组分等, 而极性较小的组分往往具有较强的脂溶性, 如挥发油组分。
2.2.4 稳定性化学稳定性:中药组分的稳定性是保证组分有效性的基础, 组分内成分的不稳定变化不仅会降低组分的整体疗效, 甚至还可能产生毒性, 故对于含有易氧化、水解、聚合及互变的组分应注意维持其化学稳定性。影响组分稳定性的因素很多, 但最主要因素为组分内化学成分自身稳定性, 如酚酸类组分本身稳定性欠佳, 在强光照射的情况下, 就容易氧化变质。挥发油组分在与空气、光线接触后会被逐渐氧化, 使其相对密度增加, 形成树脂样物质, 具有一定的不稳定性。除组分自身因素外, 温度、湿度、pH、光、氧气和溶媒等也可影响组分的稳定性, 如当pH升高时, 组分的碱性越强, 其氢氧根离子浓度就越高, 则产生的催化反应会加剧该组分药物氧化, 增加其不稳定性。另外, 溶媒对药物稳定性也具有一定的影响, 溶媒的极性是由共价键中电荷分布不均匀产生的, 极性较大的溶媒增加组分的不稳定性, 产生一定的水解反应。
胃肠道稳定性:中药组分胃肠道稳定性主要与组分的酸碱性、胃肠道pH值及胃肠道消化液有关。有些组分受胃肠道pH或消化道中菌群及内皮细胞产生的酶的作用, 其在吸收前后产生化学降解、酶降解, 或者在肠道下段被细菌菌丛代谢, 从而使得母体药量减少, 降低生物利用度。因此, 对于胃肠道不稳定的组分不宜采用口服给药, 而应该用注射或其他的给药方式。
2.2.5 “手性”目前药物的手性问题越来越引起科学界的关注, 药物的手性在生命科学领域中具有重要意义。中药糖苷类、木脂素类、黄酮类、三萜类、甾体类和生物碱类等均包含大量的手性成分。在对中药组分性质研究中, 本课题组认为组分中手性成分的研究应为组分性质研究的重点之一, 着重进行组分中手性成分的辨识。在对手性成分准确辨识的基础上, 探讨组分内手性成分的存在是否使组分具有一定的“手性”, 并在确认组分“手性”性质的前提下, 进一步解析手性成分或“手性”组分与其临床疗效之间的相关性。
对于组分而言, 由于手性成分的存在, 不可排除组分的“手性”现象, 但也可能由于中药组分的提取过程多为非手性环境, 致使在非手性环境下具有相同的物理性质的对映体不能被完全区分, 在组分内对映体含量相当的情况下, 产生组分“手性”消失的现象。组分的“手性”性质是本课题组在手性分子的基础上提出的新观点, 对于“手性”组分是否像手性成分一样在特定的构型下具有较强的生理活性, 仍需进一步验证。
2.2.6 粉体学性质中药组分多以粉末作为制剂前原料, 故组分的粉体学性质是制剂前重要的研究内容。粉体的粒形、粒径分布、比表面积及孔隙率等粉体外貌结构可影响粉体的流动性、可压性等性质, 进而影响该粉体的成型性。一般粒径较大、表面规则、光滑的球形颗粒的比表面积相对较大、流动性也较好, 粉体的粒形常以球形度和凸起度两个参数表征, 分别用来衡量粒子与圆形的接近程度及颗粒的表面粗糙程度, 当粉体粒径分布较为均匀时, 粉体压片后可有效减小片重差异。
组分粉体的含水量、吸湿性、流动性和密度等性质是影响组分粉末制剂难易程度的关键。粉体的黏性、含水量及吸湿性是影响粉体稳定性的重要因素, 其中粉体吸湿性由吸湿初始速度、吸湿加速度及平衡吸湿量表征。一般而言, 粉末的水溶性越强, 吸湿初速度和平衡吸湿量越大, 吸湿加速度越小。粉体吸湿后易呈现分散性差、流动性差、黏性增强和团聚等现象, 严重影响组分粉末的制剂成型性。组分粉体的松密度及振实密度可体现该粉体的堆积性能; 粉体的流动性可用休止角、平板角、压缩度、凝集度和黏性等表征, 也可用质量流率法、Carr指数法和Jenike法对其进行综合评价。
2.3 中药组分生物药剂学研究组分生物药剂学主要是研究组分的吸收、分布、代谢、排泄过程及药动学参数, 阐明组分内各成分相互作用和组分间相互作用与机制。
2.3.1 吸收药物在体内的吸收主要包括溶解和渗透两个过程, 药物从制剂释放到消化液中, 实现药物的溶解过程, 溶出的药物透过胃肠道上皮细胞进入血液循环, 完成渗透过程[7]。故组分除需具有一定的溶解性外, 还需具备一定的渗透性才能透过胃肠道上皮细胞黏膜进入血液循环, 被机体吸收。组分的渗透性反映组分透过胃肠上皮细胞的能力, 与组分的脂溶性相关, 常用油水分配系数进行表征, 油水分配系数大小能说明药物的亲脂、亲水情况, 预测药物跨膜转运的难易程度。一般来说, 具有较大log P值的组分往往具有较强的脂溶性, 具有较好的胃肠渗透性。此外, 组分的酸碱性、粒径大小等理化性质对胃肠吸收具有不同程度的影响。由于受到胃肠道内pH的影响, 呈一定弱酸或弱碱性的组分, 会以未解离型和解离型两种形式存在, 而构成消化道上皮的类脂膜是药物吸收的屏障, 能使脂溶性较大的未解离型分子顺利通过, 解离型的离子型分子则不易透过, 难以吸收。组分的粒径越小, 与体液的接触面积越大, 则溶出速度增大, 吸收加快。
2.3.2 分布组分的理化性质和机体各部位的生理、病理特征是决定组分分布的主要因素, 其中对组分的酸碱性、脂溶性等理化性质的研究是预测组分分布特性的关键。弱酸性及弱碱性组分的分布受细胞外液pH的影响, 弱酸性组分在细胞外液pH下容易产生解离, 不易进入组织; 弱碱性组分在血液pH下很少解离而易进入组织。组分的脂溶性也可影响组分的分布, 脂溶性高的组分越容易透过血脑屏障进入脑内产生药效。在跨膜转运时, 脂溶性高的组分易于进入细胞内, 也容易在脂肪组织中的分布蓄积。此外, 组分内各成分的化学结构中某些基团的变动也可能通过影响组分整体脂溶性, 进而影响组分分布情况。
2.3.3 代谢组分药物吸收进入机体后, 在各种酶及体液的作用下, 组分内各成分的化学结构发生改变, 产生代谢产物, 一般而言, 代谢产物极性都比原形药物大, 故容易从机体排出。组分内手性成分可影响组分整体代谢, 手性成分存在立体选择性代谢, 其中手性药物底物的立体选择性、底物与产物的立体选择性及对映体代谢过程的手性转化均会影响组分整体的代谢。另外, 组分内对映体的代谢清除率差异也可通过不同的代谢途径表现出来。
2.3.4 排泄组分的排泄与药效、药效维持时间密切相关, 其中肾脏排泄及胆汁排泄是排泄的主要途径。当某种组分的排泄速度增大时, 保留在血中的药量减少, 药效降低。一般而言, 水溶性及分子量小的组分常由肾排泄消除, 在肾小球滤过中亲脂性成分易被重吸收, 而水溶性成分不被重吸收, 能迅速从尿中排泄。对于极性太强而不能在肠内重吸收的有机阴离子和阳离子, 胆汁排泄是其重要的排泄机制。另外, 组分的酸碱性对其排泄也有一定的影响, 对于弱酸性组分, pH升高可增加其解离程度, 导致重吸收减少, 肾清除率增加; 而对于弱碱性组分, pH的升高, 可使组分的解离程度减少, 重吸收增加, 肾清除率减少。
2.3.5 药动学研究组分的药效作用是组分内多成分共同作用的结果, 以1个或几个成分在体内的量变规律表征中药组分整体药动学性质显然是不合理的。组分的药动学研究应注重组分整体药动学性质, 通过研究组分整体在机体内吸收、分布、代谢和排泄规律, 揭示组分内相似成分的体内外共性规律。在对组分吸收、分布、代谢和排泄规律研究的基础上, 结合统计矩总量的药动学研究方法[8]、中药多组分整合药代动力学[9]及多组分多维向量归一的“总量”药动学研究方法[10], 引入整体总量统计矩、多维向量校正理念及药代动力学参数、药效权重系数等参数, 实现对中药组分整体药动学性质的表征。
2.3.6 组分内各成分相互作用与组分间相互作用与机制研究成分间相互作用是多成分联合用药时的常见现象, 如人参皂苷Rg1、人参皂苷Rb1和五味子素相互作用时, 人参皂苷Rb1和五味子素可明显延缓人参皂苷Rg1在大鼠血清中的清除[11]; 五味子甲素、乙素、醇乙及酯甲与地高辛合用时均可升高地高辛的血药浓度[12]。组分作为一种多成分体系, 其整体性质除与各成分固有性质有关外, 也涉及到组分内/组分间各成分的相互作用。组分内/组分间各成分相互作用时可能协调增效, 亦或药效相消, 甚至可能产生毒副作用, 故对组分内各成分相互作用与组分间相互作用与机制研究是保证组分制剂安全有效的关键, 应作为组分制剂的重点研究内容之一。
2.4 成药性 2.4.1 毒性随着不断出现的临床不良反应, 中药的安全性问题逐渐受到重视。组分作为中药现代化的发展方向之一, 组分的毒性及其安全性评价应得到足够的重视。药物在体内大量蓄积是其产生毒性的重要原因之一, 当长期连续用药时, 具有特殊亲和性的药物从组织中解脱入血的速度比进入组织的速度慢, 使组织内药物浓度不断增加, 最终导致蓄积中毒。对组分整体理化性质的研究是规避组分蓄积中毒的前提, 如油水分配系数较高的亲脂性组分极易从水性血浆环境中分布进入脂肪组织, 长期连续用药可导致该组分在脂肪组织中大量蓄积, 产生毒性反应。一般而言, 药物的代谢产物的极性都比原型成分大, 易于从机体排出, 但含有酚羟基的成分的甲基化代谢产物的极性反而降低, 不易从机体排出而产生蓄积。目前“无毒”成分的潜在毒性逐渐被发现, 如蒽醌类、皂苷类和生物碱类等成分存在一定的安全风险, 涉及对多种组织器官包括肝脏、肾脏等在内的毒性[13]。因此, 在明确组分毒性成分的基础上, 采用毒代动力学的原理和方法[14], 搞清组分的量效-毒效关系, 调整给药剂量或给药时间, 制定较为合理的剂量使用范围, 避免其毒性的发生。
2.4.2 药效中药经过几千年实践的验证, 其疗效是毋庸置疑的。在遵循中药组分中各成分含量及比例关系的前提下, 中药组分研究尝试对多个成分进行敲入敲出、配伍优化, 选择与中药整体药理作用无统计差异的N个代表性成分, 使其代表中药的整体效应, 如本课题组研究发现三草方的黄酮类及萜类组分对两种人肺癌细胞株SPC-A-1和A549具有较强的抑制作用, 且对Lewis小鼠肿瘤生长具有抑制作用, 还可提高荷瘤小鼠的胸腺指数, 表明三草方中的黄酮类及萜类组分配伍后具有明显的协同抑瘤活性[15]。中药组分的药效是评判该组分整体成药性的基础, 是对其进行理化性质考察及剂型设计的前提。
2.5 组分整体性质表征与组分生物药剂学分类系统构建组分制剂的研究中, 组分的整体性质不能简单地采用单一成分的性质表示, 故本课题组将组分性质落在组分整体性质表征上, 基于组分的复杂特性, 提出用有限个代表性成分(累加综合药效与原提取物整体药效无统计学差异)的综合性质表征该组分的整体性质。
2.5.1 相似度评价为科学的评价组分性质, 采用相似性分析作为表征组分整体性质的关键评价指标之一, 将向量夹角余弦(Cosine)及格鲁布斯(Grubbs)法作为组分相似性分析的主要方法, 分别进行趋势分析及差异性判断。在拟合各性质值的基础上, 采用各代表性成分个体性质相对于组分综合性质的离散程度, 即离散度, 评价组分内代表性成分性质值的波动情况及其相对于组分综合性质的偏离、分散情况。最终根据相似度分析结果, 对于离散度小的组分可将其归为一类, 而对于离散度大的组分则将其分为不同的亚组分(图 3), 以避免性质差异显著的某些成分影响组分整体性质的表达。
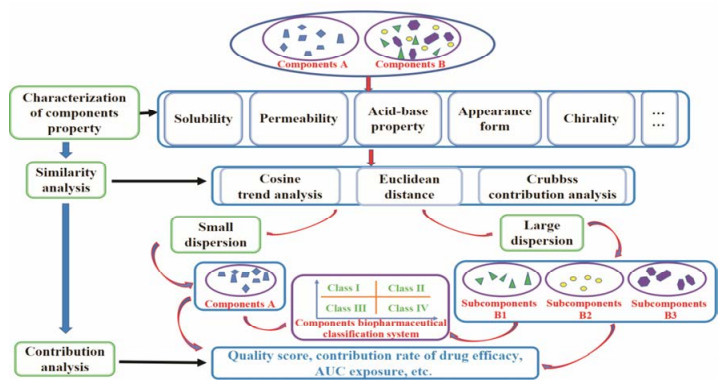
|
Figure 3 Characterizationof components properties |
在采用离散度指标及相似性分析对组分进行组分及亚组分划分后, 需对其整体性质进行表征。因组分中各成分存在一定的量比关系, 故组分中各成分对组分整体性质的影响程度不同, 而权重系数可用来表示某一指标在该指标系统中的重要程度。本课题组在中药多组分发挥整体药效的基础上, 创新引入以质量分数[16]、药效贡献率系数法[17]及AUC暴露量等为指标项的权重系数, 综合表征中药组分整体性质[18]。在以上组分表征技术的基础上, 本课题组进行了相关实践, 如在对丹酚酸组分中代表性成分进行药效贡献率及油水分配系数表征时, 采用CRITIC权重法评价代表性成分的药效贡献率, 以质量权重系数和药效贡献率相结合整合表征组分整体的油水分配系数, 为组分整体表征提供一定的参考[19]; 采用质量分数权重法对银杏黄酮组分及银杏内酯组分的溶解性及油水分配系数进行表征发现, 与直接加和法相比, 质量分数权重系数整合表征中药组分性质更为科学合理[16, 20]。
2.5.3 组分生物药剂学分类系统溶解性及渗透性是组分最为重要的两个性质, 直接影响组分的疗效, 故本课题组着重将组分的溶解性及渗透性作为组分制剂前组分整体性质研究的关键, 通过相似度评价综合分析组分整体的溶解性及渗透性, 对于离散度大的组分, 将其划分成不同的亚组分。并在生物药剂学分类系统的基础上[21], 结合组分综合性质值以溶解性及渗透性为主要生物药剂学指标提出中药组分生物药剂学分类系统[22], 将组分分为Ⅰ类组分(高溶解性、高渗透性)、Ⅱ类组分(低溶解性、高渗透性)、Ⅲ类组分(高溶解性、低渗透性)和Ⅳ类组分(低溶解性、低渗透性)。
3 以组分为基本单元的释药单元制剂技术在组分制剂中, 溶解性和渗透性是影响组分生物利用度的2个主要因素, 只有同时具备较高的溶解性及渗透性的中药组分才能进入血液循环而被吸收, 才具有一定的生物利用度[20], 故在对组分理化性质及生物药剂学性质表征时, 组分的溶解性及渗透性是组分性质的重点考察内容。对于具有较好溶解性及渗透性的组分, 如中药组分生物药剂学分类系统中的Ⅰ类组分, 在制剂过程中应注意选择不影响其溶解性及渗透性的辅料, 而对于溶解性或渗透性较差的中药组分, 如Ⅱ类、Ⅲ类及Ⅳ类组分, 则应采用能够改善组分溶解度及渗透性的制剂技术对组分自身缺陷进行修饰, 将其制备成具有较高生物利用度的释药单元(图 4)。对于溶解性较差的组分, 在制剂过程中除了加入增溶剂、助溶剂外, 还可通过固体分散体技术[23]、O/W型微乳、自微乳技术、包合技术[24]、粉体改性技术[25]、液固压缩技术、微丸技术和纳米技术等提高组分的溶解性及溶出速度; 对于渗透性较差的组分, 除可通过脂类制剂包载的方式提高渗透性外, 还可以通过添加吸收促进剂[26]及采用W/O型微乳、自微乳技术[27]、磷脂复合技术[28]、生物黏附技术[29]和脂质纳米技术等提高难渗组分的渗透性; 而对于溶解性及渗透性均存在缺陷的组分, 则需从提高溶解度及改善渗透性两个方面对组分的自身缺陷进行修饰, 如加入表面活性剂、增溶剂及吸收促进剂等, 此外还可采用穿膜肽复合胶束[30]、干乳技术[31]、乳铁蛋白纳米粒[32]和纳米混悬剂技术[33]等增加组分吸收, 提高生物利用度。
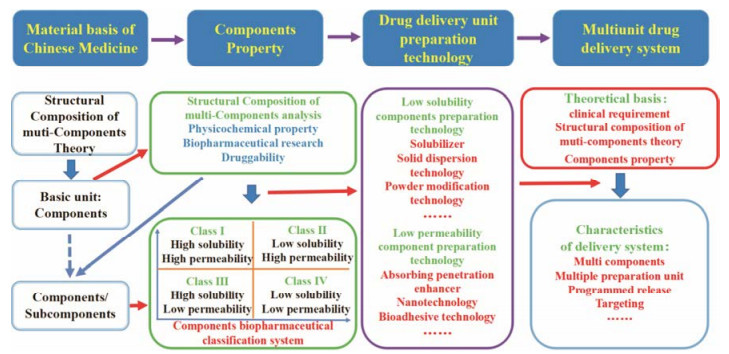
|
Figure 4 Research frontiers of Chinese medicine pharmaceutics: property characterization, preparation technology and delivery system of components |
在对理化性质及生物药剂学性质缺陷的组分进行修饰时, 也应同时考虑组分的药动学性质, 根据组分自身药动学性质及疾病轻重缓急, 将其制备成具有缓释、速释、匀释功能的微丸、微乳和纳米粒等释药单元, 以提高组分的生物利用度, 发挥最大疗效。如彭长春等[34]在复方丹参片释药系统制备时, 将水溶性组分制备成速释单元, 脂溶性组分制成缓释单元, 通过程序性释药的方式, 使其实现迅释治标、缓释治本, 最终达到标本兼治的目的。
4 基于中药多组分多单元制剂技术的多元程序释药系统构建自2006年起, 杨明等[35]提出构建“现代中药复方释药系统”的研究思路; 冯怡等[36]从世界药物释药系统市场和中药复方释药系统研究概况出发, 提出采用制剂技术改变复方中有效组分的不同释药行为, 使中药复方得到最大限度的体现和发挥。本课题组在组分中药及“组分结构”理论的基础上提出“基于物质基础组分的中药多元释药系统”[37]的概念, 认为中药多组分释药模式应是多元化的, 应结合疾病的轻重缓急、临床用药目的及各组分释药单元的特点, 采用现代多元化制剂技术构建多元释药系统, 依据多组分程序性释药, 实现多组分在时间及空间上的有效分布, 优化多组分的配伍效应, 充分发挥多组分协同作用特点。
4.1 中药组分多元释药系统的构建理论依据:中医方剂配伍理论和中药药性理论提示, 中药以多组分配伍、协同作用的形式起到标本兼治的目的, 其释药方式应是多元化的; 中药多组分间不同的理化性质及生物药剂学性质提示, 单一型制剂根本无法满足中药多组分的特点, 根据组分的不同性质采用不同的制剂技术才是提高组分生物利用度的正确选择; 中药组分间不同的药动学性质及疾病的轻重缓急提示, 根据疾病的需求调整各组分释药时间及释药部位是提高中药临床疗效的有效策略。故构建组分多元释药系统, 是符合中药多组分协同起效原则, 改善各组分生物利用度, 提高中药临床疗效的有效途径。
技术支撑:目前可应用于中药组分多元缓释系统构建的制剂技术有多元包衣技术、分层压片技术和渗透泵技术等。多元包衣技术可实现分区段或分时释药, 分区段释药主要依据胃肠系统3个区段下不同pH水平, 由不同的包衣材料依赖pH梯度实现分区释药, 分时释药制剂是将释药单元进行2次包衣, 在溶胀层外再分别包以不同厚度的控释层制成的, 不同的控释层厚度对应不同的释药时间, 最终实现多组分程序性释药, 如舒胸缓释胶囊[38]的多元定时释药研究。分层压片技术按组分的理化性质差异将其分层处理, 添加不同阻滞剂, 采用不同辅料种类及配比、给予不同的压力等压制成若干层片, 实现不同药层多组分的程序性释放, 如廖正根等[39]以难溶层成分及水溶层成分的溶出和吸收特点为依据, 制备了桂枝茯苓难溶层和水溶层双层缓释片。渗透泵技术是通过渗透压促使药物从半透膜释药孔释放出来, 目前口服中药渗透泵片多以微孔渗透泵片为主, 与单一释药孔相比, 多微孔不会出现局部高药物浓度对胃肠道的刺激, 如Li等[40]以包含致孔剂的醋酸纤维素为包衣材料利用泡腾技术和渗透泵技术制得复方丹参渗透泵片, 实现多元释药。
实践应用:本课题组在多元系统构建方面进行一系列的实践, 在中医药理论的指导下运用多元制剂技术构建了通脉微丸多元释药系统, 将疏通血管的葛根素黄酮组分、丹参酚酸组分和川芎酚酸组分设计成速释单元, 使其能够迅速释放发挥药效, 将保护心肌细胞的丹参酮组分设计成缓释单元, 使其能够缓慢释放持久保护心肌细胞, 通过程序性释药, 将速效与长效结合达到标本兼治的目的[41]。此外, 复方丹参[34]、舒胸缓释胶囊[42]和大川芎方[43]等模型药物对中药多元释药系统的成功实践, 共同表明构建中药多元释药系统的可行性, 同时也表明多元释药系统可充分发挥中药复方整体作用特点及中药多组分整体作用理念, 有利于推动中药组分制剂的技术转型升级。
4.2 多组分程序性释药在中药组分多元化释药系统中, 各组分释药单元的释放是一个有序的、有机的程序性释放过程, 是一种在考虑各组分的释放量、吸收量和释放速度的同时, 又遵循中医药的整体观的释药方式。目前部分学者指出的同步释放[44, 45]就是程序性释放的一种, 是在考虑各组分同一时刻的吸收量问题、人体内载体或生物酶数量限制等因素的基础上形成的一种特殊释药形式。然而在中药现代化进程中, 不应一味地强调同步释药, 而应提倡程序性释药, 程序性释药不受人体内载体或生物酶数量限制, 可依据疾病的轻重缓急及药效组分的整体药动学性质采用不同的制剂技术合理安排各组分的释药时间及释药部位, 最终达到改善生物利用度, 提高临床疗效的目的。
程序性释药是中药现代化的发展趋势, 因药物的消除速率与药物的浓度成正比, 程序性释药可以避免多组分同时释药时产生的血药浓度骤升或骤降等情况, 可使血药浓度维持在相对稳定的状态, 减慢组分的消除速率, 增加机体对组分的吸收。根据疾病的治疗需求及各组分的性质, 将药效组分设计成不同的释药单元, 分别实现速释、缓释和匀释等, 最终将其组装成多元化释药系统, 实现程序性释放, 以达到标本兼治的目的。如魏元峰等[43]在中药多元释药理念指导下, 根据大川芎方的作用特点及所含药味川芎、天麻中有效组分的理化性质, 分别将其制成川芎速释及缓释微丸和天麻速释及缓释微丸, 并通过优化配伍组合后制成时间型中药复方多元释药系统, 通过各组分程序性释药改变不同化学成分在体内外释药特征, 使其起效快且药效维持时间长。
4.3 中药组分多元释药系统的评价中药组分多元释药系统构建以提高组分整体疗效为目的, 而中药组分多元释药系统评价则是衡量释药系统设计成败的关键。与化学药物相比, 中药组分复杂多样且评价体系较为薄弱, 为建立以生物利用度/生物等效性为核心的中药组分多元释药系统的评价体系, 本课题组及其他研究人员均做出了有益的探索和尝试。
中药多组分整合药代动力学方法由王广基课题组[9]首次提出, 该方法可用于表征中药组分在生物体内的整体处置动力学特征, 反映整体效应物质在生物体内的存留特性, 如李晓宇等[46]以三七总皂苷为模型药物, 在自定义权重系数的基础上, 计算三七总皂苷在大鼠体内综合浓度并建立整合药动学研究模型, 探讨中药多组分整合药代动力学研究方法的可行性, 结果表明建立的整合药动学研究模型符合经典药代动力学模型特征, 所获得的参数能够最大程度上表征中药的整体处置规律。除中药多组分整合药代动力学外, 在中药组分多元释药系统的体外评价中, 指纹图谱特征峰[47]、多指标定量指纹图谱[48]、中药化合物组[49]、吸波面积法[50]、质量权重系数法[21]、“统计矩总量动力学”[8]和“总量释放动力学”[9]等方法也逐渐突破化学药物评价模式的束缚, 不再局限于单一成分逐个评价。另外, 血药浓度法、生物效应法等体内评价方法, 通过考察血药浓度、达峰时间和生物利用度等, 对于中药组分多元释药系统的评价也是一种新的探索与尝试, 对于建立系统的中药组分多元释药系统的评价体系起到一定的促进作用。
5 总结及展望组分制剂的研究正是中药系统性和整体性的体现, 在中医药理论的指导下以中药成分多组化、制剂技术多样化、释药系统多元化和药物释放程序化等体现中药整体性及系统性特点。组分制剂研究中以中药组分为研究对象, 将中医药理论与制剂理论有机融合, 通过多学科知识的交叉研究, 为中药制剂的发展提供有效的、可借鉴的模式, 可成为实现中药制剂发展和走向国际化的一个突破口。
传统中药制剂与组分制剂最明显的区别就在于制剂前处理过程:前处理是中药制剂的初始阶段, 其中组分制剂的前处理过程更为复杂。由于饮片的产地、基源及质量等差异, 如何获得恒定比例且批间稳定的组分是目前组分制剂中急需解决的问题。此外, 构建组分多元释药系统时, 如何准确地使各组分按照既定的比例程序性释放, 如何建立各释药单元与整体药效之间的联系、如何建立科学完善的中药组分多元释药系统的体内外评价体系等均是组分制剂面临的问题。总而言之, 组分制剂目前仍处于不断的探索阶段, 对于组分制剂的发展, 应加强多学科知识的交叉应用, 加强相关研究人员的学术交流, 以期实现组分制剂的飞跃性发展, 为中药制剂的现代化与国际化提供一定的助益。
| [1] | Feng L, Zhang MH, Gu JF, et al. Innovation and practice of component structure theory on material basis of traditional Chinese medicine prescriptions[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 3603–3607. |
| [2] | Jia XB, Chen Y, Li X, et al. New thoughts and methods of studying material base of traditional Chinese herbal formula[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2008, 23: 420–425. |
| [3] | Yang N, Feng L, Jia XB. Scalability and extensionality of innovative Chinese medicine preparation under guidance of component structure theory[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 144–149. |
| [4] | Ke ZC. Characterization of Biopharmaceutical Properties of Chishao Terpene Glucoside Components Based on Identification of Gepresentative Components (防治心肌缺血的赤芍萜苷组分代表性成分发现和生物药剂学性质表征)[D]. Nanjing: Nanjing University of Chinese Medicine, 2018. |
| [5] | Charifson PS, Walters WP. Acidic and basic drugs in medicinal chemistry:a perspective[J]. J Med Chem, 2014, 57: 9701–9717. DOI:10.1021/jm501000a |
| [6] | Yun YE, Edginton AN. Correlation-based prediction of tissue-to-plasma partition coefficients using readily available input parameters[J]. Xenobiotica, 2013, 43: 839–852. DOI:10.3109/00498254.2013.770182 |
| [7] | Hao TY, Wei YF, Qian SA, et al. Advances in strategies of improving solubility and permeability of taxanes[J]. Acta Pharm Sin (药学学报), 2018, 53: 54–61. |
| [8] | He FY, Deng KW, Liu WL, et al. Experimental studies on pharmacokinetics of three components in Buyanghuanwu injection on base of total quantum statistical moment[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 253–262. |
| [9] | Hao HP, Zheng CN, Wang GJ. Thoughts and experimental exploration on pharmacokinetic study of herbal medicines with multiple-components and targets[J]. Acta Pharm Sin (药学学报), 2009, 44: 270–275. |
| [10] | Yue PF, Zheng Q, Zhu GH, et al. "Total amount" release kinetics evaluation of traditional Chinese medicine sustained-release preparations based on material rough set theory[J]. Acta Pharm Sin (药学学报), 2010, 45: 1354–1360. |
| [11] | Zhan S, Guo W, Shao Q, et al. A pharmacokinetic and pharmacodynamic study of drug-drug interaction between ginsenoside Rg1, ginsenoside Rb1 and schizandrin after intravenous administration to rats[J]. J Ethnopharmacol, 2014, 152: 333–339. DOI:10.1016/j.jep.2014.01.014 |
| [12] | Qin XL, Duan WH, Wang Y, et al. Effect of six bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) on P-glycoprotein and its herb-drug interaction with digoxin[J]. Acta Pharm Sin (药学学报), 2018, 53: 1337–1343. |
| [13] | Zhang SN, Li XZ, Lu F, et al. New direction in Chinese materia medica toxicity study:discovery of potential toxicity in "non-toxic" drug[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2015, 17: 627–632. |
| [14] | Wang YG, Ma ZC, Liang QD, et al. Thoughts and methods for toxicity study on Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 1875–1879. |
| [15] | Jia XB, Shi F, Huang Y, et al. In vivo and in vitro anti-lung cancer activity of Sancaofang components and their compatibility[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 592–596. |
| [16] | Liu D, Jia XB, Xiao W. Equilibrium solubility of Ginkgo flavonoid components in water and PBS of different pHs with mass fraction weight coefficient method[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 1871–1875. |
| [17] | Yan HM, Chen XY, Xia JH, et al. Evaluation on contribution rate of each component total salvianolic acids and characterization of apparent oil/water partition coefficient[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 430–436. |
| [18] | Liu D, Feng L, Song J, et al. Research thinking and strategy on overall biopharmaceutics classification system of Chinese materia medica composition[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 4831–4835. |
| [19] | Pérez-Sánchez A, Borrás-Linares I, Barrajón-Catalán E, et al. Evaluation of the intestinal permeability of rosemary (Rosmarinus officinalis L.) extract polyphenols and terpenoids in Caco-2 cell monolayers[J]. PLoS One, 2017, 12: e0172063. DOI:10.1371/journal.pone.0172063 |
| [20] | Liu D, Jia XB, Xiao W. Study on solubility of ginkgolide components with mass fraction weight coefficient method[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 1865–1870. |
| [21] | Amidon GL, Lennernas H, Shah VP, et al. A theoretical basis for a biopharmaceutic drug classification:the correlation of in vitro drug product dissolution and in vivo bioavailability[J]. Pharm Res, 1995, 12: 413–420. DOI:10.1023/A:1016212804288 |
| [22] | Yu DH, Liu D, Zhang ZH, et al. Design technology of traditional Chinese medicine component and formulation[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 2993–2996. |
| [23] | Cong W, Shen L, Xu D, et al. Solid dispersion tablets of breviscapine with polyvinylpyrrolidone K30 for improved dissolution and bioavailability to commercial breviscapine tablets in beagle dogs[J]. Eur J Drug Metab Pharmacokinet, 2014, 39: 203–210. DOI:10.1007/s13318-013-0150-0 |
| [24] | Pan Y, Qian D, Liu P, et al. The influence of essential oils from Xiang-Fu-Si-Wu Decoction on its non-volatile components and its application for pharmacokinetics in normal rats[J]. J Chromatogr B, 2017, 1060: 221–230. DOI:10.1016/j.jchromb.2017.06.004 |
| [25] | Zhang DK, Lin JZ, Liu JY, et al. Powder modification technology used for the preparation of the hydrophilic decoction pieces of Indigo Naturalis and the modification principle[J]. Acta Pharm Sin (药学学报), 2013, 48: 1148–1155. |
| [26] | Zhu ZT, Pan JH, Wu XH, et al. Screen absorption enhancer for intranasal administration preparations of paeoniflorin based on nasal perfusion method in rats[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 493–497. |
| [27] | Wei J, He HL, Zheng CL, et al. Chitosan-coated ophthalmic submicro emulsion for pilocarpine nitrate[J]. Acta Pharm Sin (药学学报), 2011, 46: 990–996. |
| [28] | Yu F, Li Y, Chen Q, et al. Monodisperse microparticles loaded with the self-assembled berberine-phospholipid complex-based phytosomes for improving oral bioavailability and enhancing hypoglycemic efficiency[J]. Eur J Pharm Biopharm, 2016, 103: 136–148. DOI:10.1016/j.ejpb.2016.03.019 |
| [29] | Jiao J, Sun L, Guo Z, et al. Antibacterial and anticancer PDMS surface for mammalian cell growth using the Chinese herb extract paeonol (4-methoxy-2-hydroxyacetophenone)[J]. Sci Rep, 2016, 6: 38973. DOI:10.1038/srep38973 |
| [30] | Fan B, Jin MJ, Huang W, et al. The development of cell-penetrating peptides in drug delivery system[J]. Acta Pharm Sin (药学学报), 2016, 51: 264–271. |
| [31] | Li M, Hou SX, Mao SJ, et al. Preparation and dissolution characteristics of compound Danshen freeze-dried emulsion[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 2632–2637. |
| [32] | Tang HX, Zhang ZH, Zhao ZY, et al. Research progress of lactoferrin as drug carriers[J]. Acta Pharm Sin (药学学报), 2015, 50: 675–681. |
| [33] | Ji YB, Zhou XX, Guo RQ, et al. Honokiol nanosuspensions:preparation, in vitro and in vivo evaluation[J]. Acta Pharm Sin (药学学报), 2018, 53: 133–140. |
| [34] | Peng CC, Zheng Q, Hu PY, et al. Drug release of compound salvia multi-component released double-layer tablet[J]. Chin Tradit Pat Med (中成药), 2010, 32: 39–43. |
| [35] | Yang M, Feng Y, Xu DS, et al. Technical lines for advanced TCM drug release system[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2006, 8: 10–15. |
| [36] | Feng Y, Xu DS, Hong YL, et al. Studies on m arket of drug delivery system product and drug delivery system of compound Chinese Medicine[J]. China J Chin Mater Med (中国中药杂志), 2006, 31: 1669–1670, 1688. |
| [37] | Sun E, Jia XB, Huang Y, et al. Thought and application of traditional Chinese medicine multiple drug delivery system based on material basis component[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 2181–2185. |
| [38] | Song HT, Zhang Q, Wang HJ, et al. Preparation of the traditional Chinese medicine compound recipe Shuxiong sustained-release capsules by multiparticulate time-controlled explosion technology[J]. Pharmazie, 2007, 62: 372–377. |
| [39] | Liao ZG, Liang XL, Ping QN, et al. Formula design and optimization of Guizhi fuling doublelayers sustained-release tablet[J]. Chin Tradit Herb Drugs (中草药), 2009, 40: 553–557. |
| [40] | Li Y, Hou S, Bi Y, et al. Novel two-step release system for the traditional Chinese medicine compound Danshen[J]. Yakugaku Zasshi, 2007, 127: 1473–1484. DOI:10.1248/yakushi.127.1473 |
| [41] | Huang Y. The Construction of Multi-drug Delivery System of Tongmai Micro-Pellets (通脉微丸多元释药系统的构建)[D]. Zhenjiang: Jiangsu University, 2011. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1894874 |
| [42] | Song HT, Guo T, Kang LP, et al. Shuxiong sustained-release capsule prepared by multiparticulate site-controlled release technique[J]. Chin Tradit Herb Drugs (中草药), 2005, 36: 993–998. |
| [43] | Wei YF, Zhang N, Lin X, et al. Release characteristics in vitro and pharmacokinetics of Da Chuanxiong Fang multiunit drug delivery system in rats[J]. Acta Pharm Sin (药学学报), 2011, 46: 1150–1155. |
| [44] | Zhang JW, Chen LB, Gu JK, et al. Novel method for the evaluation of the synchronicity of the chemomic release/dissolution of multi-component traditional Chinese medicines[J]. Acta Pharm Sin (药学学报), 2008, 43: 647–651. |
| [45] | Yue PF, Wu B, Zheng Q, et al. Innovation and discussion on evaluation pattern of synchronism/asynchronism release characterization of sustained and controlled release preparations for Chinese herbal formula[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 1413–1417. |
| [46] | Li XY, Hao HP, Wang GJ, et al. Integrated pharmacokinetic study of multiple effective components contained in total Panax Notoginsenosides[J]. Chin J Nat Med (中国天然药物), 2008, 6: 377–381. |
| [47] | Zhang W, Song HT, Zhang Q. Evaluation on in vitro release of gastric floating sustained-release preparation of Tript-erygium wilf-ordii by HPLC fingerprints[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 376–380. |
| [48] | Zhao ZG, Zhang XM, Zhang MM, et al. Identification and determination of multiple components in Qianliexin capsules by HPLC-ESI-TOF/MS and study on the quantitative fingerprint[J]. Chin J Pharm Anal (药物分析杂志), 2017, 37: 1810–1816. |
| [49] | Zhang JW, Chen LB, Gu JK, et al. Novel theory and methods for chemomic multi-component release/dissolution kinetics of traditional Chinese medicines[J]. Chin J Nat Med (中国天然药物), 2008, 6: 48–52. DOI:10.3724/SP.J.1009.2008.00048 |
| [50] | Lai HQ, Hu Y, Li XD. The in vitro dissolution of total composition of the tablet of rhizomes of Ligusticum chuanxiong components and in vitro-in vivo correlation by the method of area under the absorbance-wavelength curve[J]. Acta Pharm Sin (药学学报), 2015, 50: 788–792. |
 2018, Vol. 53
2018, Vol. 53


