2. 中山大学药学院, 广东 广州 510006
2. School of Pharmaceutical Science, Sun Yat-Sen University, Guangzhou 510006, China
马来酸噻吗洛尔[1]是临床上治疗青光眼的一线药物, 作为β-受体阻断剂, 通过抑制睫状突上皮环腺苷酸的产生, 从而减少房水生成, 降低眼压。常见的剂型是马来酸噻吗洛尔滴眼液, 其使用方便, 降压效果显著, 但眼表流失严重, 药效维持时间短, 生物利用度低(1%~10%), 1日给药两次, 药理峰谷现象突出, 不良反应较多, 如过敏反应、哮喘、心脏毒性等。
立方液晶[2] (cubic liquid crystalline, cubic phase或cubosome)是由三维延伸、双连续网络结构、独特的内部双水道构成, 能够包封不同极性和剂量的药物, 水溶性药物可以包封在立方液晶的水道中, 脂溶性药物能包封于立方液晶的脂质双层膜中, 提高药物的稳定性[3]。立方液晶特殊的结构和性质使其成为极有潜力的药物载体, 被应用于各类给药系统的研究[4, 5]。较好的生物黏附性也可以延长立方液晶在角膜的滞留时间[6], 因而可作为眼部药物传递系统的载体[7]。为了提高马来酸噻吗洛尔的生物利用度, 延长其角膜滞留时间, 降低不良反应, 本文以立方液晶纳米粒为载体, 包载马来酸噻吗洛尔, 通过正交设计法确定最佳处方, 并进行表征, 同时考察立方液晶纳米粒的体外释放、角膜渗透和眼部滞留情况。
材料与方法主要仪器 LC-15AC型二元高压梯度高效液相色谱仪(岛津企业管理有限公司); JN-02HC高压纳米均质机(广州聚能生物科技有限公司); 研究型偏光显微镜59XA-3; SDT 2960热分析仪(美国TA公司); 马尔文纳米粒度仪(英国马尔文仪器有限公司); 小动物活体成像仪(Kodak In-vivo Imaging System FX Pro, 美国柯达公司)。
药品与试剂 单油酸甘油酯(GMO, 阿拉丁化学品试剂有限公司); 泊洛沙姆407 (F127, 德国BASF公司); 马来酸噻吗洛尔滴眼液(辰欣佛都药业有限公司); 马来酸噻吗洛尔原料药(TM, 天津市中央药业有限公司); 甲醇(上海麦克林生化科技有限公司, 色谱纯); 水为超纯水; 其余所用试剂均为分析纯。
实验动物 健康新西兰白兔, 体重2.5~3.0 kg, 雌雄各半, 许可证号: 201610773。所有动物实验均由蚌埠医学院动物实验委员会的伦理审查批准。
HPLC测定TM方法学的建立
色谱条件 色谱柱: Intertsil ODS-3C18 (250 mm × 4.6 mm, 5 μm, 中国华谱新创科技有限公司); 流动相:甲醇−水−三乙胺(50:50:0.1), 磷酸调节pH至5.0, 柱温25 ℃, 流速1.0 mL·min−1; 紫外检测波长295 nm; 进样量20 μL。
检测波长的确定 精密称取TM、GMO和F127适量, 按紫外分光光度法在200~400 nm内进行扫描。
标准曲线的建立 精密称取TM对照品适量, 配制成0.78、1.56、3.12、6.25、12.5、25、50、100和200 μg·mL−1对照品溶液, 0.22 μm微孔滤膜过滤, 续滤液进样。以质量浓度(C, µg·mL−1)为横坐标, 峰面积(A)为纵坐标, 进行回归方程。
精密度 称取TM适量, 分别配制质量浓度为1.56、50和200 μg·mL−1溶液, 每个浓度连续进样3次, 得日内精密度; 再连续3日进样测定, 得日间精密度。
立方液晶纳米粒的制备 采用高压均质法[8]制备TM立方液晶纳米粒(TM-LCNPs), 称取适量GMO和F127, 置67 ℃水浴加热至融化, 缓慢加入含适量TM的去离子水溶液, 于恒温磁力搅拌器上搅拌5 min, 室温放置1周自发乳化, 加入去离子水后通过高压均质法得立方液晶纳米粒, 用甘油调节至生理等渗。
三元相图和正交设计法优化处方 采用不同比例的处方, 即F127:GMO (1:9~9:1), 物理混合物(F127+GMO):H2O (1:9~9:1)制备处方, 利用三元相图结合偏光检测初步确定立方液晶的处方。采用正交设计法, 以粒径和包封率作为评价指标, 根据前期单因素考察的结果, 选取对评价指标影响较大的4个因素作为考察因素, 即均质压力、均质次数、载药量和辅料比例, 每个因素选取了3个水平。以粒径和包封率为评价指标采用正交设计助手V3.1统计软件优化处方。
粒径和电位 取制备的TM-LCNPs 50 μL, 用去离子水稀释适当倍数后用Malvern粒度测试仪测定粒径大小及其分布和电位。
偏光检测 将制备的样品涂于玻璃载玻片上, 加盖玻片减少水分挥发, 置于偏光显微镜下观察, 并获取玻片纹理照片。
差示扫描量热(DSC)分析 在氮气保护下, 采用SDT 2960热分析仪进行热重分析, 从室温至300 ℃, 升温速率为每分钟3 ℃。
包封率 采用超滤法[9]测定药物包封率, 精密量取等浓度TM-LCNPs 1mL于超滤管上部, 超滤管下部放10 mL甲醇。在3 500 r·min−1条件下, 离心20 min。纳米粒被截留, 游离药物进入超滤管下部, 取下部液体进行含量测定, 计算包封率(EE):
| $ {\rm{EE }}(\% ) = \frac{{{W_i} - {W_f}}}{{{W_i}}} \times 100\% $ |
其中, Wi为药物初始加入量; Wf为测得的游离药物含量。
体外释放 用透析袋法[10]比较相同浓度的TM-LCNPs和TM水溶液的释放行为。先活化透析袋, 精密量取1 mL相同浓度的TM-LCNPs和TM水溶液加入透析袋中, 用细绳系紧透析袋两端, 将透析袋悬浮于50 mL人工泪液中, 恒温磁力搅拌, 分别于0.5、1、2、3、4、5和6 h取样1 mL, 每次取样后立即补加等量预热释放介质, 取出的溶液用0.22 μm滤膜过滤, 按色谱条件测定TM浓度, 计算TM的累积释放量, 考察立方液晶纳米粒的释药性能。
TM-LCNPs离体角膜渗透实验[11] 静脉注射(ⅳ)乌拉坦处死新西兰兔后取角膜置于GRB溶液中, 将角膜放在Franz扩散池中, 角膜凸面朝向供体室, 凹面朝向接收室。37 ℃恒温磁力搅拌。用TM-LCNPs和市售滴眼液对照, 平行实验3次。分别于不同时间点吸取接收室中样品, 过滤后用HPLC法测定TM含量。
活体成像法测定TM-LCNPs在家兔角膜滞留时间 采用小动物活体成像技术[12, 13]研究罗丹明B-LCNPs (RhB-LCNPs)在家兔角膜滞留情况。将罗丹明B载于空白立方液晶纳米粒中, 按立方液晶纳米粒制备方法, 制备浓度为0.2 μmol·mL−1 RhB-LCNPs。称取适量罗丹明B溶于预热的去离子水, 缓慢滴加到熔融GMO和F127中, 于恒温磁力搅拌器搅拌5 min, 避光放置1周后, 经高压均质得RhB-LCNPs。同法操作制备罗丹明B水溶液。20%乌拉坦(5 mL·kg−1, ⅳ)麻醉家兔后, 分别取8 μL RhB-LCNPs和罗丹明B水溶液滴至家兔左眼结膜囊中, 闭合10 s后于0、30、60、90、120、150和180 min进行荧光成像。以时间为横坐标, 荧光强度百分比为纵坐标绘制荧光强度曲线, 通过荧光强度变化评价两种剂型在眼部滞留情况: R = (A − B)/C × 100%, 其中, A:不同时间点的荧光强度; B:空白背景荧光强度; C: 0 min荧光强度[9]。
TM-LCNPs眼部刺激实验 实验前进行家兔眼部检查, 确保无眼疾及眼损伤。进行兔眼病理组织切片考察[14]。选取健康新西兰兔12只, 随机分为3组, 雌雄各半, 左眼均滴生理盐水50 μL, 右眼分别滴50 μL Blank-LCNPS、TM-LCNPs和0.1%十二烷基硫酸钠(SDS)溶液。每天给药4次, 连续给药7天, 乌拉坦(ⅳ)处死家兔, 取下角膜进行病理组织切片。
统计学分析 实验数据采用SPSS 16.0统计软件进行统计学检验, 考察结果差异有无统计学意义。*P < 0.05被认为具有统计学意义。
结果与讨论 1 TM含量测定方法学考察 1.1 检测波长的确定经紫外扫描, TM在200~ 400 nm之间最大吸收峰为295 nm。因此, 295 nm作为检测波长, 且辅料在此处几乎无吸收。
1.2 标准曲线的建立在本色谱条件下, 1~200 µg·mL−1内峰面积与测定浓度线性关系良好。回归方程为: A = 24 906 C + 21 469 (r = 0.999 5)。
1.3 精密度低、中、高浓度的日内精密度分别为1.10%、2.89%和0.71%, 低、中、高浓度的日间精密度分别为4.6%、2.5%和2.4%, 精密度良好。
2 处方优化改变F127、GMO和水的比例, 利用偏光分别对不同的处方进行检测, 利用三元相图对所得到的结果进行分析, 在偏振光下, 层状液晶和反向六角液晶有双折射现象, 层状液晶的偏光纹理为十字花纹或条痕状; 六角液晶为堆砌纹理; 立方液晶无偏振光现象, 呈黑色背景[15]。结果如图 1所示, 采用不同的比例可制备得到立方液晶和层状液晶, 当GMO含量在20%~90% (w/w)、水含量在12%~80%、F127含量在10%~20%时, 能形成立方液晶; 层状液晶出现在GMO含量在10%~90%、水含量在10%~90%、F127含量在0~10%。在此基础上, 利用正交试验进行处方优化, 结果如表 1所示, 根据正交分析可知, 对TM-LCNPs包封率和粒径的主要影响因素:均质压力 > 辅料比例 > 均质次数 > 载药量, 其中均质压力和辅料比例对TM-LCNPs的粒径和包封率影响较大, 故可以通过选择合适的均质压力和辅料比例制备处方。最终确定GMO/F127为9:1, 均质压力为900 bar, 均质次数为6次, 载药量为1%, TM-LCNPs粒径为(201.3 ± 1.9) nm, 包封率约为66.2%。
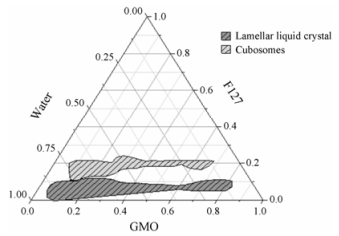
|
Figure 1 The ternary phase diagram composed of different proportions of poloxamer 127 (F127), monoolein (GMO) and water |
| Table 1 The orthogonal design and result of the experiment |
经高压均质后形成的TM-LCNPs的粒径和电位分布情况如图 2所示。结果显示, blank-LCNPs的粒径为(199.7 ± 1.8) nm, TM-LCNPs的粒径为(201.3 ± 1.9) nm, 分布较均匀, zeta电位为(−18.0 ± 0.2) mV。

|
Figure 2 Particle size distribution of timolol maleate cubic nanoparticles (TM-LCNPs). A: Blank-LCNPs; B: TM-LCNPs; C: Potential distribution |
利用偏光显微镜可分层状液晶、立方液晶和六角液晶。图 3为处方优化过程中所选取处方的偏光结果。A为空白液晶、B和C为载药液晶。可以看出, A和B呈暗视野, C呈十字花纹或油状, 初步判断A和B为立方液晶。C为层状液晶。

|
Figure 3 Polarized light texture of TM-LCNPs. A: Blank-LCNPs; B: TM-LCNPs; C: Lamellar liquid crystal |
由GMO、F127、TM、物理混合物(GMO、F127、TM、水)和TM-LCNPs形成的DSC谱图见图 4, 由图可知, GMO在30~220 ℃内不产生特征衍射峰; F127在68 ℃出现特征衍射峰; TM在206 ℃出现特征衍射峰, 物理混合物中在68 ℃和206 ℃依然可见TM和F127的特征衍射峰, 但TM-LCNPs中物理混合物的特征衍射峰消失, 结合偏光检测结果, 进一步表明TM与辅料经处方工艺形成立方液晶纳米粒。
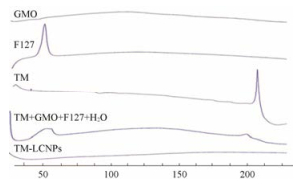
|
Figure 4 Differential scanning calorimeter (DSC) of TM-LCNPs |
TM-LCNPs的体外释放结果见图 5。由图可知, TM水溶液在5 min左右释放量达50%; 50 min左右累积释放了总药量的80%。TM-LCNPs在5 min释放量为10%; 50 min累积释放量达60%, TM水溶液和TM-LCNPs体外释放结果表明, 立方液晶纳米粒的特殊立体空间结构, 可以有效避免药物因突释而随泪滴大量消除, 延缓TM释放, 这种缓释作用结合制剂在眼部的长时间滞留, 可以有效增加药物在眼部的保留时间。推测可能是由于立方液晶内部独特的双水道结构与药物相互作用, 从而降低了药物释放速率。

|
Figure 5 In vitro release profiles of TM solution and TM-LCNPs at 37 ℃ in simulated tear fluid (STF) (n = 3, x ± s) |
立方液晶纳米粒具有两亲性和生物黏附性[8], 且与角膜上皮细胞具有相似的结构特征[16], 更易在角膜上皮细胞聚集并透过角膜到达病灶。因此, 将药物包载于立方液晶纳米粒中可以在一定程度上提高药物在角膜的渗透能力。由图 6所示, TM-LCPNs和市售的TM滴眼液角膜渗透性存在明显差异, 前4 h两者药物累计透过量相近, 4 h后TM-LCNPs的角膜累积透过量明显高于市售滴眼液, 结果表明, TM-LCNPs能够提高水溶性药物TM的角膜渗透能力, 有效减少药物从眼表流失, 提高生物利用度。
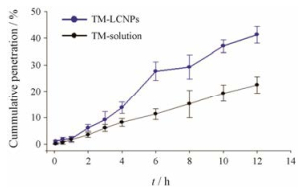
|
Figure 6 In vitro corneal penetration test with TM-LCNPs and TM solution (n = 3, x ± s) |
RhB-LCNPs和罗丹明B水溶液在家兔角膜荧光强度随时间变化情况分别见图 7a, b。RhB-LCNPs和RhB水溶液在家兔角膜滞留情况见图 8。以自身0 min荧光强度为100%, 通过比较在相同时间内两者的荧光强度百分比, 可以看出RhB-LCNPs的荧光强度较RhB水溶液强, 角膜清除速率较慢, 且药物通过鼻泪管流失较少。分析原因可能是由于立方液晶具有闭合脂质双分子层构成蜂窝状结构, 其两亲性可以延长药物在角膜的滞留时间, 有效降低药物的清除率。

|
Figure 7 Observation of Rhodamine B cubic liquid crystal nanoparticles (RhB-LCNPs, a) and Rhodamine B solution (RhB-solution, b) in rabbit cornea retention by fluorescence imaging |

|
Figure 8 RhB-LCNPs and RhB-solution in rabbit corneal retention (n = 3, x ± s) |
分别给予家兔眼滴生理盐水(NS)、SDS和TM-LCNPs, 观察动物的眨眼情况, 时间为10 min, 结果如表 2所示。与NS和TM-LCNPs组相比, 滴加0.1% SDS溶液的兔子眨眼次数明显增多, 经过后续观察眼角有类似分泌物的硬痂, 可能是出现了炎症反应。结果表明TM-LCNPs对家兔眼部没有明显的刺激。
| Table 2 Number of eye blinks in rabbits. n = 5, x ± s. NS: Physiological saline; SDS: Sodium dodecyl sulfate. **P < 0.01 vs SDS group |
给药后的家兔角膜病理切片如图 9所示。结果可见, SDS组的角膜上皮细胞间隙变大, 细胞排列较松散, 出现明显的病理组织变化; NS和TM-LCNPs组的角膜上皮细胞都较为完整, 细胞排列紧密, 基质无明显损伤, 未引起病理组织改变, 结果表明TM-LCNPs对家兔角膜上皮细胞无明显损伤, 较为安全。
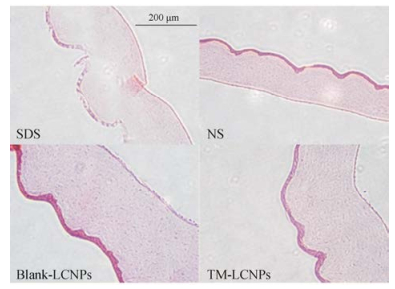
|
Figure 9 Pathological section of rabbit cornea under microscope |
本实验将治疗青光眼药物TM作为模型药物载于新型药物载体立方液晶纳米粒中, 用于评价该制剂在眼部给药中的优势和前景。经处方筛选、制备方法和工艺优化等相关方面的研究, 制备了TM-LCNPs。制剂表征、体外释放性能及眼部刺激性的评价研究表明, TM-LCNPs用于眼部给药, 与市售滴眼液相比, 可以延长药物在眼表滞留时间, 减少给药次数, 增加药物角膜透过性, 同时不会对眼部产生刺激和损伤, 有临床应用价值。
| [1] | Holló G, Katsanos A. Safety and tolerability of the taflu-prost/timolol fixed combination for the treatment of glaucoma[J]. Expert Opin Drug Saf, 2015, 14: 609–617. DOI:10.1517/14740338.2015.1010507 |
| [2] | Karami Z, Hamidi M. Cubosomes:remarkable drug delivery potential[J]. Drug Discov Today, 2016, 21: 789–801. DOI:10.1016/j.drudis.2016.01.004 |
| [3] | Han S, Shen JQ, Gan Y, et al. Novel vehicle based on cubosomes for ophthalmic delivery of flurbiprofen with low irritancy and high bioavailability[J]. Acta Pharmacol Sin, 2010, 31: 990–998. DOI:10.1038/aps.2010.98 |
| [4] | Wu HB, Huo DF, Jiang XG. Advances in the study of lipid-based cubic liquid crystalline nanoparticles as drug delivery system[J]. Acta Pharm Sin (药学学报), 2008, 43: 450–455. |
| [5] | Chen YL, Gui SY, Liang X, et al. Preparation and evaluation of intra-articular injectable sinomenine hydrochloride-loaded in situ liquid crystals[J]. Acta Pharm Sin (药学学报), 2016, 51: 132–139. |
| [6] | Gan L, Han S, Shen J, et al. Self-assembled liquid crystalline nanoparticles as a novel ophthalmic delivery system for dexamethasone:improving preocular retention and ocular bioavailability[J]. Int J Pharm, 2010, 396: 179–187. DOI:10.1016/j.ijpharm.2010.06.015 |
| [7] | Hartnett TE, O'Connor AJ, Ladewig K. Cubosomes and other potential ocular drug delivery vehicles for macromolecular therapeutics[J]. Expert Opin Drug Deliv, 2015, 12: 1513–1526. DOI:10.1517/17425247.2015.1021680 |
| [8] | Góźdź WT. Cubosome topologies at various particle sizes and crystallographic symmetries[J]. Langmuir, 2015, 31: 13321–13326. DOI:10.1021/acs.langmuir.5b03799 |
| [9] | Boyd BJ. Characterisation of drug release from cubos-omes using the pressure ultrafiltration method[J]. Int J Pharm, 2003, 260: 239–247. DOI:10.1016/S0378-5173(03)00262-X |
| [10] | Fu JW, Tu YS, Sun DM, et al. Entrapment efficiency of curcumin and piperine in compound curcumin lipid-based liquid crystalline nanoparticles[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2013, 24: 200–205. |
| [11] | Kojarunchitt T, Baldursdottir S, Dong YD, et al. Modified thermoresponsive Poloxamer 407 and chitosan sol-gels as potential sustained-release vaccine delivery systems[J]. Eur J Pharm Biopharm, 2015, 89: 74–81. DOI:10.1016/j.ejpb.2014.11.026 |
| [12] | Biffi S, Andolfi L, Caltagirone C, et al. Cubosomes for in vivo fluorescence lifetime imaging[J]. Nanotechnology, 2017, 28: 055102. DOI:10.1088/1361-6528/28/5/055102 |
| [13] | Mulet X, Boyd BJ, Drummond CJ. Advances in drug delivery and medical imaging using colloidal lyotropic liquid crystalline dispersions[J]. J Colloid Interface Sci, 2013, 393: 1–20. DOI:10.1016/j.jcis.2012.10.014 |
| [14] | Huang J, Peng T, Li Y, et al. Ocular cubosome drug deliv-ery system for timolol maleate:preparation, characterization, cytotoxicity, ex vivo, and in vivo evaluation[J]. AAPS PharmSciTech, 2017, 18: 2919–2926. DOI:10.1208/s12249-017-0763-8 |
| [15] | Rizwan SB, Boyd BJ. Cubosomes: Structure, Preparation and Use as an Antigen Delivery System[M]//Foged C, Foged T, Foged Y, et al. Subunit Vaccine Delivery. New York: Springer, 2015: 125-140. |
| [16] | Murgia S, Falchi AM, Meli V, et al. Cubosome formulations stabilized by a dansyl-conjugated block copolymer for possible nanomedicine applications[J]. Colloids Surf B Biointerfaces, 2015, 129: 87–94. DOI:10.1016/j.colsurfb.2015.03.025 |
 2018, Vol. 53
2018, Vol. 53


