重金属与有害元素毒性和生物有效性不仅与其浓度相关, 还决定于其化学形态[1−3]。其中, 有机汞因其具有亲脂性和生物放大效应, 毒性大于无机汞, 例如甲基汞(MeHg)的毒性要远高于离子汞(ion-Hg), 并且MeHg具有极强的生物亲和力, 更容易进入体内, 主要侵犯中枢神经系统, 典型症状为末梢感觉错乱、视野收缩、运动性共济失调等, 甲基汞还可透过胎盘屏障, 对胎儿脑细胞发育造成严重损害[4]。日本水俣病事件就是由MeHg污染食物链引起的, 人体血液中MeHg的含量超过0.2 mg·kg−1就会出现中毒症状[5]。甲基汞已被列入2B类致癌物清单中, GB 2762-2017规定水产动物及其制品中MeHg的限量值为0.5 mg·kg−1, 联合国粮食及农业组织和世界卫生组织(FAO/WHO)联合食品添加剂专家委员会(JECFA)规定MeHg的暂定每周可耐受摄入量(PTWI)为1.6 μg·kg−1体重, 美国环境保护署(EPA)规定人体每日摄入MeHg的参考剂量(RfD)为0.1 μg·kg−1。对于砷(As), 无机As的毒性大于有机砷, 亚砷酸盐化合物的可溶性、迁移性和毒性更高[6], 三价砷[As(Ⅲ)]的毒性是五价砷[As(Ⅴ)]的60倍, 是一甲基砷(MMA)的70倍[7]; 而有机态的As中, MMA的毒性要强于其他的有机态As, 砷甜菜碱(AsB)、砷胆碱(AsC)等则基本无毒, 以砷化合物的半数致死量LD50计, 其毒性由大到小依次为AsH3 > As(Ⅲ) > As(Ⅴ) > MMA > DMA > TMAO > AsC > AsB > As[8, 9]。重金属与有害元素主要通过生物链的富集作用进入动物或人体, 其富集倍数可高达1×106~1×107[10, 11]。动物药是来源于动物的药物, 为动物的全体﹑器官或组织等, 与植物药相比, 其在生物链中富集有机态元素的途径更广, 残留问题也变得越来越突出[12], 应给予足够的重视。
然而, 目前动物药的重金属与有害元素残留研究并不系统和深入, 品种涉及不全面, 且主要围绕残留总量开展研究[13], 2015版《中国药典》收录了阿胶、水蛭、蜂胶、牡蛎、蛤壳、珍珠、昆布、海藻、海螵蛸等动物药的重金属与有害元素限量标准[14]。虽有风险评估工作, 但基本是参考当前的国家或国际标准关于总残留量限量的初步分析[15]。据统计, 目前动物药蟾酥、蜈蚣检测过AsB和AsC[16−19], 全蝎检测过6种As元素形态; 尚未发现动物药中Hg元素形态检测的报道, 部分有海产品中Hg元素形态研究。另外, 有少量文献报道了海水[20]、海鱼[21]、白鲸和北极熊中Hg形态[19, 20]。综上所述, 动物药中重金属形态研究及质量控制处于初级阶段, 还有很长的路要走。本文拟对常用动物中As、Hg元素形态残留情况进行系统研究, 为科学的风险评估及质量控制提供基础数据。
材料与方法材料 31种动物药收集于药材市场、各大药店等销售点, 冷藏运输至实验室及时分批打粉并处理。
仪器与试剂 Thermo U-3000高效液相色谱仪(HPLC); 美国iCAP-Q电感耦合等离子体质谱仪(ICP-MS); 美国Millipore超纯水仪(Milli-Q); 德国Christ Alpha 2-4 LD plus实验室型冻干机; 凯达牌TGL16M台式高速冷冻离心机。Hg元素溶液标准物质[GBW(E) 080124, 100 μg·mL−1]、MeHg溶液标准物质(GBW08675, 65.0 ± 2.5 μg·mL−1)、EtHg溶液标准物质[GBW(E) 081524, 70.6 ± 2.5 μg·mL−1]、亚砷酸根[As(Ⅲ), GBW08666, 以As计, 75.7 μg·g−1]、砷酸根[As(Ⅴ), GBW08667, 以As计, 17.5 μg·g−1]、一甲基砷(MMA, GBW08668, 以As计, 25.1 μg·g−1)、二甲基砷(DMA, GBW08669, 以As计, 52.9 μg·g−1)、砷甜菜碱(AsB, GBW08670, 以As计, 38.8 μg·g−1)、砷胆碱(AsC, GBW08671, 以As计, 28.0 μg·g−1)、扇贝成分分析标准物质(GBW10024)、冻干人尿中砷形态成分标准物质(GBW09115), 均购自中国计量科学研究院。乙酸铵(≥99.99%, trace metals basis)、2-巯基乙醇(≥99.0%)、碳酸铵(99.999%, trace metals basis)购自美国Sigma公司; L-半胱氨酸(99%)购自上海阿拉丁生化科技股份有限公司; 盐酸(优级纯)购自国药集团化学试剂有限公司; 硝酸(优级纯)购自美国Fisher公司。
色谱条件 Hg形态: Agilent ZORBAX SB-C18 (250 mm × 4.6 mm, 3.5 μm)分析柱, Agilent ZORBAX SB-C18 (12.5 mm × 4.6 mm, 5 μm)保护住, 流动相:甲醇−0.01 mol·L−1乙酸铵溶液(含0.12% L-半胱氨酸) (8:92), 等度洗脱, 流速0.8 min·mL−1。As形态:离子色谱分析柱Dionex IonPacTM Analytical AS7 (4 mm × 250 mm), 保护柱Dionex IonPacTM Guard AS7 (4 mm × 50 mm), 流动相A 2 mmol·L−1碳酸铵溶液, 流动相B 100 mmol·L−1碳酸铵溶液, 流速1.0 mL·min−1, 梯度洗脱程序见表 1。
| Table 1 Gradient elution program of arsenic speciation |
质谱条件 等离子体射频功率: 1 550 W, 冷却气Ar流速: 14 L·min−1, 雾化气Ar流速: 1.09 L·min−1, 辅助气Ar流速: 0.8 L·min−1, 汞形态测定为STD模式; 砷形态测定为KED模式, 碰撞气He流速: 5.075 mL·min−1, 蠕动泵转速: 40 r·min−1, 监测质量数202Hg和75As。
Hg混合标准溶液 精密称取MeHg和EtHg标准溶液适量(甲醇溶液), 以及Hg2+标准溶液(3%硝酸溶液)适量, 加8%甲醇−92%水(v/v)配制成3种Hg形态浓度均为1 μg·mL−1的混合母液, 以8%甲醇−92%水(v/v)分别稀释成质量浓度为10.00、8.00、5.00、4.00、2.00、0.50和0.20 μg·L−1的Hg形态系列溶液。
As混合标准溶液 分别精密称取MMA、DMA、As(Ⅲ)、As(Ⅴ)、AsB、AsC标准溶液(水溶液)适量, 加超纯水配制成As形态质量浓度均为1 μg·mL−1的混合母液, 以超纯水逐级稀释成质量浓度为50.00、20.00、10.00、5.00、1.00和0.50 μg·L−1等的As形态系列溶液。
供试品溶液的制备
Hg形态 取动物药粉末约0.5 g, 精密称定, 加入提取液(0.12% L-半胱氨酸, 0.10% 2-巯基乙醇, 0.10% HCl溶液) 5 mL, 涡旋混匀静置30 min, 35 ℃ 40 kHz超声提取30 min, 5 000 r·min−1离心5 min, 取上清液0.5 mL于冻干机中冻干, 加0.5 mL流动相溶液复溶, 加至0.5 mL-3 kDa Millipore超滤离心管14 000 r·min−1离心20 min, 滤液供HPLC-ICP-MS进样检测。对于超出线性上限样品, 选择超滤后的样品溶液, 加入流动相稀释至适当倍数后再次进样分析, 计算含量。
As形态 取动物药粉末约0.5 g, 精密称定, 加入纯水5 mL, 涡旋混匀静置30 min, 70 ℃ 40 KHz超声提取30 min, 5 000 r·min−1离心5 min, 收集上清液, 加至0.5 mL-3 kDa Millipore超滤离心管14 000 r·min−1离心20 min, 滤液供HPLC-ICP-MS进样检测。
标准样品的制备
扇贝 取扇贝标准物质约0.5 g, 精密称定, 参照供试品溶液制备项下Hg形态方法制备。
冻干人尿 取冻干人尿As形态标准物质(冻干品, 西林瓶装), 加5.00 mL超纯水溶解, 过0.22 μm滤膜, 待用。
结果 1 方法学考察 1.1 标准工作曲线与检出限取1 μg·mL−1 As、Hg形态混合标样母液, 分别加8%甲醇−92%水、超纯水, 逐级稀释各形态系列溶液。以As、Hg各形态的峰面积为纵坐标, 以浓度为横坐标, 绘制标准曲线。结果表明As、Hg各元素形态的标准曲线线性关系良好, R2值均大于0.999, 3种Hg形态的线性范围为0.2~10 μg·L−1, 5种As形态的线性范围为0.1~100 μg·L−1, 混标色谱图见图 1A、C, 线性考察结果见表 2。
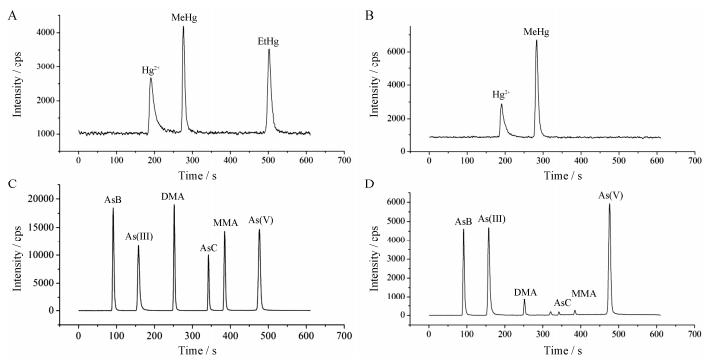
|
Figure 1 Chromatograms of (A) mix standards of mercury speciation, (B) a real sample of Scorpio, (C) mix standards of arsenic speciation, and (D) a real sample of Zaocys |
| Table 2 Standard curves, linear ranges and limit of quantification. MeHg: Methyl mercury; EtHg: Ethyl mercury; As(Ⅲ): Trivalent arsenite; As(Ⅴ): Pentavalent arsenate; MMA: Monomethylarsononous acid; DMA: Dimethylarsinic acid; AsB: Arsenobetaine; AsC: Arsenocholine |
在进样量为10 μL, 流速为0.8 min·mL−1的条件下, 采用逐级稀释法对标准溶液进行稀释, 参考2015版《中国药典》项下药品质量标准分析方法验证指导原则, 以信噪比为10:1时相对应浓度确定定量限, 测定Hg2+、MeHg、EtHg的定量限分别为0.4、0.25、0.65 μg·L−1; 在进样量为10 μL, 流速为1.0 min·mL−1的条件下, 采用逐步稀释法测定AsB、As(Ⅲ)、DMA、AsC、MMA、As(Ⅴ)的定量限分别为0.1、0.2、0.2、0.4、0.2和0.2 μg·L−1。
1.2 仪器精密度取含浓度为1 μg·L−1 Hg和5 μg·L−1 As的混合标准溶液, 连续进样6次, 分别以As、Hg各形态峰面积值计算RSD值。各形态的RSD值均小于2%, 说明仪器精密度良好。
1.3 重复性分别取全蝎、乌梢蛇粉末约0.5 g, 精密称定, 平行操作6份, 分别按供试品溶液中Hg形态和As形态的制备方法操作, 按照上述色谱条件和质谱条件进行测定, 计算Hg、As元素形态含量。结果表明Hg2+、MeHg的含量均值分别为46.12、45.12 μg·kg−1, RSD分别为5.31%、6.16%; AsB、As(Ⅲ)、DMA、AsC、MMA、As(Ⅴ)的含量均值分别为102.48、170.12、20.18、5.77、6.22和23.15 μg·kg−1, RSD分别为4.73%、3.99%、6.64%、5.03%、2.41%和3.84%。
1.4 加样回收率取重复性实验所用全蝎、乌梢蛇样品粉末各约0.5 g (已计算Hg、As元素形态含量), 精密称定, 置于离心管中, 分别加入3个水平的Hg、As标准溶液(表 3), 按照供试品溶液的制备方法及上述色谱和质谱条件进行测定, 计算加样回收率。结果表明Hg2+、MeHg在20、40和80 μg·kg−1的添加水平时的加样回收率均值范围为90.8%~116.6%; AsB、As(Ⅲ)在50、100和200 μg·kg−1的添加水平时的加样回收率均值范围为92.0%~117.4%; DMA、As(Ⅴ)在10、20和40 μg·kg−1的添加水平时的加样回收率均值范围为96.7%~108.7%; AsC、MMA在5、10和20 μg·kg−1的添加水平时的加样回收率均值范围为86.9%~98.2% (表 3)。
| Table 3 Recoveries and precisions of the method in Scorpio and Zaocys samples. n = 3 |
取扇贝标准物质约0.5 g, 精密称定, 参照供试品溶液制备项下Hg形态方法制备。结果表明Hg2+、MeHg的平均检出值分别为18.14和24.45 μg·kg−1, 3种常见形态的总量为(42.59 ± 1.49) μg·kg−1, 在标定值(40 ± 7) μg·kg−1范围内(表 4)。
| Table 4 Contents of mercury speciation in certified reference scallop by HPLC-ICP-MS (n = 3) |
取冻干人尿As形态标准物质, 按照说明加超纯水溶解, 过膜检测, 结果表明As(Ⅲ)、DMA、MMA的检出值分别为11.25 ± 0.10、62.45 ± 2.3、16.12 ± 0.50 μg·kg−1, 在标定值的范围内(表 5)。
| Table 5 Contents of arsenic speciation in certified reference lyophilized human urine by HPLC-ICP-MS (n = 3, x ± s) |
以上结果表明所建立的方法适合于动物药中As、Hg元素形体的定量分析。
3 样品分析采用上述建立的方法和操作步骤, 采用HPLC-ICP-MS法对31种动物药共87个批次的As、Hg元素形态进行了测定, 结果见表 6、表 7和图 1B, D。
| Table 6 The contents of mercury speciation in 31 animal medicines. ND: Not detected |
| Table 7 The contents of arsenic speciation in 31 animal medicines. ND: Not detected |
牛黄、麝香和冬虫夏草收集到1批, 其他品种各收集到3批。结果发现, 31种动物药共87个批次均检测到Hg2+, 含量为2.39~6567 μg·kg−1, 其中地龙、蝉蜕、僵蚕、鹿角的检出值最高, 冬虫夏草和牛黄次之; 12种动物药共33个批次检测到MeHg, 含量为2.83~319.7 μg·kg−1, 其中蕲蛇、金钱白花蛇、蜈蚣、乌梢蛇的检出值较高。EtHg均未检出(表 6)。其中有部分样品的单批检出值与另外两批差异较大, 提示重金属污染不仅与品种相关, 也与其生长环境相关。
31种动物药批次中不同砷形态的检出率分别为: As(Ⅲ): 96.77%, As(Ⅴ): 100%, MMA: 45.16%, DMA: 90.32%, AsB: 93.55%, AsC: 22.58%。其中, As(Ⅲ)检出值最高的品种为地龙, 其次为蕲蛇、乌梢蛇、水蛭、僵蚕; As(Ⅴ)与MMA检出值最高的品种为地龙; DMA检出值最高的品种为海螵蛸、海龙, 其次为金钱白花蛇、土鳖虫、水蛭; AsB检出值较高的是海龙、海螵蛸; AsC检出值最高的品种为海龙、海螵蛸, 其次为地龙、乌梢蛇、蜈蚣。结果见表 7。
讨论本文对常用动物药的Hg、As元素形态进行了分析, 结果表明重金属总量与形态并非呈简单的正相关。以Hg元素为例, 大部分动物药品种以Hg2+为主(如地龙、蝉蜕), 少部分则以MeHg为主(如蛇类动物药)。蕲蛇的Hg2+含量低于10 μg·kg−1, 但其中MeHg含量高达300 μg·kg−1, 提示该品种的风险较高, 与地龙(Hg2+ > 4 000 μg·kg−1, MeHg < 20 μg·kg−1)相比更有控制必要。另外, 地龙中As(Ⅲ)和As(Ⅴ)含量高, 而海洋动物药中AsB与AsC含量高。由于不同形态的重金属毒性可能相差极大, 单以总量控制的模式存在明显的弊端。
中药的风险评估工作刚刚起步, 重金属的风险评估也逐渐有报道。Zhou等[22]采用人工胃肠消化模型, 测定重金属在全粉及煎煮入药方式下的转移率, 并利用靶标危害系数法(target hazard quotient, THQ)对黄连的重金属风险进行风险评估, 该评估是基于5种重金属的总摄入量及转移率, 结果黄连重金属含量处于安全范围, 不会对人体产生明显危害。Zuo等[23]对冬虫夏草中砷进行了风险评估, 该评估是基于WHO推荐的无机As的暂定每周耐受摄入量(provisional tlerable weekly intake, PTWI), 结合危害指数(hazard index, HI)、癌症风险(cancer risk, CR)、THQ等进行风险评估, 进而提出人群建议消费率2月/年时可将健康风险降至最低。
笔者认为中药材重金属风险评估首先应明确评估目的, 收集相关信息和数据, 可先进行保守评估, 如评估结论是风险极低, 则无需进一步评估; 相反, 对于风险高的品种, 应针对其毒性强的存在形态进行评估, 对中药材(如动物药)的每日服用量、服用天数等进行系统的调研和统计(如中国居民中药消费情况调查), 并选择合适的模型进行风险评估。此外, 在进行中药材中重金属风险评估时, 不应忽略日常膳食的重金属暴露, 明确留给中药的暴露空间。
最后, 关于重金属与有害元素现行的限量标准, 中国药典2015版共收载动物药46种, 部分动物药如水蛭、牡蛎、海藻、海螵蛸等收录了重金属总限量[14], 但并未收录Hg、As残留水平很高的地龙、蝉蜕、僵蚕等品种。更为重要的是, 现行的标准控制模式对于高毒形态的残留无法控制, 如蕲蛇、金钱白花蛇、蜈蚣等, 而对于这类动物药品种需要针对某种或某一类高毒形态进行评估(如MeHg、无机As), 计算最大限量理论值并结合中药的污染特点对理论值进行修订, 制定适合我国当前国情的动物药重金属形态限量标准。
| [1] | Han X, Luo JY, Yang MH, et al. The present situation of Chinese herbal pieces with heavy metals and harmful elements and the control measures[J]. World Chin Med (世界中医药), 2015, 10: 1152–1156. |
| [2] | Han X, Luo JY, Liu QT, et al. Study on species and valence state of heavy metals and deleterious elements of mineral medicine[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4552–4559. |
| [3] | Zhang PD, Xu GW, Wei FS. Recent study of the analytical methods in arsenic speciation[J]. Chin J Anal Chem (分析化学), 2001, 29: 971. |
| [4] | Clarkson TW, Magos L, Myers GJ. The toxicology of mercury:current exposures and clinical manifestations[J]. New Eng J Med, 2003, 349: 1731–1737. DOI:10.1056/NEJMra022471 |
| [5] | Shang LH, Feng XB, Yan HY, et al. The review of the analytical methods of methylmercury in environment samples[J]. Earth Environ, 2004, 32: 17–22. |
| [6] | Guo HM, Yang SZ, Shen ZL. High arsenic groundwater in the world:overview and research perspectives[J]. Adv Earth Sci (地球科学进展), 2007, 22: 1109–1117. |
| [7] | Thomas MG, Gregory KD, Mccleskey RB, et al. Rapid arsenic oxidation by thermus aquaticus and thermus thermophilus:fied and laboratory investigations[J]. Environ Sci Techol, 2001, 35: 3857–3862. DOI:10.1021/es010816f |
| [8] | World Health Organization (WHO). Arsenic and arsenic compound (environmental health ctiteria 224)[R]. 2nd ed. Geneva: International Programme on Chemical Safety, 2001: 224. |
| [9] | Vega L, Styblo M, Patterson R, et al. Differential effects of trivalent and pentavalent arsenicals on cell proliferation and cytokine secretion in normal human-epidermal keratinocytes[J]. Toxicol Appl Pharm, 2002, 172: 225. |
| [10] | Li LM, Xia J, Wang XM, et al. Speciations of soluble arsenic in five Chinese patent medicines by HPLC-ICP-MS[J]. Chin Tradit Pat Med (中成药), 2012, 34: 2118. |
| [11] | Liu CZ, Wang SR. Kinetic spectrophotometric determination of trace mercury(Ⅱ) in pollute waters[J]. Analy Chem (分析化学), 1990, 18: 348–351. |
| [12] | Zhao LH, Yang YH, Hu YC, et al. Current situation analysis and countermeasures on contamination of heavy metal in traditional Chinese medicinal materials in China[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 1199–1206. |
| [13] | Zuo TT, Li YL, Jin HY, et al. Determination of residues of heavy metals and harmful elements in 18 types of animal medicines by ICP-MS and preliminary risk analysis[J]. Chin J Pharm Anal (药物分析杂志), 2017, 37: 237–242. |
| [14] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol 1. 2015 ed. Beijing: China Medical Science Press, 2015: 84, 173, 209, 232, 295, 300, 343, 358. |
| [15] | Guo LP, Zhou L, Wang S, et al. Statistic analysis of heavy metal residues in Chinese crude drugs with the international standards of Chinese medicine-Chinese herbal medicine heavy metal limit[J]. Sci Technol Rev (科技导报), 2017, 35: 91–98. |
| [16] | Hao CL, Zhao L, Zhuang ZX. Analysis of arsenic speciation in traditional Chinese medicines by hyphenated technique of high performance liquid chromatography-inductively coupled plasma mass spec-trometry[J]. Chin J Anal Lab (分析试验室), 2011, 30: 90–93. |
| [17] | Hao CL, Wang G, Yu JJ, et al. Arsenic speciation analysis of 15 traditional Chinese medicines[J]. J Instrum Anal (分析测试学报), 2009, 28: 918–921. |
| [18] | Wang G. Determination of Heavy Metals and Speciation Analysis of Mercury and Arsenic in Marine and Chinese Medicinal Herbs by ICP-MS (ICPMS用于海洋和中药材中重金属元素及其汞砷形态分析的研究)[D]. Jinan: Shan-dong University, 2008. |
| [19] | Cao X. Identification of Arsenic and Arsenic Metabolites Based on Chemical Speciation Analysis (以形态分析为基础的砷及砷生物代谢过程与产物的表征研究)[D]. Qingdao: Ocean University of China, 2009. |
| [20] | Chen XP, Han C, Cheng HY, et al. Rapid speciation analysis of mercury in seawater and marine fish bycation exchange chromatography hyphenated with inductively coupled plasma mass spectrometry[J]. J Chromatogr A, 2013, 1314: 86–93. DOI:10.1016/j.chroma.2013.08.104 |
| [21] | Montero-Alvarez A, de la Campa MRF, Sanz-Medel A. Mercury speciation in Cuban commercial edible fish by HPLC-ICP-MS using the double spike isotope dilution analysis strategy[J]. Int J Environ Anal Chem, 2014, 94: 36–47. DOI:10.1080/03067319.2013.814119 |
| [22] | Zhou L, Yang J, Zhan ZL, et al. Determination of heavy metals in Coptidis Rhizoma of different habitats and risk assessment of heavy metals under different ways of administration[J]. Acta Pharm Sin (药学学报), 2018, 53: 432–438. |
| [23] | Zuo TT, Li YL, Jin HY, et al. HPLC-ICP-MS speciation analysis and risk assessment of rsenic in Cordyceps sinensis[J]. Chin Med, 2018, 13: 19. DOI:10.1186/s13020-018-0178-9 |
 2018, Vol. 53
2018, Vol. 53


