雷公藤(Tripterygium wilfordii Hook F)属于卫矛科雷公藤属植物, 在我国具有悠久的药用历史, 具有免疫抑制[1]、抗肿瘤[2]等活性。临床上主要使用其多苷提取物的制剂治疗类风湿和慢性肾炎等自身免疫性疾病[3−5], 具有良好疗效。然而雷公藤多苷片(Tripterygium glycosides tablets, TGT)对肝肾组织具有严重的毒副作用[6, 7]:临床研究发现雷公藤多苷片(1 mg·kg−1·d−1)治疗2个月后患者转氨酶升高[8]; 过量使用雷公藤多苷片可诱发肾功能异常甚至肾衰竭[9]。动物实验也发现连续给予雷公藤多苷片(100 mg·kg−1·d−1) 10天可引起肾小球肾炎模型大鼠血中谷丙转氨酶(alanine aminotransferase, ALT)水平显著升高, 并导致肝组织病变[10]。连续给予雷公藤多苷片(600 mg·kg−1·d−1) 16天可引起大鼠肾近端小管功能异常及病理异常[11]。但是目前雷公藤多苷片的毒性作用机制研究较少。已报道的仅包括采用代谢组学技术发现其毒性作用与能量代谢紊乱、氨基酸和胆碱代谢上调、肠道菌群失调有关[12]; 以及与免疫细胞活性受到抑制及诱导炎症因子合成有关[13]。
鞘脂(sphingolipid, SPL)是一类重要的内源性脂质, 参与调节细胞生长、分化、衰老和凋亡等信号传导过程[14, 15], 包括二氢鞘氨醇(dihydrosphingosine, dhSph)、二氢神经酰胺(dihydroceramide, dhCer)、神经酰胺(ceramide, Cer)、1-磷酸-神经酰胺(ceramide-1-phosphate, Cer-1-P)、葡萄糖基神经酰胺(glucosylceramide, HexCer)、半乳糖基神经酰胺(galactosylceramide, HexCer)、神经鞘磷脂(sphingomyelin, SM)等。SPL及其合成代谢酶共同组成SPL代谢网络, 发挥生理功能。研究表明多种疾病都与SPL代谢异常相关[16, 17]。如Ⅰ型糖尿病动物模型中含C24:1脂肪酸链的Cer、SM、HexCer水平显著升高, Sph-1-P显著降低[18]。遗传性感觉神经病Ⅰ型的发病机制为dhCer脱氢酶基因发生突变, 导致体内Cer水平显著升高, 引起神经细胞凋亡[19]。头颈部肿瘤组织中dhCer合成酶Lass1的mRNA表达显著降低, 其产物Cer(C18:0)显著下调, 并且SPL水平与肿瘤发展周期呈高度相关性[20]。作者之前的研究表明雷公藤多苷片的主要成分雷公藤甲素对迟发型超敏反应(delayed-type hypersensitivity, DTH)的抑制作用和组织毒性与其对SPL代谢的调节密切相关[21, 22]。
代谢组学和转录组学可以从整体水平研究生物体受到内在和外在因素刺激后产生的内源性代谢应答, 已广泛用于疾病的诊断治疗、药物药效和毒副作用机制的研究。利用这两种组学方法不仅能够发现中毒诊断和预后评估的生物标志物, 同时为药物毒性作用机制的阐明提供帮助[23−26]。如马兜铃酸可导致大鼠尿中高半胱氨酸和丝氨酸水平显著上调, 这两种代谢物可作为表征其肾毒性的潜在标志物[23]。柴胡毒素脑损伤研究中发现了大鼠血浆中17种差异代谢物, 并进一步推测柴胡毒素对γ-氨基丁酸受体的抑制作用可能是其毒性作用机制之一[24]。研究启示可以通过整合两种组学技术从SPL代谢角度探索雷公藤多苷片的药效和毒性作用机制并寻找指征其药效和毒性作用的SPL类生物标志物。
因此, 本研究将靶向鞘脂组学技术和转录组学技术相结合, 采用鞘脂组学液质联用分析方法定量分析给予DTH模型小鼠不同剂量的雷公藤多苷片后肝肾组织和血浆中的76种SPL, 采用转录组学荧光定量PCR方法测定肝肾组织中29种SPL合成代谢酶的mRNA表达水平。采用正交偏最小二乘判别分析等模式识别方法和相关性分析方法分析雷公藤多苷片的药效和毒性作用对SPL及其合成代谢酶的影响, 从SPL代谢角度揭示其药效和肝肾毒性的作用机制, 寻找表征雷公藤多苷片药效和毒性的SPL生物标志物, 为其中毒预测和预后判断提供有价值的信息。
材料与方法试剂 雷公藤多苷片购自湖北黄石飞云有限公司(10 mg/片, 以雷公藤多苷提取物计), 使用前研磨成细粉后加入0.5%羧甲基纤维素钠溶液配置成混悬液。甲醇(农残级)购自美国Mallinckrodt Baker公司; 甲酸(分析级)购自TEDIA公司; 甲酸铵(质谱级)、牛血清白蛋白、2, 4-二硝基氟苯(2, 4-dinitrofluorobenzene, DNFB)购自Sigma-Aldrich试剂公司; 超纯水由美国Milli-Q净化系统制备; 所有的SPL标准品均购自美国Avanti Polar Lipids公司。谷丙转氨酶(ALT)、谷草转氨酶(aspartate aminotransferase, AST)、血尿素氮(blood urea nitrogen, BUN)检测试剂盒均购自中生北控生物科技有限公司; 丙二醛(malondialdehyde, MDA)、还原态谷胱甘肽(glutathione reduced, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)试剂盒均购自南京建成生物工程研究所。考马斯亮蓝G250购自SERVA公司; qPCR相关试剂均购自美国Invitrogen公司; 29种SPL酶的引物均由Life Technologies公司提供。
动物实验 BALB/c小鼠(雄性, 6~8周龄, 体重21.3 ± 1.2 g), 购自北京维通利华实验动物技术有限公司。小鼠在中国医学科学院药物研究所动物房nbsp; 清洁间中饲养(12 h光照/黑暗, 温度23 ± 2 ℃, 湿度55% ± 5%, 自由饮水进食)。动物实验遵守中国医学科学院药物研究所动物实验伦理委员会规程。小鼠适应环境两周后开始试验。小鼠随机分为4组, 每组10只, 分别为对照组(control)、DTH模型组(model)、低剂量雷公藤多苷片模型组(15 mg·kg−1, 以雷公藤提取物重量计, 相当于治疗剂量, L-TGT)、高剂量雷公藤多苷片模型组(900 mg·kg−1, 相当于LD50剂量, H-TGT)。
采用丙酮−橄榄油(4:1)混合溶剂溶解配制0.5% DNFB溶液。实验第0天和第1天对模型组和模型给药组小鼠给予0.5% DNFB溶液20 μL刺激后足, 同时对照组小鼠采用空白溶剂刺激。实验第9天对模型组和模型给药组小鼠给予0.5% DNFB溶液20 μL刺激左耳, 诱发迟发型超敏反应, 右耳涂抹空白溶剂20 μL处理。同时对照组小鼠采用空白溶剂处理。在刺激的1 h前和12 h后, 对照组和模型组小鼠灌胃给予0.5%羧甲基纤维素钠溶液, 给药组小鼠灌胃给予对应剂量的给药液。第10天小鼠被处死后, 分取耳片用于耳肿胀系数评价, 血浆用于鞘脂组学分析, 血清用于生化指标测定, 肝肾组织用于荧光定量PCR、鞘脂组学、氧化应激指标分析, 以及病理组织学检查。
生化指标和氧化应激指标测定 采用东芝TBA-40FR全自动生化分析仪测定血清中的ALT, AST和BUN水平。称取肝肾组织约0.1 g加入生理盐水1 mL, 冰浴下高速匀浆制备10%组织匀浆液, 按200 μL体积分装, 分别用于测定SOD活力、MDA水平、GSH的含量、蛋白浓度, 采用组织蛋白浓度对数值进行校正。SOD测定采用黄嘌呤氧化酶法[27], MDA测定采用硫代巴比妥酸沉淀法[28], GSH测定采用二硫代双硝基苯甲酸法[29], 蛋白浓度测定采用考马斯亮蓝法[30]测定。
耳肿胀系数测定和组织病理切片检查 采用万分子一天平分别称量同一小鼠左右耳片的重量, 计算耳肿胀系数。耳肿胀系数(mg) =左耳片重量−右耳片重量。将肝肾组织放入4%福尔马林溶液中固化48 h后组织包埋在石蜡块中, 制成4 μm厚切片, 采用苏木精曙红染色, 用于组织病理学检查。
靶向鞘脂组学分析 靶向鞘脂组学的分析方法参考已发表文献[21, 22]。肝肾组织和血浆中的SPL经甲基叔丁基醚提取后采用Agilent 6410B三重四极杆液质联用仪分析。采用C8色谱柱(150 mm × 3.0 mm, 3 μm; Peeke Scientific, Redwood City, CA)。二元梯度洗脱, 流动相A为含0.2%甲酸的2 mmol·L−1的乙酸铵水溶液, 流动相B为含0.2%甲酸的1 mmol·L−1乙酸铵甲醇溶液, 流速为0.4 mL·min−1。对于不同类型的SPL采用不同的洗脱梯度[21, 22]。进样量为10 μL, 柱温为30 ℃。使用ESI电离源正离子检测模式, 毛细管电压: 4 000 V, 干燥气温度: 350 ℃; 干燥气流速: 6 L·min−1; 雾化气流速: 15 psi; 采用MRM分段扫描模式同时测定76种SPL。采用MassHunter Quantitative Analysis软件计算SPL浓度, 肝肾组织中的SPL水平采用蛋白浓度进行校正。
RNA的分离和实时定量PCR分析 采用Invitrogen RNA试剂提取肝肾组织中总的RNA, 然后以beta-actin作为内参基因, 采用SYBR green法在Applied Biosystems 7500 Fast Real-Time PCR系统上进行实时定量PCR分析。20 μL反转录系统包括cDNA1 μL、提取RNA (含5 μg) 1 μL、dNTP 2 μL、Taq buffer 2 μL、Taq DNA polymerase 0.2 μL、SYBR Green I 0.3 μL、待测酶(含5 pmol) 1 μL、1 μL beta-actin的上游和下游引物和超纯水11.5 μL。PCR反应顺序为: 95 ℃×10 s, 60 ℃×30 s, 40个循环。数据处理时将ACTB基因作为内标基因, 采用2−△△Ct方法计算SPL合成代谢酶基因的mRNA的相对表达量, 其中Ct值为循环阈值, 相对表达量=2−△△Ct; △△Ct= (Ct分析组目标基因−Ct分析组内标基因ACTB) − (Ct对照组目标基因−Ct对照组ACTB内标基因), 计算不同组相对于对照组的表达量。
数据分析 采用SPSS18.0软件(SPSS Inc., Chicago, IL, USA)比较组间数据差异。其中耳肿胀系数、生化指标和氧化应激指标数据采用T检验法; qPCR数据采用单因素方差分析; 鞘脂组学数据首先采用Shapiro-Wilktest检验是否符合正态分布, 对于符合的变量, 采用单因素方差分析, 非正态分布的变量, 采用Mann-Whitney U test检验。显著性判断标准为P < 0.05。将具有显著性差异的SPL导入Simca-P软件(version 12.0.1, Umetrics, Umea, Sweden)正交偏最小二乘判别分析(orthogonal partial least square- discriminate analysis, OPLS-DA)。潜在生物标志物需满足以下标准: ① VIP值大于1; ② jack-knife值不过0点; ③ Pcorr绝对值大于0.58[21, 22]。将潜在生物标志物与生化指标和氧化应激指标进行Spearman相关性分析, 相关系数r绝对值大于0.6为判断相关性的标准。
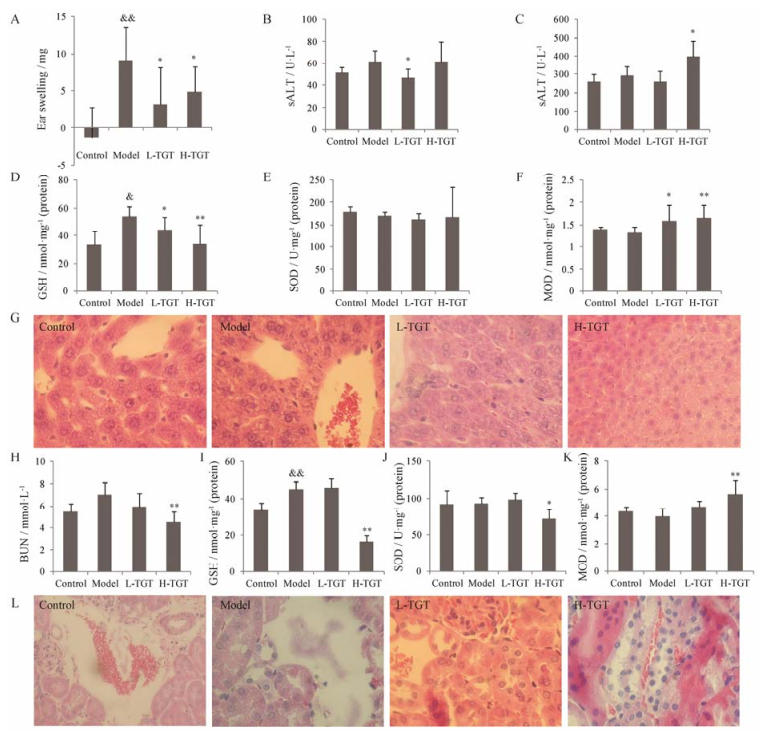
结果 1 雷公藤多苷片对迟发型超敏反应的抑制作用DTH属于T细胞介导的超敏反应[31], 是自身免疫性疾病的重要发病机制。本研究采用了经典的DNFB刺激法建立DTH动物模型[32], 并采用耳肿胀系数评价模型严重程度。结果如图 1A所示, 模型组小鼠的耳肿胀程度比对照组有显著性升高, 表明模型建立成功。与模型组相比, 低剂量多苷片组和高剂量多苷片组的耳肿胀度分别显著降低了64.8%和47.2%。表明不同剂量的雷公藤多苷片对DTH均有显著的抑制作用。
|
Figure 1 Effects of TGT on liver and kidney tissues of delayed-type hypersensitivity (DTH) model mouse. A: Ear swelling index; B: Alanine aminotransferase (ALT); C: Aspartate aminotransferase (AST); D: Malondialdehyde (MDA) in the liver; E: Glutathione reduced (GSH) in the liver; F: Superoxide dismutase (SOD) in the liver; G: histological picture ×200 in the liver; H: Blood urea nitrogen (BUN); I: MDA in the kidney; J: GSH in the kidney; K: SOD in the kidney; L: histological picture ×200 in the kidney. & P < 0.05, & & P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
不同剂量的雷公藤多苷片对DTH模型小鼠肝肾组织的影响采用血清中指征肝功能的生化指标(ALT、AST)和肾功能的生化指标(BUN)、肝肾组织中的氧化应激指标(MDA、GSH、SOD)和组织病理学检查综合评价。
如图 1B~1G所示, 与模型组相比, 低剂量多苷片组小鼠肝组织中GSH水平明显降低, 同时MDA水平显著升高, 但未观察到组织病理学异常, 表明低剂量的雷公藤多苷片可引起肝脏的抗氧化能力降低, 氧化应激水平升高。高剂量多苷片组小鼠AST显著升高, GSH显著降低, MDA显著升高, 组织病理学检查发现5例样本出现1例病理异常, 表现为肝细胞浊肿、变性、坏死和再生, 表明高剂量的雷公藤多苷片可使肝脏抗氧化能力降低, 脂质过氧化产物增加, 并发生显著的组织病理变化。
如图 1H~1L所示, 与模型组相比, 低剂量多苷片组未观察到BUN、氧化应激指标和组织病理的明显变化, 表明低剂量的雷公藤多苷片对肾组织无明显的毒性作用。高剂量多苷片组的GSH和SOD活性水平均显著降低, MDA显著升高, 同时病理检查发现在5例样本中有2例出现肾远曲小管上皮细胞水样变性、坏死和细胞结构消失等异常变化, 表明高剂量的雷公藤多苷片可导致肾的氧化应激升高和组织异常病变。
通过上述结果可见, 低剂量的雷公藤多苷片除了引起肝组织氧化应激水平升高外, 没有产生显著的组织病理改变, 没有发现显著的毒性; 而高剂量的雷公藤多苷片不仅引起肝肾组织中相关生化指标和氧化应激指标的显著异常, 还会引起肝肾组织显著的组织病理变化, 说明产生了显著的肝肾毒性。
3 迟发型超敏反应和雷公藤多苷片对组织和血浆中SPL水平的影响采用鞘脂组学分析平台[21, 22]分析小鼠肝肾组织和血浆中的76种SPL, 并比较不同组间SPL代谢物的差异。与对照组相比, 模型组的肝、肾组织和血浆中分别有2、9和6种SPL发生显著变化; 与模型组相比, 低剂量多苷片和高剂量多苷片组在肝组织中分别有6种和20种SPL发生显著变化, 在肾组织中分别有18种和19种SPL发生显著变化, 在血浆中分别有9种和30种SPL发生显著变化。
3.1 迟发型超敏反应和雷公藤多苷片对不同类型SPL含量的影响如图 2A所示, DTH可引起小鼠肝肾组织和血浆中SPL总量以及不同亚类SPL总量发生显著变化。与对照组相比, 模型组肝和肾组织中Cer(d18:1/18:0)-1-P显著升高, 血浆中Cer总量显著升高。而Cer的升高与疾病和炎症作用相关[33]。
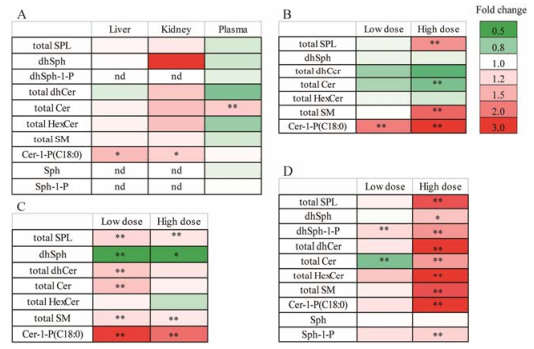
|
Figure 2 Effects of DTH model and TGT on different subspecies sphingolipids. A: Change in different tissues in DTH reactions; B: Change in the liver exposure to TGT; C: Change in the kidney exposure to TGT; D: Change in the plasma exposure to TGT. *P < 0.05, **P < 0.01. Cer: Ceramide; Cer-1-P: Ceramide-1-phosphate; dhCer: Dihydroceramide; dhSph: Dihydrosphingosine; dhSph-1-P: Dihydrosphingosine-1-phosphate; HexCer: Glucosylceramide or galactosylceramide; SM: Sphingomyelin; Sph: Sphingosine; SPL: Sphingolipid |
在肝组织中, 如图 2B所示, 与模型组相比, 低剂量多苷片组Cer(d18:1/18:0)-1-P水平显著升高, 其他亚类SPL无明显影响。Cer-1-P会促进炎症反应[31], 因此推测低剂量的雷公藤多苷片对于肝脏具有促炎的毒性作用。高剂量多苷片组Cer总量显著降低、SPL总量、SM总量和Cer(d18:1/18:0)-1-P显著升高。高低剂量的雷公藤多苷片均能引起Cer(d18:1/18:0)-1-P显著升高, 且呈现剂量相关性, 剂量增加, 其变化加剧, 这可能是大剂量服用多苷片引起肝毒性的原因之一。
在肾组织中, 如图 2C所示, 与模型组相比, 低剂量多苷片组SPL总量、dhCer总量、Cer总量、SM总量、Cer(d18:1/18:0)-1-P含量显著升高, dhSph水平显著降低。dhCer对于细胞凋亡起到抑制作用[14], 因此其总量升高可能与雷公藤多苷片的药效作用有关。高剂量多苷片组SPL总量、SM总量、Cer(d18:1/18:0)-1-P显著升高, dhSph水平显著降低。其中Cer(d18:1/ 18:0)-1-P的升高是雷公藤多苷片引起肾组织毒性的重要作用机制。与肝组织类似, 雷公藤多苷片对肾组织中的SPL的影响呈剂量相关性。
在血浆中, 如图 2D所示, 与模型组相比, 低剂量多苷片组1-磷酸-鞘氨醇(dihydrosphingosine-1-phosphate, dhSph-1-P)水平显著升高, 而Cer总量显著降低, Cer总量的降低可能与其抑制DTH的药效作用有关; 而在高剂量多苷片组中, 除Sph外, 血浆中各亚类SPL含量均呈现显著升高, 其中HexCer总量、Cer总量和Cer(d18:1/18:0)-1-P的升高可能与其毒性作用有关。雷公藤多苷片对于血浆中SPL含量的影响同样表现出剂量相关性。此外, 高剂量的雷公藤多苷片可引起Sph-1-P水平显著升高。有研究表明Sph激酶Sphk控制底物Sph和产物Sph-1-P的代谢平衡, 这一代谢反应对控制细胞存活和凋亡过程发挥重要作用[34], 因此雷公藤多苷片对其调节作用可能是其毒性作用的原因之一。
通过上述结果可见, 高低剂量的雷公藤多苷片可以均引起肝肾组织中的Cer(d18:1/18:0)-1-P含量显著升高, 此外, 高剂量的雷公藤多苷片还会引起肝肾组织中其他多种类型的SPL显著升高, 进一步导致血浆中SPL的整体含量上升, 说明其鞘脂代谢紊乱与其毒性作用密切相关。
3.2 迟发型超敏反应和雷公藤多苷片对不同碳链长度SPL比例的影响按照脂肪酸侧链长度, SPL可分为长链SPL (16~20个碳, long chain SPL)和超长链SPL (22~24个碳, very long chain SPL)。如图 3A所示, 在肝组织中, 与对照组相比, 模型组不同碳链长度的SPL比例无显著变化。与模型组比较, 低剂量多苷片组长链HexCer的比例显著降低, 高剂量多苷片组长链SPL、长链dhCer、长链Cer的比例显著升高, 长链HexCer的比例显著降低。
在肾组织中, 与对照组比较, 模型组不同碳链长度的SPL的比例无显著变化。与模型组比较, 低剂量多苷片组中长链SM比例显著降低, 高剂量多苷片组的长链dhCer比例显著升高, 这些变化可能与其肾组织毒性作用相关。
在血浆中, 模型组的长链SM比例显著低于模型组。与模型组比较, 低剂量多苷片组的长链Cer、长链HexCer和长链SM比例显著升高, 低剂量的雷公藤多苷片对于造模引起的长链SM比例降低有调节作用, 可能与药效作用相关。高剂量多苷片组的长链SM比例显著升高, 长链Cer的比例显著降低。
有文献报道长链Cer的增加伴随着细胞凋亡, 不同链长的Cer之间的平衡对细胞的存活至关重要[35]。高剂量雷公藤多苷片引起肝组织中长链Cer的比例显著升高, 并且肝肾组织中不同链长的多种类型的SPL比例发生显著变化, 显示平衡被破坏, 这可能与其毒性作用机制密切相关。
3.3 迟发型超敏反应和雷公藤多苷片对不同不饱和度SPL比例的影响按照脂肪酸侧链的不饱和度, SPL可分为饱和SPL (不含双键, saturated sphingolipids, satSPL)和不饱和SPL (至少含1个双键, unsaturated sphingolipids, unsatSPL)。如图 3所示, 在肝组织中, 与对照组相比, 模型组的饱和SM比例显著降低。与模型组比较, 低剂量多苷片组的饱和dhCer的比例显著降低, 但高剂量多苷片组的饱和dhCer、饱和SM比例显著上升, 饱和Cer和饱和HexCer比例显著降低。其中饱和SM的比例上升与造模引起的饱和SM比例降低相反, 可能与其药效作用相关。
在肾组织中, 与对照组相比, 模型组的饱和Cer和饱和HexCer的比例显著升高, 而饱和SM的比例显著降低。与模型组相比, 低剂量多苷片组中饱和SPL、饱和dhCer、饱和SM比例均显著降低, 类似地, 高剂量多苷片组的饱和SPL、饱和dhCer、饱和SM、饱和Cer比例均显著降低。其中饱和Cer的降低对造模引起的饱和Cer异常升高有抑制作用, 可能与其药效作用相关。雷公藤多苷片对肾组织中不同不饱和度SPL的影响随剂量增加而加剧, 这也可能与其药效和毒性作用相关。
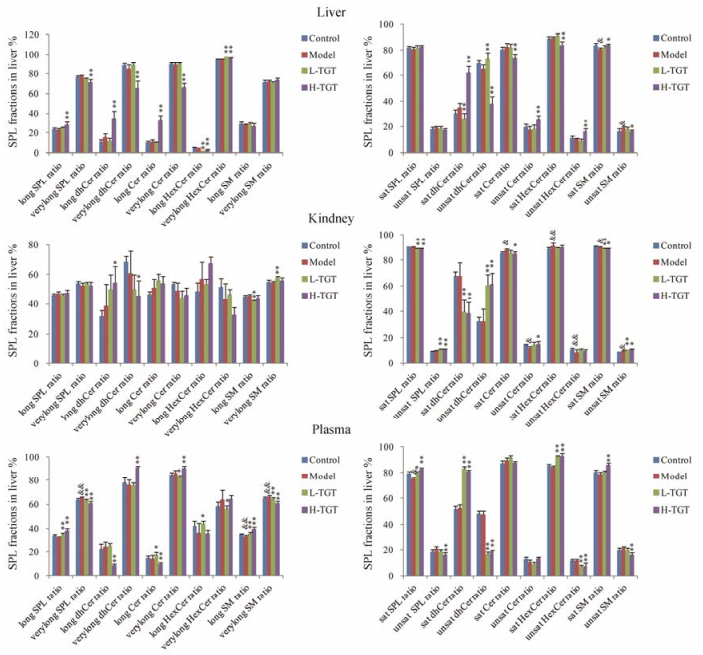
|
Figure 3 The fractions of SPLs and its subspecies with various length and unsaturated acyl chain in liver, kidney and plasma. & P < 0.05, & & P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
在血浆中, 模型组饱和SPL的比例与对照组相比显著降低。与模型组相比, 低剂量多苷片组中饱和SPL、饱和dhCer、饱和HexCer的比例显著升高, 高剂量多苷片组的饱和SPL、饱和dhCer、饱和HexCer、饱和SM比例显著升高, 其中高低剂量雷公藤多苷片对饱和SPL升高与造模引起的饱和SPL异常降低有相反的抑制作用, 可能与其药效作用相关。雷公藤多苷片对血浆中不同不饱和度SPL的影响随剂量的增加而加剧, 可能与其药效和毒性作用相关。
有文献[36]报道, 饱和与不饱和的Cer的比例会影响细胞膜的性质和形态, 改变细胞膜的流动性, 对细胞的功能产生显著影响, 雷公藤多苷片对肝组织中不同不饱和度SPL的调节, 尤其是高剂量的雷公藤多苷片, 可能会打破组织细胞膜中SPL的分布平衡, 从而引起肝肾细胞的功能, 产生毒性作用。
4 迟发型超敏反应和雷公藤多苷片对组织中SPL代谢酶的mRNA表达水平的影响从鞘脂组学研究结果发现雷公藤多苷片的药效与毒性作用均与SPL代谢密切相关, 因此进一步采用转录组学方法研究其对SPL代谢酶的调控作用, 深入揭示雷公藤多苷片影响SPL代谢的机制。在肝组织中, 与对照组相比, 模型组共发现12种SPL代谢酶的转录水平发生显著变化; 与模型组相比, 低剂量多苷片和高剂量多苷片组分别有13种和17种SPL代谢酶的mRNA表达水平发生显著变化。在肾组织中, 与对照组相比, 模型组共发现6种SPL代谢酶的转录水平发生显著变化; 与模型组相比较, 低、高剂量多苷片组分别有12种和2种SPL代谢酶的mRNA表达水平发生显著变化。
4.1 SPL代谢酶mRNA表达水平对SPL含量的影响雷公藤多苷片通过调节相应SPL的合成代谢酶, 进而调节不同类型SPL在体内的水平, 如图 4所示。当给予低剂量的雷公藤多苷片后, 与模型组比较, 肾组织中dhCer脱氢酶1 (degenerative spermatocyte homolog 1 lipid desaturase, Degs1)水平显著升高, 进而引起反应产物Cer的水平升高, 这可能是其毒性作用的调节机制。

|
Figure 4 Possible regulatory effect of TGT on key enzymes and sphingolipids in different tissues. A: Network of sphingolipid metabolism; B: Possible regulatory effect of low dose TGT; C: Possible regulatory effect of high dose TGT |
雷公藤多苷片在高剂量下会引起肝和肾组织中SM水解酶(sphingomyelin phosphodiesterase, Smpd) 1和2转录水平显著降低, 导致两种组织中SM水平显著升高。高剂量多苷片组Sph激酶1 (sphingosine kinase 1, Sphk1)的mRNA表达水平显著上调, 引起血浆中Sph-1-P和dhSph-1-P的水平显著升高。而Sph-1-P对于细胞凋亡具有抑制作用[37], Sphk对SPL代谢的调节作用可能决定了细胞的凋亡或存活[36], 因此, 高剂量的雷公藤多苷片对Sphk酶的调节与其毒性作用相关。此外, 高剂量多苷片组小鼠肾组织中的丝氨酸棕榈酰基转移酶(serine palmitoyltransferase, long chain base subunit, Sptlc) 1和2的mRNA表达显著下调, 进一步引起了dhSph水平显著降低。同时肝组织中Smpd1的mRNA表达显著降低, 导致了肝组织中代谢产物Cer总量显著降低。从上述结果可见, 雷公藤多苷片能够显著调节相关SPL合成代谢酶的mRNA表达水平, 导致SPL代谢的变化, 进而引起雷公藤多苷片的毒性作用。
4.2 Cer合成酶CerS对不同碳链长度SPL比例的影响现已发现真核生物具有6种Cer合成酶(ceramide synthase, CerS), 这6种酶对不同碳链的dhCer具有高度选择性[38], 因此这些酶的转录水平变化对组织和细胞中不同碳链长度SPL比例变化产生较大影响[39]。结果如表 1所示, 在肝组织中, 与模型组相比, 低剂量多苷片组小鼠肝中负责合成超长链Cer的CerS2、CerS4的mRNA表达分别升高了2.6倍和2.8倍, 而合成长链Cer的CerS1、CerS5、CerS6则分别为模型组的−1.1、2和−1.5倍, 鞘脂组学结果显示长链dhCer和Cer的比例均无显著变化。与模型组相比, 高剂量多苷片组小鼠肝中CerS2、CerS4酶的mRNA表达分别降低了38倍和209倍, 而CerS1、CerS5、CerS6则分别降低了1.5、51和33倍, 相应地, 长链dhCer和Cer的比例显著升高。
肾组织与肝组织相似, 如表 1所示, 给予不同剂量的雷公藤多苷片后, 6种CerS酶的转录水平发生了不同程度的变化, 与不同长度碳链SPL的比例变化趋势基本一致, 与文献[40]报道的酶功能相同。合成超长链Cer的CerS酶(CerS2、CerS4)的降低倍数大于合成长链Cer的CerS酶(CerS1、CerS5、CerS6), 从而引起了长链SPL的比例显著升高以及超长链SPL的比例显著降低[40]。这些结果显示雷公藤多苷片可能通过调节CerS酶的表达从而改变不同长度碳链SPL的组成比例。
| Table 1 Change of 6 CerSs at transcriptional levels in liver and kidney induced by TGT |
通过上述对肝肾组织中鞘脂代谢酶的转录组学分析发现, 雷公藤多苷片可以通过调节这些代谢酶, 引起肝肾组织中鞘脂代谢物的显著变化, 进而引起血浆中鞘脂代谢物的改变, 造成机体鞘脂代谢通路改变甚至是紊乱。这与其药效和毒性作用机制密切相关。
5 潜在的SPL生物标志物为了寻找表征雷公藤多苷片药效作用和组织毒性作用的生物标志物, 将组间差异SPL进行OPLS-DA分析, 筛选出能够区分不同的差异代谢物。其中区分模型组与药效剂量组的SPL作为表征药效作用的潜在生物标志物, 如表 2所示, 在肝、肾组织和血浆中分别发现2、16和2种SPL生物标志物。
| Table 2 Fold changes of SPL biomarkers associated with therapeutic effects, hepatotoxicity and nephrotoxicity of TGT |
将区分模型组与中毒剂量组的SPL代谢物与指征肝肾组织毒性的生化指标和氧化应激指标进行相关性分析, 筛选出指征雷公藤多苷片毒性作用的生物标志物。根据生化指标和氧化应激指标结果, 选择ALT、AST、SOD、GSH作为评价肝组织毒性作用的指标, SOD、GSH作为评价肾组织毒性作用的指标。如表 2所示, 在肝组织和血浆中分别发现13和10种与潜在的肝毒性生物标志物, 在肾组织和血浆中分别发现14和9种潜在的肾毒性生物标志物。
讨论本研究整合鞘脂组学和转录组学技术研究给予不同剂量雷公藤多苷片后DTH模型小鼠肝肾组织和血浆中SPL水平及其相关合成代谢酶的mRNA表达水平的变化, 从SPL代谢角度探索雷公藤多苷片药效和毒性作用机制。研究结果首先发现不同剂量的雷公藤多苷片对DTH均有显著的抑制作用。高剂量的多苷片能引起肝肾组织的损伤, 表现为生化指标异常、氧化应激加剧和组织病理异常。其次, 通过鞘脂组学手段从不同亚类SPL含量、不同碳链长度和不饱和度的SPL比例角度分析发现: ①低剂量的雷公藤多苷片可引起血浆中Cer总量显著降低, 可能与其药效作用相关; 高剂量的雷公藤多苷片可引起血浆、肝肾组织中Cer总量和Cer(d18:1/18:0)-1-P水平显著升高, 这些变化可能进一步激活下游与炎症、氧化应激、细胞凋亡相关的信号通路, 导致其毒性作用。②低剂量的雷公藤多苷片主要引起长链SPL比例在肝肾组织中降低在血浆中显著升高, 而高剂量的雷公藤多苷片引起长链SPL比例在组织和血浆中均显著升高。此外, 雷公藤多苷片引起饱和SPL比例在肝肾组织中显著降低和血浆中显著升高, 并且不同剂量呈现出明显差异。其中一些表现为对DTH引起异常变化的抑制, 可能与药效相关; 另外一些则导致了组织中不同碳链长度和不饱和度SPL分布的失衡, 从而影响细胞膜的相关形态和功能, 与毒性相关。最后, 通过转录组学手段发现雷公藤多苷片能够导致多种SPL代谢酶的转录水平发生明显变化, 它们可能是雷公藤多苷片药效和毒性作用过程中的关键代谢酶, 包括肝组织中的CerS1、Smpd1、Smpd 2、Sphk1和肾组织中的Degs1、Smpd1、Smpd 2。此外, 6种CerS转录水平的差异引起了组织中不同长度碳链SPL比例的差异。结合上述鞘脂组学和转录组学的结果可以推测雷公藤多苷片的药效与毒性作用可能是其成分通过对肝肾组织中鞘脂代谢酶的调节, 从而引起肝肾组织中鞘脂代谢的改变甚至是紊乱, 鞘脂代谢物从组织进入循环系统, 进而引起血浆中鞘脂代谢物的显著变化。总之, 雷公藤多苷片的药效与毒性作用机制与SPL代谢密切相关, 发现的表征药效和毒性作用的潜在SPL生物标志物对于临床上雷公藤多苷片药效和毒性作用的早期评价具有很好的参考价值, 为其减毒增效研究提供了重要信息。
| [1] | Tao X, Cush JJ, Garret M, et al. A phase I study of ethyl acetate extract of the Chinese antirheumatic herb Tripterygium wilfordii Hook F in rheumatoid arthritis[J]. J Rheumatol, 2001, 28: 2160–2167. |
| [2] | He MF, Liu L, Ge W, et al. Antiangiogenic activity of Tripterygium wilfordii and its terpenoids[J]. J Ethnophar-macol, 2009, 121: 61–68. DOI:10.1016/j.jep.2008.09.033 |
| [3] | Li LS. Clinical study of Tripterygium wilfordii Hook in treating glomerulonephritis[J]. Chin J Intern Med (中华内科杂志), 1981, 20: 216–220. |
| [4] | Canter PH, Lee HS, Ernst E. A systematic review of randomised clinical trials of Tripterygium wilfordii for rheu-matoid arthritis[J]. Phytomedicine, 2006, 13: 371–377. DOI:10.1016/j.phymed.2006.01.010 |
| [5] | Ho LJ, Lai JH. Chinese herbs as immunomodulators and potential disease-modifying antirheumatic drugs in autoim-mune disorders[J]. Curr Drug Metab, 2004, 5: 181–192. DOI:10.2174/1389200043489081 |
| [6] | Jiang YS, Zhao S. Tripterygium wilfordii Hook induced acute toxicity with kidney involvement in 17 cases[J]. Chin J Kidney Dis (中华肾脏病杂志), 1987, 3: 167. |
| [7] | Chen LN, Cai H, Yu DY. Clinical analysis of 10 cases of Tripterygium wilfordii Hook induced toxicity[J]. Jiangsu Med J (江苏医药), 1987, 13: 667. |
| [8] | Xu G, Tu W, Jiang D, et al. Tripterygium wilfordii Hook F treatment for idiopathic refractory nephrotic syndrome in adults:a meta-analysis[J]. Nephron Clin Pract, 2009, 111: c223–c228. DOI:10.1159/000208990 |
| [9] | Bi KB. Acute renal failure induced by Tripterygium wilfordii Hook F:clinical analysis of 20 cases[J]. Chin J Mod Appl Pharm (中国现代应用药学杂志), 2000, 6: 502. |
| [10] | Wan YG, Zhao Q, Sun W, et al. Contrasting dose-effects of multi-glycoside of Tripterygium wilfordii Hook. F. on glomerular inflammation and hepatic damage in two types of anti-Thy1.1 glomerulonephritis[J]. J Pharmacol Sci, 2012, 118: 433–446. DOI:10.1254/jphs.11157FP |
| [11] | Dan H, Peng RX, Ao Y, et al. Segment-specific proximal tubule injury in Tripterygium glycosides intoxicated rats[J]. J Biochem Mol Toxic, 2008, 22: 422–428. DOI:10.1002/jbt.v22:6 |
| [12] | Chen M, Ni Y, Duan H, et al. Mass spectrometry-based metabolic profiling of rat urine associated with general toxicity induced by the multiglycoside of Tripterygium wilfordii Hook. F[J]. Chem Res Toxicol, 2008, 21: 288–294. DOI:10.1021/tx7002905 |
| [13] | Tang SX, Yang X, Ding RL, et al. Study on the "time-toxicity" relationship and mechanisms of immunotoxicity of liver injury induced by Tripterygium glycosides in rats[J]. Pharm Clin Chin Mater Med (中药药理与临床), 2012, 28: 78–82. |
| [14] | Young MM, Kester M, Wang HG. Sphingolipids:regulators of crosstalk between apoptosis and autophagy[J]. J Lipid Res, 2013, 54: 5–19. DOI:10.1194/jlr.R031278 |
| [15] | Hannun YA, Obeid LM. Principles of bioactive lipid signalling:lessons from sphingolipids[J]. Nat Rev Mol Cell Bio, 2008, 9: 139–150. DOI:10.1038/nrm2329 |
| [16] | Kolter T. A view on sphingolipids and disease[J]. Chem Phys Lipids, 2011, 164: 590–606. DOI:10.1016/j.chemphyslip.2011.04.013 |
| [17] | Napolitano G, Karin M. Sphingolipids:the oil on the TRA Fire that promotes inflammation[J]. Sci Signal, 2010, 3: pe34. |
| [18] | Fox TE, Bewley MC, Unrath KA, et al. Circulating sphin-golipid biomarkers in models of type 1 diabetes[J]. J Lipid Res, 2011, 52: 509–517. DOI:10.1194/jlr.M010595 |
| [19] | Dawkins JL, Hulme DJ, Brahmbhatt SB, et al. Mutations in SPTLC1, encoding serine palmitoyltransferase, long chain base subunit-1, cause hereditary sensory neuropathy type Ⅰ[J]. Nat genet, 2001, 27: 309–312. DOI:10.1038/85879 |
| [20] | Karahatay S, Thomas K, Koybasi S, et al. Clinical relevance of ceramide metabolism in the pathogenesis of human head and neck squamous cell carcinoma (HNSCC):attenuation of C18-ceramide in HNSCC tumors correlates with lymphovascular invasion and nodal metastasis[J]. Cancer lett, 2007, 256: 101–111. DOI:10.1016/j.canlet.2007.06.003 |
| [21] | Qu F, Wu CS, Hou JF, et al. Sphingolipids as new biomarkers for assessment of delayed-type hypersensitivity and response to triptolide[J]. PLoS One, 2012, 7: 5806–5819. |
| [22] | Qu L, Qu F, Jia Z, et al. Integrated targeted sphingolipidomics and transcriptomics reveal abnormal sphingolipid metabolism as a novel mechanism of the hepatotoxicity and nephrotoxicity of triptolide[J]. J Eth-nopharmacol, 2015, 170: 28–38. |
| [23] | Chen M, Su M, Zhao L, et al. Metabonomic study of aris-tolochic acid-induced nephrotoxicity in rats[J]. J Pro-teome Res, 2006, 5: 995–1002. DOI:10.1021/pr050404w |
| [24] | Zhang Z, Lu C, Liu X, et al. Global and targeted me-tabolomics reveal that bupleurotoxin, a toxic type of polyacetylene, induces cerebral lesion by inhibiting GABA receptor in mice[J]. J Proteome Res, 2013, 13: 925–933. |
| [25] | Joseph P, Umbright C, Sellamuthu R. Blood transcriptomics:applications in toxicology[J]. J Appl Toxicol, 2013, 33: 1193–1202. |
| [26] | Amin RP, Vickers AE, Sistare F, et al. Identification of putative gene based markers of renal toxicity[J]. Environ Health Persp, 2004, 112: 465–479. DOI:10.1289/ehp.6683 |
| [27] | Sun YI, Oberley LW, Li Y. A simple method for clinical assay of superoxide dismutase[J]. Clin Chem, 1988, 34: 497–500. |
| [28] | Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J]. Anal Biochem, 1979, 95: 351–358. DOI:10.1016/0003-2697(79)90738-3 |
| [29] | Ellman GL. Tissue sulfhydryl groups[J]. Arch Biochem Biophys, 1959, 82: 70–77. DOI:10.1016/0003-9861(59)90090-6 |
| [30] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72: 248–254. DOI:10.1016/0003-2697(76)90527-3 |
| [31] | Adam J, Pichler WJ, Yerly D. Delayed drug hypersensitivity:models of T-cell stimulation[J]. Brit J Clin Pharmacol, 2011, 71: 701–707. DOI:10.1111/j.1365-2125.2010.03764.x |
| [32] | Feng YH, Zhou WL, Wu QL, et al. Low dose of resveratrol enhanced immune response of mice[J]. Acta Pharmacol Sin, 2002, 23: 893–897. |
| [33] | Maceyka M, Spiegel S. Sphingolipid metabolites in inflamematory disease[J]. Nature, 2014, 510: 58–67. DOI:10.1038/nature13475 |
| [34] | Haass NK, Nassif N, McGowan EM. Switching the sphin-golipid rheostat in the treatment of diabetes and cancer comorbidity from a problem to an advantage[J]. Biomed Res Int, 2015, 2015: 165105. |
| [35] | Hartmann D, Lucks J, Fuchs S, et al. Long chain ceramides and very long chain ceramides have opposite effects on human breast and colon cancer cell growth[J]. Int J Biochem Cell B, 2012, 44: 620–628. DOI:10.1016/j.biocel.2011.12.019 |
| [36] | Pinto SN, Silva LC, Futerman AH, et al. Effect of ceramide structure on membrane biophysical properties:the role of acyl chain length and unsaturation[J]. BBA-Biomembranes, 2011, 1808: 2753–2760. DOI:10.1016/j.bbamem.2011.07.023 |
| [37] | Laychock SG, Tian Y, Sessanna SM. Endothelial differentiation gene receptors in pancreatic islets and INS-1 cells[J]. Diabetes, 2003, 52: 1986–1993. DOI:10.2337/diabetes.52.8.1986 |
| [38] | Mizutani Y, Kihara A, Igarashi Y. Mammalian Lass6 and its related family members regulate synthesis of specific ceramides[J]. Biochem J, 2005, 390: 263–271. DOI:10.1042/BJ20050291 |
| [39] | Hartmann D, Wegner MS, Wanger RA, et al. The equilib-rium between long and very long chain ceramides is important for the fate of the cell and can be influenced by co-expression of CerS[J]. Int J Biochem Cell B, 2013, 45: 1195–1203. DOI:10.1016/j.biocel.2013.03.012 |
| [40] | Mullen TD, Spassieva S, Jenkins RW, et al. Selective knockdown of ceramide synthases reveals complex interregulation of sphingolipid metabolism[J]. J Lipid Res, 2011, 52: 68–77. DOI:10.1194/jlr.M009142 |
 2018, Vol. 53
2018, Vol. 53


