2. 山东大学药学院, 山东 济南 250012
2. School of Pharmacy, Shandong University, Ji'nan 250012, China
植物内生菌(endophyte)是一定阶段或全部阶段生活在健康植物的组织内部而不引起明显负面影响的微生物, 主要包括真菌和细菌[1, 2]。植物内生菌之间, 内生菌和宿主植物之间, 以及内生菌和外界环境之间存在着长期、稳定且复杂的相互作用[3]。这些互作特点促使内生菌具有较强的生物合成能力, 可以产生结构新颖、类型多样、活性广泛的次级代谢产物[4]。内生菌已成为药物先导化合物发现的重要源泉。
小檗科植物狭叶十大功劳(Mahonia fortunei)作为传统的中国药用植物, 具有清热解毒、消肿、止痢疾等功效[5]。基于内生菌和宿主植物的互作机制, 药用植物十大功劳在功能内生菌发现方面有一定的优势[6]。本课题组前期研究发现, 采自上海的一株十大功劳内生真菌Diaporthe sp. LG23可以产生一个结构新颖且具有芳香B环的四环三萜类化合物, 此化合物对测试的细菌具有明显的抑制活性[7]; 采自广州的一株十大功劳内生真菌Fusarium decemcellulare LG53可以生物合成3个新环五肽类化合物[8]。基于以上研究背景, 继续对植物十大功劳内生真菌进行化学研究, 以期发现结构新颖且活性良好的次级代谢产物。本工作对采自青岛的一株十大功劳内生真菌Colletotrichum fioriniae F18进行大规模发酵, 分离纯化得到了3个吲哚衍生物(1~3)和6个芳香化合物(4~9) (图 1), 其中化合物1为新化合物。

|
Figure 1 Chemical structures of compounds 1−9 |
化合物1为淡黄色粉末, HR-ESI-MS给出准分子离子峰m/z 220.097 0 ([M+H]+, C12H14NO3+; Calcd. 220.096 8)和242.079 1 ([M+Na]+, C12H13NO3Na+; Calcd. 242.078 8), 推测分子式为C12H13NO3, 不饱和度为7。1H NMR谱图显示化合物含有4个芳香氢信号: 7.12 (1H, t, J = 7.2 Hz, H-5)、7.32 (1H, t, J = 7.2 Hz, H-6)、7.47 (1H, d, J = 7.2 Hz, H-4)和8.11 (1H, d, J = 8.0 Hz, H-7), 说明化合物1结构中含有一个邻位二取代的苯环。13C NMR谱图显示化合物含有12个碳信号, 包括3个连氧碳信号(δC 69.0、88.0和100.8)和一个羰基碳信号(δC 172.8)。1H和13C NMR数据结合2D NMR谱图分析确定了化合物含有1个单峰甲基、2个亚甲基(1个氧化)、1个氮杂缩酮碳信号、1个连氧季碳、6个芳香碳和1个羰基碳。
1H-1H COSY NMR谱证实了化合物中C-2/C-3以及C-4/C-5/C-6/C-7两个片段。通过H-4/C-6、H-4/ C-7a、H-5/C-3b、H-5/C-7、H-6/C-4、H-6/C-7a、H-7/C-5和H-7/C-3b的一系列HMBC相关确定了化合物在C-3b和C-7a处双取代的苯环结构片段。在HMBC谱中, H2-2与C-3a和C-8a、H2-3与C-3a和C-8a以及H-8a与C-2和C-3a存在远程相关, 同时考虑到C-2 (δC 69.0)和C-8a (δC 100.8)的化学位移, 故而确定了一个在C-3a和C-8a处取代的四氢呋喃的结构片段。进一步分析HMBC谱图, H-8a与C-3b和C-7a以及H2-3与C-3b存在远程相关, 同时考虑到C-7a (δC 144.2)和C-8a的化学位移, 确定了C-3a-C-3b和C-7a-N-C-8a的连接。H3-2'/C-1'的HMBC相关以及C-1' (δC 172.8)、H3-2' (δH 2.34)和C-2' (δC 23.5)的化学位移确定了一个乙酰基基团连接在氮原子上。一个羟基基团连接在C-3a位置, 符合C-3a (δC 88.0)化学位移以及质谱分子量的要求。因此, 如图 2所示, 化合物1的平面结构被确定。

|
Figure 2 Key COSY (bold line) and HMBC (arrows) correlations of compound 1 |
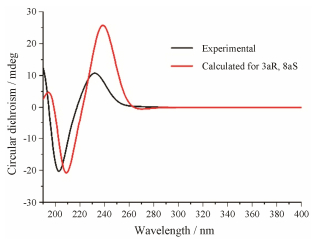
化合物1的绝对构型是通过圆二色谱ECD计算确定的。化合物具有两个手性中心, 存在4种可能的绝对构型(3aR, 8aR; 3aR, 8aS; 3aS, 8aR; 3aS, 8aS), 这4种构型分别进行ECD计算, 计算结果与实验ECD进行比对。采用Frog2 (2.14在线版本)搜索化合物可能存在的构象, 然后使用高斯09进行化合物构象几何优化、频率计算、和ECD计算[9, 10]。计算基组采用6-31G(d), 泛函为杂化泛函B3LYP, 溶剂化模式为极化连续模型PCM。如图 3所示, 构型为(3aR, 8aS)的ECD数据和实验所测得的ECD曲线最为接近。最终化合物1的结构被确定, 并命名为makomotindoline B。经文献检索发现化合物1与天然产物makomotindoline以及madindolines A和B具有相同的吲哚并四氢呋喃母核[11−13]。
|
Figure 3 Experimental and calculated ECD spectra of compound 1 |
Broker Avance DRX-600型核磁共振波谱仪(布鲁克公司); LTQ-Orbitrap高分辨质谱仪(赛默飞世尔科技公司); Thermo Scientific Nicolet iS5 FT-IR光谱仪(赛默飞世尔科技公司); JASCO-815圆二色谱仪(日本JASCO公司); JASCO P-1020旋光仪(日本JASCO公司); 超净台(上海智城分析仪器制造有限公司); 培养箱(上海申贤恒温设备厂); 中低压反相柱色谱仪(天津博纳艾杰尔科技有限公司); 中低压反相柱色谱仪配备一个C18色谱柱(20~5 μm, 100 , 80 g); 中压柱反相柱色谱仪(天津博纳艾杰尔科技有限公司); 中压反相柱色谱仪配备一个C18色谱柱(10 mm × 250 mm, 10 μm); 柱色谱硅胶(200~300目) (青岛海洋化工厂); 薄层色谱硅胶(GF254) (青岛海洋化工厂); Sephadex LH-20 (25~100 μm; Pharmacia Biotech, 丹麦); 氘代甲醇; 其他试剂为分析纯。
菌株F18分离自狭叶十大功劳的茎, 植物材料于2016年10月采自山东青岛中山公园。内生菌分离方法采用之前报道的方法[14, 15]。内生真菌采用ITS序列分析并鉴定为Colletotrichum fioriniae, 序列信息保存在GenBank (序列号为MH256139)。内生真菌编号为F18, 目前保存于青岛大学药学院天然药物与生药学系。
1 发酵产物的分离纯化 1.1 菌株发酵菌株在马铃薯葡萄糖琼脂(PDA)培养基上培养5天(28 ℃), 然后用接菌环挑取菌落接入到20个500 mL锥形瓶(每瓶含有80 g大米、120 mL水和0.3%蛋白胨), 于28 ℃培养箱静置培养30天。
1.2 提取与分离待发酵结束后, 向每瓶培养基加入200 mL乙酸乙酯, 超声提取3次, 合并有机溶剂提取液并减压浓缩后得到粗提物31.34 g。对所得粗提物水混悬后, 使用环己烷和乙酸乙酯萃取, 分别得到对应有机相提取物15.51 g和6.40 g。对乙酸乙酯相萃取物进行硅胶柱色谱分离, 用石油醚/乙酸乙酯(100:0~0:100, v/v)系统梯度洗脱共得到19个组分(Fr.1-19)。
Fr.9 (53.7 mg)通过中低压反相柱色谱仪(40%甲醇−水, 15 mL·min−1)得到化合物8 (10.9 mg)。采用类似的方法, 3个组分(Fr.10、Fr.17和Fr.19)分别通过中低压反相柱色谱仪进行分离, 分别得到相应的子馏分。来自于Fr.10的子馏分Fr.10-2 (68.0 mg)进一步经中压反相柱色谱(40%甲醇−水, 2.0 mL·min−1)纯化得到化合物4 (tR 28.8 min; 39.7 mg)。来自于Fr.17的子馏分Fr.17-3 (18.4 mg)和Fr.17-4 (49.8 mg)采用Fr.10-2类似的纯化方法分别得到化合物9 (40%甲醇−水, 2.0 mL·min−1; tR 15.4 min; 8.5 mg)和10 (60%甲醇−水, 2.0 mL·min−1; tR 12.5 min; 21.4 mg)。通过中压反相柱色谱仪纯化Fr.19-3 (21.0 mg, Fr.19的子馏分)得到化合物3 (40%甲醇−水, 2.0 mL·min−1; tR 20.0 min; 4.6 mg)。
Fr.11 (640 mg)经Sephadex LH-20 (MeOH)凝胶柱色谱洗脱得到2个馏分Fr.11-2 (210 mg)和Fr.11-3 (21.4 mg)。Fr.11-2经中低压反相柱色谱洗脱(20%甲醇−水20 min; 40%甲醇−水20 min, 15 mL·min−1)得到2个子馏分Fr.11-2-1 (113.9 mg)和Fr.11-2-2 (32.6 mg)。通过中压反相柱色谱洗脱(30%甲醇−水20 min; 40%甲醇−水20 min; 60%甲醇−水20 min, 2.0 mL·min−1)进一步纯化Fr.11-2-1得到化合物5 (tR 18.7 min; 17.6 mg)、6 (tR 37.1 min; 23.2 mg)和7 (tR 55.4 min; 16.6 mg)。Fr.11-2-2经中压反相柱色谱纯化(40%甲醇−水, 2.0 mL·min−1)得到化合物1 (tR 29.3 min; 1.9 mg)。最后, 馏分Fr.11-3经中压反相柱色谱仪纯化(60%甲醇−水, 2.0 mL·min−1)得到化合物2 (tR 17.8 min; 2.0 mg)。
2 结构鉴定化合物1 淡黄色粉末。HR-ESI-MS给出准分子离子峰m/z 220.097 0 ([M+H]+, C12H14NO3+; Calcd. 220.096 8)和242.079 1 ([M+Na]+, C12H13NO3Na+; Calcd. 242.078 8); [α]D24= +5.05 (c 0.1, MeOH); UV λmax (MeOH)/nm: 206、246; IR υmax/cm−1: 3 415、2 926、2 855、1 653、1 602、1 481、1 465、1 398、1 288、1 121、1 052等。1H NMR (CD3OD, 400 MHz)和13C NMR (CD3OD, 100 MHz)数据见表 1。
| Table 1 1H (400 MHz) and 13C (100 MHz) NMR data of 1 in CD3OD |
化合物2 黄色油状, ESI-MS显示m/z 190.09 [M+H]+, 207.11 [M+NH4]+。1H NMR (CD3OD, 400 MHz) δH: 3.68 (3H, s, OCH3-9), 3.77 (2H, s, H-8), 7.01 (1H, bt, J = 8.0 Hz, H-6), 7.10 (1H, bt, J = 8.0 Hz, H-5), 7.16 (1H, s, H-2), 7.34 (1H, bd, J = 8.0 Hz, H-7), 7.51 (1H, bd, J = 8.0 Hz, H-4); 13C NMR (CD3OD, 100 MHz) δC: 31.8 (C-8, CH2), 52.3 (9-OCH3), 108.5 (C-3, C), 112.2 (C-7, CH), 119.3 (C-4, CH), 119.8 (C-5, CH), 122.4 (C-6, CH), 124.6 (C-2, CH), 128.5 (C-3a, C), 138.0 (C-7a, C), 174.8 (C-9, C)。上述波谱数据与文献报道[16]基本一致, 因此化合物2被鉴定为3-indoleacetic acid methyl ester。
化合物3 黄色油状, ESI-MS显示m/z 203.12 [M+H]+, 225.10 [M+Na]+, 405.23 [2M+H]+。1H NMR (CD3OD, 400 MHz) δH: 1.91 (3H, s, H-2'), 2.93 (2H, t, J = 7.4 Hz, H-9), 3.46 (2H, t, J = 7.2 Hz, H-8), 6.99 (1H, t, J = 7.8 Hz, H-6), 7.06 (1H, s, H-2), 7.08 (1H, t, J = 7.8 Hz, H-5), 7.32 (1H, d, J = 8.1 Hz, H-7), 7.55 (1H, d, J = 7.8 Hz, H-4); 13C NMR (CD3OD, 100 MHz) δC: 22.5 (C-2', CH3), 26.2 (C-8, CH2), 41.5 (C-9, CH2), 112.2 (C-7, CH), 113.2 (C-3, C), 119.2 (C-4, CH), 119.5 (C-5, CH), 122.2 (C-6, CH), 123.3 (C-2, CH), 128.8 (C-3a, C), 138 (C-7a, C), 173.2 (C-1', C)。上述波谱数据与文献报道[17]基本一致, 因此化合物3被鉴定为N-acetyltryptamine。
化合物4 无色结晶, ESI-MS显示m/z 151.04 [M−H]−, 187.02 [M+Cl]−, 303.09 [2M−H]−。1H NMR (CD3OD, 400 MHz) δH: 3.48 (2H, s, H-7), 6.73 (2H, d, J = 8.4 Hz, H-2, H-6), 7.09 (2H, d, J = 8.4 Hz, H-3, H-5); 13C NMR (CD3OD, 100 MHz) δC: 41.4 (C-7, CH2), 116.1 (C-2, 6, CH), 126.7 (C-4, C), 131.3 (C-3, 5, CH), 157.3 (C-1, C), 176.6 (C-8, C)。上述波谱数据与文献报道[18]基本一致, 因此化合物4被鉴定为对羟基苯乙酸。
化合物5 无色结晶, ESI-MS显示m/z 137.06 [M−H]−, 173.04 [M+Cl]−, 275.13 [2M−H]−。1H NMR (CD3OD, 400 MHz) δH: 2.71 (2H, t, J = 7.3 Hz, H-7), 3.68 (2H, t, J = 7.3Hz, H-8), 6.70 (2H, d, J = 8.4 Hz, H-2, H-6), 7.03 (2H, d, J = 8.4 Hz, H-3, H-5); 13C NMR (CD3OD, 100 MHz) δC: 39.3 (C-7, CH2), 63.2 (C-8, CH2), 116.1 (C-2, 6, CH), 130.8 (C-3, 5, CH), 131.0 (C-4, C), 156.7 (C-1, C)。上述波谱数据与文献报道[19]基本一致, 因此化合物5被鉴定为对羟基苯乙醇。
化合物6 黄色油状, ESI-MS显示m/z 165.06 [M−H]−, 201.03 [M+Cl]−, 331.12 [2M−H]−。1H NMR (CD3OD, 400 MHz) δH: 3.52 (2H, s, H-7), 3.65 (3H, s, OCH3-1), 6.72 (2H, d, J = 8.4 Hz, H-2, H-6), 7.07 (2H, d, J = 8.4 Hz, H-3, H-5); 13C NMR (CD3OD, 100 MHz) δC: 40.8 (C-7, CH2), 52.3 (1-OCH3), 116.2 (C-2, 6, CH), 126.3 (C-4, C), 131.2 (C-3, 5, CH), 157.5 (C-1, C), 174.5 (C-8, C)。上述波谱数据与文献报道[20]基本一致, 因此化合物6被鉴定为对甲氧基苯乙酸。
化合物7 黄色油状, ESI-MS显示m/z 271.10 [M−H]−, 307.07 [M+Cl]−, 543.20 [2M−H]−。1H NMR (CD3OD, 400 MHz) δH: 2.78 (2H, t, J = 6.8 Hz, H-7), 3.48 (2H, s, H-11), 4.20 (2H, t, J = 6.8 Hz, H-8), 6.68 (2H, d, J = 8.6 Hz, H-14, H-16), 6.71 (2H, d, J = 8.6 Hz, H-3, H-5), 6.96 (2H, d, J = 8.6 Hz, H-13, H-17), 7.02 (2H, d, J = 8.6 Hz, H-2, H-6); 13C NMR (CD3OD, 100 MHz) δC: 35.1 (C-7, CH2), 41.2 (C-11, CH2), 66.8 (C-8, CH2), 116.2 (C-3, 5, 14, 16, CH), 126.3 (C-12, C), 129.9 (C-1, C), 130.9 (C-2, 6, CH), 131.3 (C-13, 17, CH), 157.0 (C-4, C), 157.5 (C-15, C), 174.0 (C-10, C)。上述波谱数据与文献报道[21]基本一致, 因此化合物7被鉴定为4-hydroxyphenethyl 2-(4-hydroxyphenyl)acetate。
化合物8 淡黄色粉末, ESI-MS显示m/z 177.06 [M−H]−, 194.05 [M+NH3−H]−, [α]D16= 2.28 (c 0.25, MeOH)。1H NMR (CDCl3, 400 MHz) δH: 1.69 (1H, brs, OH-4), 2.19 (1H, m, H-3a), 2.35 (1H, m, H-3b), 2.65 (1H, ddd, J = 17.8, 8.3, 4.8 Hz, H-2a), 3.01 (1H, ddd, J = 17.8, 8.3, 4.8 Hz, H-2b), 4.92 (1H, dd, J = 7.4, 3.7 Hz, H-4), 6.93 (1H, d, J = 8.0 Hz, H-7), 7.02 (1H, d, J = 7.4 Hz, H-5), 7.45 (1H, t, J = 8.0 Hz, H-6), 12.42 (1H, s, OH-8); 13C NMR (CDCl3, 100 MHz) δC: 31.2 (C-2, CH2), 34.5 (C-3, CH2), 67.7 (C-4, CH), 115.2 (C-8a, C), 117.3 (C-7, CH), 117.7 (C-5, CH), 136.9 (C-6, CH), 145.8 (C-4a, C), 162.7 (C-8, C), 204.2 (C-1, C)。上述波谱数据与文献中化合物regiolone[22]基本一致, 化合物8旋光度[α]D16= 2.28 (c 0.05, MeOH)与化合物regiolone也基本一致, 因此鉴定化合物8为regiolone。
化合物9 黄色油状, ESI-MS显示m/z 164.11 [M+ H]+, 186.09 [M+Na]+以及327.21 [2M+H]+。1H NMR (CD3OD, 400 MHz) δH: 1.90 (3H, s, H-2'), 2.78 (2H, t, J = 7.4 Hz, H-7), 3.38 (2H, t, J = 7.4 Hz, H-8), 7.1~7.29 (5H, m, H-2~H-6); 13C NMR (CD3OD, 100 MHz) δC: 22.5 (C-2', CH3), 36.4 (C-7, CH2), 42.1 (C-8, CH2), 127.3 (C-4, CH), 129.4 (C-2, 6, CH), 129.7 (C-3, 5, CH), 140.5 (C-1, C), 173.2 (C-1', C)。上述波谱数据与文献报道[23]基本一致, 因此化合物9被鉴定为N-苯乙基乙酰胺。
3 生物活性采用药敏片扩散法[24]测定化合物1~9的抑菌活性, 测试菌株为B. subtilis、S. aureus、E. coli和P. aeruginosa。实验设置4个浓度梯度(0.04、0.08、0.2、0.4 μg化合物/药敏片), 3个重复, 置于37 ℃恒温培养箱中培养24 h, 以含有甲醇的滤纸片为阴性对照, 以含有等量链霉素的滤纸片为阳性对照。实验结果显示化合物1~9均无明显抑制活性。
采用平板琼脂打孔法[25]测定化合物1~9的菌体感应抑制活性, 测试菌株为基因缺陷型紫色杆菌C. violaceum, 以甲醇为阴性对照, 以等量的CV026为阳性对照, 置于37 ℃恒温培养箱中培养24 h。观察是否有抑制活性。实验设置两个浓度梯度(每孔10、20 μg化合物), 3个重复。实验结果显示化合物1~9均无明显群体感应抑制活性。
小结本文从采自青岛的一株狭叶十大功劳茎来源的内生真菌Colletotrichum fioriniae F18中分离得到9个化合物, 其中化合物1为新化合物(makomotindoline B), 通过质谱和核磁共振等波谱数据确定了化合物1~9的结构, 并且通过圆二色谱ECD计算确定了化合物1的绝对构型。对分离得到的9个化合物进行了抗菌和群体感应抑制活性测试, 结果显示所有化合物都没有明显的抑制活性。
| [1] | Zhang HW, Song YC, Tan RX. Biology and chemistry of endophytes[J]. Nat Prod Rep, 2006, 23: 753–771. DOI:10.1039/b609472b |
| [2] | Che YS. Discovery of new bioactive natural products from fungi of unique ecological niches[J]. J Int Pharm Res, 2011, 38: 12–27. |
| [3] | Li G, Lou HX. Strategies to diversify natural products for drug discovery[J]. Med Res Rev, 2018, 38: 1255–1294. DOI:10.1002/med.2018.38.issue-4 |
| [4] | Gao H, Li G, Lou HX. Structural diversity and biological activities of novel secondary metabolites from endophytes[J]. Molecules, 2018, 23: 646. DOI:10.3390/molecules23030646 |
| [5] | Li AR, Zhu Y, Li XN, et al. Antimicrobial activity of four species of Berberidaceae[J]. Fitoterapia, 2007, 78: 379–381. DOI:10.1016/j.fitote.2007.03.001 |
| [6] | Strobel G, Daisy B. Bioprospecting for microbial endophytes and their natural products[J]. Microbiol Mol Biol Rev, 2003, 67: 491–502. DOI:10.1128/MMBR.67.4.491-502.2003 |
| [7] | Li G, Kusari S, Kusari P, et al. Endophytic Diaporthe sp. LG23 produces a potent antibacterial tetracyclic triterpenoid[J]. J Nat Prod, 2015, 78: 2128–2132. DOI:10.1021/acs.jnatprod.5b00170 |
| [8] | Li G, Kusari S, Golz C, et al. Three cyclic pentapeptides and a cyclic lipopeptide produced by endophytic Fusarium decemcellulare LG53[J]. RSC Adv, 2016, 59: 54092–54098. |
| [9] | Li RJ, Wang S, Li G, et al. Four new kaurane diterpenoids from the Chinese liverwort Jungermannia comata Nees[J]. Chem Biodivers, 2016, 13: 1685–1690. DOI:10.1002/cbdv.201600123 |
| [10] | Li G, Kusari S, Golz C, et al. Epigenetic modulation of endophytic Eupenicillium sp. LG41 by a histone deacetylase inhibitor for production of decalin-containing compounds[J]. J Nat Prod, 2017, 80: 983–988. DOI:10.1021/acs.jnatprod.6b00997 |
| [11] | Suzuki T, Choi JH, Kawaguchi T, et al. Makomotindoline from Makomotake, Zizania latifolia infected with Ustilago esculenta[J]. Bioorg Med Chem Lett, 2012, 22: 4246–4248. DOI:10.1016/j.bmcl.2012.05.021 |
| [12] | Hayashi M, Kim YP, Takamatsu S, et al. Madindoline, a novel inhibitor of IL-6 activity from Streptomyces sp. K93-0711Ⅰ. taxonomy, fermentation, isolation and biological activities[J]. J Antibiot, 1996, 49: 1091–1095. DOI:10.7164/antibiotics.49.1091 |
| [13] | Takamatsu S, Kim YP, Enomoto A, et al. Madindoline, a novel inhibitor of IL-6 activity from Streptomyces sp. K93-0711Ⅱ. Physico-chemical properties and structural elucidation[J]. J Antibiot, 1997, 50: 1069–1072. DOI:10.7164/antibiotics.50.1069 |
| [14] | Kusari S, Lamshoft M, Zuhlke S, et al. An endophytic fungus from Hypericum perforatum that produces hypericin[J]. J Nat Prod, 2008, 71: 159–162. DOI:10.1021/np070669k |
| [15] | Li G, Kusari S, Lamshoft M, et al. Antibacterial secondary metabolites from an endophytic fungus, Eupenicillium sp. LG41[J]. J Nat Prod, 2014, 77: 2335–2341. DOI:10.1021/np500111w |
| [16] | Manzo E, Pagano D, Carbone M, et al. Synthesis of phidianidine B, a highly cytotoxic 1, 2, 4-oxadiazole marine me-tabolite[J]. Arkivoc, 2012, 9: 220–228. |
| [17] | Astolfi P, Panagiotaki M, Rizzoli C, et al. Reactions of indoles with nitrogen dioxide and nitrous acid in an aprotic solvent[J]. Org Biomol Chem, 2006, 4: 3282–3290. DOI:10.1039/b607680g |
| [18] | Ma HY, Yang L, Zhang M, et al. A new compound from Senecio cannabifolius var integrilifolius[J]. Acta Pharm Sin (药学学报), 2008, 43: 626–629. |
| [19] | Dong LW, Wang JL, Zhao M, et al. Chemical constituents of the alabastrum of Syringa oblata Lindl[J]. Nat Prod Res Dev (天然产物研究与开发), 2011, 23: 658–660. |
| [20] | Shao HJ, Fang LZ, Liu JK. Chemical constituents of culture broth of Hebeloma westraliense[J]. Nat Prod Res Dev (天然产物研究与开发), 2010, 22: 786–788. |
| [21] | Wang YN, Tian L, Hua HM, et al. Two new compounds from the broth of the marine fungus Penicillium griseofulvum Y19-07[J]. J Asian Nat Prod Res, 2009, 11: 912–917. DOI:10.1080/10286020903219923 |
| [22] | Gulder TAM, Hong H, Correa J, et al. Isolation, structure elucidation and total synthesis of lajollamide A from the marine fungus Asteromyces cruciatus[J]. Mar Drugs, 2012, 10: 2912–2935. DOI:10.3390/md10122912 |
| [23] | Zhou H, Yang YB, Liu Y, et al. Chemical constituents from the fermentation broth of Streptomyces sp. (YIM69228)[J]. Nat Prod Res Dev (天然产物研究与开发), 2013, 25: 293–295. |
| [24] | Loesgen S, Magull J, Schulz B, et al. Isofusidienols:novel chromone-3-oxepines produced by the endophytic fungus Chalara sp.[J]. Eur J Org Chem, 2008: 698–703. |
| [25] | Tello E, Castellanos L, Arevalo-Ferro C, et al. Disruption in quorum-sensing systems and bacterial biofilm Inhibition by cembranoid diterpenes isolated from the octocoral Eunicea knighti[J]. J Nat Prod, 2012, 75: 1637–1642. DOI:10.1021/np300313k |
 2018, Vol. 53
2018, Vol. 53


