肿瘤多药耐药性(multidrug resistance, MDR)是指肿瘤细胞对一种化疗药物产生耐药性的同时, 对其他结构不同的、作用机制各异的化疗药物也产生交叉耐药性。肿瘤MDR会严重影响化疗药物的疗效, 所以寻找一种克服肿瘤MDR的策略是癌症化疗亟需解决的问题之一, 也是改善临床疗效的突破口。引发肿瘤MDR的原因有很多, 如ATP结合盒(ATP binding cattle, ABC)转运蛋白家族表达和功能异常、DNA损伤修复增强、肿瘤干细胞表达异常、酶系统表达异常和细胞凋亡机制异常等。其中, 有关ABC转运蛋白家族中P-糖蛋白(P-glycoprotein, P-gp)过表达的研究最为广泛[1]。P-gp由于在肿瘤细胞内过度表达, 外排抗癌药物的活性增强, 进而导致肿瘤MDR。因此, 临床上联合应用抗癌药物和P-gp抑制剂, 可以增加抗癌药物在肿瘤细胞内的蓄积, 提高药物生物利用度, 达到逆转肿瘤MDR的效果。近年来, 天然产物、肽类和表面活性剂由于其毒性小, 抑制P-gp性能好等原因, 在逆转肿瘤MDR方面的应用越来越多[2]。聚乙二醇1000维生素E琥珀酸酯(D-α-tocopheryl polyethylene glycol 1000 succinate, TPGS)作为一种非离子型表面活性剂类P-gp抑制剂, 以其为基础的纳米递药系统在逆转肿瘤MDR方面的应用得到了国内外学者的广泛关注。本文从P-gp抑制功能入手, 对TPGS纳米递药系统的应用研究进展进行综述。
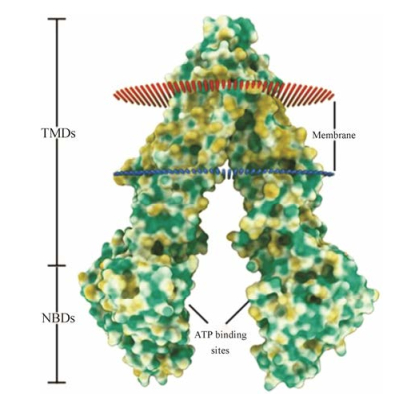
1 P-gp及其抑制剂Juliano等[3]在1979年发现P-gp, 一种ATP依赖性细胞膜转运体, 属于膜ABC转运蛋白家族, 又称ATP结合盒亚家族B成员1 (ABCB1)或多药耐药蛋白1 (MDR1)。P-gp广泛分布于肠上皮、肝细胞、肾近端包括血脑和血睾屏障的管状细胞、肾上腺和毛细血管内皮细胞, 参与多种内、外源性物质的吸收、分布、代谢及排泄(ADME)过程[4-6]。其分子质量大约为170 kDa, 由1 280个氨基酸残基组成, 3D结构如图 1所示。整个分子由几乎相同的两个单体构成, 每个单体具有1个跨膜结构域(transmembrane domain, TMD)和1个核苷酸结合结构域(nucleotide-binding domain, NBD), 两个部分由线性多肽易变区隔开[7]。其中TMD由6个TM构成, 可以对底物进行识别并与之结合; 而NBD则由ATP酶与ATP结合并水解ATP, 进而将各种底物从细胞内膜运送至细胞膜外, 减少胞内药物的蓄积。由于肿瘤细胞过度表达P-gp而导致胞内抗癌药物浓度降低, 从而导致肿瘤细胞对抗癌药物的MDR效应。
|
Figure 1 The three-dimensional structure of P-glycoprotein (P-gp). TMDs: Transmembrane domain; NBDs: Nucleotide- binding domain |
目前, P-gp小分子抑制剂已发展至第三代[2, 4]。第一代为竞争性抑制剂, 包括环孢素A和维拉帕米等。由于第一代抑制剂对P-gp选择性低, 随着其浓度的下降逆转MDR作用会降低, 因此需要维持较高的胞内浓度才可发挥逆转作用, 然而高浓度引起的毒副作用不可忽视(如维拉帕米的心脏毒性、环孢素A的肾毒性和免疫抑制等), 这限制了其临床应用; 第二代为第一代的衍生物或结构改进的新化合物等竞争性抑制剂, 如环孢菌素类似物PSC188和维拉帕米R-对映体右旋维拉帕米, 尽管较第一代选择性高, 但是它们同时又可能是细胞色素P-450 (CYP 3A4)或其他ABC转运蛋白的底物, 能够引起更复杂的药代动力学反应, 如同时抑制ABC转运蛋白BCRP (一种造血干细胞功能调节因子)进而导致中性粒细胞减少症和其他骨髓毒性作用等严重的不良反应, 因此限制了其应用; 第三代是采用定量构效关系和组合化学设计的化合物, 通过该设计可使化合物具有特定结构或功能, 如具有亲脂性或在中性pH条件下带正电荷等。Tariquidar为第三代P-gp抑制剂[2], 其可通过抑制ATP酶活性进而非竞争性抑制P-gp, 抑制效果远远超过前两代抑制剂; 然而, 在3期临床试验中, 其在非小细胞肺癌患者上产生较高毒性而停止试验。其他第三代抑制剂也发生过类似情况, 如左苏喹达、依克立达、laniquidar和ontogen等。为了获得更为理想的P-gp抑制剂, 研究者在不断优化这些小分子抑制剂的同时, 开始寻找新策略, 如寻找具有抑制P-gp作用且毒性小的天然产物、肽类和表面活性剂类等。Yamazaki等[8]发现表面活性剂Tween 80在人白血病耐药细胞K562/ADM中, 通过增强抗癌药物VP-16的胞内蓄积, 达到逆转MDR效果。Bogman等[9]在P-gp过表达的小鼠白血病耐药细胞P388/MDR中, 比较了非离子表面活性剂Tween 80、泊洛沙姆(Pluronic PE8100)、聚氧乙烯蓖麻油(Cremophor EL)、TPGS等对P-gp介导的底物外排的抑制效果。根据P-gp底物罗丹明123转运研究结果, 它们的P-gp抑制能力大小排列如下: TPGS > Pluronic PE8100 > Cremophor EL > Pluronic PE6100 > Tween 80, 可见TPGS抑制效果最好。
2 TPGS及其抑制P-gp机制TPGS是维生素E的水溶性衍生物, 具有刺激性小、毒性低和生物相容性好等优点[10], 其结构式如图 2所示。美国FDA早已批准TPGS作为一种安全的药用辅料, 可广泛应用于药用处方中, 在制剂中可作为增溶剂、吸收促进剂、乳化剂、增塑剂、致孔剂及固体分散体的载体等[11, 12]。更重要的是, TPGS能够有效地抑制P-gp功能, 逆转肿瘤MDR, 这一特性使得其在药物递送系统中的应用具有更大的优势, 基于TPGS的纳米载体在抗肿瘤方面得到了研究者的广泛关注[13]。

|
Figure 2 Structure of TPGS (n = 23). The yellow hydroxy represents the section which is usual chemical modified. TPGS: D-α-Tocopheryl polyethylene glycol 1 000 succinate |
另外, TPGS的结构特征能够影响其抑制P-gp能力。Buckingham等[14]认为表面活性剂的疏水结构域(脂肪酸)和亲水亲油平衡值(hydrophile-lipophile balance, HLB)对于判断其作为P-gp抑制剂有至关重要的作用。研究显示, HLB值在10~17的表面活性剂对于促进肿瘤细胞内表柔比星的聚集更有效[15]。由于TPGS结构具有亲水和疏水两亲性, HLB值为13.2, 使其成为出色的非离子表面活性剂和一种适用于逆转肿瘤MDR的有效P-gp抑制剂。TPGS是由维生素E琥珀酸酯与聚乙二醇(PEG)酯化而成, 构效关系研究显示, PEG链长度影响其P-gp抑制效果[13]。Collnot等[16]在人结肠腺癌细胞Caco-2上考察具有不同PEG链长度(200~6 000)的TPGS对P-gp的抑制作用, 研究结果表明, PEG链长为1 000时最为有效。Zhao等[17]同样发现具有PEG1000的TPGS衍生物聚乳酸(PLA)-TPGS1000的抑制效果亦较PLA-TPGS2000/3350/5000等更强。本课题组探索研究了TPGS及其衍生物的构效关系及它们的HLB对P-gp抑制能力的影响。研究发现, 亲水性和负电荷性质基团对TPGS PEG端的化学修饰有助于提高TPGS抑制P-gp的能力, 另外, HLB值高的TPGS衍生物更能有效地抑制P-gp ATP酶活性[18]。
TPGS的P-gp抑制机制研究是从上世纪末开始的, Dintaman等[19]最先发现, 较低浓度的TPGS能够减少罗丹明123从Caco-2细胞的基底侧膜B向顶侧膜A的外排, 且随着TPGS浓度的增加, 抑制外排作用增强, 说明TPGS可抑制P-gp介导的药物转运, 且在低于其临界胶束浓度(CMC)时可以发挥抑制作用。Rege等[20]通过荧光偏振法检测TPGS在Caco-2细胞中抑制P-gp介导的外排罗丹明123时对膜流动性的影响, 结果表明TPGS不是通过影响膜流动性达到抑制P-gp的外排转运作用。Collnot等[21]早期的实验也表明TPGS不是改变膜流动性调节P-gp的外排转运, 而是通过抑制与P-gp结合的ATP酶来抑制P-gp的外排转运。进而利用Caco-2细胞进一步探讨TPGS的ATP酶抑制机制[22]。采用P-gp单克隆抗体转运分析的检测方法, 探讨TPGS1000诱导的P-gp构象的改变。结果表明TPGS1000可能不是P-gp的底物, 也不是竞争性P-gp抑制剂, 同时他们也提出TPGS1000没有影响胞内线粒体功能。进一步研究显示, TPGS可以通过与P-gp上非转运活性位点结合, 导致P-gp的构象改变, 进而丧失外排转运功能[22]。本课题组采用分子模拟方法结合细胞水平实验协同研究TPGS及其衍生物抑制P-gp的分子机制, 结果也发现, TPGS及其衍生物没有消耗肿瘤细胞内ATP或损伤线粒体功能, 亦没有干预肿瘤细胞内P-gp的表达。进一步的研究证实, TPGS及其衍生物通过结合P-gp NBDs结构域的ATP活性位点, 则ATP酶不能结合和水解ATP, 致使P-gp缺少能量供应, 无法执行外排底物功能, 进而逆转肿瘤MDR[18]。
尽管Collnot等[21, 22]和本课题组[18]在研究结果中提到TPGS并没有影响线粒体功能, 但Hao等[23]发现TPGS可以减少ATP消耗量(△RLU)并降低线粒体膜电位(mitochondrial membrane potential, MMP), 因此提出TPGS不仅能降低ATP酶活性, 还能影响线粒体功能从而发挥抑制P-gp作用。Wang等[24]制备TPGS2000/PLGA纳米粒并考察了其逆转肿瘤MDR机制。MMP和线粒体基础耗氧率的降低说明TPGS影响线粒体功能; 同时, 透射电子显微镜图像显示线粒体微结构被破坏, 表明TPGS不仅影响线粒体功能, 还影响其结构进而达到逆转肿瘤MDR效果。Wang等[25]提出, 在荷载多西他赛的DSPE-PEG/TPGS混合胶束(TPGS/DTX-M)及叶酸修饰混合胶束(FA@TPGS/DTX-M)中, TPGS能够通过触发线粒体凋亡达到抑制P-gp功能的目的。随着研究的深入, 还有学者提出TPGS及其衍生物通过下调P-gp表达水平进而抑制P-gp功能。Zhu等[26]和Tsend-Ayush等[27]分别制备了TPGS-甘草次酸(GA)衍生物聚合物胶束和TPGS-乳糖(LA)衍生物聚合物胶束, 在动物水平上的蛋白印迹实验表明, TPGS及其衍生物通过下调肿瘤细胞内P-gp水平达到逆转肿瘤MDR效果, 从而发挥提高药物生物利用度的作用。不难发现, 相对于P-gp的ATP酶活性抑制的机制研究, 目前TPGS或其衍生物对线粒体功能影响、结构损伤及下调动物肿瘤组织P-gp表达水平的研究仍很浅泛而观点不一, 需要从细胞水平或基因方面进一步的探索研究。
有研究显示表面活性剂类赋形剂能够抑制CYP 3A4酶, 降低药物代谢, 进而增加药物生物利用度[28]。Christiansen等[29]提到TPGS在低于其CMC浓度时即可抑制CYP 3A4酶介导的药物代谢作用。然而, Mudra等[30, 31]在原位灌注大鼠肠道模型中考察TPGS对药物吸收影响时发现, 在大鼠肠黏膜中低于CMC浓度的TPGS几乎没有或未直接影响CYP 3A4酶作用, 但对P-gp有显著的抑制作用。结果表明低浓度的TPGS通过抑制P-gp功能进而达到逆转肿瘤MDR作用。
目前, 对于TPGS抑制P-gp的具体机制仍在研究讨论中, 到现在为止考察过的机制包括影响膜流动性、作为P-gp底物竞争性抑制、抑制ATP酶活性、影响线粒体功能和结构、触发线粒体凋亡和下调P-gp水平等。然而, 近年的研究显示, TPGS通过改变膜流动性和作为P-gp底物竞争性抑制P-gp的两种机制已逐渐被排除; 而TPGS结合P-gp的NBD结构域, 抑制ATP酶活性, 进而抑制P-gp转运外排作用的机制以及TPGS影响线粒体的功能、结构和凋亡机制和下调P-gp水平仍是可能的机制(图 3)。虽然, 在动物水平上的蛋白印迹实验能说明TPGS下调P-gp表达水平机制的可能性, 然而还可以有更深入的研究探讨是否通过影响P-gp合成器官如细胞核或高尔基体继而达到下调P-gp表达水平等; TPGS或其衍生物对线粒体功能影响、结构损伤的研究也可以从细胞水平或基因方面进一步的探索研究。纵观TPGS抑制P-gp机制的研究进展, 新的思路和发现不断涌现, 是由浅到深、不断论证和推陈出新的过程。尽管当前研究较多, 还需要更多更深入的实验工作来完善TPGS抑制P-gp的具体机制, 为其在逆转肿瘤MDR应用奠定基础。

|
Figure 3 Schematic of the P-gp inhibition mechanism by TPGS |
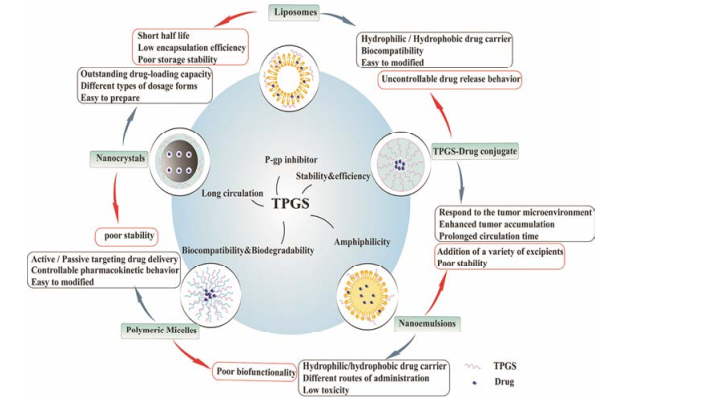
纳米递药系统在肿瘤药物递送系统中研究最为广泛, 其具有粒径小、可主动或被动地被肿瘤细胞摄取和能荷载多种药物等优势。TPGS作为一种能够抑制P-gp外排转运的非离子表面活性剂, 浓度达到其CMC时可在溶液中自组装成纳米粒或与其他聚合物形成复合纳米体系, 用于装载各种类型抗癌药物。基于TPGS通过抑制ATP酶活性、影响线粒体功能和下调P-gp表达水平等多途径抑制P-gp的功能, TPGS的纳米递药系统能有效逆转肿瘤MDR, 提高抗癌药物的生物利用度, 降低毒副作用, 增强其化疗效果(表 1)[32-38]。其纳米递药系统主要包括聚合物纳米粒、聚合物-药物偶联物、脂质体、纳米乳和纳米晶体等(图 4)。
| Table 1 The application of TPGS-based nano-drug delivery system in reversing P-gp mediated multidrug resistance. MDR: Multidrug resistance. MCF-7/PTX: PTX-resistant human breast cancer cell line; MCF-7/ADR: Doxorubicin-resistant human breast cancer cell line; A549/DDP: Cisplatin-resistant human lung adenocarcinoma cell line; KBv: Multidrug resistant cell line; HepG2: Human hepatoma cell line; H460/RT: PTX-resistant human non-small-cell lung cancer cell line |
|
Figure 4 Schematic illustration of several representative nanomedicines, includingpolymeric micelles, liposomes, TPGS-drug conjugate, nanoemulsions and nanocrystals |
由于聚合物材料的生物降解性、生物相容性和能够通过表面修饰获得靶向或其他功能等特性, 聚合物纳米粒能降低药物毒性、提高药动学行为可控性及药物生物利用度。因此, 聚合物纳米粒在逆转肿瘤MDR中发展迅速, 前景可期。TPGS可以作为一种载体材料, 使用物理或化学方法修饰在纳米粒表面, 或者与其他聚合物材料混合制备聚合物纳米粒, 发挥基本聚合物材料作用及P-gp抑制作用。
作为非离子表面活性剂和P-gp抑制剂, TPGS可对聚合物纳米粒进行表面修饰, 进而改善纳米粒相关性质。Kulkarni等[39]通过物理吸附法制得TPGS修饰的不同粒径的荧光聚苯乙烯纳米粒, 其在Caco-2细胞和犬肾上皮细胞MDCK上的细胞摄取效率明显高于未修饰的相同粒径纳米粒。Cheng等[40]将TPGS- NH2与多柔比星-聚多巴胺涂覆介孔二氧化硅纳米粒混合, 制得TPGS修饰纳米粒(MSNs-DOX@PDA- TPGS)。结果显示, 其细胞毒作用比游离药物增加了2.5倍, 相比PEG修饰的纳米粒则增加了6.57倍。体内研究亦显示, 针对A549/MDR荷瘤裸鼠的抑瘤效果显著优于PEG修饰纳米粒。Song等[41]制备的荷载淫羊藿次苷Ⅱ的TPGS与磷脂混合胶束(Icar-MC)能显著增强淫羊藿次苷Ⅱ对人乳腺癌耐药细胞MCF-7/ ADR的杀伤作用, 并有效抑制MCF-7/ADR荷瘤裸鼠肿瘤增长。研究还发现, TPGS通过抑制P-gp的活性, 明显增加药物的细胞摄取量, 但其并未影响P-gp表达水平。
TPGS可与其他聚合物材料进行化学接枝形成TPGS衍生物来制备聚合物纳米粒。与TPGS相比, 其衍生物不仅能够改善聚合物纳米粒粒径等物理性质, 还可改进纳米递药体系的功能特性, 如选择性更强的靶向递送和更强的肿瘤MDR逆转效应。研究显示, 疏水性或亲水性链段聚合物的结构修饰不仅增强了TPGS的分子结构稳定性, 同时合成的聚合物应用于纳米递药系统中, 能够提高抗癌药物载药量、延长体内循环、改善肿瘤细胞摄取、增强细胞毒作用及有效抑制肿瘤生长[13]。Bao等[42]合成了PLGA-TPGS共聚物, 用于制备载齐墩果酸(OA)聚合物纳米粒(OPTN)。TPGS的引入明显降低了聚合物纳米粒的粒径, 有利于改善其体内递送行为。相比于PLGA载药纳米体系, OPTN具有更强的细胞毒性和抗肿瘤作用。Zhu等[26]和Tsend-Ayush等[27]分别采用小分子化合物甘草次酸(GA)和乳糖酸(LA)对TPGS的PEG羟基端进行结构修饰, 合成得到TPGS衍生物TGA和TLA, 并制备依托泊苷(ETO)聚合物胶束(ETO- TGA PMs和ETO-TLA PMs)。TGA和TLA的CMC值明显低于TPGS, 说明TGA和TLA聚合物胶束在体内稀释后的稳定性更好, 有利于药物递送。研究亦发现, 与TPGS相比, TGA和TLA能够显著下调Heps荷瘤小鼠肿瘤组织内P-gp表达水平, 从而抑制荷瘤鼠的肿瘤生长。此外, TPGS还可以与转铁蛋白[43]、叶酸[32]、西妥昔单抗[44]和半乳糖[45]等配体一起修饰聚合物胶束。通过靶细胞特异性受体对应的配体来修饰, 药物载体可以达到主动靶向的作用, 进一步增加药物在肿瘤内的积累。Zhang等[32]制备了一种由葡聚糖-g-聚(丙交酯-共-乙交酯)-g-组氨酸(HDP)和叶酸(FA)化学接枝TPGS2000 (FA-TPGS2K)组成的紫杉醇(PTX) pH响应性混合聚合物胶束(FA-TPGS2K/ HDP)。细胞毒实验显示, FA-TPGS2K/HDP对人乳腺癌细胞MCF-7的IC50值(15.5 μg·mL-1)明显小于游离PTX (921.5 μg·mL-1)和TPGS2K/HDP (42.1 μg·mL-1), 说明叶酸受体介导的胞吞作用能够有效地躲避P-gp的外排过程, 有助于提高化疗药物的生物活性。研究进一步发现TPGS2K可通过破坏线粒体功能来抑制P-gp作用。
TPGS因其良好的生物降解性和两亲性, 亦可用于制备支化聚合物, 相比于线型聚合物具有优异的流变学性质、较低的黏度及更高的载药量。Zeng等[46]制备了荷载多西他赛的胆酸功能化PLGA-TPGS星型聚合物纳米粒用于治疗宫颈癌。结果显示, 在人宫颈癌细胞HeLa孵育48 h后其IC50值小于载药线型聚合物纳米粒和市售制剂(Taxotere), 另外, 其载药量也高于线型聚合物纳米粒(10.08%和8.75%)。Yang等[47]设计了β环糊精为核心, 具有不同数量TPGS分支的几种星型聚合物载体以荷载多柔比星(DOX@ CDT2、DOX@CDT4和DOX@CDT6)。结果显示, 随着TPGS分支的增加, PEG含量及纳米粒稳定性提高且抑瘤效果增强, 如DOX@CDT2不能稳定存在于去离子水及PBS溶液, 而DOX@CDT4和DOX@CDT6稳定性高, 且其抑瘤率分别可达84.5%和85.3%。此外, TPGS也可用于制备树枝型聚合物载体, 进一步构建纳米载药系统[48]。
3.2 基于TPGS的纳米脂质体脂质体是由磷脂双分子层组成的球形囊泡, 含亲水内核和疏水双分子夹层, 能够分别装载亲脂性和亲水性药物。脂质体的类生物膜结构赋予其细胞亲和力高、低毒性和低免疫原性等特征, 使其成为一种重要的递药系统。但是脂质体进入体内后能被巨噬细胞吞噬, 而富集在巨噬细胞丰富的肝、脾和骨髓等组织器官中, 其他组织部位分布少, 导致药物生物利用度下降。将TPGS应用于脂质体系统, 基于其亲水表面特性, 能够改善脂质体的体内分布特性, 延长体内循环时间; 同时, 借助TPGS的P-gp外排抑制活性, 能够增加肿瘤部位的药物蓄积, 提高药物生物利用度。
TPGS可修饰脂质体表面, 改善其稳定性、延长体内循环寿命及提高药物蓄积浓度进而增强抗癌药物的治疗效果。Li等[49]制备的荷载木犀草素的TPGS修饰脂质体(LUT-TPGS)与游离药物相比, 具有较高的细胞毒性、细胞摄取效率和肿瘤病灶蓄积能力。活体荧光成像结果显示, TPGS-DiR脂质体相比DiR荧光强度高, 维持时间长(24 h和1 h)且集中在肿瘤部位。另外, 体内药效学结果表明, TPGS显著增强了脂质体抗肿瘤作用。Muthu等[50]采用TPGS修饰脂质体荷载DTX后, 其细胞毒作用相较于Taxotere高7倍, 并且优于PEG修饰脂质体(IC50: 5.93 ± 0.57和7.70 ± 0.22 μg·mL-1)。TPGS和肿瘤靶向配体可联合修饰脂质体, 协同克服MDR。Sonali等[51]制备了精氨酸-甘氨酸-天冬氨酸(RGD)肽修饰的载DTX和量子点(QDs)的RGD-TPGS靶向脂质体。与市售制剂及非靶向脂质体相比, RGD-TPGS靶向脂质体能够穿过血脑屏障, 将DTX和QDs高效运送到脑组织, 增强治疗效果, 同时, 显著改善其生物相容性和安全性。Muthu等[52]则以叶酸为靶向配体制备携载DTX的TPGS脂质体, 并进行体外评估。在耐药乳腺癌细胞MCF-7孵育24 h后, 其IC50值相比非靶向TPGS脂质体低(0.23 ± 0.05和1.56 ± 0.19 μg·mL-1), 而孵育2 h后通过共聚焦激光显微镜图像证实其细胞摄取作用也高于非靶向TPGS脂质体。Assanhou等[53]设计了TPGS和透明质酸(HA)双功能修饰的1, 5-二十八烷基-N-组氨酰-L-谷氨酸(HG2C18)阳离子脂质体(HA-TPGS-CL), 用于荷载PTX和化疗增敏剂氯尼达明(LND)。该脂质体基于阳离子性质和组氨酸部分的质子海绵效应可以实现溶酶体内逃逸, 进而使抗癌药物在肿瘤细胞内高效传递。脂质体外壳的HA是肿瘤细胞过表达CD44受体的靶向配体, 能与后者发生特异性相互作用, 使得脂质体快速、有效地富集于肿瘤病灶部位, 表现出优异的抗肿瘤效果。另外, 经TPGS表面修饰的脂质体, 通过抑制P-gp外排作用, 提高药物蓄积量, 为逆转MDR提供了一个好策略。
TPGS可联合线粒体靶向策略以克服肿瘤MDR。Li等[54]采用线粒体靶向分子地喹氯铵(DQA)和TPGS表面修饰脂质体, 其中DQA可增强药物的跨线粒体膜递送效率, 联合TPGS的P-gp抑制作用, 实现有效的线粒体靶向治疗及改善肿瘤耐药性。相比于对照组, 靶向脂质体可选择性蓄积在线粒体中并降低MMP, 与肺癌耐药细胞A549/cDDP孵育4 h后, 线粒体内药物含量明显增加, 同时, 与非靶向脂质体相比, 胞质内细胞色素C含量及抗肿瘤效果显著提高。Yu等[55]制备的DQA和TPGS修饰线粒体靶向脂质体也可负载拓扑替康, 治疗耐药乳腺癌, 其粒径小(64 nm)、包封率高(≥95%), 且可稳定存在于含有血液成分的系统中, 泄漏极少。综上, TPGS联合线粒体靶向脂质体或许是一种有效治疗肿瘤耐药的方案。
3.3 基于TPGS的聚合物-药物偶联物TPGS可与其他药物化学偶联制成前药, 以优化药物的药代动力学和药效学性质和改善制剂的效果, 如提高药物溶解度、渗透性、稳定性、生物利用度、治疗效果和降低毒副作用等。相比于TPGS表面修饰的聚合物纳米粒, 亲水性TPGS与药物偶联可延长药物的体内循环时间, 同时, 化学结合更牢固, 往往能提高荷载药物量, 且可更为有效地调控药物的释放, 避免在血液循环系统中药物的突释。但值得注意的是, 若TPGS与药物偶联的化学键太牢固, 可能会导致其进入肿瘤细胞后TPGS与药物分离困难, 从而影响药效发挥, 故亦可设计肿瘤微环境智能响应释药, 来控制药物的释放速度和释放部位, 从而增强治疗效果。
Mi等[56]制备的TPGS缀合顺铂的前药胶束相比游离顺铂及PEG缀合顺铂前药显著提高了HepG2细胞摄取效率, 同时改善了药物稳定性及生物利用度。Hou等[57]选择pH敏感型TPGS-DOX前药纳米粒荷载光敏剂e6 (Ce6), 由于其酰胺键的水解作用, 能够有效调控药物释放, 在弱酸条件下(pH 5.5) 10 h时Ce6和DOX释药量分别达到约70%和60%, 而在pH 7.4条件下稳定性良好, 均为20%左右; TPGS缀合亦可增强药物在病灶部位的富集, 给药12 h时的体内平均荧光强度比游离Ce6高18倍。Bao等[58]制备了氧化还原敏感型TPGS-SS-PTX前药聚合物胶束, 以实现在肿瘤微环境下的调控释药和P-gp抑制协同作用, 其在卵巢癌耐药细胞A2780/T的摄取量高于TPGS-CC-PTX, 同时, 细胞毒性显著高于游离PTX及TPGS-CC-PTX。另外, 他们以P-gp底物罗丹明123在A2780/T细胞内的摄取量为评价指标, 进一步考察了TPGS-药物偶联物对P-gp活性的影响。结果显示, TPGS-SS-PTX和TPGS-CC-PTX组处理后的A2780/T细胞内罗丹明123蓄积量均明显高于维拉帕米(第一代P-gp抑制剂)组, 且TPGS-SS-PTX组蓄积量最高, 提示基于TPGS的前药递药系统, 可通过设计敏感键及借助TPGS抑制P-gp作用, 实现增加药物蓄积量, 有效逆转MDR效果。
TPGS-药物偶联物亦可进一步采用靶向配体修饰, 增强药物的肿瘤细胞选择性, 协同克服肿瘤耐药。Mi等[59]制备了赫塞汀化学修饰的TPGS-顺铂前药纳米粒(HTCP NPs), 用于靶向联合递送赫塞汀、多西他赛和顺铂至表皮生长因子受体2高表达的乳腺癌细胞SK-BR-3。赫塞汀与类表皮生长因子受体2特异性相互作用, 可进一步增加纳米粒的肿瘤细胞摄取及提高抗癌药物的细胞毒性。由此, 具有敏感键或特异性靶向功能的TPGS前药纳米体系为解决抗癌药物的溶解性、渗透性、稳定性和体内循环等提供了重要的研究策略。
3.4 基于TPGS的纳米乳纳米乳是将两种不相容的液体通过表面活性剂形成水包油型(O/W)或油包水型(W/O)分散系, 纳米乳剂可以进一步制成不同的剂型, 如液体制剂、乳膏剂和喷雾剂等。纳米乳液滴的平均粒径在20~200 nm之间, 因其较小的粒径而具有长期的物理稳定性, 可用于靶向药物递送、诊断及癌症治疗[60]。低毒性的、HLB值适宜的TPGS可以作为乳化剂应用于纳米乳体系, 可通过降低其界面张力, 提高纳米乳的稳定性; 同时, 基于TPGS的P-gp抑制活性, 改善纳米乳的瘤内药物滞留量, 逆转MDR。
Sun等[61]以TPGS为乳化剂, 制备荷载难溶性药物乙酰葛根素的纳米乳时发现, TPGS可以促进乳糜微粒的形成, 进而改善淋巴转运, 提高药物口服利用度(提高率可达30%), 并且随着TPGS用量增加, 纳米乳平均粒径及多分散指数降低。Bu等[34]制备TPGS修饰的紫杉醇纳米乳NE-PTX, 用于乳腺癌的治疗。结果显示, NE-PTX具有较高的细胞毒性和肿瘤细胞摄取效率, 其肿瘤抑制率高达93.84%。进一步的机制研究发现, 相比于PTX, NE-PTX和空白纳米乳(SN)显著降低了肿瘤细胞线粒体膜电位和细胞内ATP水平, 而胞内P-gp表达水平未发生变化。Ma等[62]制备的紫杉醇纳米乳(PTX-VE NEs)生物利用度相比PTX的市售制剂(Taxol)高(AUC: 2 285和2.7 mg·L-1·h-1), 所制备的5-氟尿嘧啶纳米乳(5-Fu-TPGS NEs)生物利用度也比游离5-Fu高(AUC: 95.2和9.8 mg·L-1·h-1); 为了进一步优化抗肿瘤效果, 他们设计了联合载药纳米乳(PTX-VE + 5-FU-TPGS NEs), 其在人表皮癌耐药细胞KB-8-5上细胞毒作用相比两种单独载药纳米乳均高2倍。因TPGS特有的结构特点, 将其用于纳米乳体系中, 不仅提高纳米乳的性能, 且拓展了纳米乳在逆转MDR领域的应用, 更值得关注。
3.5 基于TPGS的纳米晶体纳米晶体中药物无需载体材料, 是一种药物亚微米颗粒的胶状分散体系, 依靠电荷保护剂和立体保护剂来维持制剂的稳定性[63]。纳米晶体能够克服疏水性药物溶解性差的局限, 提高药物的溶出度和生物利用度, 且制备工艺简单, 明显优于其他聚合物和脂质纳米给药系统[64]。TPGS作为非离子型表面活性剂应用于纳米晶体给药系统, 可以增加系统的稳定性和抑制P-gp外排转运, 进一步提高药物生物利用度。
Srivalli等[65]采用TPGS和L-抗坏血酸-2-葡糖苷(AA2G)作为稳定剂, 将BCS Ⅱ类的药物依替米贝(Eze)制备成纳米晶体, 显著改善了Eze的溶解性, 溶解度从1.99 ± 0.62 μg·mL-1提高到24.73 ± 1.24 μg·mL-1。Eze是一种抑制胆固醇吸收的降血脂药, 总胆固醇(TC)、低密度脂蛋白胆固醇(LDL)和脂蛋白胆固醇(HDL)水平是常用评价指标。药效学实验结果显示, 与原药组和单用AA2G组相比, TPGS与AA2G联用组显著降低TC和LDL水平, 提高HDL水平, 表明TPGS能够提高Eze纳米晶的治疗效果。TPGS同样作为稳定剂用于BCS Ⅱ类药物替米沙坦纳米晶体后, 其生物利用度增加了10倍[66]。Liu等[67]以TPGS为赋形剂制备的PTX纳米晶体载药量高达50%。研究表明, PTX纳米晶体可高效诱导卵巢腺癌耐药细胞NCI/ADR-RES凋亡, 早期凋亡比和晚期凋亡比均在95%以上, 而Taxol组则仅分别为19.4%和7.1%;此外, PTX/TPGS纳米晶体抑瘤率是Taxol的2.3倍, 显示出更强的抗肿瘤作用。Gao等[38]设计的以TPGS为P-gp抑制剂和稳定剂制备的PTX纳米晶混悬液(Nano-PTX), 在人肺癌耐药细胞H460上有良好的抗肿瘤效果。结果显示, H460耐药细胞P-gp表达水平相比敏感细胞高4倍, 在TPGS溶液(100 μg·mL-1)暴露24 h后其P-gp表达降低25.41%; Nano-PTX与PTX溶液相比, 细胞毒性显著提高, 在每个时间点都具有较低的IC50值, 并且静脉给药后抑瘤率增加了约5倍。
4 总结和展望肿瘤MDR效应极大程度限制了化疗药物的临床应用, 其发生机制复杂, 目前仍然未能完全明了针对P-gp介导的MDR效应, TPGS因其独特的结构特征和安全、高效的P-gp抑制能力, 在逆转肿瘤MDR的应用中得到广泛关注。随着人们对TPGS的深入研究, 其抑制P-gp的分子机制亦越来越清晰, 结合其与纳米粒、物理或化学的灵活修饰与构建方式, 在改善纳米递药系统的性能与功能方面将更具优越性。同时, 为多种手段联合逆转肿瘤MDR的治疗提供新的策略。随着TPGS作用机制研究逐步深入及其衍生物不断改进, 基于TPGS的纳米递药系统的功能将更广泛、更高效, 对肿瘤临床治疗具有十分重要的意义。
| [1] | Chen ZL, Shi TL, Zhang L, et al. Mammalian drug efflux transporters of the ATP binding cassette (ABC) family in multidrug resistance: a review of the past decade[J]. Cancer Lett, 2016, 370: 153–164. DOI:10.1016/j.canlet.2015.10.010 |
| [2] | Palmeira A, Sousa E, Vasconcelos MH, et al. Three decades of P-gp inhibitors: skimming through several generations and scaffolds[J]. Curr Med Chem, 2012, 19: 1946–2025. DOI:10.2174/092986712800167392 |
| [3] | Juliano RL, Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants[J]. Biochim Biophys Acta, 1976, 455: 152–162. DOI:10.1016/0005-2736(76)90160-7 |
| [4] | Abdallah HM, Al-Abd AM, El-Dine RS, et al. P-glycoprotein inhibitors of natural origin as potential tumor chemo- sensitizers: a review[J]. J Adv Res, 2015, 6: 45–62. DOI:10.1016/j.jare.2014.11.008 |
| [5] | Silva R, Vilas-Boas V, Carmo H, et al. Modulation of P-glycoprotein efflux pump: induction and activation as a therapeutic strategy[J]. Pharmacol Ther, 2015, 149: 1–123. DOI:10.1016/j.pharmthera.2014.11.013 |
| [6] | Li YH, Huang L, Wei XH, et al. Regulation of P-glycoprotein gene expression by PKC/NF-κB-PXR signaling pathway[J]. Acta Pharm Sin (药学学报), 2017, 52: 51–57. |
| [7] | Syed SB, Coumar MS. P-glycoprotein mediated multidrug resistance reversal by phytochemicals: a review of SAR & future perspective for drug design[J]. Curr Top Med Chem, 2016, 16: 2484–2508. DOI:10.2174/1568026616666160212123814 |
| [8] | Yamazaki T, Sato Y, Hanai M, et al. Non-ionic detergent tween 80 modulates VP-16 resistance in classical multidrug resistant K562 cells via enhancement of VP-16 influx[J]. Cancer Lett, 2000, 149: 153–161. DOI:10.1016/S0304-3835(99)00355-9 |
| [9] | Bogman K, Erne-Brand F, Alsenz J, et al. The role of surfactants in the reversal of active transport mediated by multidrug resistance proteins[J]. J Pharm Sci, 2003, 92: 1250–1261. DOI:10.1002/jps.10395 |
| [10] | Zhang ZP, Tan SW, Feng SS. Vitamin E TPGS as a molecular biomaterial for drug delivery[J]. Biomaterials, 2012, 33: 4889–4906. DOI:10.1016/j.biomaterials.2012.03.046 |
| [11] | Zhu HJ, Chen HB, Zeng XW, et al. Co-delivery of chemotherapeutic drugs with vitamin E TPGS by porous PLGA nanoparticles for enhanced chemotherapy against multi-drug resistance[J]. Biomaterials, 2014, 35: 2391–2400. DOI:10.1016/j.biomaterials.2013.11.086 |
| [12] | Pham CV, Cho CW. Application of D-α-tocopheryl polyethylene glycol 1000 succinate (TPGS) in transdermal and topical drug delivery systems (TDDS)[J]. J Pharm Investig, 2017, 47: 111–121. DOI:10.1007/s40005-016-0300-x |
| [13] | Guo YY, Luo J, Tan SW, et al. The applications of vitamin E TPGS in drug delivery[J]. Eur J Pharm Sci, 2013, 49: 175–186. DOI:10.1016/j.ejps.2013.02.006 |
| [14] | Buckingham LE, Balasubramanian M, Emanuele RM, et al. Comparison of Solutol HS 15, Cremophor EL and novel ethoxylated fatty acid surfactantsas multidrug resistance modification agents[J]. Int J Cancer, 1995, 62: 436–442. DOI:10.1002/(ISSN)1097-0215 |
| [15] | Lo YL. Relationships between the hydrophilic-lipophilic balance values of pharmaceutical excipients and their multidrug resistance modulating effect in Caco-2 cells and rat intestines[J]. J Control Release, 2003, 90: 37–48. DOI:10.1016/S0168-3659(03)00163-9 |
| [16] | Collnot EM, Baldes C, Wempe MF, et al. Influence of vitamin E TPGS poly (ethylene glycol) chain length on apical efflux transporters in Caco-2 cell monolayers[J]. J Control Release, 2006, 111: 35–40. DOI:10.1016/j.jconrel.2005.11.005 |
| [17] | Zhao J, Feng SS. Effects of PEG tethering chain length of vitamin E TPGS with a Herceptin-functionalized nanoparticle formulation for targeted delivery of anticancer drugs[J]. Biomaterials, 2014, 35: 3340–3347. DOI:10.1016/j.biomaterials.2014.01.003 |
| [18] | LiuTF, Liu XY, Xiong H, et al. Mechanisms of TPGS and its derivatives inhibiting P-glycoprotein efflux pump and application for reversing multidrug resistance in hepatocellular carcinoma[J]. Polym Chem, 2018, 9: 1827–1839. DOI:10.1039/C8PY00344K |
| [19] | Dintaman JM, Silverman JA. Inhibition of P-glycoprotein by D-α-tocopheryl polyethylene glycol 1000 succinate (TPGS)[J]. Pharm Res, 1999, 16: 1550–1556. DOI:10.1023/A:1015000503629 |
| [20] | Rege BD, Kao JP, Polli JE. Effects of nonionic surfactants on membrane transporters in Caco-2 cellmonolayers[J]. Eur J Pharm Sci, 2002, 16: 237–246. DOI:10.1016/S0928-0987(02)00055-6 |
| [21] | Collnot EM, Baldes C, Wempe MF, et al. Mechanism of inhibition of P-glycoprotein mediated efflux by vitamin E TPGS: influence on ATPase activity and membrane fluidity[J]. Mol Pharm, 2007, 4: 465–474. DOI:10.1021/mp060121r |
| [22] | Collnot EM, Baldes C, Schaefer UF, et al. Vitamin E TPGS P-glycoprotein inhibition mechanism: influence on conformational flexibility, intracellular ATP levels, and role of time and site of access[J]. Mol Pharm, 2010, 7: 642–651. DOI:10.1021/mp900191s |
| [23] | Hao TN, Chen DW, Liu KX, et al. Micelles of D-α-tocopheryl polyethylene glycol 2000 succinate (TPGS2K) for doxorubicin delivery with reversal of multidrug resistance[J]. ACS Appl Mater Interf, 2015, 7: 18064–18075. DOI:10.1021/acsami.5b04995 |
| [24] | Wang DF, Rong WT, Lu Y, et al. TPGS 2k/PLGA nanoparticles for overcoming multidrug resistance by interfering mitochondria of human alveolar adenocarcinoma cells[J]. ACS Appl Mater Interf, 2015, 7: 3888–3901. DOI:10.1021/am508340m |
| [25] | Wang AT, Liang DS, Liu YJ, et al. Roles of ligand and TPGS of micelles in regulating internalization, penetration and accumulation against sensitive or resistant tumor and therapy for multidrug resistant tumors[J]. Biomaterials, 2015, 53: 160–172. DOI:10.1016/j.biomaterials.2015.02.077 |
| [26] | Zhu XM, Tsend-Ayush A, Yuan ZY, et al. Glycyrrhetinic acid-modified TPGS polymeric micelles for hepatocellular carcinoma-targeted therapy[J]. Int J Pharm, 2017, 529: 451–464. DOI:10.1016/j.ijpharm.2017.07.011 |
| [27] | Tsend-Ayush A, Zhu X, Ding Y, et al. Lactobionic acid- conjugated TPGS nanoparticles for enhancing therapeutic efficacy of etoposide against hepatocellular carcinoma[J]. Nanotechnology, 2017, 28: 195602. DOI:10.1088/1361-6528/aa66ba |
| [28] | Ren XH, Mao XL, Si LQ, et al. Pharmaceutical excipients inhibit cytochrome P450 activity in cell free systems and after systemic administration[J]. Eur J Pharm Biopharm, 2008, 70: 279–288. DOI:10.1016/j.ejpb.2008.03.019 |
| [29] | Christiansen A, Backensfeld T, Denner K, et al. Effects of nonionic surfactants on cytochrome P450-mediated metabolism in vitro [J]. Eur J Pharm Biopharm, 2011, 78: 166–172. DOI:10.1016/j.ejpb.2010.12.033 |
| [30] | Mudra DR, Borchardt RT. Absorption barriers in the rat intestinal mucosa. 3: effects of polyethoxylated solubilizing agents on drug permeation and metabolism[J]. J Pharm Sci, 2010, 99: 1016–1027. DOI:10.1002/jps.21836 |
| [31] | Mudra DR, Jin JY, Borchardt RT. Absorption barriers in the rat intestinal mucosa: 2. application of physiologically based mathematical models to quantify mechanisms of drug permeation and metabolism[J]. J Pharm Sci, 2010, 99: 999–1015. DOI:10.1002/jps.21965 |
| [32] | Zhang JL, Zhao XF, Chen Q, et al. Systematic evaluation of multifunctional paclitaxel-loaded polymeric mixed micelles as a potential anticancer remedy to overcome multidrug resistance[J]. Acta Biomater, 2017, 50: 381–395. DOI:10.1016/j.actbio.2016.12.021 |
| [33] | Dong K, Yan Y, Wang PC, et al. Biodegradable mixed MPEG-SS-2SA/TPGS micelles for triggered intracellular release of paclitaxel and reversing multidrug resistance[J]. Int J Nanomedicine, 2016, 11: 5109–5123. DOI:10.2147/IJN |
| [34] | Bu HH, He XY, Zhang ZW, et al. A TPGS-incorporating nanoemulsion of paclitaxel circumvents drug resistance in breast cancer[J]. Int J Pharm, 2014, 471: 206–213. DOI:10.1016/j.ijpharm.2014.05.039 |
| [35] | Wang SP, Yang Y, Wang YT, et al. Gambogic acid-loaded pH-sensitive mixed micelles for overcoming breast cancer resistance[J]. Int J Pharm, 2015, 495: 840–848. DOI:10.1016/j.ijpharm.2015.09.041 |
| [36] | Fan ZY, Chen C, Pang XY, et al. Adding vitamin E-TPGS to the formulation of genexol-PM: specially mixed micelles improve drug-loading ability and cytotoxicity against multidrug- resistant tumors significantly[J]. PLoS One, 2015, 10: e0120129. DOI:10.1371/journal.pone.0120129 |
| [37] | Han SM, Baek JS, Kim MS, et al. Surface modification of paclitaxel-loaded liposomes using D-α-tocopheryl polyethylene glycol 1000 succinate: enhanced cellular uptake and cytotoxicity in multidrug resistant breast cancer cells[J]. Chem Phys Lipids, 2018, 213: 39–47. DOI:10.1016/j.chemphyslip.2018.03.005 |
| [38] | Gao L, Liu GY, Ma JL, et al. Paclitaxel nanosuspension coated with P-gp inhibitory surfactants: Ⅱ. Ability to reverse the drug-resistance of H460 human lung cancer cells[J]. Colloids Surf B Biointerf, 2014, 117: 122–127. DOI:10.1016/j.colsurfb.2014.02.016 |
| [39] | Kulkarni SA, Feng SS. Effects of particle size and surface modification on cellular uptake and biodistribution of polymeric nanoparticles for drug delivery[J]. Pharm Res, 2013, 30: 2512–2522. DOI:10.1007/s11095-012-0958-3 |
| [40] | Cheng W, Liang CY, Xu L, et al. TPGS-functionalized polydopamine-modified mesoporous Silica as drug nanocarriers for enhanced lung cancer chemotherapy against multidrug resistance[J]. Small, 2017, 13: 1700623. DOI:10.1002/smll.v13.29 |
| [41] | Song J, Huang HC, Xia Z, et al. TPGS/phospholipids mixed micelles for delivery of icariside Ⅱ to multidrug-resistant breast cancer[J]. Integr Cancer Ther, 2016, 15: 390–399. DOI:10.1177/1534735415596571 |
| [42] | Bao X, Gao M, Xu H, et al. A novel oleanolic acid-loaded PLGA-TPGS nanoparticle for liver cancer treatment[J]. Drug Dev Ind Pharm, 2015, 41: 1193–1203. DOI:10.3109/03639045.2014.938081 |
| [43] | Agrawal P, Singh RP, Sonali, et al. TPGS-chitosan cross- linked targeted nanoparticles for effective brain cancer therapy[J]. Mater Sci Eng C Mater Biol Appl, 2017, 74: 167–176. DOI:10.1016/j.msec.2017.02.008 |
| [44] | Kutty RV, Chia SL, Setyawati MI, et al. In vivo and ex vivo proofs of concept that cetuximab conjugated vitamin E TPGS micelles increases efficacy of delivered docetaxel against triple negative breast cancer[J]. Biomaterials, 2015, 63: 58–69. DOI:10.1016/j.biomaterials.2015.06.005 |
| [45] | Wang Y, Liu XQ, Liu GP, et al. Novel galactosylated biodegradable nanoparticles for hepatocyte-delivery of oridonin[J]. Int J Pharm, 2016, 502: 47–60. DOI:10.1016/j.ijpharm.2016.02.025 |
| [46] | Zeng XW, Tao W, Mei L, et al. Cholic acid-functionalized nanoparticles of star-shaped PLGA-vitamin E TPGS copolymer for docetaxel delivery to cervical cancer[J]. Biomaterials, 2013, 34: 6058–6067. DOI:10.1016/j.biomaterials.2013.04.052 |
| [47] | Yang CL, Qin YT, Tu K, et al. Star-shaped polymer of β-cyclodextrin-g-vitamin E TPGS for doxorubicin delivery and multidrug resistance inhibition[J]. Colloids Surf B Biointerfaces, 2018, 169: 10–19. DOI:10.1016/j.colsurfb.2018.05.001 |
| [48] | Zeng XW, Tao W, Wang ZY, et al. Docetaxel-loaded nanoparticles of dendritic amphiphilic block copolymer H40- PLA-b-TPGS for cancer treatment[J]. Part Part Syst Char, 2015, 32: 112–122. DOI:10.1002/ppsc.201400048 |
| [49] | Li JL, Cheng XD, Chen Y, et al. Vitamin E TPGS modified liposomes enhance cellular uptake and targeted delivery of luteolin: an in vivo/in vitro evaluation[J]. Int J Pharm, 2016, 512: 262–272. DOI:10.1016/j.ijpharm.2016.08.037 |
| [50] | Muthu MS, Kulkarni SA, Xiong JQ, et al. Vitamin E TPGS coated liposomes enhanced cellular uptake and cytotoxicity of docetaxel in brain cancer cells[J]. Int J Pharm, 2011, 421: 332–340. DOI:10.1016/j.ijpharm.2011.09.045 |
| [51] | Sonali, Singh RP, Sharma G, et al. RGD-TPGS decorated theranostic liposomes for brain targeted delivery[J]. Colloids Surf B Biointerfaces, 2016, 147: 129–141. DOI:10.1016/j.colsurfb.2016.07.058 |
| [52] | Muthu MS, Kulkarni SA, Raju A, et al. Theranostic liposomes of TPGS coating for targeted co-delivery of docetaxel and quantum dots[J]. Biomaterials, 2012, 33: 3494–3501. DOI:10.1016/j.biomaterials.2012.01.036 |
| [53] | Assanhou AG, Li WY, Zhang L, et al. Reversal of multidrug resistance by co-delivery of paclitaxel and lonidamine using a TPGS and hyaluronic acid dual-functionalized liposome for cancer treatment[J]. Biomaterials, 2015, 73: 284–295. DOI:10.1016/j.biomaterials.2015.09.022 |
| [54] | Li N, Zhang CX, Wang XX, et al. Development of targeting lonidamine liposomes that circumvent drug-resistant cancer by acting on mitochondrial signaling pathways[J]. Biomaterials, 2013, 34: 3366–3380. DOI:10.1016/j.biomaterials.2013.01.055 |
| [55] | Yu Y, Wang ZH, Zhang L, et al. Mitochondrial targeting topotecan-loaded liposomes for treating drug-resistant breast cancer and inhibiting invasive metastases of melanoma[J]. Biomaterials, 2012, 33: 1808–1820. DOI:10.1016/j.biomaterials.2011.10.085 |
| [56] | Mi Y, Zhao J, Feng SS. Vitamin E TPGS prodrug micelles for hydrophilic drug delivery with neuroprotective effects[J]. Int J Pharm, 2012, 438: 98–106. DOI:10.1016/j.ijpharm.2012.08.038 |
| [57] | Hou WX, Zhao X, Qian XQ, et al. pH-Sensitive self- assembling nanoparticles for tumor near-infrared fluorescence imaging and chemo-photodynamic combination therapy[J]. Nanoscale, 2016, 8: 104–116. DOI:10.1039/C5NR06842H |
| [58] | Bao YL, Guo YY, Zhuang XT, et al. D-α-Tocopherol polyethylene glycol succinate-based redox-sensitive paclitaxel prodrug for overcoming multidrug resistance in cancer cells[J]. Mol Pharm, 2014, 11: 3196–3209. DOI:10.1021/mp500384d |
| [59] | Mi Y, Zhao J, Feng SS. Targeted co-delivery of docetaxel, cisplatin and herceptin by vitamin E TPGS-cisplatin prodrug nanoparticles for multimodality treatment of cancer[J]. J Control Release, 2013, 169: 185–192. DOI:10.1016/j.jconrel.2013.01.035 |
| [60] | Singh Y, Meher JG, Raval K, et al. Nanoemulsion: concepts, development and applications in drug delivery[J]. J Control Release, 2017, 252: 28–49. DOI:10.1016/j.jconrel.2017.03.008 |
| [61] | Sun DQ, Wei XB, Xue X, et al. Enhanced oral absorption and therapeutic effect of acetylpuerarin based on D-α- tocopheryl polyethylene glycol 1000 succinate nanoemulsions[J]. Int J Nanomedicine, 2014, 9: 3413–3423. |
| [62] | Ma Y, Liu D, Wang D, et al. Combinational delivery of hydrophobic and hydrophilic anticancer drugs in single nanoemulsions to treat MDR in cancer[J]. Mol Pharm, 2014, 11: 2623–2630. DOI:10.1021/mp400778r |
| [63] | Chogale MM, Ghodake VN, Patravale VB. Performance parameters and characterizations of nanocrystals: a brief review[J]. Pharmaceutics, 2016, 8: 26. DOI:10.3390/pharmaceutics8030026 |
| [64] | Pawar VK, Singh Y, Meher JG, et al. Engineered nanocrystal technology: in-vivo fate, targeting and applications in drug delivery[J]. J Control Release, 2014, 183: 51–66. DOI:10.1016/j.jconrel.2014.03.030 |
| [65] | Srivalli KM, Mishra B. Preparation and pharmacodynamic assessment of ezetimibe nanocrystals: effect of P-gp inhibitory stabilizer on particle size and oral absorption[J]. Colloids Surf B Biointerfaces, 2015, 135: 756–764. DOI:10.1016/j.colsurfb.2015.08.042 |
| [66] | Bajaj A, Rao MR, Pardeshi A, et al. Nanocrystallization by evaporative antisolvent technique for solubility and bioavailability enhancement of telmisartan[J]. AAPS Pharm Sci Tech, 2012, 13: 1331–1340. DOI:10.1208/s12249-012-9860-x |
| [67] | Liu Y, Huang L, Liu F. Paclitaxel nanocrystals for overcoming multidrug resistance in cancer[J]. Mol Pharm, 2010, 7: 863–869. DOI:10.1021/mp100012s |
 2018, Vol. 53
2018, Vol. 53


