2. 包头医学院药学院, 内蒙古 包头 014060
2. School of Pharmacy, Baotou Medical College, Baotou 014060, China
白木香(Aquilaria sinensis)是我国特有而珍贵的药用植物[1], 也是国产名贵药材沉香的唯一正品植物来源, 已被列入《濒危野生动植物种国际贸易公约》 (CITES)附录Ⅱ[2]和国家濒危二级保护植物[3]。沉香是我国传统名贵中药, 具有行气止痛、温中止呕、纳气平喘等功效, 对于胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急等有显著疗效[1], 药理研究表明, 沉香具有消化系统和中枢神经系统的保护作用。另外, 沉香是一种名贵香料, 具有龙涎香与檀香混合物的香味, 至今仍旧无法复制这种香味[4]。健康的白木香并不产生沉香, 只有通过自然因素(雷劈、火烧、虫蛀等)或者人为因素(砍伤、打洞、接菌等)的作用才能形成沉香, 但是沉香形成的分子机制一直没有揭示, 严重制约高效人工结香技术的建立[5]。长期以来, 白木香为适应逆境胁迫[6, 7], 进化产生了一系列对逆境胁迫的防御机制。在白木香遭受外界生物与非生物胁迫时, 可以使多种基因诱导表达[8, 9], 进而引起植物体内抵御胁迫的反应。
S-腺苷甲硫氨酸合成酶(S-adenosylmethionine synthetase, SAMS)是植物代谢过程中的一个关键酶, 它能催化ATP和甲硫氨酸反应生成S-腺苷甲硫氨酸(S-adenosyl-methionine, SAM), 是重要的甲基供体, 并且是生物合成多胺和乙烯等的前体, 能够参与植物的转氨丙基、转甲基和转硫等多种重要的生化反应过程, 在指导中间体走向特定生物合成途径中起着至关重要的作用[10-12]。同时, SAMS还可以与RNA结合参与基因的表达调控[13]。研究表明, SAMS基因的功能与植物的胁迫反应密切相关[14-16]。小麦中SAMS是其抗旱节水中的关键基因, SAMS基因的表达受水分胁迫及水分胁迫后复水诱导[16]。Ma等[17]发现盐地碱蓬中SAMS基因在盐胁迫下表达量升高, 酶活性检测发现盐胁迫条件下该酶的活性增强。Guo等[18]研究表明ABA、H2O2和NO相互作用进而介导冷胁迫下MfSAMS1的表达, 并且过表达该基因后还可以显著提高H2O2诱导的抗氧化保护作用, 可以增强转基因植株对低温和低温胁迫的耐受性, 说明SAMS基因能够提高植物的抗逆性。因而分离S-腺苷甲硫氨酸合成酶基因并分析其表达对于理解其在植物生长发育和逆境胁迫中的作用具有重要意义。目前在高山离子芥[19]、蜈蚣草[20]、番茄[21]、拟南芥[22]等植物中克隆得到了SAMS基因并对其相关功能进行了研究, 但是白木香SAMS基因的克隆、蛋白原核表达、及其在植物防御反应中作用尚未见文献报道, 因此研究白木香中SAMS的生物信息学、蛋白原核表达及在非生物胁迫和激素处理下的表达方式有利于丰富SAMS的生物合成功能及在植物防御反应中的重要作用, 同时有利于阐明白木香的结香机制。本研究中通过分析高通量测序结果, 利用RT-PCR结合RACE技术在白木香愈伤组织中克隆得到一条SAMS基因的cDNA全长, 命名为AsSAMS1, 并对其序列进行了生物学信息分析和蛋白原核表达分析, 通过荧光定量PCR技术分析其在不同组织中的表达差异, 并研究其在受到盐、干旱、低温及重金属胁迫和外源茉莉酸甲酯、水杨酸、脱落酸和赤霉素处理不同时间愈伤组织中的表达及积累情况, 为研究沉香结香机制及植物的防御反应机制奠定基础。
材料与方法材料及处理 白木香种苗是从广州移植, 现种植于北京中医药大学中药现代研究中心6年(白木香培养条件:室温25 ℃左右, 湿度在60%左右), 采集6月份的白木香的根、茎、茎尖及叶提取总RNA, 检测AsSAMS1基因在不同器官中的特异性表达。利用白木香叶片和茎尖诱导的愈伤组织, 选取长势相同的白木香愈伤组织, 分别经NaCl (150 mmol·L-1)、低温(4 ℃)、CdCl2 (500 µmol·L-1)、甘露醇(750 mmol·L-1) 4种非生物胁迫及脱落酸(ABA) (150 µmol·L-1)、茉莉酸甲酯(MeJA) (150 µmol·L-1)、赤霉素(GA3) (150 µmol·L-1)、水杨酸(SA) (150 µmol·L-1) 4种外源激素处理, 在处理后0、12、24、36、48 h提取RNA作为样品检测AsSAMS基因在各种处理下的表达差异。所用菌种为大肠杆菌(Escherichia coli) DH5α购自天根生物科技有限公司。高效液相色谱仪(LC-20), 日本Shimadzu公司; 色谱柱: Ultimate LP-C18 (4.6 mm × 250 mm, 5.0 μm), 中国月旭科技公司; S-腺苷甲硫氨酸(SAM)购自美国Sigma公司; 三氯乙酸购自中国Aladdin公司。
白木香组织及愈伤组织中总RNA的提取和cDNA的合成 按照EASYspin Plus植物RNA快速提取试剂盒(Aidlab, 中国)实验操作步骤进行植物总RNA提取, 利用NanoDrop 2000C检测RNA浓度, 同时利用1.2%琼脂糖凝胶电泳检测RNA的完整性和质量。利用Sigma公司的反转录酶M-MLV将白木香的总RNA反转录为第一链(cDNA), 反转录的条件按照说明书进行。
白木香AsSAMS1基因核心片段的克隆 从白木香转录组高通量测序结果[6]中获得1个由表达序列标签拼接而成的序列, 经注释分析发现为AsSAMS1核心片段, 依据该序列利用Primer软件设计两端特异引物, 引物序列见表 1。以白木香总RNA的反转录产物为模板, 按照下列体系对白木香中AsSAMS1基因进行扩增: cDNA 1 µL, LA Taq (2.5 U·µL-1) 0.5 µL, 10×LA Taq buffer 5 µL, dNTP Mix (2.5 mmol·L-1) 4 µL, 10 µmol引物各1 µL, 终体积为50 µL。反应: 94 ℃预变性5 min; 然后进行35个循环, 94 ℃ 40 s, 59 ℃ 30 s, 72 ℃ 2 min 30 s; 程序循环结束后72 ℃延伸反应10 min, 4 ℃保存。1%的琼脂糖凝胶电泳检测PCR产物, 利用Axygen DNA凝胶回收试剂盒回收PCR产物。将回收后的PCR产物与pMD19-T连接, 转化到DH5α菌株, 在氨苄抗性的平板上进行筛选, 并经过菌落PCR检测后送上海英潍捷基公司测序。
| Table 1 Primers sequence |
白木香AsSAMS1基因的RACE扩增 根据已经获得的核心片段设计2条特异引物, 见表 1, 进行RACE扩增。按照Clontech RACE试剂盒将白木香的总RNA反转录成cDNA, 并按照试剂盒说明书扩增白木香AsSAMS1基因的3'端。将扩增的片段利用Axygen DNA凝胶回收试剂盒回收, 将回收后的PCR产物与pMD19-T连接, 转化到DH5α菌株, 在氨苄抗性的平板上进行筛选, 并经过菌落PCR检测后送上海英潍捷基公司测序。将RACE测序结果与核心序列结果进行拼接, 得到AsSAMS1基因的全长。根据拼接的序列, 设计特异引物, 以反转录cDNA为模板, PCR验证序列的正确性。扩增程序为94 ℃预变性5 min; 然后进行35个循环, 94 ℃ 40 s, 59 ℃ 30 s, 72 ℃ 2 min 30 s; 程序循环结束后72 ℃延伸反应10 min, 4 ℃保存。扩增产物进行电泳检测、切胶回收、克隆和测序验证。
白木香AsSAMS1生物信息学分析 通过在线软件ProtParam预测蛋白结构, 分析目的基因编码蛋白质的氨基酸组成、蛋白质分子质量、理论等电点及稳定性等参数; 通过ExPASY中的SOPMA工具分析蛋白质序列的二级结构; 利用SWISS-MODEL Workspace在线分析软件构建蛋白质三级结构模型; 利用软件TMHMM 2.0进行蛋白质跨膜结构分析; 将所获得的AsSAMS1基因编码的氨基酸序列在GenBank数据库中进行Blast P对比分析, 利用DNAMAN对其他物种的SAMS基因编码的氨基酸序列进行同源性分析; 通过MEGA 6.0软件构建Neighbor-joining系统进化树, 进化距离的计算采用泊松校正法, Bootstrap重复次数为1 000次。
AsSAMS原核表达载体的构建及异源表达1 利用引物SAMS-5E和SAMS-3S (表 1)扩增AsSAMS1基因全长, 用EcoR Ⅰ和Sal Ⅰ双酶切包含有目的基因AsSAMS1的PCR产物以及表达载体pET28a, 酶切产物纯化后, 利用T4 DNA连接酶, 将酶切PCR产物与酶切载体连接, 连接产物转入大肠杆菌DH5α感受态细胞, 挑取经扩增筛选、测序鉴定正确的单克隆; 提取质粒pET28a-AsSAMS1, 将重组质粒转入大肠杆菌BL21 (DE3)感受态细胞。挑取单菌落接种于含有50 μg·mL-1卡那霉素的LB液体培养基中, 37 ℃活化过夜; 活化菌液按1:100比例加入到适量新鲜含有50 μg·mL-1卡那霉素的LB液体培养基中, 37 ℃振荡培养至OD600达0.6左右, 加IPTG至终浓度0.8 mmol·L-1。先180 r·min-1、37 ℃振荡培养至OD600达0.4~0.6, 调节温度至16 ℃振荡培养16 h诱导AsSAMS1过度表达; 4 ℃、12 000 r·min-1离心收集大肠杆菌菌体之后, 悬浮于40 mmol·L-1 KPB缓冲液(pH 7.9, 含有100 mmol·L-1 NaCl, 5 mmol·L-1咪唑)中。将菌体置于冰上, 用超声破碎仪(Colo Parmer)来破碎细胞, 破碎液高速离心30 min以上。取上清液, 利用镍离子亲和色谱柱纯化AsSAMS1蛋白, 先以20 mmol·L-1 KPB缓冲液(pH 7.9, 含有500 mmol·L-1 NaCl和40 mmol·L-1咪唑)洗脱以去除杂蛋白, 再以15 mmol·L-1 KPB缓冲液(pH 7.5, 含10%甘油和500 mmol·L-1咪唑)洗脱目的蛋白, 利用SDS-PAGE检测重组蛋白表达。
白木香AsSAMS1基因在不同组织和不同的胁迫时间的表达分析 利用实时荧光定量PCR (quantitative real-time PCR, qRT-PCR)的方法检测白木香不同组织中AsSAMS1基因表达情况和不同胁迫处理和激素处理下不同时间的表达情况。分析使用SYBR Green Ⅰ荧光染料法, 在qRT-PCR仪上进行。选取白木香GAPDH基因作为目标基因定量表达的内参基因, 引物序列见表 1。每个样品设3个重复, 重复3次。反应体系中含有10 µL STBR Premix Ex Taq酶、上下游引物(10 µmol·L-1)各0.4 µL、模板0.5 µL, 总体系为20 µL。反应程序是: 95 ℃预变性3 min, 95 ℃变性30 s, 60 ℃退火/延伸30 s (每次循环后采集荧光), 40个循环后, 95 ℃变性10 s, 65~95 ℃做熔解曲线分析, 每个温度以每步0.5 ℃上升, 每个温度停留5 s。根据熔解曲线判断RT-PCR产物的特异性, 相对定量分析采用2-ΔΔCt方法进行分析。
愈伤组织中的S-腺苷甲硫氨酸检测 为验证AsSAMS1基因在胁迫和激素处理下的表达变化与产物S-腺苷甲硫氨酸积累之间的关系, 将不同非生物胁迫处理后AsSAMS1基因表达量最高时间点的0.3 g白木香愈伤组织进行研磨, 提取研磨液置于1.5 mL离心管中, 加入400 g·L-1三氯乙酸40 µL, 冰上静置30 min, 以14 000 r·min-1离心20 min, 取上清180 µL, 用0.22 µm针头过滤器过滤, 进样分析。色谱条件:流动相: A乙腈, B 0.15%三氟乙酸, 梯度洗脱程序: 0~10 min, 1% A; 10~15 min, 1%~95% A; 15~20 min, 95% A; 20~27 min, 1% A; 流速为0.9 mL·min-1, 柱温为30 ℃, 进样体积8 μL。标准溶液配制:称取SAM 2.5 mg, 加水溶解, 配成浓度为1.0、0.8、0.5、0.4、0.1 g·L-1的标准溶液。
结果与分析 1 白木香AsSAMS1基因全长cDNA的克隆利用AsSAMS1基因保守序列设计引物, 通过RT-PCR扩增获得白木香AsSAMS1基因的核心片段, 通过BLAST与NCBI中已知的SAMS基因序列进行比对分析, 确定该核心序列为SAMS基因序列, 见图 1A;根据核心序列设计特异引物, 进行3' RACE扩增, 扩增结果见图 1B。3' RACE扩增所得片段测序结果表明扩增序列与核心序列存在重叠片段, 说明此扩增序列为白木香SAMS基因序列, 将3' RACE扩增片段和核心片段序列拼接后得到含有完整ORF框的全长序列, 设计特异引物, 利用白木香RNA反转录产物进行扩增, 扩增结果如图 1C所示, 扩增的序列全长为1 182 bp, 编码393个氨基酸, 测序结果与拼接结果一致, 将该基因命名为AsSAMS1。
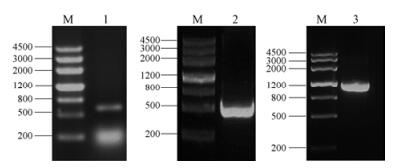
|
M: DNA marker; 1: Amplification of AsSAMS1 core sequence; 2: Amplification of AsSAMS1 3' RACE; 3: PCR product of AsSAMS1 gene Figure 1 Cloning of AsSAMS1 gene from Aquilaria sinensis calli. |
通过Protparam软件预测AsSAMS1基因编码的蛋白的理化性质。推测AsSAMS1编码的蛋白分子式为C1912H3008N528O585S14, 相对分子质量为43 200.94, 理论等电点为5.59, 不稳定系数Ⅱ为22.59, 属于稳定蛋白, 总平均亲水性GRAVY为-0.342, 为亲水性蛋白; 利用TMHMM 2.0预测白木香AsSAMS1的跨膜区域, 预测结果表明AsSAMS1没有跨膜区域。
2.2 AsSAMS1蛋白的二级结构分析及三维结构预测运用ExPASY中的SOPMA工具预测AsSAMS1基因编码蛋白的二级结构, 结果显示AsSAMS1蛋白的二级结构由43.26%的随机卷曲(random coil)、32.32%的α-螺旋(α-helices)、16.54%的延伸链(extended strand)和7.89%的β-折叠(β-turn)组成(图 2), 推测随机卷曲是其最大量的二级结构元件, 而α-螺旋、延伸链和β-折叠散布于整个蛋白中。
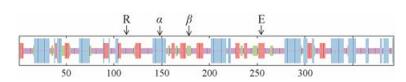
|
α: α-helices; β: β-turn; E: Extended strand; R: Random coil Figure 2 Predicted secondary structure of AsSAMS1 protein with SOPMA. |
将白木香AsSAMS1的氨基酸序列通过SWISS- MODEL Workspace在线分析软件建立了AsSAMS1的三维结构模型, 因为目前的三级结构数据库中没有植物相关的SAMS的结构模型, 因此选择人类SAMS的结构模型为模板, 对白木香AsSAMS1的结构进行预测, 结果表明, 白木香AsSAMS1与人类SAMS一致性为67.28%, 具有参考价值。具体三维结构如图 3所示。
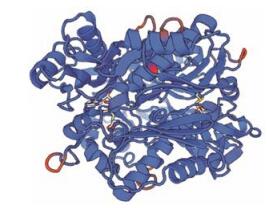
|
Figure 3 The deduced three-dimensional structure of AsSAMS1 protein |
将白木香AsSAMS1氨基酸序列与GenBank中其他植物中的SAMS氨基酸序列进行比对, 通过DNAMAN软件与多种植物进行多序列比对分析(图 4), 发现AsSAMS1包含3个SAMS的特征序列, 分别为GHPDK、GAGDQGHMFGY、GGGAFSGKD (图 4中用红色虚线标出)。多重比对分析发现, 白木香AsSAMS1氨基酸序列与橡胶树(Hevea brasiliensis)、黑丝苔草(Gossypium raimondii)、野生烟草(Nico tiana attenuata)中SAMS氨基酸序列相似性分别为98%、97%、97%。说明白木香AsSAMS1的氨基酸序列与其他植物氨基酸序列之间有较高的同源性, 不同植物SAMS存在高度保守序列, 但也存在明显差异。为了进一步了解白木香AsSAMS1蛋白在植物SAMS家族中的进化位置, 从NCBI blastp的比对结果中选取来源于其他植物的35条SAMS蛋白序列, 利用MEGA6.0构建了系统进化树(图 5)。从图 5可以看出, 白木香AsSAMS1与野大豆(Glycine soja) SAMS蛋白亲缘关系比较接近, 同源性为57%, 可以确定该蛋白为SAMS蛋白, 并且SAMS种间保守性随着种属关系变远略有降低。

|
Black shading indicates amino acid identities, red and blue shading indicates amino acid with different similarity. The conserved sequence of SAMS proteins are shown under the red line. As: Aquilaria sinensis; Na: Nicotiana attenuata; Nn: Nelumbo nucifera; Eg: Eucalyptus grandis; Hb: Hevea brasiliensis; Pe: Populus euphratica; Gr: Gossypium raimondii; Cm: Cucurbita moschata; Gs: Glycine soja; Jc: Jatropha curcas Figure 4 Multiple sequence alignment of AsSAMS1 and SAMS from other plant species. |

|
Figure 5 Phylogenetic analysis of SAMS proteins from plants |
将原核表达载体pET28a-AsSAMS1质粒转化大肠杆菌BL21 (DE3)后, 通过预实验探索及SDS-PAGE电泳检测蛋白是否可溶并确定最佳诱导条件, 使用终浓度为0.8 mmol·L-1的IPTG于16 ℃下诱导16 h达到最佳效果。由于AsSAMS1在其氨基酸序列的N端带有一个6个His (组氨酸)的标签, 用镍离子亲和色谱柱纯化AsSAMS1蛋白, 利用SDS-PAGE检测发现在44 kDa出现一条AsSAMS1蛋白纯化条带(图 6)。
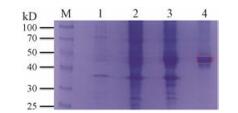
|
M: Marker; 1: Uninduced E.coli containing pET28a-AsSAMS1; 2: Soluble protein from induced E.coli containing pET28a-AsSAMS1; 3: Insoluble fraction from the induced E.coli containing pET28a-AsSAMS1; 4: The purified recombinant AsSAMS1 protein Figure 6 SDS-PAGE analysis of recombinant AsSAMS1 protein. |
利用荧光定量PCR检测AsSAMS1基因的组织特异性表达, 结果显示AsSAMS1基因在白木香所有组织中均有表达, 在茎中表达最高, 叶和茎尖次之, 在根中表达最低, 说明AsSAMS1基因表达具有器官特异性(图 7)。

|
Note: Repeat 3 samples, each for 3 times Figure 7 Relative expression level of AsSAMS1 gene in different tissues. |
SAMS在植物抗逆反应中起着重要作用[23], 研究表明SAMS不仅能够响应低温[24]、干旱胁迫, 还能够参与盐胁迫与氧化胁迫等[25]。为验证白木香AsSAMS1在植物防御反应中的作用, 对白木香的愈伤组织分别进行盐、干旱、低温及重金属处理, 以相同生长情况下未进行任何处理的愈伤组织作对照, 不同时间点取样提取RNA后进行实时荧光定量PCR分析, 检测AsSAMS1的表达水平。实验结果显示盐、干旱、低温和重金属胁迫下都诱导AsSAMS1基因的表达。经NaCl处理后AsSAMS1基因表达出现双峰现象, 在24 h时达到最高, 之后随时间的增加表达量逐渐降低, 48 h表达量再次升高(图 8A)。而甘露醇诱导产生的干旱胁迫条件下, AsSAMS1的表达随时间的增加在36 h表达量最高, 在低温处理后, AsSAMS1的表达也出现双峰现象, 12 h表达量升高, 24 h降低, 之后上升, 48 h达到最高(图 8A)。在重金属胁迫下, AsSAMS1表达量在12 h升高, 之后随时间的增加36 h的表达量达到最高, 出现双峰现象(图 8A)。
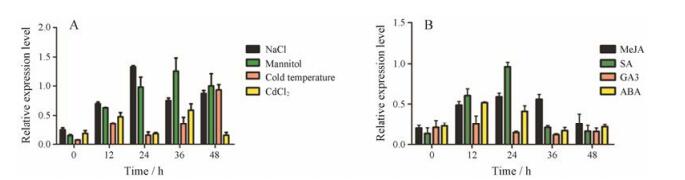
|
A: Relative expression level of AsSAMS1 gene under different abiotic stress; B: Relative expression level of AsSAMS1 gene under different hormone treatments. MeJA: Methyl jasmonate; SA: Salicylic acid; GA3: Gibberellin; ABA: Abscisic acid. Note: Repeat 3 samples, each for 3 times Figure 8 Relative expression level of AsSAMS1 gene under different abiotic stress and different hormone treatments in Aquilaria sinensis calli. |
为研究白木香中扩增得到的AsSAMS1基因是否受到脱落酸(ABA)、赤霉素(GA3)信号通路以及茉莉酸甲酯(MeJA)、水杨酸(SA)等激素的诱导。本研究对白木香愈伤组织进行茉莉酸甲酯、水杨酸、赤霉素、脱落酸处理, 实验结果表明, 在茉莉酸甲酯和水杨酸诱导下, AsSAMS1基因的表达量在24 h达到最高, 之后随时间的增加表达量逐渐降低(图 8B); 而经ABA和GA3诱导后, AsSAMS1的表达量在12 h最高(图 8B)。利用GA3处理愈伤组织后, AsSAMS1的表达量变化微小, 说明GA3对白木香中AsSAMS1基因的表达影响微弱。
6 不同胁迫影响S-腺苷甲硫氨酸的合成上述实验结果表明, 非生物胁迫条件下对白木香中AsSAMS1的表达量影响比较大, AsSAMS1能够合成S-腺苷甲硫氨酸(SAM), 因此非生物胁迫下可能会影响SAM的积累量。为检测不同胁迫处理下AsSAMS1基因表达是否会影响白木香愈伤组织中产物S-腺苷甲硫氨酸的积累, 本研究首先构建SAM的标准曲线。取配置好的标准品溶液, 采用优化的流动相和洗脱程序进行HPLC分析, 重复3次, 以峰面积(y)对SAM浓度(x)绘制标准曲线。如图 9A所示。标准曲线方程为: y = 1 188 926.162 93 x + 10 360.575 56, R2 = 0.999 71。其次, 检测不同胁迫处理下AsSAMS1基因表达量最高时SAM的积累量, 实验结果表明盐胁迫对AsSAMS1基因表达量影响最大, 并在24 h达到最高, SAM积累量在盐胁迫诱导24 h下最高; 重金属CdCl2胁迫下对AsSAMS1基因表达量影响最小, 而SAM的积累量也最少; 甘露醇诱导产生的干旱胁迫和低温胁迫诱导产生的SAM积累量少于NaCl诱导下的积累量, 但高于CdCl2诱导下的积累量, 这些实验结果表明在不同胁迫下AsSAMS1基因表达量上升, SAM的积累量也上升, SAM的积累量变化趋势与AsSAMS1基因表达量变化趋势一致。
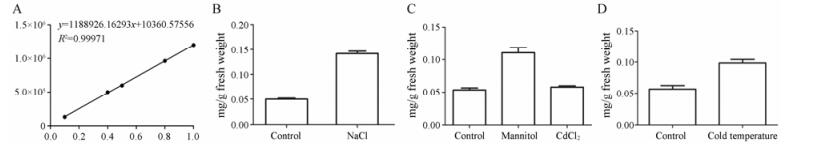
|
A: The standard curve of SAM; B: The content of SAM under NaCl treatment at 24 h; C: The content of SAM under mannitol and CdCl2 treatment at 36 h; D: The content of SAM under cold temperature at 48 h Figure 9 Content of SAM under different abiotic stress in Aquilaria sinensis calli. |
S-腺苷甲硫氨酸合成酶是S-腺苷甲硫氨酸代谢途径的关键酶, 是乙烯、多胺等合成的前体物质[10, 11], 在体内主要起转甲基、转硫和转丙氨基的作用。近年来研究表明SAMS作为S-腺苷甲硫氨酸合成的催化酶, 其能够参与植物的抗逆反应[26, 27]。
SAMS蛋白作为植物代谢过程中的关键酶, 在番茄[21]、拟南芥[22]等植物中已有研究, 同时SAMS也可以参与多种逆境胁迫, 对于植物的生长发育起着重要作用[28, 29]。所以对白木香中AsSAMS进行蛋白原核表达及在不同非生物胁迫和激素处理下的表达分析, 有利于研究AsSAMS基因体外合成功能和在植物防御反应中的作用, 为进一步研究AsSAMS基因在白木香结香过程中的作用奠定基础。目前多种植物中分离得到SAMS基因, 本研究利用RACE、RT-PCR技术首次在白木香愈伤组织中克隆得到1条AsSAMS1基因全长, 并对其进行生物信息学分析, 三维结构预测结果表明白木香中AsSAMS1与人类SAMS的三维结构相似; 多重序列分析, 发现AsSAMS1与其他物种具有较高的同源性, 含有3个SAMS的特征序列, 聚类分析结果表明AsSAMS1与野大豆(Glycine soja) SAMS蛋白的相似性较高。本研究首次在大肠杆菌中表达了白木香的AsSAMS1蛋白, 希望能够在蛋白水平研究白木香中AsSAMS1蛋白的生物学功能和体外研究AsSAMS1蛋白的生物合成功能。本研究通过构建原核表达载体pET28a-AsSAMS1在BL21 (DE3)菌株中诱导表达了白木香AsSAMS1蛋白, 而且重组蛋白AsSAMS1在表达菌中能够以可溶性蛋白存在, 经SDS-PAGE电泳结果显示, 纯化产物浓度较高, 为进一步研究AsSAMS1的功能奠定基础。
不同植物SAMS在不同的组织器官中具有不同的表达模式, Zhu等[30]发现玉米中克隆得到的SAMS1-4具有组织特异性, 在根茎中的表达量明显高于叶中的表达量。拟南芥中2个氨基酸序列相似性较高的SAMS1和SAMS2基因, 在根和茎中的表达量很高[31]。本研究表明, 白木香的AsSAMS1基因具有器官特异性, 在茎中表达量最高, 叶和茎尖次之, 而根中的表达量最少。SAMS作为S-腺苷甲硫氨酸合成的催化酶, 其能够参与植物的抗逆反应。蝴蝶兰在4 ℃低温胁迫下SAMS基因能够在短时间内对低温做出积极调控反应, 提高蝴蝶兰的抗冷能力[24]。苜蓿叶片中的MfSAMS1能够被低温诱导, 转基因烟草发现, 过表达MfSAMS1基因增强转基因植物的抗冷能力[18]。说明SAMS的表达可能在植物防御反应中起着重要作用。在植物生长过程中, 盐、干旱、低温和重金属是最常见的非生物胁迫, 本研究表明, 盐、低温、干旱以及重金属胁迫均能促进白木香AsSAMS1基因的表达及SAM的积累量的增加, 并且NaCl对AsSAMS1的表达量和SAM的积累量影响最大; 文献报道NaCl能够诱导白木香愈伤组织产生大量的2-苯乙基色酮类化合物(沉香的主要特征成分)[6]。实验结果表明AsSAMS1基因参与植物的非生物胁迫防御反应, AsSAMS1基因也可能与盐胁迫诱导的沉香特征性成分2-苯乙基色酮的生物合成相关。
SAMS基因的表达能够受到外源脱落酸、赤霉素等的诱导[23, 32], 番茄中SAMS1和SAMS3能够特异性地受ABA的诱导表达。ABA诱导盐地碱蓬的SAMS2基因, 发现其表达量明显提高。赤霉素能够调节小麦糊粉中S-腺苷甲硫氨酸合成酶的表达[33]。脱落酸、赤霉素、茉莉酸甲酯、水杨酸等激素彼此间能够相互作用, 共同调节植物体内重要的生命活动。因此, 本研究利用外源的茉莉酸、水杨酸、脱落酸和赤霉素处理白木香的愈伤组织, 表明茉莉酸甲酯、水杨酸以及脱落酸均可以诱导白木香中AsSAMS1基因的表达, 但是赤霉素对其表达影响不大。文献报道茉莉酸甲酯和水杨酸均可以诱导沉香产生特征性成分—倍半萜类化合物[34, 35]。本研究结果表明AsSAMS1基因的表达与沉香特征性成分的生物合成可能受多种激素交叉调控。对AsSAMS1基因非生物胁迫和激素处理下的表达分析, 为进一步研究白木香结香的分子调控机制奠定基础, 同时有利于丰富植物的防御反应研究。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典: 一部)[S]. Beijing: China Medical Science Press, 2015. |
| [2] | CITES. Amendments to Appendix Ⅰ and Ⅱ of CITES[C]. In Proceedings of Thirteenth Meeting of the Conference of the Parties, Bangkok, Thailand, 2004: 2-14. |
| [3] | State Environmental Protection Administration of China. Institute of Botany, the Chinese Academy of Sciences. List of Rare and Endangered Plants in China (Vol 1) (中国珍稀濒危保护植物名录:第一册)[M]. Beijing: Science Press, 1987. |
| [4] | Feng YY, Zhang ZX, Shi SP, et al. Expression analysis of allene oxide synthase gene from Aquilaria sinensis[J]. Acta Pharm Sin (药学学报), 2017, 52: 1962–1969. |
| [5] | Zhang Z, Yang Y, Wei JH, et al. Advances in studies on mechanism of agarwood formation in Aquilaria sinensis and its hypothesis of agarwood formation induced by defense response[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 156–159. |
| [6] | Wang XH, Gao BW, Liu X, et al. Salinity stress induces the production of 2-(2-phenylethyl)chromones and regulates novel classes of responsive genes involved in signal transduction in Aquilaria sinensis calli[J]. BMC Plant Biol, 2016, 16: 119. DOI:10.1186/s12870-016-0803-7 |
| [7] | Wang XH, Dong XJ, Feng YY, et al. H2O2 and NADPH oxidases involve in regulation of 2-(2-phenylethyl) chromones accumulation during salt stress in Aquilaria sinensis calli[J]. Plant Sci, 2018, 269: 1–11. |
| [8] | Dong XJ, Wang XH, Gao BW, et al. Cloning and expression analysis of allene oxide cyclase gene from Aquilaria sinensis[J]. Acta Pharm Sin (药学学报), 2018, 53: 468–487. |
| [9] | Wang XH, Shi SP, Tu PF, et al. Identification and functional characterization of three type Ⅲ polyketide synthases from Aquilaria sinensis calli[J]. Biochem Biophy Res Commun, 2017, 486: 1040–1047. DOI:10.1016/j.bbrc.2017.03.159 |
| [10] | Roeder S, Dreschler K, Wirtz M, et al. SAM levels, gene expression of SAM synthetase, methionine synthase and ACC oxidase, and ethylene emission from N. suaveolens flowers[J]. Plant Mol Biol, 2009, 70: 535–546. DOI:10.1007/s11103-009-9490-1 |
| [11] | Merchante C, Alonso JM, Stepanova AN. Ethylene signaling:simple ligand, complex regulation[J]. Curr Opin Plant Biol, 2013, 16: 554–560. DOI:10.1016/j.pbi.2013.08.001 |
| [12] | Sauter M, Moffatt B, Saechao MC, et al. Methionine salvage and S-adenosylmethionine:essential links between sulfur, ethylene and polyamine biosynthesis[J]. Biochem J, 2013, 451: 145–154. DOI:10.1042/BJ20121744 |
| [13] | Grundy FJ, Henkin TM. Regulation of gene expression by effectors that bind to RNA[J]. Curr Opin Microbio, 2004, 7: 126–131. DOI:10.1016/j.mib.2004.02.013 |
| [14] | Kevbrin VV, Zengler K, Lysenko AM, et al. Anoxybacillus kamchatkensis sp. nov., a novel thermophilic facultative aerobic bacterium with a broad pH optimum from the Geyser valley, Kamchatka[J]. Extremophiles, 2005, 9: 391–398. DOI:10.1007/s00792-005-0479-7 |
| [15] | Foyer CH, Bloom AJ, Queval G, et al. Photorespiratory metabolism:genes, mutants, energetics, and redox signaling[J]. Annu Rev Plant Biol, 2009, 60: 455–484. DOI:10.1146/annurev.arplant.043008.091948 |
| [16] | Chen R, Chen L, Hu YG, et al. Expression analysis of wheat S-adenosylmethionine synthetase gene during water stress and re-watering by semi-quantitative RT-PCR[J]. J Trit Crops (麦类作物学报), 2009, 29: 954–958. |
| [17] | Ma X, Wang Z, Qi Y, et al. Isolation of S-adenosylmethionine synthetase gene from Suaeda salsa and its differential expression under NaCl stress[J]. Acta Bot Sin, 2003, 45: 1359–1365. |
| [18] | Guo Z, Tan J, Zhuo C, et al. Abscisic acid, H2O2 and nitric oxide interactions mediated cold-induced S-adenosylmethionine synthetase in Medicago sativa subsp. falcata that confers cold tolerance through up-regulating polyamine oxidation[J]. Plant Biotechnol J, 2014, 12: 601–612. DOI:10.1111/pbi.12166 |
| [19] | Ding C, Chen T, Yang Y, et al. Molecular cloning and characterization of an S-adenosylmethionine synthetase gene from Chorispora bungeana[J]. Gene, 2015, 572: 205–213. |
| [20] | Luo J, Liu M, Zhang C, et al. Transgenic centipedegrass (Eremochloa ophiuroides[Munro] Hack.) overexpressing S-adenosylmethionine decarboxylase (SAMDC) gene for improved cold tolerance through involvement of H2O2 and NO signaling[J]. Front Plant Sci, 2017, 8: 1655. DOI:10.3389/fpls.2017.01655 |
| [21] | Gong B, Wang X, Wei M, et al. Overexpression of S-adenosylmethionine synthetase 1 enhances tomato callus tolerance to alkali stress through polyamine and hydrogen peroxide cross-linked networks[J]. Plant Cell Tiss Organ Cult, 2016, 124: 377–391. DOI:10.1007/s11240-015-0901-5 |
| [22] | Mao D, Yu F, Li J, et al. Feronia receptor kinase interacts with S-adenosylmethionine synthetase and suppresses S-adenosylmethionine production and ethylene biosynthesis in Arabidopsis[J]. Plant Cell Environ, 2015, 38: 2566–2574. DOI:10.1111/pce.12570 |
| [23] | Pulla RK, Kim YJ, Parvin S, et al. Isolation of S-adenosyl-L-methionine synthetase gene from Panax ginseng C.A. meyer and analysis of its response to abiotic stresses[J]. Physiol Mol Biol Plants, 2009, 15: 267. DOI:10.1007/s12298-009-0030-x |
| [24] | Yuan XY, Lei ZH, Cui B, et al. Cloning of a S-adenosylmethionine synthetase gene from Phalaenopsis amabilis and its expression under low temperature[J]. Plant Physiol J (植物生理学报), 2015, 51: 754–762. |
| [25] | Song XP, Yang LT, Li YR, et al. Cloning and expression of sugarcane S-adenosylmethionine synthetase gene ScSAM[J]. Acta Agron Sin (作物学报), 2014, 40: 1002–1010. |
| [26] | Shen W, Nada K, Tachibana S. Involvement of polyamines in the chilling tolerance of cucumber cultivars[J]. Plant Physiol, 2000, 124: 431–440. DOI:10.1104/pp.124.1.431 |
| [27] | Hatmi S, Gruau C, Trotel-Aziz P, et al. Drought stress tolerance in grapevine involves activation of polyamine oxidation contributing to improved immune response and low susceptibility to Botrytis cinerea[J]. J Exp Bot, 2014, 66: 775–787. |
| [28] | Kasukabe Y, He L, Nada K, et al. Overexpression of spermidine synthase enhances tolerance to multiple environmental stresses and up-regulates the expression of various stress-regulated genes in transgenic Arabidopsis thaliana[J]. Plant Cell Physiol, 2004, 45: 712–722. DOI:10.1093/pcp/pch083 |
| [29] | Fan R, Wang H, Wang YL, et al. Proteomic analysis of soybean defense response induced by cotton worm (Prodenia litura, fabricius) feeding[J]. Proteome Sci, 2012, 10: 16. DOI:10.1186/1477-5956-10-16 |
| [30] | Zhu JY, Wang HY, Yu AiL, et al. Differential expression of maize S-adenosylmethionin synthetase gene family members during salt stress[J]. J Nucl Agric Sci (核农学报), 2011, 3: 427–431, 493. |
| [31] | Peleman J, Boerjan W, Engler G, et al. Strong cellular preference in the expression of a housekeeping gene of Arabidopsis thaliana encoding S-adenosylmethionine synthetase[J]. Plant Cell, 1989, 1: 81–93. DOI:10.1105/tpc.1.1.81 |
| [32] | Alcázar R, Altabella T, Marco F, et al. Polyamines:molecules with regulatory functions in plant abiotic stress tolerance[J]. Planta, 2010, 231: 1237–1249. DOI:10.1007/s00425-010-1130-0 |
| [33] | Mathur M, Satpathy M, Sachar RC. Phytohormonal regulation of S-adenosylmethionine synthetase by gibberellic acid in wheat aleurones[J]. BBA-Mol Cell Res, 1992, 1137: 338–348. |
| [34] | Okudera Y, Ito M. Production of agarwood fragrant constituents in Aquilaria calli and cell suspension cultures[J]. Plant Biotechnol, 2009, 26: 307–315. DOI:10.5511/plantbiotechnology.26.307 |
| [35] | Xu YH, Liao YC, Zhang Z, et al. Jasmonic acid is a crucial signal transducer in heat shock induced sesquiterpene formation in Aquilaria sinensis[J]. Sci Rep, 2016, 6: 21843. DOI:10.1038/srep21843 |
 2018, Vol. 53
2018, Vol. 53


