肾小管间质纤维化以细胞外基质沉积、瘢痕硬化为特点, 是慢性肾脏疾病(CKD)进行性发展的主要病理过程, 并最终导致终末期肾病。肾间质纤维化的生理病理学特点可分为4个阶段: ①细胞的活化、启动和损伤; ②纤维化信号的转导和激活; ③细胞外基质沉积和纤维化; ④肾脏结构和功能的破坏[1]。无论原发疾病的病因如何, 肾间质纤维化是各种CKD发展进程中的共同病理特征[2]。肾小管间质病变直接导致肾功能下降, 肾小管间质纤维化被广泛认为是慢性肾脏疾病发展至终末期肾病的共通途径[3]。目前临床上没有用于治疗肾纤维化的特效药物, 许多药物由于缺乏体内分布的特异性, 常引起各种全身毒副作用, 且疗效不佳而难以进入临床[4]。因此, 开发肾靶向递药策略或针对关键靶分子构建靶向治疗药物是当前慢性肾病药物研究的热点。
肾脏纤维化微环境中的成纤维细胞来源于不同类型的细胞, 主要是骨髓来源的成纤维细胞, 部分来源于通过内皮-间充质转化的内皮细胞和通过上皮-间充质转化的肾小管上皮细胞[5]。肾小管上皮细胞构成肾脏大部分的肾实质, 在CKD的病程进展中起关键作用[6]。研究表明, 这些细胞参与了间质性疾病的进程, 并且参与分泌多种炎性细胞因子和促纤维化生长因子[7]。CKD晚期、功能性肾小管上皮细胞通过上皮-间充质转化或细胞死亡逐渐丧失其应有的形态和功能, 并最终导致肾小管萎缩变形[8]。
葡萄糖转运蛋白(glucose transporters, GLUTs)是广泛存在于人体各组织器官的转运蛋白, 一方面由于其对体内糖转运起重要作用, 关系到各脏器的结构功能; 另一方面由于其体内分布具有组织特异性, 有作为分子靶点的潜力, 而被广泛研究。GLUT1广泛分布于血脑屏障, 故以葡萄糖为配体/载体的前药和靶向递药载体被研究用于脑靶向递药[9, 10]。肠道上皮中分布的GLUT负责从肠道内的饮食中吸收葡萄糖, 而肾近端小管上皮细胞上的GLUT则负责葡萄糖的重吸收[8]。跨上皮葡萄糖转运涉及两类葡萄糖转运蛋白:顶端的钠-葡萄糖转运蛋白(sodium- dependent glucose transporters, SGLTs)和基底侧的GLUT。SGLT在肾脏的表达已经被广泛研究, 但对于GLUT的研究则较少。肾脏重吸收主要发生在近端小管的S1节段, 通过位于顶端和基底膜的SGLT2和GLUT2协同作用完成[11]。少量残留的葡萄糖在S3段中被重新吸收, 通过存在于管腔膜中SGLT1, 与基底膜的GLUT1共同作用[12]。以葡萄糖为配体的前药已被证实有一定的肾靶向作用[13]。GLUT5的主要功能之一是介导膳食果糖在小肠顶膜上的摄取, 在肾脏中, GLUT5在S3近端小管细胞的顶端质膜中表达[14, 15]。由于GLUT5对果糖具有很高的特异性, 其具有作为分子靶点的应用潜力。
在组织纤维化过程中由于细胞外基质的分泌和沉积可导致组织硬度显著增加。研究表明, 在组织纤维化期间, 肺和肝脏的硬度从体内稳态的约0.5~1 kPa增加到25~100 kPa[16, 17]。传统上基质硬化被视为器官纤维化的终点或后果, 但研究发现基质硬化在组织损伤后纤维化发展之前, 提示基质硬化在肌纤维母细胞早期活化中发挥着关键作用[17]。在生理条件下, 不同阶段的肾脏组织可能表现出不同的硬度, 这一特点可能影响其细胞生长行为。目前, 体外细胞培养技术常用的培养皿或培养板多以聚苯乙烯(TCPS)为主要材质, 其硬度接近于1 GPa[18]。一方面, TCPS培养板的硬度与生理环境下的组织硬度相差很大, 难以模拟细胞在体内生长的实际情况; 另一方面, TCPS培养板的硬度恒定, 无法提供研究基质硬度的变化对细胞生物学行为影响的平台。聚丙烯酰胺凝胶(photopolymerized polyacrylamide gels, PAA gel)由于具有可控的硬度, 生物相容性良好等特点被广泛运用于细胞机械信号转导的研究, 以探索力学因素对细胞形态和行为的影响[19-22]。
为了探索基质硬度和肾小管上皮细胞生长行为和功能之间的联系, 本研究通过构建硬度可控的Ⅰ型胶原(collagenⅠ)修饰的PAA gel作为体外细胞培养基质, 模拟肾纤维化进程中组织硬度变化, 考察了基质硬度对肾小管上皮细胞细胞形态和几个代表性葡萄糖转运蛋白表达的影响, 从而揭示肾纤维化过程中力学因素变化对肾小管上皮细胞生长行为的影响。
材料与方法试剂与药品 丙烯酰胺(acrylamide)、N, N-亚甲基双丙烯酰胺(N, N-methylene bis-acroylamide)、irgacure 2959 (I-2959)、3-氨丙基三甲氧硅烷(3- ammonia propyl trimethoxy silane, APS)、罗丹明标记的鬼笔环肽(TRITC-phalloidin) (美国Sigma-Aldrich公司); Sulfo-SANPAH、MEM培养基(美国Thermo Fisher Scientific公司); 磷酸盐缓冲液(PBS)、HEPES缓冲液(美国Hyclone公司); Ⅰ型鼠尾胶原(美国Advanced Biomatrix公司); 胰蛋白酶溶液(trypsin)和青链霉素混合液(penicillin/streptomycin) (北京索莱宝生物科技有限公司); 胎牛血清(fetal bovine serum, FBS, 上海复蒙生物制品有限责任公司); GLUT1抗体、GLUT2抗体、GLUT5抗体(美国Santa Cruz Bio technology公司); 4', 6-diamidino-2-pheylindole (DAPI)、Alexa Fluor 488标记山羊抗小鼠IgG (Alexa Fluor 488- labeled Goat Anti-Mouse IgG) (江苏碧云天生物有限公司); 实验用水为灭菌超纯水; 其余试剂均为分析纯。
仪器 LED式紫外光固化仪(Uvata, 上海和沁光电有限公司); 动态热机械分析仪(Q800, 美国TA Instrument公司); Varioskan Flash全波长多功能酶标仪(美国Thermo Fisher Scientific公司); LSM510型激光共聚焦显微镜(德国Carl Zeiss公司)。
细胞培养 HK-2细胞(武汉普诺赛生命科技有限公司)在含有10% FBS和青霉素/链霉素的MEM培养基中培养, 并置于含5% CO2、饱和湿度、37 ℃的孵箱中连续培养。
活化盖玻片 按照文献[22]所述方法活化盖玻片, 具体操作如下:将盖玻片浸于稀酸中过夜, 自来水冲洗后浸于95%乙醇超声, 随后用超纯水冲洗并置于40 ℃烘箱中干燥。将干燥后的盖玻片在2%氨丙基三甲氧硅烷试剂(用异丙醇现用现配)搅拌浸泡约10 min。用超纯水浸泡清洗盖玻片4次, 每次10 min。将清洗后的盖玻片于37 ℃烘干并冷却至室温。将盖玻片在1%戊二醛水溶液中搅拌浸泡约30 min, 再用超纯水清洗3次, 每次10 min, 最后盖上锡箔纸, 室温晾干。
模拟肾纤维化组织硬度基质的制备 按表 1所示, 分别取处方量的50%丙烯酰胺I-2959水溶液、2%双丙烯酰胺I-2959水溶液、0.5% I-2959水溶液加入EP管中配成预聚物溶液, 涡旋混匀。取80 µL预聚物溶液滴于盖有封口胶的载玻片(13 mm)上并盖上活化后的盖玻片, 采用功率80 W, 波长365 nm的紫外灯照射6 min使材料聚合。将聚合后的胶用超纯水中浸泡后移至细胞房超净台, 75%乙醇清洗2 min后用无菌1.2% HEPES溶液洗2遍。在胶上滴加0.5 mg·mL-1 Sulfo-SANPAH溶液(50 mg + DMSO储备液2 mL, 放置于-80 ℃, 临用前用1.2% HEPES溶液稀释使用) 100 µL, 紫外照射5 min, 然后用HEPES洗去残液, 重复上述操作1次。
| Table 1 Formulation of photopolymerized polyacrylamide gels (PAA gel) |
将载有PAA gel的盖玻片转移至24孔板中, 加0.1 mg·mL-1 Ⅰ型鼠尾胶原(0.2%醋酸溶液配制) 300 µL, 4 ℃避光放置, 反应过夜。次日, 用PBS溶液清洗3次, 洗净胶原残液, 加入适量双抗溶液, 紫外照射灭菌(每次照射3 h, 照射2次)。接种细胞前再次紫外照射灭菌30 min, PBS洗去双抗残液, 加培养基孵育30 min, 即可接种细胞。在细胞接种到PAA gel基底之前, HK-2细胞经无血清培养基孵育过夜。取对数生长期的HK-2细胞, 消化, 制成单细胞悬液, 按照预实验筛选的接种细胞数, 处方1、2和3分别按照细胞数1.5×105、1.25×105和4×104/cm2接种于不同的PAA gel上, 待细胞贴壁生长后即可进行后续实验操作。
PAA基质的硬度表征 为了研究基底硬度对细胞形态和功能的影响, 通过改变丙烯酰胺和双丙烯酰胺的浓度, 制备了具有恒定化学成分但硬度不同的3个底物。将制备好的PAA gel, 浸泡于超纯水中3天使其充分溶胀饱和, 使用动态热机械分析仪测量其杨氏模量。测试条件:扫描模式为应变扫描模式; 频率为1 Hz。试样尺寸:直径8 mm (夹持系统:平行板); 应变范围: 0.01%~20% (初始应变扫描); 测量杨氏模量应力-应变曲线应力范围: 0.01%~10%;温度:室温。通过应力-应变曲线计算各处方PAA gel的杨氏模量(E ')。
PAA基质表面蛋白含量的测定 为了避免凝胶表面偶联的胶原蛋白含量对细胞的生物学行为产生影响, 采用BCA法对其进行定量测定, 具体操作如下:在装有PAA gel的24孔板中每孔加入PBS 80 μL和工作液640 μL, 37 ℃孵育2 h。用酶标仪测定在562 nm的吸光值(A), 根据制备的标准曲线计算蛋白含量。
细胞纤维状肌动蛋白(F-actin)染色 待细胞生长完全贴附后, 吸走培养基, 用PBS洗涤细胞3次, 加入4%多聚甲醛固定30 min, 再用PBS洗涤3次, 接着用0.5% Triton X-100处理10 min, 用PBS洗涤3次, 1% BSA封闭处理30 min, 弃去封闭液, PBS洗涤3次。加入5 μg·mL-1 TRITC-phalloidin室温染色30 min后, 用PBS溶液清洗3次。加入20 μg·mL-1 DAPI染色5 min, PBS溶液清洗3次, 在激光共聚焦显微镜下观察细胞形态, 并在图像采集中保持以下参数相同:曝光时间、HV、增益和偏移等。
葡萄糖转运蛋白(GLUT1、GLUT2、GLUT5)免疫荧光染色 为了检测基质硬度对HK-2细胞葡萄糖转运蛋白的影响, 采用免疫荧光染色法标记GLUT1、GLUT2和GLUT5。以2×104/cm2接种HK-2细胞, 培养24 h; 待细胞完全贴附于PAA gel后吸走培养基, 用PBS洗涤细胞3次, 加入4%多聚甲醛固定30 min, 再用PBS洗涤3次, 用0.5% Triton X-100处理10 min, 用PBS洗涤3次, 1% BSA封闭处理30 min, 弃去封闭液, PBS洗涤3次, 然后用一抗稀释液孵育细胞。在湿盒中4 ℃过夜。随后, 用PBS洗涤细胞3次, 并在室温下与稀释后的二抗(Alexa Fluor 488标记山羊抗小鼠IgG)孵育60 min。最后用20 μg·mL-1 DAPI染色5 min, PBS洗涤细胞3次。在激光共聚焦显微镜下观察细胞, 方法同上。
数据分析 采用GraphPad Prism 7.0软件进行统计学分析。计量数据用x±s表示。采用ANOVA进行统计学分析, P < 0.05被认为有显著性差异。
结果与讨论 1 PAA基底的硬度表征正常肾脏各部位弹性系数不同, 有文献通过剪切波弹性成像技术对健康志愿者进行测量, 得到正常肾皮质的杨氏模量值为(5.0 ± 2.9) kPa, 髓质杨氏模量值为(23.6 ± 5.4) kPa[23]。慢性肾病的发生会导致肾脏出现不可逆的纤维化, 有文献[24]表明, 随着肾内疾病的发展, 肾脏的硬度值会增加。在肾移植的患者中, 其肾脏硬度可达30 kPa甚至更高[25]。通过调节丙烯酰胺与双丙烯酰胺比例的变化, 采用光催化聚合方法制备了不同硬度的PAA gel。通过动态热分析法对各处方PAA gel进行表征, 选择3个不同E ' (图 1)的PAA gel制剂进行后续研究:硬度(4.5 ± 0.7) kPa基质作为正常组织硬度的模型, 而硬度为(10.8 ± 1.3) kPa和(35.3 ± 5.2) kPa的基质作为随着肾纤维化程度不同而具有不同硬度的两种组织模型。
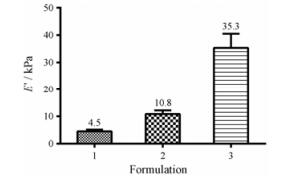
|
n = 3, x±s Figure 1 The Young's moduli (E ') of different PAA gel formu lations as determined by dynamic mechanical analysis. |
细胞外基质的物理特性被证明是调节各种细胞行为的关键并对细胞的生物学功能产生影响[26]。因此, 本研究考察了基质硬度对HK-2细胞生长黏附的影响。经BCA法测试, 3种PAA gel表面共价连接的胶原蛋白量并无显著性的差异, 可以避免由于表面蛋白含量差异对后续实验结果产生影响。由于黏附细胞密度可能影响细胞增殖和凋亡[27], 为了避免贴壁细胞密度对细胞生长的影响, 通过预实验调整了细胞在不同硬度基质上的接种密度, 在3个PAA gel基底上获得相似的贴壁细胞密度。如图 2a所示, 在接种后24 h, 每个基底上的贴壁细胞密度几乎相等, 并且细胞计数表明在不同基底硬度上的贴壁细胞数未见显著差异(图 2b)。在此培养条件下, 3个不同硬度PAA gel上黏附的HK-2细胞形态呈现较明显的差异。在软基质(4.5 kPa)上, 细胞成簇状生长, 细胞面积较小; 随着基质硬度增加(10.3和35.5 kPa), 细胞转为不规则形态, 肌动蛋白纤维束形成增加, 细胞能够更好铺展, 细胞铺展面积更大。使用Image J对黏附在3种PAA基底上的HK-2细胞的细胞铺展面积进行量化。如图 2c所示, 细胞铺展面积表现出硬度依赖性变化, 随着硬度的增加而显著增加(P < 0.05)。结果表明, 在该实验培养条件下HK-2细胞更倾向于在较硬基质上生长和铺展。细胞在软硬基质之间的差异可能是由于在E '不同的基质上贴壁生长的细胞F-肌动蛋白束重塑引起的。

|
Cell cytoskeleton: F-actin (red); Nuclei: DAPI (blue). Scale bar = 20 μm; b: Cell adhesion density on PAA gel substrates of varying stiffness (n = 9); c: Spreading area of cells in PAA gel substrates of varying stiffness (n = 60). x±s. *P < 0.05 Figure 2 Morphological characterizations of HK-2 on PAA gel substrates of varying stiffness at 20× and 60×, respectively (a). |
为了考察基质硬度对HK-2上葡萄糖转运体的影响, 选取了在各个组织都广泛表达的GLUT1, 对葡萄糖低亲和力GLUT2及对果糖具有高度特异性亲和力的GLUT5, 考察了它们在不同基质硬度上的表达, 为肾纤维化靶向治疗筛选分子靶点。这3种葡萄糖转运蛋白在HK-2的细胞核和细胞膜上均有分布, 但生长在硬度不同基质上的HK-2细胞葡萄糖转运蛋白的表达有较大差异。GLUT1的表达与分布呈现出硬度依赖性(图 3a), 而GLUT2的表达与分布则表现出对基底硬度的非依赖性(图 3b), GLUT5的表达与分布也呈现出硬度依赖性(图 3c)。GLUT1在软基质(4.5 kPa)上的表达量最高, 在硬基质(10.3和35.5 kPa)上表达量显著下降(图 3d)。同时, 随着基质硬度增加, HK-2细胞膜和细胞质上GLUT1的表达明显降低; 而在细胞核上, GLUT1的表达量没有明显的改变。不同基质硬度上GLUT2表达与分布没有显著差距(图 3e)。与GLUT1类似, GLUT5在软基质(4.5 kPa)上的表达量最高, 在硬基质(10.3和35.5 kPa)上表达量显著下降(图 3f), 与GLUT1不同的是, GLUT5在HK-2细胞上的表达随着基质硬度的增加而整体降低。研究表明, 随着基质硬度增加而表达降低的GLUT1与GLUT5可能并不适宜作为肾脏的分子靶点, 而表达不受基质硬度影响的GLUT2则有作为间质纤维化相关肾脏疾病靶标的潜力。有研究表明细胞外基质硬度的增加会促进上皮-间充质转化[28, 29], GLUT出现变化可能是由于基质硬度增加促使肾小管上皮细胞通过上皮-间充质转化而逐步丧失其功能, 但具体机制还需要进一步研究与探讨。

|
Nuclei: DAPI (blue); GLUT: Alexa Fluor 488-labeled goat anti-mouse IgG (green). Scale bar = 20 μm. Normalized fluorescence intensity to cell number (d, e, f). n = 5, x±s. *P < 0.05, **P < 0.01 Figure 3 The expression pattern of glucose transporter 1 (GLUT1, a), GLUT2 (b), GLUT5 (c) in HK-2 cells adhered on PAA gels of varying stiffness via fluorescence immunostaining. |
本研究通过调整PAA凝胶处方获得模拟肾间质生理和病理条件下基质硬度的PAA gel, 并成功构建了以光催化聚合PAA gel为基底的二维细胞培养模型。本研究以人肾小管上皮细胞HK-2为研究对象, 研究表明, HK-2细胞更倾向于在较硬的基质上黏附生长, 细胞铺展面积随基质硬度增加而增加。然而, 基质硬度的增加会导致GLUT1和GLUT5表达量的降低, 提示间质纤维化可能影响肾小管上皮细胞GLUT的表达量及糖转运功能。综上, 本文为研究物理力学因素如何调节细胞表面葡萄糖转运蛋白提供了重要参考依据, 同时也为肾纤维化靶向治疗的分子靶点提供了新的研究思路和研究方法。关于不同肾纤维化细胞培养模型中基质硬度对细胞生长和葡萄糖转运蛋白的调控机制还有待于进一步深入研究。
| [1] | Genovese F, Manresa AA, Leeming DJ, et al. The extracellular matrix in the kidney:a source of novel non-invasive biomarkers of kidney fibrosis?[J]. Fibrog Tissue Repair, 2014, 7: 4. DOI:10.1186/1755-1536-7-4 |
| [2] | Ma LJ, Jha S, Ling H, et al. Divergent effects of low versus high dose anti-TGF-beta antibody in puromycin aminonucleoside nephropathy in rats[J]. Kidney Int, 2004, 65: 106–115. |
| [3] | Tampe D, Zeisberg M. Potential approaches to reverse or repair renal fibrosis[J]. Nat Rev Nephrol, 2014, 10: 226–237. DOI:10.1038/nrneph.2014.14 |
| [4] | Zhong Y, Deng Y, Chen Y, et al. Therapeutic use of traditional Chinese herbal medications for chronic kidney diseases[J]. Kidney Int, 2013, 84: 1108–1118. DOI:10.1038/ki.2013.276 |
| [5] | LeBleu VS, Taduri G, O'Connell J, et al. Origin and function of myofibroblasts in kidney fibrosis[J]. Nat Med, 2013, 19: 1047–1053. DOI:10.1038/nm.3218 |
| [6] | Hodgkins KS, Schnaper HW. Tubulointerstitial injury and the progression of chronic kidney disease[J]. Pediatr Nephrol, 2012, 27: 901–909. DOI:10.1007/s00467-011-1992-9 |
| [7] | Nangaku M. Mechanisms of tubulointerstitial injury in the kidney:final common pathways to end-stage renal failure[J]. Intern Med, 2004, 43: 9–17. |
| [8] | Zeisberg M, Neilson EG. Biomarkers for epithelial-mesenchymal transitions[J]. J Clin Invest, 2009, 119: 1429–1437. DOI:10.1172/JCI36183 |
| [9] | Shao K, Ding N, Huang S, et al. Smart nanodevice combined tumor-specific vector with cellular microenvironment-triggered property for highly effective antiglioma therapy[J]. ACS Nano, 2014, 8: 1191–1203. DOI:10.1021/nn406285x |
| [10] | Li X, Qu B, Jin X, et al. Design, synthesis and biological evaluation for docetaxel-loaded brain targeting liposome with "lock-in" function[J]. J Drug Target, 2014, 22: 251–261. DOI:10.3109/1061186X.2013.865032 |
| [11] | Sabino-Silva R, Mori RC, David-Silva A, et al. The Na+/glucose cotransporters:from genes to therapy[J]. Braz J Med Biol Res, 2010, 43: 1019–1026. DOI:10.1590/S0100-879X2010007500115 |
| [12] | Wright EM, Loo DDF, Hirayama BA, et al. Surprising versatility of Na+-glucose cotransporters:SLC5[J]. Physiology, 2004, 19: 370–376. DOI:10.1152/physiol.00026.2004 |
| [13] | Liu X, Li W, Liang Z, et al. Prednisolone-glucose derivative conjugate:synthesis, biodistribution and pharmacodynamics evaluation[J]. Arch Pharm, 2012, 345: 925–933. |
| [14] | Mueckler M, Thorens B. The SLC2(GLUT) family of membrane transporters[J]. Mol Aspects Med, 2013, 34: 121–138. DOI:10.1016/j.mam.2012.07.001 |
| [15] | Sugawara-Yokoo M, Suzuki T, Matsuzaki T, et al. Presence of fructose transporter GLUT5 in the S3 proximal tubules in the rat kidney[J]. Kidney Int, 1999, 56: 1022–1028. DOI:10.1046/j.1523-1755.1999.00635.x |
| [16] | Liu F, Mih JD, Shea BS, et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression[J]. J Cell Biol, 2010, 190: 693–706. DOI:10.1083/jcb.201004082 |
| [17] | Georges PC, Hui JJ, Gombos Z, et al. Increased stiffness of the rat liver precedes matrix deposition:implications for fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 293. |
| [18] | Pebworth MP, Cismas SA, Asuri P. A novel 2.5D culture platform to investigate the role of stiffness gradients on adhesion-independent cell migration[J]. PLoS One, 2014, 9: e110453. DOI:10.1371/journal.pone.0110453 |
| [19] | Wang Y, Gong T, Zhang ZR, et al. Matrix stiffness differentially regulates cellular uptake behavior of nanoparticles in two breast cancer cell lines[J]. ACS Appl Mater Interfaces, 2017, 9: 25915–25928. DOI:10.1021/acsami.7b08751 |
| [20] | Leight JL, Wozniak MA, Chen S, et al. Matrix rigidity regulates a switch between TGF-beta 1-induced apoptosis and epithelial-mesenchymal transition[J]. Mol Biol Cell, 2012, 23: 781–791. DOI:10.1091/mbc.e11-06-0537 |
| [21] | Stroka KM, Aranda-Espinoza H. Effects of morphology vs cell-cell interactions on endothelial cell stiffness[J]. Cell Mol Bioeng, 2011, 4: 9–27. DOI:10.1007/s12195-010-0142-y |
| [22] | Wang Y, Qin S, Gong T, et al. Matrix stiffness regulates cell uptake of nanoparticles in 2D and 3D cultures of breast cancer cells[J]. Acta Pharm Sin (药学学报), 2017, 52: 1324–1330. |
| [23] | Arda K, Ciledag N, Aktas E, et al. Quantitative assessment of normal soft-tissue elasticity using shear-wave ultrasound elastography[J]. Am J Roentgenol, 2011, 197: 532–536. DOI:10.2214/AJR.10.5449 |
| [24] | Derieppe M, Delmas Y, Gennisson JL, et al. Detection of intrarenal microstructural changes with supersonic shear wave elastography in rats[J]. Eur Radiol, 2012, 22: 243–250. DOI:10.1007/s00330-011-2229-9 |
| [25] | Sommerer C, Scharf M, Seitz C, et al. Assessment of renal allograft fibrosis by transient elastography[J]. Transpl Int, 2013, 26: 545–551. |
| [26] | Mitra SK, Hanson DA, Schlaepfer DD. Focal adhesion kinase:in command and control of cell motility[J]. Nat Rev Mol Cell Biol, 2005, 6: 56–68. DOI:10.1038/nrm1549 |
| [27] | Wang N, Butler JP, Ingber DE. Mechanotransduction across the cell-surface and through the cytoskeleton[J]. Science, 1993, 260: 1124–1127. DOI:10.1126/science.7684161 |
| [28] | Wei SC, Fattet L, Tsai JH, et al. Matrix stiffness drives epithelial mesenchymal transition and tumour metastasis through a TWIST1-G3BP2 mechanotransduction pathway[J]. Nat Cell Biol, 2015, 17: 678–688. DOI:10.1038/ncb3157 |
| [29] | Mihalko EP, Brown AC. Material strategies for modulating epithelial to mesenchymal transitions[J]. ACS Biomater Sci Eng, 2018, 4: 1149–1161. DOI:10.1021/acsbiomaterials.6b00751 |
 2018, Vol. 53
2018, Vol. 53


