2. 兰州大学药学院, 甘肃 兰州 730000
2. School of Pharmacy, Lanzhou University, Lanzhou 730000, China
人体肠道微生物是一个数量庞大、种类繁多的微生态系统, 正常状态下, 机体与肠道微生物保持动态平衡, 共同维持人体健康[1]。然而, 外界环境、机体病理状态、异生物、抗生素等会引起菌群失调, 触发各种疾病, 甚至会对药物的代谢及吸收产生影响, 进而影响临床治疗效果[2]。已有多种药物被鉴定为肠道菌群的底物[3], 抗生素对肠道菌群的影响极有可能产生潜在的药物-药物相互作用(DDI)。
硝苯地平作为二氢吡啶钙通道阻滞剂, 临床主要用于心绞痛、高血压等心血管疾病的治疗[4]。经胃肠道吸收[5], 吸收前可能受胃肠道微生物群的影响。假设肠道微生物参与硝苯地平的代谢, 那么抗生素极有可能通过改变肠道微生物群来改变硝苯地平的生物利用度及治疗效果。阿莫西林是使用比较广泛的口服抗生素, 大大增加了与其他药物联合使用的几率。高血压患者使用硝苯地平的过程中若发生感染, 极有可能使用阿莫西林, 而关于二者的DDI未见文献报道, 因此本实验对阿莫西林和硝苯地平DDI进行研究。
材料与方法仪器与试药 UFLC-20A高效液相色谱仪(日本岛津公司); API3200三重四极杆串联质谱仪(美国应用生物系统公司)。硝苯地平片(批号F160504)、硝苯地平对照品(批号100338-201103)、尼莫地平对照品(批号Y17A6C246g)分别购自山西汾河制药有限公司、中国食品药品检定研究院、上海源叶生物技术有限公司。色谱纯乙腈购自德国Merck公司。磷酸盐缓冲液(pH 7.2~7.4)购自北京索莱宝生物科技有限公司。
动物实验 健康雄性Wistar大鼠12只, 体重200 g左右, 由中国农业科学院兰州兽医研究所提供(许可证号: SCXK (甘) 2015-0001)。在20~25 ℃、(50 ± 10) %相对湿度下标准饲养, 经兰州总医院伦理委员会批准且实验均按照相关指导原则和规定进行。将大鼠随机分为硝苯地平组(N1)和阿莫西林+硝苯地平组(N2), N1组收集空白粪便, 迅速置于液氮罐保存。禁食12 h后分别灌胃给予硝苯地平(1.05 mg·kg-1), 于给药前(0 h)及给药后0.167、0.33、0.5、0.75、1、1.5、2、4、6、8、12和24 h由眼眶后静脉丛取血0.3 mL, 4 000 r·min-1离心5 min, 取血浆于-20 ℃保存。N2组在进行药代动力学实验前, 灌胃给予阿莫西林(157.5 mg·kg-1)每天一次, 持续3天。阿莫西林给药结束后第二天晚上禁食, 于第3天早上先收集空白粪便, 迅速置于液氮罐保存。然后灌胃给予硝苯地平(1.05 mg·kg-1), 采血时间点同N1组。空白粪便用于菌群观察及体外孵育实验, 血样用于药代动力学实验。
排泄物菌群观察 为了观察阿莫西林对肠道微生物群的影响, 分别取N1和N2组大鼠空白粪便样品0.1 g, 10倍体积稀释后, 将稀释液均匀涂抹于载玻片, 革兰染色后镜检, 观察菌群数量和种类的变化[6]。
粪便孵育液的制备 分别称取空白大鼠粪便标本约0.5 g, 然后悬浮在4.5 mL冷盐水中。将粪便悬浮液以5 000 r·min-1离心5 min。将所得上清液超声处理10 min, 然后以100 000 r·min-1离心20 min, 取上层提取液为粪便孵育液[7]。
体外孵育实验 为了确定硝苯地平是否经肠道菌群代谢, 本实验进行了体外孵育实验。孵育体系:粪便液0.1 mL, 硝苯地平对照溶液(0.72 mmol·L-1) 0.1 mL和磷酸缓冲液(0.1 mol·L-1, pH 7.0) 0.3 mL, 在37 ℃分别孵育12和24 h[8]。孵育结束后, 加入冰冷乙腈9.5 mL以终止反应。
质谱色谱条件 使用Shim-pack XR-ODS柱, 以乙腈-水(90:10)为流动相, 流速为0.4 mL·min-1, 分析单个样品用时3.0 min。质谱喷雾电压为-4 500 V, 雾化温度为300 ℃, 硝苯地平及内标尼莫地平检测离子对分别为m/z 345.0→122.0, m/z 417.0→122.0, 碰撞诱导解离电压分别为-21 psi (1 psi ≈ 6.9 kPa)和-57 psi, 碰撞能量分别为-19 eV和-30 eV。
血浆及粪便样品处理 准确吸取血浆30 μL或孵育终止后溶液于0.5 mL离心管, 加入乙腈(含内标尼莫地平25 ng·mL-1) 75 μL, 涡旋振荡1 min, 13 000 r·min-1高速离心5 min后取上清于进样瓶, LC- MS/MS法测定硝苯地平。
数据统计分析 将所得血药浓度-时间数据用DAS 2.0软件计算两组硝苯地平药代动力学参数。实验结果均采用SPSS 13.0软件进行单因素方差分析, P < 0.05具有显著性差异。
结果 1 方法学考察分析空白血浆样品、配置的含硝苯地平的血浆样品、大鼠血浆样品以及空白粪便提取液、配置的含硝苯地平的粪便提取液样品、粪便孵育体系样品中硝苯地平的含量。结果表明, 血浆及粪便提取液中杂质不干扰样品的测定, 血浆样品中硝苯地平的保留时间为1.30 min (图 1), 粪便液色谱图与血浆样品色谱图基本一致。定量限为5 ng·mL-1, 灵敏度高, 专属性强, 未见内源性物质干扰, 可用于生物样品分析。
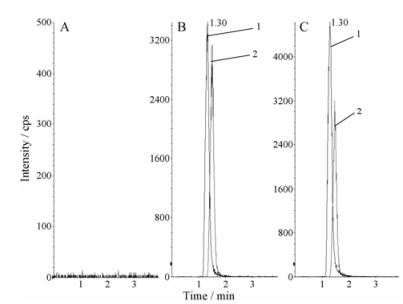
|
1: Nifedipine, 2: Nimodipine Figure 1 The chromatograms of nifedipine of blank plasma (A), blank plasma spiked with standard nifedipine (B) and sample (C). |
以硝苯地平峰面积对浓度作线性回归, 得血样标准曲线为Y = 0.002 27 X + 0.000 28, r = 0.999 1, 在质量浓度为5~2 000 ng·mL-1内线性良好。粪便样品标准曲线为Y = 0.002 7 X - 0.003 92, r = 0.999 2, 在质量浓度为5~2 000 ng·mL-1内线性良好。分别配制低、中、高3种浓度(6.25、100和1 850 ng·mL-1)的标准血浆及粪便溶液, 处理后分析, 血浆中低、中、高3个浓度的提取回收率分别为93.53%、94.63%和96.55%, RSD分别为4.96%、4.77%和3.83%。粪便样品中3个浓度的提取回收率分别为92.88%、94.65%和96.42%, RSD分别为5.16%、4.98%和3.96%。
同上配制低、中、高浓度的硝苯地平血浆及粪便样品, 于日内分别测定5次, 考察方法日内精密度, 连续测定3天, 考察方法日间精密度。结果表明, 日内和日间RSD均小于8.68%, 符合生物样品分析要求。同上配制100 ng·mL-1的硝苯地平血浆及粪便样品, 分别于配制后24 h、3次反复冻融、-20 ℃下保存一个月后测定。血样RSD%分别为6.72%、5.18%和7.14%, 粪便样品RSD%分别为7.52%、6.14%和5.88%, 说明血样及粪便样品在上述条件下稳定。
2 阿莫西林处理后肠道菌群的改变革兰染色法不仅能观察到细菌的形态而且还可将细菌分为两大类, 染色反应呈蓝紫色的称为革兰阳性细菌, 染色反应呈红色复染颜色的称为革兰阴性细菌, 通过镜检法可以估计细菌总数、革兰阳性菌与革兰阴性菌的比例。革兰染色法观察阿莫西林对肠道微生物群的影响, 如图 2所示。革兰染色实验结果可以看出, N1组革兰阳性球菌与革兰阴性杆菌的比值为1:10。而N2组革兰阳性球菌的数量减少, 总菌群数量也相应的减少, 说明阿莫西林会改变肠道菌群的组成。
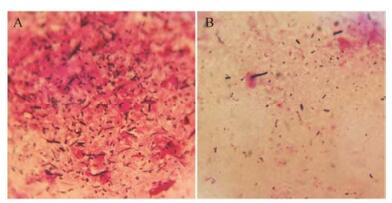
|
Figure 2 The microscopic examination of intestinal flora (×200) of (A) nifedipine (N1); (B) amoxicillin + nifedipine group (N2) |
本实验中以未做任何处理的空白大鼠粪便提取液作为阴性对照, 孵育0、12和24 h后均未检测到硝苯地平, 说明粪便提取液中其他物质不干扰硝苯地平的测定, 且空白粪便提取液中无硝苯地平。以空白大鼠粪便提取液、阿莫西林处理组粪便提取液为基质, 分别加入相同量的硝苯地平, 混匀后避光孵育。于0、12和24 h后取孵育样品, 通过LC-MS/MS法测定不同时间点剩余硝苯地平量的变化, 如图 3所示, 孵育12和24 h后, N1和N2组硝苯地平的剩余量减少, 表明粪便微生物会代谢硝苯地平。与N1组相比, 随着孵育时间的延长, 阿莫西林处理组硝苯地平的量下降缓慢(孵育12 h, N1和N2组硝苯地平剩余量分别为0.057 6、0.064 8 μmol·L-1, 24 h后, 硝苯地平剩余量分别为0.039 6、0.050 4 μmol·L-1), 说明阿莫西林处理后, 肠道菌群对硝苯地平代谢减慢。结果表明, 肠道微生物群参与了硝苯地平的代谢, 且在给予阿莫西林后, 肠道微生物群对其代谢减慢。
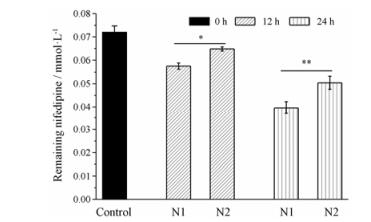
|
*P < 0.05, **P < 0.01 Figure 3 The remaining amount of nifedipine after incubation 12 h and 24 h. |
单剂量给予大鼠硝苯地平片后, LC-MS/MS法测定血药浓度, 根据每组血药浓度均值做药-时曲线图(图 4)。
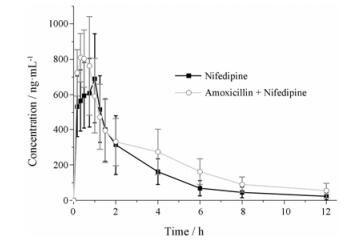
|
Figure 4 The plasma concentration-time curve of nifedipine |
采用DAS 2.0软件对两组血药浓度值进行分析, 发现给予阿莫西林后, 0~24 h内硝苯地平药时曲线下面积(AUC0-t)增加了39.10%, 达峰时间(tmax)提前了0.45 h, 清除率(CL)降低了34.71%, 其变化均具有统计学意义(表 1)。
| Table 1 The pharmacokinetic parameters of nifedipine at N1 and N2. n = 6, x±s. *P < 0.05 vs N1 |
肠道菌群是人体内正常微生物群, 被认为是机体重要的微生态系统, 其在外源性物质包括药物代谢中作用显著, 被称为机体“隐形器官”[9, 10]。目前肠道菌群与中药相互作用的研究在国内逐渐兴起[11]。口服药物在进入血液循环前, 先在胃肠道内与菌群接触, 极有可能被菌群转化, 以致产生活性或毒性代谢产物, 影响原形药物及代谢物的入血量, 从而引起药物生物利用度及疗效的改变[12]。本实验中, 将目标药物与粪便提取液共同孵育12和24 h后, 体系内硝苯地平的量减少, 说明肠道微生物群可能参与硝苯地平进入血液循环前的生物转化, 以致检测到的硝苯地平的剩余量减少, 且随着孵育时间的延长, 硝苯地平剩余量越来越少, 这可能会影响其生物利用度, 最终影响该药物的疗效。
有文献[13]报道, 抗生素可以改变大鼠肠道菌群的数量和种类, 以致给予阿司匹林、氨氯地平、洛伐他汀后, 其药代动力学参数发生显著变化, 影响药物疗效的发挥。β-内酰胺类抗生素胃肠道内药物浓度较高, 对肠道菌群影响可能比较明显, 本实验中阿莫西林同样会引起肠道菌群的改变, 减少菌群数量, 进而使硝苯地平在肠道吸收前代谢减慢, 从而影响硝苯地平的药代动力学参数, 使吸收前肠道内硝苯地平的量相对增加, 吸收加快, 吸收相同一时间点吸收入血的量更多, 吸收相更早地达到平衡; 且AUC增加明显, 提高了母体药物的血浆水平, 生物利用度增加。比较两组孵育实验结果得出, 随着孵育时间的延长, 阿莫西林处理组硝苯地平剩余量较多, 代谢减慢, 从而增加其入血量。
大多数研究DDI的文献多集中于代谢酶和转运体[14], 而对由肠道菌群引起的DDI研究较少, 但是肠道菌群对口服药物的代谢及抗生素对其他药物的影响非常重要, 是值得去深入探讨的科学问题。本课题组前期研究发现高原缺氧会减弱肠道菌群的代谢活性, 从而提高硝苯地平的生物利用度[15]。本实验为了消除由代谢酶或转运体的变化引起DDI的发生, N2组在药代动力学实验前3天灌胃给予阿莫西林, 每天1次, 连续给药3天, 让其达到稳态并且作用于肠道菌群, 给药结束3天后, 阿莫西林基本排泄完全, 然后给予硝苯地平, 进行药代动力学实验, 以避免可能由阿莫西林引起的肠道转运体或肝脏代谢酶对硝苯地平药代动力学的影响, 从而进一步研究由肠道菌群介导的阿莫西林和硝苯地平的DDI。
实验结果证明, 给予阿莫西林后, 大鼠血浆中硝苯地平浓度的升高可能是胃肠道中微生物被抑制的结果, 其药代动力学的改变与肠道菌群的变化相关联。提示给予阿莫西林后硝苯地平的生物利用度会增加, 可能会增加其疗效。总之, 抗生素与其他药物合用时, 由肠道菌群介导的DDI不容忽视, 这可能是影响药物疗效的重要因素之一。
| [1] | Koppel N, Rekdal VM, Balskus EP. Chemical transformation of xenobiotics by the human gut microbiota[J]. Science, 2017, 356: 1246–1256. |
| [2] | Wilson ID, Nicholson JK. Gut microbiome interactions with drug metabolism, efficacy, and toxicity[J]. Transl Res, 2017, 179: 204–222. |
| [3] | Carmody RN, Turnbaugh PJ. Host-microbial interactions in the metabolism of therapeutic and diet-derived xenobiotics[J]. J Clin Invest, 2014, 124: 4173–4181. DOI:10.1172/JCI72335 |
| [4] | Alkhaja KA, Sequeira RP, Alkhaja AK, et al. Drug treatment of hypertension in pregnancy:a critical review of adult guideline recommendations[J]. J Hypertens, 2014, 32: 454–463. DOI:10.1097/HJH.0000000000000069 |
| [5] | Grigoriev A, Nikitina A, Yaroshenko I, et al. Development of a HPLC-MS/MS method for the simultaneous determination of nifedipine and lidocaine in human plasma[J]. J Pharm Biomed Anal, 2016, 131: 13–19. DOI:10.1016/j.jpba.2016.08.004 |
| [6] | Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis[J]. Nat Rev Gastro Hepat, 2018, 15: 111–128. |
| [7] | Kim D. Gut microbiota-mediated drug-antibiotic interactions[J]. Drug Metab Dispos, 2015, 43: 1581–1589. |
| [8] | Yoo HH, Kim IS, Yoo DH, et al. Effects of orally administered antibiotics on the bioavailability of amlodipine:gut microbiota-mediated drug interaction[J]. J Hypertens, 2016, 34: 156–162. DOI:10.1097/HJH.0000000000000773 |
| [9] | Scott TA, Quintaneiro LM, Norvaisas P, et al. Host-microbe co-metabolism dictates cancer drug efficacy in C. elegans[J]. Cell, 2017, 169: 442–456. |
| [10] | Lin Z, Zu XP, Xie LS, et al. Research progress in mechanism of intestinal microorganisms in human diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 843–852. |
| [11] | Tang L, Fu LL, Shen LT, et al. Degradation of total saponins of Panax notoginseng by intestinal flora of rats in vitro[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 396–400. |
| [12] | Nicholson JK, Holmes E, Kinross J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336: 1262–1266. DOI:10.1126/science.1223813 |
| [13] | Kim I, Yoo D, Jung I, et al. Reduced metabolic activity of gut microbiota by antibiotics can potentiate the antithrombotic effect of aspirin[J]. Biochem Pharmacol, 2016, 122: 72–79. DOI:10.1016/j.bcp.2016.09.023 |
| [14] | Liu Q, Liu KX. Advances in enzymes and transporters-mediated pharmacokinetic mechanism for herb-drug interaction[J]. Acta Pharm Sin (药学学报), 2015, 50: 406–412. |
| [15] | Zhang JH, Chen YY, Sun YM, et al. Plateau hypoxia attenuates the metabolic activity of intestinal flora to enhance the bioavailability of nifedipine[J]. Drug Deliv, 2018, 25: 1175–1181. DOI:10.1080/10717544.2018.1469687 |
 2018, Vol. 53
2018, Vol. 53


