2. 北京中医药大学中药分析与转化研究中心, 北京 100029;
3. 北京中医药大学生命科学学院, 北京 100029;
4. 北京中医药大学北京中医药研究院, 北京 100029
2. Research Center for Chinese Medicine Analysis and Transformation, Beijing University of Chinese Medicine, Beijing 100029, China;
3. School of Life Science, Beijing University of Chinese Medicine, Beijing 100029, China;
4. Beijing Research Institute of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
动脉粥样硬化(atherosclerosis, AS)是一种严重危害人类健康的复杂代谢紊乱综合征, 是众多缺血性心脑血管疾病的重要生理病理基础[1]。在动脉粥样硬化众多发病机制中, 游离脂肪酸(free fatty acid, FFA)是动脉粥样硬化危险因素之一, 作为重要的能源物质和信号传导分子, 脂肪酸参与动脉粥样硬化的发生发展过程, 对调节生物体生理功能起着重要作用[2]。研究发现, 十六碳酸能够通过刺激C反应蛋白(CRP)、肿瘤坏死因子(TNF-α)和诱导型一氧化氮合酶(iNOS)的表达促进血管平滑肌炎性反应进而参与动脉粥样硬化的形成[3]。十八碳烯酸通过改善炎性信号对内皮功能的影响来减少血管平滑肌的增值和凋亡, 有助于改善动脉粥样硬化进程和斑块稳定性[4]。十八碳二烯酸和二十碳五烯酸可以有效减少胆固醇的积累, 是抗动脉粥样硬化的保护剂[5], 因此脂肪酸代谢轮廓变化与动脉粥样硬化发病密切相关。
巨噬细胞脂质化后形成泡沫细胞是动脉粥样硬化发生的始动因素, 巨噬细胞中的脂滴摄取氧化低密度脂蛋白(ox-LDL)促进脂质负载形成泡沫细胞, 进而胆固醇酯水解为游离胆固醇和游离脂肪酸[6]。课题组[7]前期研究发现二十碳四烯酸代谢产物花生四烯酸乙醇胺(AEA)过度积累是巨噬细胞泡沫化的关键代谢特征, 巨噬细胞泡沫化过程机体的代谢紊乱涉及到脂肪酸相关代谢通路, 然而系统脂肪酸异常代谢与泡沫细胞之间的关系目前尚不清楚。因此基于氧化低密度脂蛋白诱导巨噬细胞泡沫化模型, 深入研究动脉粥样硬化早期脂肪酸代谢特征, 无论是筛选疾病早期代谢标志物, 全面预防疾病发生发展, 还是从分子水平揭示药物作用机制都是非常必要且有意义的。
活血化瘀中药在动脉粥样硬化的防治中发挥着显著的疗效[8], 羟基红花黄色素A (hydroxysafflor yellow A, HSYA)是中药红花主要的活性成分, 能够通过抑制氧化低密度脂蛋白摄取来减少细胞内胆固醇酯沉积从而抑制巨噬细胞的泡沬化进而发挥抗早期动脉粥样硬化的作用[9], 然而羟基红花黄色素A对动脉粥样硬化疾病状态下脂肪酸代谢异常的调控规律尚不清楚。代谢组学能够即时、灵敏、真实反映在各种外界因素刺激下生物体整体功能状态的应答与调节, 靶向代谢组学能够有针对性地对疾病特征代谢物开展系统研究, 加强定量的准确性, 有助于更深入理解病变和治疗过程机体内物质的代谢状况。因此本文以氧化低密度脂蛋白诱导的巨噬细胞泡沫化为动脉粥样硬化的早期模型, 系统考察脂肪酸异常代谢及羟基红花黄色素A的调控作用, 揭示羟基红花黄色素A治疗动脉粥样硬化的作用机制和筛选药物潜在的作用靶点, 为动脉粥样硬化临床诊断以及新药研发提供借鉴和参考。
材料与方法试剂 羟基红花黄色素A (Q-008-170303)购于中国成都瑞芬思生物科技有限公司; 脂肪酸对照品均购买自美国Nu-Chek公司:十二碳酸(dodecanoic acid, C12:0)、十六碳酸(palmitic acid, C16:0)、十四碳酸(tetradecanoic acid, C14:0)、十四碳烯酸(myris toleic acid, C14:1)、十六碳烯酸(palmitoleic acid, C16:1)、十七碳酸(heptadecanoic acid, C17:0)、十七碳烯酸(heptadecenoic acid, C17:1)、十八碳酸(steatic acid, C18:0)、十八碳烯酸(9Z-octadecenoic acid, C18:1)、十八碳二烯酸(linoleic acid, C18:2)、α-十八碳三烯酸(α-linolenic acid, α-C18:3)、γ-十八碳三烯酸(γ-linolenic acid, γ-C18:3)、十九碳酸(nonadecanoic acid, C19:0)、十九碳烯酸(nonadecenoic acid, C19:1)、二十碳酸(arachidate, C20:0)、二十碳烯酸(eicosenoic acid, C20:1)、二十碳二烯酸(eicosadienoic acid, C20:2)、二十碳三烯酸(eicosatrienoic acid, C20:3)、二十碳四烯酸(arachidonic acid, C20:4)、二十碳五烯酸(timnodonate, C20:5)、二十二碳烯酸(erucic acid, C22:1)、二十二碳三烯酸(docosatrienoic acid, C22:3)、二十二碳四烯酸(docosatetraenoic acid, C22:4)、二十二碳六烯酸(dacosahexaenoic acid, C22:6)、二十四碳烯酸(tetracosenic acid, C24:1), 上述对照品纯度均大于98%; RAW 264.7细胞株(国家实验细胞资源共享平台); DMEM培养基、胎牛血清和胰蛋白酶(美国HyClone公司); 噻唑兰(MTT, 北京索莱宝科技有限公司); 二甲基亚砜(DMSO, 法国Sigma-Aldrich公司); 总胆固醇(TC)、游离胆固醇(FC)检测试剂盒(北京普利莱基因技术有限公司); 氧化低密度脂蛋白(广州奕源生物科技有限公司); 无水乙醇、甲醇、甲基叔丁基醚(MTBE)、甲酸和乙腈均为色谱纯(美国Fisher Chemical公司); 超纯水(美国Millipore公司)。
仪器 Agilent 1260高效液相色谱仪和Agilent 6470三重四级杆串联质谱仪(美国Agilent公司); Infinite 200 PRO多功能酶标仪(瑞士Tecan公司); 细胞培养箱(美国Thermo Scientific公司); IX71倒置荧光显微镜(日本Olympus公司); 3-18KS离心机(德国Sigma公司); Bead Ruptor 24珠式样品研磨器(美国OMNI公司); Concentrator plus真空浓缩机(德国Eppendorf公司)。
细胞培养及实验分组 RAW 264.7细胞贴壁生长, 培养于含10%胎牛血清、1%双抗的DMEM培养基中, 置于37 ℃、5% CO2的孵育箱中培养, 0.25%胰酶消化传代, 选取对数生长期细胞进行实验。实验分为空白组、模型组和羟基红花黄色素A药物干预组3个组别, 每组平行6个样品。空白组不加氧化低密度脂蛋白和羟基红花黄色素A, 模型组采用100 μg·mL-1氧化低密度脂蛋白培养细胞24 h, 羟基红花黄色素A组采用40 μg·mL-1羟基红花黄色素A预先处理1 h后继续用100 μg·mL-1氧化低密度脂蛋白培养细胞24 h。羟基红花黄色素A用超纯水配制成10 mg·mL-1母液, 实验中用DMEM完全培养基稀释成40 μg·mL-1加入细胞中[9]。
巨噬细胞泡沫化模型评价 MTT法检测细胞活力:将RAW 264.7细胞按每孔1×104个接种于96孔板中, 每孔加培养基200 μL, 实验分组及药物处理同前。吸弃细胞培养液, 向各孔细胞加入MTT (0.5 mg·mL-1) 200 mL避光培养4 h, 吸弃培养基, 加入DMSO溶液150 μL, 室温振荡1 min, 用酶标仪测定490 nm波长吸光度。细胞存活率=各组细胞吸光度值/空白组细胞吸光度值×100%。
测定胆固醇酯/总胆固醇(CE/TC)值:按照总胆固醇和游离胆固醇试剂盒操作说明书, 测定细胞内CE/TC值。CE/TC=(TC-FC)/TC。
细胞收集及细胞内代谢物提取 将RAW 264.7细胞按每孔2×106个接种于60 mm的细胞培养皿中, 每个培养皿加培养基2 mL, 实验分组及药物处理同前, 吸弃细胞培养液, 用PBS清洗3遍, 加入冷甲醇1 mL淬灭细胞, 然后加入PBS 2 mL, 采用细胞刮顺着同一方向轻轻的刮取培养皿底部, 将细胞悬液4 ℃下离心(1 000 r·min-1、10 min)获得细胞饼, PBS吹散, 离心, 重复淋洗两遍, 收集细胞饼于5 mL EP管中。以上过程均采用冰上操作[10]。
采用甲基叔丁基醚-甲醇-水(MTBE)体系进行细胞代谢物提取[11]。首先加入75%甲醇400 μL并用样品研磨均质匀浆机破碎细胞(S: 5、T: 20 s、D: 20 s、C: 3), 随即加入MTBE 1 mL振摇30 min, 然后加入水250 μL室温下静置分层10 min, 4 ℃下离心(14 000 r·min-1、15 min), 收集上清液, 然后进行真空浓缩, 并用80%甲醇150 μL复溶。
测定细胞内游离脂肪酸工作液的配制 分别精密称定27种游离脂肪酸对照品, 用无水乙醇配制成质量浓度为1 mg·mL-1储备液, 再按照1:2.5:2:2:2.5:10:2比例逐步稀释混合对照品溶液。其中C18:0、C14:0浓度稀释为10、4、2、1、0.4、0.04、0.02 μg·mL-1; α-C18:3、γ-C18:3、C12:0、C15:0、C16:1、C17:0、C18:2、C20:4、C20:0、C14:1、C17:1、C20:1、C22:1浓度稀释为2.5、1、0.5、0.25、0.1、0.01、0.005 μg·mL-1; C20:5、C20:3、C22:3、C19:0、C22:2、C24:1、C19:1浓度稀释为0.5、0.2、0.1、0.05、0.02、0.002、0.001 μg·mL-1; C20:2、C22:4、C22:6浓度稀释为0.25、0.1、0.05、0.025、0.01、0.001、0.000 5 μg·mL-1; C18:1浓度稀释为5、2、1、0.5、0.2、0.02、0.01 μg·mL-1; C16:0浓度稀释为20、8、4、2、0.8、0.08、0.04 μg·mL-1。
测定细胞内游离脂肪酸的液相-质谱条件 ZORBAX Eclipse Plus C8色谱柱(2.1 mm × 100 mm, 1.8 μm); 柱温45 ℃; 流动相: A相为2 mmol·L-1乙酸铵-水, B相为乙腈; 梯度条件: A相起始为45%, 保持0.5 min, 20 min升至90%, 保持2 min; 流速为0.5 mL·min-1; 进样量1 μL; 质谱分析采用负离子模式, 离子源: AJS ESI; 动态多反应监测模式, 离子对优化及碎裂电压结果列于表 1;干燥气温度350 ℃; 干燥气流速9 L·min-1; 鞘气温度250 ℃; 鞘气流速11 L·min-1。
| Table 1 The dynamic multiple reaction monitoring mass spectrometry parameters of free fatty acids (FFA) |
统计学分析 采用MetaboAnalyst (www.metaboanalyst.ca)在线工具对脂肪酸含量原始数据进行归一化处理, 采用SIMCA-P 12.0软件进行PCA和PLS-DA模式识别分析, Origin 8.0软件绘制柱形图和箱形图, Cytoscape软件进行代谢网络分析。
结果 1 羟基红花黄色素A对巨噬细胞泡沫化损伤调控作用参照文献[9]设置40 μg·mL-1为羟基红花黄色素A的作用剂量, 首先采用MTT法测定羟基红花黄色素A (40 μg·mL-1)药物干预下的细胞存活率为95%, 表明40 μg·mL-1是羟基红花黄色素A的安全剂量; CE/TC值是巨噬细胞泡沫化的评价指标, 巨噬细胞经过氧化低密度脂蛋白诱导形成泡沫细胞, 进而引起胆固醇酯含量升高, 通过测定CE/TC值评价羟基红花黄色素A对巨噬细胞泡沫化损伤的调控作用(正常细胞CE/TC < 50%)[12]。CE/TC值测定结果如表 2所示, 与空白组相比, 模型组CE/TC值为63% (P < 0.01), 表明早期动脉粥样硬化模型建立成功; 与模型组相比, 羟基红花黄色素A药物干预后CE/TC值为0.38% (P < 0.01), 表明羟基红花黄色素A对巨噬细胞泡沫化有调控作用。
| Table 2 The relative value of cholesteryl ester of different cell groups. n = 6, x±s. **P < 0.01 vs control group; △△P < 0.01 vs model group. HSYA: Hydroxy safflor yellow A |
为了改善峰型和分离度, 实验优化了流动相、流动相梯度、色谱柱温度、流速等液相条件; 对于质谱条件优化, 采用动态多反应监测扫描模式, 该模式根据各个脂肪酸离子对的质荷比进行定量, 能够提高检测灵敏度和定量准确性。根据检测的目标化合物, 首先确定了在负离子模式下脂肪酸质谱响应较好, 然后对相应母离子(precursor ion)、碎裂电压(frag mentor)、子离子(product ion)及碰撞能量(collision energy)进行优化, 最终建立针对于每个化合物的多反应监测方法, 从而实现对各化合物选择性检测。为了实现各化合物的最大离子化, 同时优化了干燥气温度、干燥气流速、鞘气温度、鞘气流速等离子源参数。图 1为各个游离脂肪酸提取的动态多反应监测的叠加图, 在20 min内实现了27种脂肪酸的分离和定量分析。脂肪酸出峰顺序与其结构(链长和不饱和度)相关, 对于饱和脂肪酸, 碳链越长, 保留时间越大; 对于不饱和脂肪酸, 相同碳链数, 不饱和键越多, 保留时间越小。
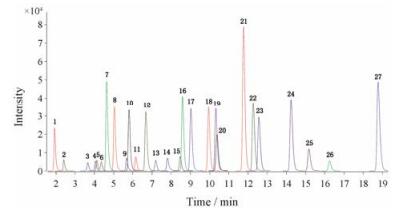
|
Peak order: 1. C12:0; 2. C14:1; 3. C14:0; 4. C20:5; 5. α-C18:3; 6. γ-C18:3; 7. C16:1; 8. C15:0; 9. C20:4; 10. C18:2; 11. C17:1; 12. C16:0; 13. C20:3; 14. C18:1; 15. C17:0; 16. C22:4; 17. C20:2; 18. C19:1; 19. C18:0; 20. C22:3; 21. C20:1; 22. C19:0; 23. C22:2; 24. C20:0; 25. C22:1; 26. C22:6; 27. C24:1 Figure 1 Dynamic MRM chromatogram of 27 FFAs. |
本实验所测游离脂肪酸均为内源性组分, 结合脂肪酸的溶解性, 采用无水乙醇作为溶剂, 配制对照品溶液。定量限(LOQ)是信噪比为10时脂肪酸的浓度, 线性范围(linear range)最低浓度为各脂肪酸的定量限。按照所建立HPLC- QQQ/MS分析方法分析, 然后以目标测定的27种脂肪酸对照品峰面积为纵坐标y, 浓度为横坐标x, 绘制标准曲线方程并得到相关系数(R2)。结果表明目标测定脂肪酸的峰面积与浓度线性关系良好, 相关系数R2值均高于0.995 5, 线性范围和定量限见表 3。
| Table 3 Liner regression equation and limit of quantitation (LOQ) of 27 FFAs |
取中等浓度的脂肪酸混合标准溶液, 日内精密度为脂肪酸对照品连续进样6次, 日间精密度为脂肪酸对照品连续3天进样, 根据峰面积测得浓度并计算RSD值。结果日内精密度RSD均值1.64%, 日间精密度RSD均值8.99%, 表明仪器精密度良好, 满足样品测定的要求。
2.2.3 稳定性本实验考察了细胞样品处理后24 h内4 ℃放置的稳定性, 取同一时间点细胞样品, 分别于0、12和24 h进样分析, 根据峰面积测得浓度并计算RSD值, 结果样品稳定性RSD均值4.01%, 表明样品在24 h内4 ℃放置稳定。
2.2.4 回收率待测游离脂肪酸为内源性物质, 本实验按中浓度加入脂肪酸混合标准溶液(中浓度水平约为样品含量的0.5~1.5倍)进样分析, 根据峰面积测得浓度并计算回收率。结果各脂肪酸回收率均值113.48%, RSD均值5.6%, 表明该方法可用于细胞中脂肪酸测定要求。
2.3 细胞游离脂肪酸含量测定按照所建立HPLC-QQQ/MS分析方法, 同时检测不同浓度脂肪酸对照品和细胞样品, 将采集的数据导入安捷伦定量分析软件计算空白组、模型组和羟基红花黄色素A药物干预组细胞中脂肪酸含量, 同时统计了饱和脂肪酸(saturated fatty acid, SFA)、单不饱和脂肪酸(monounsaturated fatty acid, MUFA)和多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)的总含量(图 2)。结果表明C16:0和C18:0是主要的饱和脂肪酸, C18:1是主要的单不饱和脂肪酸, 同时C18:2是主要的多不饱和脂肪酸, 这些脂肪酸含量变化主要影响饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸总含量的变化。
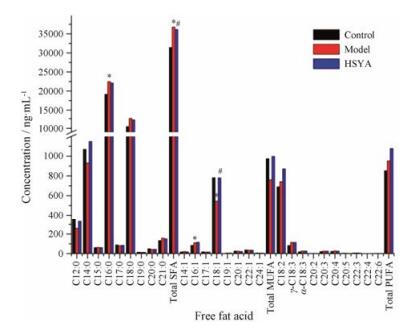
|
SFA: Saturated fatty acid; MUFA: Monounsaturated fatty acid; PUFA: Polyunsaturated fatty acid. *P < 0.05 vs control group; #P < 0.05 vs model group Figure 2 Concentrations of 27 free fatty acids of different cell groups. |
根据细胞中游离脂肪酸含量结果, 采用代谢组学数据处理方法, 考察不同组内脂肪酸的分布规律。首先采用MetaboAnalyst (www.metaboanalyst.ca)在线工具设置归一化参数“Normalization by sum、Log transformation、Mean centering”以减小极大极小值对整体数据的影响[13]。将归一化的数据导入SIMCA-P软件进行多元统计分析[14], 以各样本所测得脂肪酸的含量为统计变量, 对各组进行无监督的PCA分析, 通过散点图对样本进行整体评价, 其中空白组和模型组可明显区分(R2X = 0.646, Q2 = 0.435) (图 3A), 表明巨噬细胞泡沫化后细胞内脂肪酸含量发生了变化; 空白组、模型组和羟基红花黄色素A组可相互分开, 且羟基红花黄色素A组位于空白组和模型组之间(R2X = 0.634, Q2 = 0.424) (图 3B), 表明给予羟基红花黄色素A后细胞中的脂肪酸水平发生了变化。
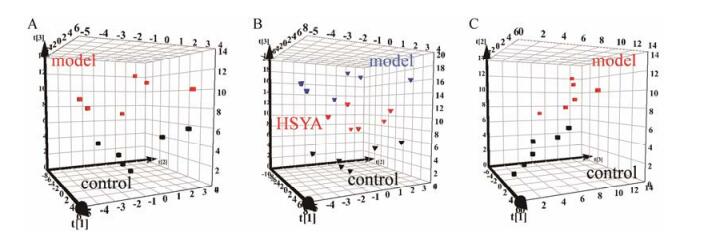
|
A: PCA plot between control and model; B: PCA plot between control, model and HSYA; C: PLS-DA plot between control and model Figure 3 The pattern recognition result of different cell groups. |
为了筛选巨噬细胞泡沫化生物标志物, 首先对空白组和模型组进一步建立有监督的PLS-DA模型来增强对分类贡献大的变量的识别(图 3C), PLS-DA模型中VIP值(variable importance of projection)可以用来衡量变量对于分组的贡献, VIP值越大对差异的贡献越大, 其中VIP值> 1.0可作为区分健康与泡沫化巨噬细胞的潜在生物标志物, 基于此筛选确定了C12:0, C14:0, C17:0, C17:1, C18:1, C19:0, C20:0, C20:1, C20:5, C22:1, C22:3, Total MUFA和Total SFA 13个巨噬细胞泡沫化潜在生物标志物(表 4)。在上述标志物中饱和脂肪酸和单不饱和脂肪酸占主要部分, 表明巨噬细胞泡沫化扰乱细胞内脂肪酸正常代谢以饱和脂肪酸和单不饱和脂肪酸为主。
| Table 4 Potential biomarkers of macrophage-derived foam cells (VIP > 1). VIP: Varible importance of projection |
根据3.2筛选的特征标志物, 应用Cytoscape软件中的Metscape插件通过构建巨噬细胞泡沫化特征标志物化合物-反应-酶-基因的代谢网络深入了解特征标志物信息[15]。图 4所示, 在代谢网络中六边形表示相关代谢物, 菱形表示相关反应, 方形表示相关酶, 圆形表示相关基因, 红色表示本实验巨噬细胞泡沫化的特征标志物。通路富集分析结果表明脂肪酸生物合成通路(de novo fatty acid biosynthesis), 二十碳五烯酸抗炎代谢物合成通路(putative anti-inflam matory metabolites formation from EPA)和多不饱和脂肪酸代谢通路(Ω3 fatty acid metabolism)与疾病有重要相关性。图 4结果表明3个特征标志物C12:0、C14:0和C18:1均富集到脂肪酸生物合成通路, 提示脂肪酸生物合成通路在疾病发生发展过程中发挥重要作用, 也是药物调控规律研究的主要切入点。
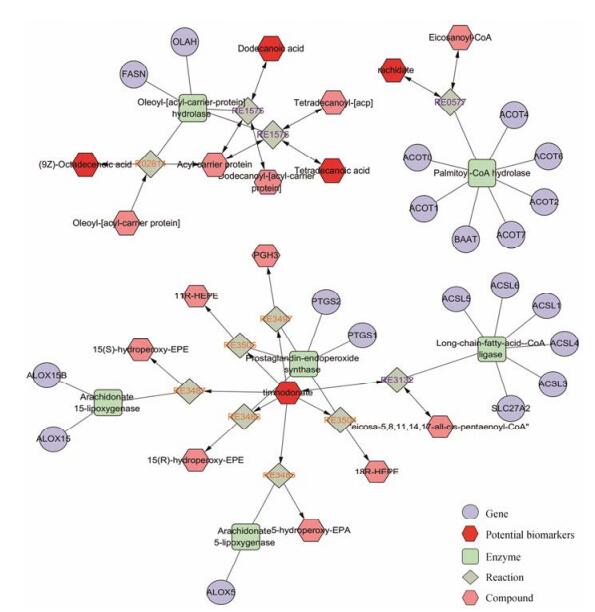
|
ALOX5: Arachidonate 5-lipoxygenase; ALOX15: Arachidonate 15-lipoxygenase; OLAH: Oleoyl-(acyl-carrier-protein) hydrolase; PTGS2: Prostaglandin-endoperoxide synthase; ACOT2: Acyl-coenzyme A thioesterase 2; BAAT: Bile acid-CoA; Acsl1: Long-chain-fatty-acid-CoA ligase 1 Figure 4 Network result of macrophage-derived foam cells (Compound-Reaction-Enzyme-Gene). |
通过脂肪酸标志物的筛选明确了巨噬细胞泡沫化过程代谢紊乱, 以此为基础进一步考察羟基红花黄色素A的调控方式和作用机制。首先分析13个特征标志物在3组样本中的含量分布情况(图 5), 结果表明与空白组相比, C12:0、C14:0、C17:0、C17:1、C18:1、C19:0、C20:0、C22:1、C22:3、Total MUFA含量降低, 而Total SFA含量升高; 通过羟基红花黄色素A药物干预后, 与模型组比较羟基红花黄色素A对C12:0、C14:0、C17:1、C18:1、C22:1、C22:3、Total MUFA、Total SFA有调控作用。值得注意的是, 羟基红花黄色素A能够有效改善脂肪酸生物合成通路上的3个特征脂肪酸(C12:0、C14:0和C18:1)的异常代谢, 表明羟基红花黄色素A通过调控这3个特征代谢物进而影响脂肪酸生物合成通路。
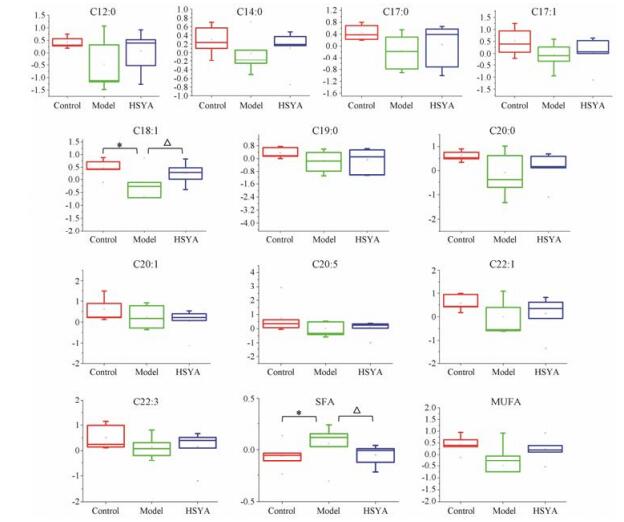
|
*P < 0.05 vs control group; △P < 0.05 vs model group Figure 5 Content of characteristics bio-markers intervented by HSYA. |
系统认识疾病代谢异常情况是研究药物作用机制的前提与基础, 本文以游离脂肪酸为研究对象开展靶向代谢组学研究, 筛选了动脉粥样硬化早期的13个特征标志物, 进而发现羟基红花黄色素A能够通过有效调节Total SFA, C14:0和C18:1等特征标志物和影响脂肪酸生物合成通路来改善动脉粥样硬化异常代谢状况、该工作对于深入认识动脉粥样硬化早期脂肪酸代谢状况, 发现特效药物具有重要的意义。
本文在筛选的疾病标志物中发现羟基红花黄色素A对Total SFA和C18:1这两个标志物作用显著, 结合相关文献对Total SFA和C18:1在动脉粥样硬化早期的作用情况进行探讨。SFA是一类碳链中不含双键的脂肪酸, 临床研究发现, 与健康人群相比动脉粥样硬化患者中饱和脂肪酸浓度增加, 同时发现肿瘤坏死因子、白介素-6 (IL-6)和白介素-8 (IL-8)浓度也增多[16], IL-6、IL-8等炎性细胞因子能够参与动脉粥样硬化的炎症反应, 炎症反应在动脉粥样硬化斑块形成、进展和继发病变中均发挥重要作用[17], 因此SFA的增多可促进动脉粥样硬化。此外, 体内过量的SFA能够被Toll样受体4 (TLR4)识别, 并引起炎症转录因子的表达[如核因子κB (NF-κB)、环氧酶(COX2)等][18], 促进单核细胞黏附和激活炎症反应。本实验在巨噬细胞泡沫化过程中SFA浓度升高, 进而促进动脉粥样硬化炎症反应, 经羟基红花黄色素A给药后细胞中SFA浓度降低(图 5), 推测羟基红花黄色素A通过减轻机体炎性反应从而发挥对动脉粥样硬化的治疗作用; C18:1是脂肪酸中的主要成分约占血液中脂肪酸含量的40%[19]。有报道, 人体内C18:1含量异常升高与非酒精性脂肪肝和动脉粥样硬化这两种代谢综合征发展有关[20], C18:1对心血管水平有有益的影响, 通过抑制JNK-1/2和NF-κB通路, 减少血管平滑肌细胞(VSMCs)的增殖和凋亡可能有助于改善动脉粥样硬化的过程及其稳定性[4]。羟基红花黄色素A治疗后细胞中C18:1水平上调(图 5), 推测羟基红花黄色素A发挥对动脉粥样硬化治疗作用可能与减轻炎症反应有关。
基于疾病标志物构建代谢网络能够追踪代谢物和蛋白间的连接, 有助于从整体层面上认识疾病的本质。根据3.4结果, 脂肪酸生物合成通路在动脉粥样硬化发挥重要作用, oleoyl-(acyl-carrier-protein) hydrolase (OLAH)是脂肪酸生物合成通路上的关键酶, OLAH参与脂肪酸生物合成过程和脂质生物合成过程[21], 能够改善C12:0、C14:0和C18:1代谢异常(图 4), 由此表明羟基红花黄色素A可能通过调控OLAH表达影响脂肪酸代谢异常从而改善动脉粥样硬化, 推测OLAH可能是羟基红花黄色素A治疗动脉粥样硬化的潜在作用靶点, 相关作用机制后续将进行深入研究。
综上所述, 本研究以巨噬细胞泡沫化为动脉粥样硬化早期模型, 从脂肪酸代谢轮廓的层面明确早期动脉粥样硬化代谢紊乱及羟基红花黄色素A调控作用, 网络分析表明脂肪酸生物合成通路是羟基红花黄色素A治疗动脉粥样硬化的重要代谢通路, 推测OLAH可能是羟基红花黄色素A调控脂肪酸代谢的潜在靶点, 这一研究结果为动脉粥样硬化的临床治疗及新药研发提供参考。
| [1] | Moore KJ, Tabas I. Macrophages in the pathogenesis of atherosclerosis[J]. Cell, 2011, 145: 341–355. DOI:10.1016/j.cell.2011.04.005 |
| [2] | Boden G. Obesity, insulin resistance and free fatty acids[J]. Curr Opin Endocrinol Diabetes Obes, 2011, 18: 139–143. DOI:10.1097/MED.0b013e3283444b09 |
| [3] | Wu D, Liu J, Pang X, et al. Palmitic acid exerts pro-inflammatory effects on vascular smooth muscle cells by inducing the expression of C-reactive protein, inducible nitric oxide synthase and tumor necrosis factor-α[J]. Int J Mol Med, 2014, 34: 1706–1712. DOI:10.3892/ijmm.2014.1942 |
| [4] | Perdomo L, Beneit N, Otero YF, et al. Protective role of oleic acid against cardiovascular insulin resistance and in the early and late cellular atherosclerotic process[J]. Cardiovasc Diabetol, 2015, 14: 75. DOI:10.1186/s12933-015-0237-9 |
| [5] | Song Y, Zhang LJ, Li H, et al. Polyunsaturated fatty acid relatively decreases cholesterol content in THP-1 macrophage-derived foam cell:partly correlates with expression profile of CIDE and PAT members[J]. Lipids Health Dis, 2013, 12: 111. DOI:10.1186/1476-511X-12-111 |
| [6] | Javad ZR, Hossein N, Reza M, et al. Effect of unsaturated fatty acids on molecular markers of cholesterol homeostasis in THP-1 macrophages[J]. Iran Red Crescent Med J, 2013, 15: 554–559. DOI:10.5812/ircmj |
| [7] | Xu WJ, Wei ZY, Dong JJ, et al. Global metabolomics reveals the metabolic dysfunction in ox-LDL induced macrophage-derived foam cells[J]. Front Pharmacol, 2017, 8: 586. DOI:10.3389/fphar.2017.00586 |
| [8] | Yan CL, Yang J, Han JH, et al. Advances in anti-atherosclerosis mechanisms of traditional Chinese medicine[J]. Tianjin Med J (天津医药), 2014, 28: 904–913. |
| [9] | MaYinuer-YeErkenbieke. Safflower Flavonoids Extraction and Purification and in vitro Activity Against Atherosclerosis Effect Evaluation (红花总黄酮提取纯化及体外抗动脉粥样硬化药效活性评价)[D]. Urumqi: Xinjiang Medical University, 2014. |
| [10] | Liu XY, Liu YQ, Chen MC, et al. A metabolomics study of the inhibitory effect of 17-beta-estradiol on osteoclast proliferation and differentiation[J]. Mol Biosyst, 2015, 11: 635–646. DOI:10.1039/C4MB00528G |
| [11] | Chen SL, Hoene M, Li J, et al. Simultaneous extraction of metabolome and lipidome with methyI tert-butyI ether from a single small tissue sample for ultra-high performance liquid chromatography/mass spectrometry[J]. J Chromatogr A, 2013, 1298: 9–16. DOI:10.1016/j.chroma.2013.05.019 |
| [12] | Zhou Y, Wo XD, Lu DZ. The model establishment and identification of RAW264.7 macrophage-derived foam cell[J]. Chin J Arterioscler (中国动脉硬化杂志), 2010, 18: 687–690. |
| [13] | Xia JD, Sinelnikov I, Han B, et al. MetaboAnalyst 3.0-making metabolomics more meaningful[J]. Nucleic Acids Res, 2015, 43: W251–W257. DOI:10.1093/nar/gkv380 |
| [14] | Wang DF, Wang YL, Wang YW, et al. Effect of Huangqin Tang on serum metabolic profile in rats with ulcerative colitis based on UHPLC-MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 1306–1312. |
| [15] | Gao J, Tarcea VG, Karnovsky A, et al. Metscape:a cytoscape plug-in for visualizing and interpreting metabolomic data in the context of human metabolic networks[J]. Bioinformatics, 2010, 26: 971–973. DOI:10.1093/bioinformatics/btq048 |
| [16] | Polonskaya YV, Shramko VS, Morozov SV, et al. Balance of fatty acids and their correlations with parameters of lipid metabolism and markers of inflammation in men with coronary atherosclerosis[J]. Bull Exp Biol Med, 2017, 164: 33–35. DOI:10.1007/s10517-017-3920-x |
| [17] | Liu JT. Progress in inflammatory pathogenesis of atherosclerosis[J]. J Xi'an Jiaotong Univ Med Sci (西安交通大学学报), 2015, 36: 141–152. |
| [18] | Lee JY, Ye JP, Gao ZG, et al. Reciprocal modulation of toll-like Receptor-4 signaling pathways involving MyD88 and phosphatidylinositol 3-Kinase/AKT by saturated and polyunsaturated fatty acids[J]. Biol Chem J, 2003, 278: 37041–37051. DOI:10.1074/jbc.M305213200 |
| [19] | Richieri GV, Kleinfeld AM. Unbound free fatty acid levels in human serum[J]. J Lipid Res, 1995, 36: 229–240. |
| [20] | Assy N, Nassar F, Nassar G. Olive oil consumption and non-alcoholic fatty liver disease[J]. World J Gastroenterol, 2009, 15: 1809–1815. DOI:10.3748/wjg.15.1809 |
| [21] | Ohlrogge JB, Shine WE, Stumpf PK. Fat metabolism in higher plants. Characterization of plant acyl-ACP and acyl-CoA hydrolases[J]. Arch Biochem Biophys, 1978, 189: 382–391. DOI:10.1016/0003-9861(78)90225-4 |
 2018, Vol. 53
2018, Vol. 53


