2. 济宁医学院附属医院, 山东 济宁 272067;
3. 济宁医学院行为医学教育研究所, 山东 济宁 272067;
4. 济宁医学院基础医学院, 山东 济宁 272067
2. Affiliated Hospital, Jining Medical University, Jining 272067, China;
3. Institute of Behavioral Medicine Education, Jining Medical University, Jining 272067, China;
4. School of Basic Medicine, Jining Medical University, Jining 272067, China
溃疡性结肠炎(ulcerative colitis, UC)是目前发病机制不明的慢性炎症, 且有终身复发倾向[1]。患者可出现反复发作的腹泻、黏液脓血便和腹痛, 并可出现结节性红斑、外周关节炎等肠外表现, 给患者带来持久的痛苦[2]。临床药物应用以控制炎症为主, 其中柳氮磺嘧啶为常用药物[3], 但是随着临床广泛应用, 逐渐发现这类药物存在较多的不良反应以及部分治疗无效的患者[4]。目前, UC的临床治疗仍需高效、专一、不良反应少的药物。
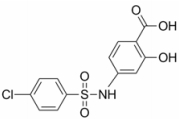
N-对氯苯磺酰基-4-氨基水杨酸(N-p-chlorobenzenesulfonyl-4-amino salicylic acid, 缩写为N-p--Cl-Bs-4-ASA, 图 1)是自主合成的化合物, 为5-氨基水杨酸(5-amino salicylic acid, 5-ASA)类似物, 具有5-ASA发挥疗效的活性基团, 目前并没有相关文献报道, 尤其是对UC的作用。葡聚糖硫酸钠(dextran sodium sulfate, DSS)诱导的UC模型是科研中稳定可靠的临床前模型, 与人类UC在症状和病理中有许多相似之处[5, 6]。因此, 本研究以DSS诱导的小鼠UC模型为基础, 通过对体重变化、精神状态、大便形态(大便是否成形)、肉眼血便、饮食饮水量、炎症因子表达、炎细胞浸润、结肠长度等, 研究N-p--Cl-Bs-4-ASA对小鼠UC的疗效, 为临床药物应用提供参考。
|
Figure 1 The chemical structure of N-p-chlorobenzenesulfonyl-4-amino salicylic acid (N-p--Cl-Bs-4-ASA) |
N-p-Cl-Bs-4-ASA由济宁医学院自主合成; DSS购自美国MP Biomedicals公司; 福尔马林购自西陇化工股份有限公司; H&E染色试剂由碧云天生物技术研究所购得; 髓过氧化物酶(myeloperoxidase, MPO)检测试剂购自江苏科晶生物科技有限公司; 小鼠肿瘤坏死因子α (tumor necrosis factor alpha, TNF-α)、白细胞介素1β (interleukin 1 beta, IL-1β)、白细胞介素6 (interleukin 6, IL-6)、巨噬细胞炎性蛋白2 (macrophage inflammatory protein 2, MIP-2)的ELISA试剂盒购自江苏科晶生物科技有限公司。
实验动物BALB/c小鼠由济南朋悦实验动物繁育有限公司提供[实验动物使用许可证: SCXK (鲁) 2014-0007]。周龄6~8周, 体质量18~22 g, 饲养室内保持适宜的温度和湿度, 并建立正常昼夜节律以维持小鼠正常生理活动。所有小鼠在实验开始前均适应性饲养1周。
实验仪器702型超低温冰箱购自美国Thermo Electron公司; LD4-2普通离心机购自北京医用离心机厂; 电子天平购自北京赛多利斯仪器系统有限公司; DGX-9003型鼓风干燥箱购自上海福玛实验设备有限公司; 电光分析天平购自北京赛多利斯仪器系统有限公司; Research型单道可调移液器、5417R型台式冷冻高速离心机购自德国Eppendorf公司; Varioskan全波长酶标仪购自美国Thermo公司。光学显微镜购自日本奥林巴斯公司。
药物配制N-p-Cl-Bs-4-ASA给药组分为高、中、低剂量组。高、中剂量组(40、20 mg·kg-1)给药配制方法如下:取20和10 mg分别溶于生理盐水5 mL中, 即为药物的工作浓度4、2 mg·mL-1。低剂量组(10 mg·kg-1)给药配制方法如下:取10 mg溶于生理盐水10 mL中, 即为药物的工作浓度1 mg·mL-1。5-ASA组(40 mg·kg-1)配制方法如下:取20 mg溶于生理盐水5 mL中, 即为药物的工作浓度4 mg·mL-1。给药组每只小鼠灌胃量0.2 mL。
分组、给药方法及DSS诱导小鼠结肠炎模型的建立60只健康雌性小鼠, 随机分为6组:空白组、DSS模型组、N-p-Cl-Bs-4-ASA高、中、低剂量给药组(40、20、10 mg·kg-1)和5-ASA组(40 mg·kg-1), 每组10只。小鼠自由饮用DSS溶液7天后更换为正常饮用水3天, 建立急性结肠炎小鼠模型[5-7]。空白对照组10天均给予正常饮用水。建立模型的第1天至第10天, 高、中、低剂量组和5-ASA组以灌胃的方法给予0.2 mL溶液。第11天小鼠取血后, 处死所有小鼠, 摘取重要脏器(心、肝、肺、肾)及结肠组织。称重脏器并记录数据, 并通过HE染色对各组小鼠的重要脏器和结肠组织进行病理学评分, 观察其病理变化[7, 8]。分离结肠, 精确测量结肠长度并记录, 对比各组别结肠长度并拍照记录。实验期间所有小鼠均可自由获得食物及水。
DSS诱导小鼠结肠炎模型评价标准实验期间每天同一时段观察并记录小鼠的活动状况、毛发光泽、饮食饮水情况, 观察小鼠精神状态(好、一般、差), 对小鼠进行称重, 观察记录小鼠大便情况(大便的形态)和肉眼血便情况。汇总每组小鼠的体质量下降百分比、粪便性状及血便为评价标准处理成疾病活动指数(disease activity index, DAI), 依次进行评分, 评分公式“疾病活动指数= (体质量评分+粪便性状评分+隐血评分)/10”评分标准见表 1。
| Table 1 Scoring method of disease activity index. Stool property: normal (0 points): forming stool; loose stool (2 points): a mushy, semi-formed stool which not attached to the anus; diarrhea (4 points): a watery stool which adhered to the anus |
将重要脏器(心、肝、肺、肾)和结肠样本置于10%福尔马林溶液固定, 固定后以浓度梯度酒精脱水, 继续处理组织块置于二甲苯中替换出组织中酒精。透明后浸蜡包埋切片。将切下的薄片置于60 ℃烘箱中直至切片的石蜡呈液体状。二甲苯重复脱蜡2次, 每次均使用新配二甲苯。脱蜡后将切片依次放入无水乙醇5 min, 90%乙醇2 min, 70%乙醇2 min, 蒸馏水2 min中浸泡处理。随后用苏木素染色液染色10 min。PBS缓冲液洗涤10 min, 蒸馏水继续清洗10 min。随后将样品切片置于70%乙醇中脱水2 min, 换新配90%乙醇, 再次脱水2 min。伊红染色30 s。染色后无水乙醇脱水, 二甲苯中浸泡5 min, 换新配二甲苯, 再次浸泡5 min使切片透明, 封片剂封片, 显微镜下观察。
血清ELISA检测小鼠取血, 静置30 min, 并离心10 min, 移液枪收集上层血清进行ELISA检测。每次取样时均更换枪头。实验步骤包括加样、洗涤、加入酶标抗体、辣根过氧化酶标记的亲和素酶并孵化洗涤, 最后加入酶反应底物、显色液和终止液, 用波长450 nm检测各组吸光度。
数据处理及分析实验数据分析处理平行操作3次, 结果以x±s表示, one-way ANOVA检验各组间差异, P < 0.05显示有统计学差异。
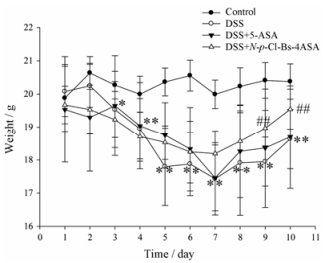
结果 1 N-p-Cl-Bs-4-ASA对DSS诱导的UC小鼠的治疗作用实验进行中发现, 空白组小鼠体重持续增长, 饮食饮水正常, 精神状态佳, 活动频繁, 粪便形态未见明显异常; DSS模型组小鼠体重明显下降, 饮食少, 食欲差, 精神状态萎靡, 不喜活动, 毛发灰暗无光泽, 出现腹泻、肉眼血便、脓便等症状, 出现早且严重; 给药组小鼠稀便和血便情况明显减少, 与DSS模型组小鼠相比各项症状得到明显改善。如图 2所示, 相比于DSS模型组, 给予N-p-Cl-Bs-4-ASA (40 mg·kg-1)后, 小鼠体重开始逐渐回升。
|
Figure 2 Body weight changes of each group after DSS induction of ulcerative colitis. n = 10, x±s. *P < 0.05, **P < 0.01 vs normal mice; ##P < 0.01 vs DSS-treated ulcerative colitis mice. DSS: Dextran sodium sulfate; 5-ASA: 5-Amino salicylic acid |
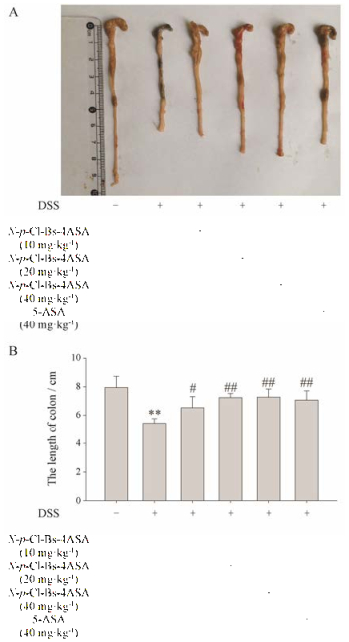
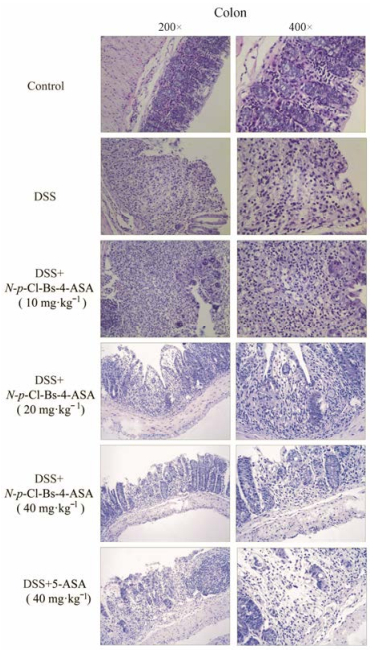
解剖后发现, 模型组较空白组结肠长度明显减少, 而给药组小鼠结肠长度较模型组明显增加(低剂量组P < 0.05;中、高剂量组P < 0.01), 如图 3。对结肠组织的HE染色(图 4)显示, DSS模型组小鼠结肠黏膜层出现重度炎症细胞浸润, 局部出现不同程度的坏死, 坏死处已有成纤维细胞增生, 黏膜肌层组织出现炎症细胞浸润; 低剂量给药组(10 mg·kg-1)小鼠黏膜层慢性炎症并伴有坏死, 嗜酸性粒细胞浸润, 局部泡沫样组织细胞聚集, 药效不明显; 中剂量给药组(20 mg·kg-1)小鼠黏膜层中度炎症伴少量坏死, 少量嗜酸性粒细胞浸润, 局灶泡沫样组织细胞聚集, 情况略有改善; 高剂量给药组(40 mg·kg-1)小鼠结肠黏膜结构基本恢复正常, 上皮结构较完整, 少量炎症细胞浸润, 情况明显好转。
|
Figure 3 Macroscopic appearances (A) and the lengths (B) of colons from each group of mice were measured. n = 10, x±s. **P < 0.01 vs normal mice; #P < 0.05, ##P < 0.01 vs the DSS- treated ulcerative colitis mice |
|
Figure 4 Serial sections of colon tissues were stained with hematoxylin and eosin (HE) |
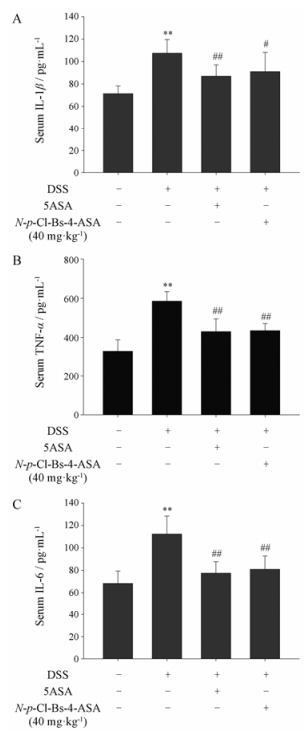
炎症因子在UC的进程与转归中起着重要作用[9, 10], 通过ELISA实验检测发现N-p-Cl-Bs-4-ASA (40 mg·kg-1)显著降低血清中IL-1β、TNF-α和IL-6的含量(图 5)。
|
Figure 5 The production of inflammation-related cytokine IL-1β (A), TNF-α (B) and IL-6 (C) in serum were determined by ELISA. n = 10, x±s. **P < 0.01 vs normal mice; ##P < 0.01 vs DSS-treated ulcerative colitis mice. TNF-α: Tumor necrosis factor alpha; IL-1β: Interleukin 1 beta; IL-6: Interleukin 6 |
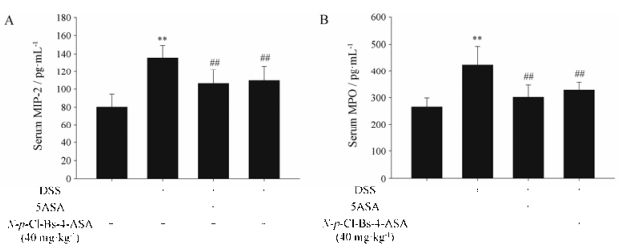
如前所述, HE染色观察结肠组织病理发现, 给药组小鼠结肠组织只有少量炎症细胞浸润, 进一步检测血清中MIP-2和MPO水平, 结果显示N-p-Cl- Bs-4-ASA (40 mg·kg-1)显著降低MIP-2和MPO水平。MIP-2水平显示巨噬细胞的数量[11], MPO是中性粒细胞的功能标志[12], 证实N-p-Cl-Bs-4-ASA减少DSS诱导的UC小鼠的炎症细胞浸润(图 6)。
|
Figure 6 The production of MIP-2 (A) and MPO (B) in serum were determined by ELISA. n = 10, x±s. **P < 0.01 vs normal mice; ##P < 0.01 vs DSS-treated ulcerative colitis mice. MIP-2: Macrophage inflammatory protein 2; MPO: Myeloperoxidase |
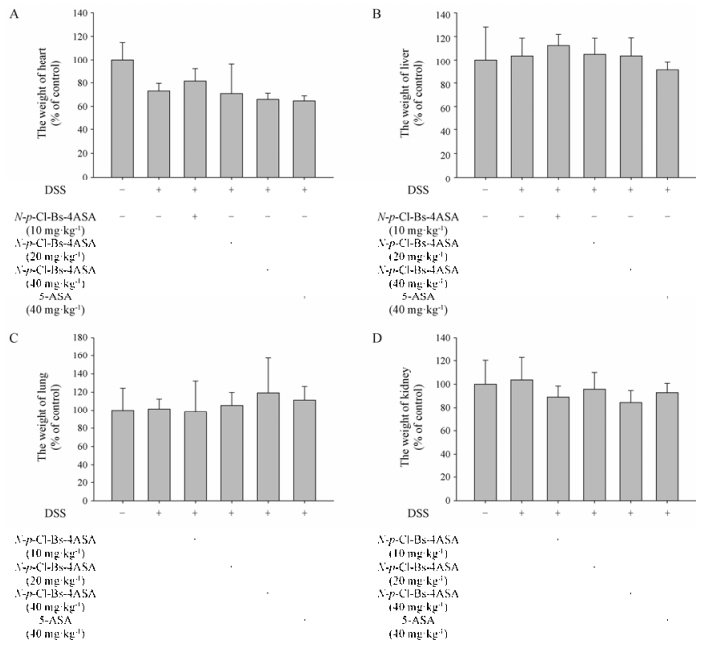
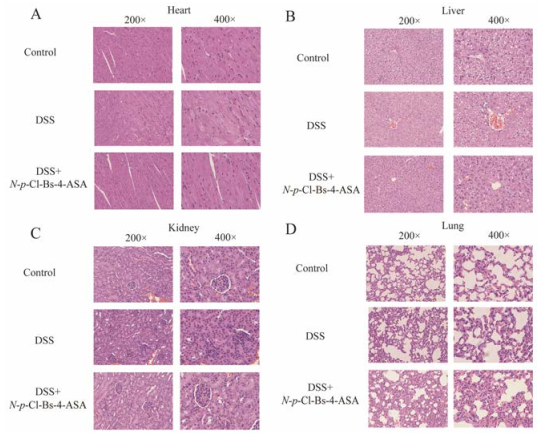
解剖小鼠后对小鼠重要脏器称量, 给药组(10、20、40 mg·kg-1)与空白组无明显差异(图 7)。HE染色后镜下观察发现, 给药组(40 mg·kg-1)小鼠心、肝、肺、肾并没有明显病变(图 8)。
|
Figure 7 The weight changes of main organs (A, heart; B, liver; C, lung; D, kidney) during the colitis process. n = 10, x±s |
|
Figure 8 Serial sections of main organs tissues (A, heart; B, liver; C, kidney; D, lung) were stained with HE |
本研究选用DSS诱导的UC动物模型进行实验, 并对模型组和给药组小鼠进行症状评分, 结果显示DSS模型组小鼠结肠组织损伤情况均比空白组严重, 证明建模成功。DSS模型组小鼠出现不同程度体重下降, 粪便不成形和血便, 而中、高剂量给药组症状明显改善。病理分析发现, DSS模型组小鼠结肠黏膜层出现重度炎症细胞浸润, 局部出现不同程度的坏死, 坏死处已有成纤维细胞增生, 黏膜肌层组织出现炎症细胞浸润; 低剂量给药组(10 mg·kg-1)小鼠黏膜层慢性炎症并伴有坏死, 嗜酸性粒细胞浸润, 局部泡沫样组织细胞聚集, 药效不明显; 中剂量给药组(20 mg·kg-1)小鼠黏膜层中度炎症伴少量坏死, 少量嗜酸性粒细胞浸润, 局灶泡沫样组织细胞聚集, 情况略有改善; 高剂量给药组(40 mg·kg-1)小鼠结肠黏膜结构基本恢复正常, 上皮结构较完整, 少量炎症细胞浸润, 情况明显好转。5-ASA组(40 mg·kg-1)结肠病变改善程度与中剂量组(20 mg·kg-1)相似。血清ELSA检测发现, 5-ASA组与给药组均能显著降低炎症因子表达水平。结果表明, N-p-Cl-Bs-4-ASA对UC小鼠有改善症状、减轻炎症、保护体重的作用, 与5-ASA作用类似或优于5ASA。
近年来, 出现了很多治疗UC的生物制品, 如抗TNF-α单克隆抗体(英夫利昔单抗和阿达木单抗), 但是治疗中度到重度炎症性肠病仍以氨基水杨酸盐为主要选择。其中包括柳氮磺吡啶(salazosulfapyridine, SASP)和5-ASA等[13]。SASP可能的作用机制包括抑制局部和全身的炎症反应、抑制免疫反应及清除氧自由基等[13]。5-ASA作为SASP的替代药品, 已开发很久并广泛用于临床, 可以有效缓解UC的发生发展、预防复发和降低癌症风险[14, 15]。目前研究认为, UC的发病与肠黏膜免疫紊乱和细胞因子网格紊乱有密切联系, 5-ASA通过调节促炎因子和抗炎因子平衡发挥疗效[16]。5-ASA作为花生四烯酸潜在的抑制剂, 减少花生四烯酸和前列腺素的合成, 其也被认为是自由基的清道夫[13, 17, 18]。有文献报道, 5-ASA能够抑制炎症细胞中NO和IL-6的产生, 降低iNOS的表达, 这些抗炎效应可能是由于抑制JNK和p38的磷酸化而不是NF-κB通路的激活[13]。本文采用的药物N-p-Cl-Bs-4-ASA为4-aminosalicylic acid (4-ASA)的类似物。4-ASA不仅对抗结核有确切的药效, 在UC的治疗中也有很好的效果[13, 19, 20], 这与本文的结果相符。4-ASA不同于5-ASA, 它不能抑制花生四烯酸的脂肪氧化作用, 对于自由基的清除也没有作用, 但是能够抑制NF-κB通路的激活[21]。综上所述, 下一步本课题组将着重探讨N-p-Cl-Bs-4-ASA的作用机制以及与5-ASA作用机制的异同点, 研究寻找用药前后炎症因子水平变化的证据, 探讨N-p-Cl-Bs-4-ASA的代谢、适合血药浓度和临床应用的可能。UC的病因与发病机制研究不明, 给临床治愈和缓解症状带来极大的困难, 寻找新的治疗药物是医务工作者的任务和挑战, N-p-Cl-Bs-4-ASA在本次动物实验中取得满意疗效, 并且未出现明显组织损伤和毒副作用, 给寻找、合成安全有效的抗UC药物提供新的方向。
| [1] | Sartor RB. Mechanisms of disease:pathogenesis of Crohn's disease and ulcerative colitis[J]. Nat Clin Pract Gastroenterol Hepatol, 2006, 3: 390–407. DOI:10.1038/ncpgasthep0528 |
| [2] | Rao SS, Holdsworth CD, Read NW. Symptoms and stool patterns in patients with ulcerative colitis[J]. Gut, 1988, 29: 342–345. DOI:10.1136/gut.29.3.342 |
| [3] | Azad Khan AK, Howes DT, Piris J, et al. Optimum dose of sulphasalazine for maintenance treatment in ulcerative colitis[J]. Gut, 1980, 21: 232–240. DOI:10.1136/gut.21.3.232 |
| [4] | Constantinidis KA. Letter:eosinophilic pneumonia:an unusual side effect of therapy with salicylazosulfapyridine[J]. Chest, 1976, 70: 315–316. |
| [5] | Zhao S, Wang P, Wang Q, et al. The establishment and evaluation of acute ulcerative colitis in mice induced with DSS[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报), 2016, 18: 42–44. |
| [6] | Zhang Y, Huang X. The establishment of acute ulcerative colitis in mice induced with DSS[J]. Chin J Gastroenterol Hepatol (胃肠病学和肝病学杂志), 2006, 15: 130–133. |
| [7] | Wang DF, Wang YL, Wang YW, et al. Effect of Huangqin Tang on the function of regulatory TLR4/MyD88 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2016, 51: 1558–1563. |
| [8] | Warren BF, Shepherd NA, Bartolo DC, et al. Pathology of the defunctioned rectum in ulcerative colitis[J]. Gut, 1993, 34: 514–516. DOI:10.1136/gut.34.4.514 |
| [9] | Zhuo X, Huang C, Zhang S. Value of serum homocysteine and inflammatory factor in the diagnostis of ulcerative colitis[J]. J Bethune Med Sci (白求恩医学杂志), 2016, 14: 145–147. |
| [10] | Sands BE, Kaplan GG. The role of TNFα in ulcerative colitis[J]. J Clin Pharmacol, 2007, 47: 930–941. DOI:10.1177/0091270007301623 |
| [11] | Driscoll KE. TNFα and MIP-2:role in particle-induced inflammation and regulation by oxidative stress[J]. Toxicol Lett, 2000, 112-113: 177–183. DOI:10.1016/S0378-4274(99)00282-9 |
| [12] | Masoodi I, Kochhar R, Dutta U, et al. Evaluation of fecal myeloperoxidase as a biomarker of disease activity and severity in ulcerative colitis[J]. Dig Dis Sci, 2012, 57: 1336–1340. DOI:10.1007/s10620-012-2027-5 |
| [13] | Dhaneshwar SS. Colon-specific prodrugs of 4-aminosalicylic acid for inflammatory bowel disease[J]. World J Gastroenterol, 2014, 20: 3564–3571. DOI:10.3748/wjg.v20.i13.3564 |
| [14] | Tang H, Xiang D, Wang F, et al. 5-ASA-loaded SiO2 nanoparticles-a novel drug delivery system targeting therapy on ulcerative colitis in mice[J]. Mol Med Rep, 2017, 15: 1117–1122. DOI:10.3892/mmr.2017.6153 |
| [15] | Hanauer SB. Oral or topical 5-ASA in ulcerative colitis[J]. Dig Dis, 2016, 34: 122–124. DOI:10.1159/000443026 |
| [16] | Gisbert JP, Gomollon F, Mate J, et al. Role of 5-aminosalicylic acid (5-ASA) in treatment of inflammatory bowel disease:a systematic review[J]. Dig Dis Sci, 2002, 47: 471–488. DOI:10.1023/A:1017987229718 |
| [17] | Ahnfelt-Ronne I, Nielsen OH, Christensen A, et al. Clinical evidence supporting the radical scavenger mechanism of 5-aminosalicylic acid[J]. Gastroenterology, 1990, 98: 1162–1169. DOI:10.1016/0016-5085(90)90329-Y |
| [18] | Williams JG, Hallett MB. Effect of sulphasalazine and its active metabolite, 5-amino-salicylic acid, on toxic oxygen metabolite production by neutrophils[J]. Gut, 1989, 30: 1581–1587. DOI:10.1136/gut.30.11.1581 |
| [19] | Vadnerkar G, Dhaneshwar S. Macromolecular prodrug of 4-aminosalicylic acid for targeted delivery to inflamed colon[J]. Curr Drug Discov Technol, 2013, 10: 16–24. |
| [20] | Suneela D, Gaurav V, Himanshu R. Design and development of novel azo prodrugs using various permutations and combinations of 5-and 4-aminosalicylic acids for inflammatory bowel disease:a colon-targeted approach[J]. Inflamm Allergy Drug Targets, 2013, 12: 328–340. DOI:10.2174/18715281113129990059 |
| [21] | Nielsen OH, Ahnfelt-Ronne I. 4-Aminosalicylic acid, in contrast to 5-aminosalicylic acid, has no effect on arachidonic acid metabolism in human neutrophils, or on the free radical 1, 1-diphenyl-2-picrylhydrazyl[J]. Pharmacol Toxicol, 1988, 62: 223–226. DOI:10.1111/bcpt.1988.62.issue-4 |
 2018, Vol. 53
2018, Vol. 53


